Похожие презентации:
Фенол. Фізичні та хімічні властивості
1.
Фенол. Фізичні тахімічні властивості
2.
План• Склад і будова молекули
фенолу
• Електронна будова
• Фізичні властивості
• Хімічні властивості
• Вплив на здоров’я людини та
довкілля
• Застосування фенолу
3.
Склад і будова молекули• Фенол C6H5OН - представник органічних
речовин, у молекулах яких гідроксильні
групи безпосередньо сполучені з
бензеновим кільцем;
• склад молекули фенолу розглядають як
похідну бензену, у молекулі якого один
атом Гідрогену заміщений на
характеристичну гідроксильну групу
Кулестержнева
модель
Масштабна
модель
4.
Склад і будова молекули• за будовою структурної формули та
моделлю молекули фенолу
гідроксильна група -OH безпосередньо
сполучена з атомом Карбону
бензенового кільця;
• молекула фенолу має форму
правильного шестикутника, у якому
атоми Карбону розміщуються під кутом
120°, тобто молекула фенолу плоска
Структурна
формула
5.
Електронна будова• Фенол - приклад, який ілюструє третє положення теорії Бутлерова щодо взаємного
впливу атомів і груп атомів у молекулах органічних сполук
молекула має неподілену пара електронів атома Оксигену відтягується бензеновим
ядром і взаємодіє з його шестиелектронною π-системою.
Завдяки перерозподілу електронної густини відбувається:
1) збільшення полярності зв’язку О-Н. Електронна хмара відтягується
від атома Гідрогену значно сильніше, ніж в молекулах спиртів, з
чим пов'язані нехарактерні для спиртів властивості фенолу як
слабкої кислоти;
2) зміщення електронної густини всередині бензенового ядра. У
орто- і пара-положеннях (положення 2, 4 і 6) бензенового ядра на
атомах Карбону виникають часткові негативні заряди, а на
відповідних атомах Гідрогену — часткові позитивні заряди, завдяки
чому вони значно легше, ніж у молекулі бензену, вступають у
реакції заміщення
6.
Фізичні властивостіФенол — безбарвна кристалічна речовина з
характерним запахом, отруйна;
• на повітрі окиснюється й набуває рожевого
забарвлення;
• оскільки температура плавлення фенолу становить 42 °С,
то він добре розчиняється в гарячій воді. У цьому легко
переконатися, якщо пробірку з фенолом помістити в склянку
з гарячою водою;
• має антисептичну дію
7.
Хімічні властивостіРеакції за гідроксильною групою
Реакція заміщення
• враховуючи наявність гідроксильної групи, фенол має
вступати в реакції заміщення
• з металічним натрієм (Na) при нагріванні, утворюються
натрій фенолят та виділяється газ водень
• фенол проявляє властивості, подібні до властивостей
спиртів
2С6Н5OH + 2Na → 2С6Н5ONa + Н2↑
8.
Хімічні властивостіРеакція заміщення
• враховуючи вплив бензенового кільця, яке відтягує на
себе електронну густину атому Оксигену, послаблюючи
між ними зв'язок. Атом Гідрогену стає рухливіший, що
теж впливає на властивості фенолу
• завдяки наявності бензенового кільця фенол, на відміну
від спиртів, реагує з розчином лугу, утворюючи сіль
(натрій фенолят) і воду:
С6Н5OH + 2NaОН → 2С6Н5ONa + Н2О
9.
Хімічні властивостіДисоціація
• у розчині проявляє кислотні властивості й
дуже слабо дисоціює:
С6Н5ОН ⇄ С6Н5О- + H+
Тривіальна назва фенолу — карболова кислота
10.
Хімічні властивостіРеакції в бензеновому кільці
• реакція бензену з бромом за звичайних умов не
відбувається. А в молекулі фенолу наявність гідроксильної
групи впливає на зв'язки між атомами в бензеновому
кільці: у положеннях 2, 4, 6 атоми Гідрогену мають більшу
рухливість;
• реакція заміщення - бромна вода реагує з фенолом,
заміщаючи атоми Гідрогену на атоми Брому з утворенням
білого осаду 2,4,6-трибромфенолу:
С6Н5OH + 3Br2 → С6Н2Br3OH + 3НBr
11.
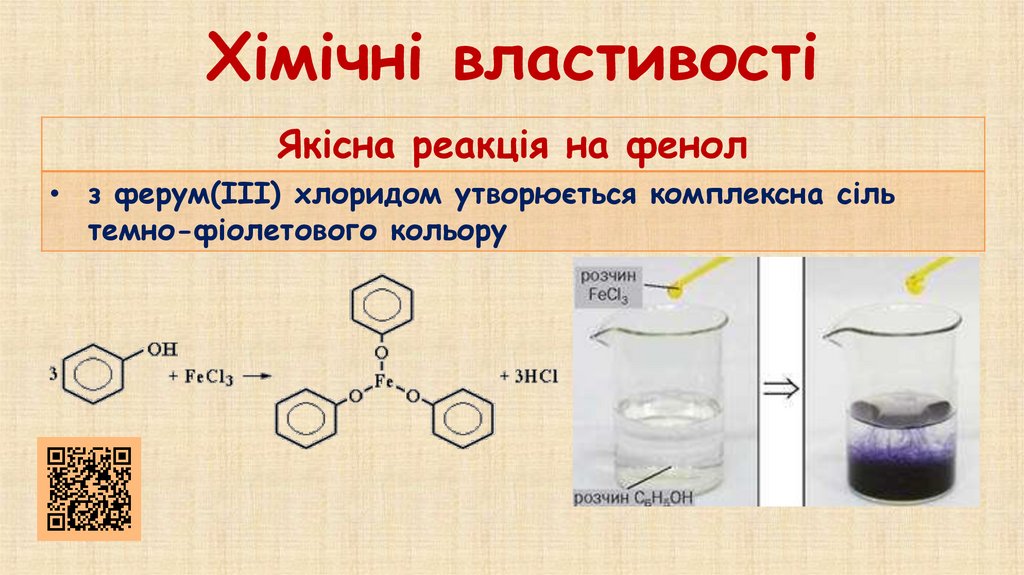
Хімічні властивостіЯкісна реакція на фенол
• з ферум(ІІІ) хлоридом утворюється комплексна сіль
темно-фіолетового кольору
12.
Вплив на здоров’я людинита довкілля
• під час синтезу феноло-формальдегідних пластмас,
барвників, вибухових речовин відбуваються викиди
отруйних газів у довкілля;
• разом з промисловими відходами фенол потрапляє в
стічні води та спричиняє загибель водних рослин й
риби;
• Фенол — отруйна речовина, що становить загрозу не
тільки для здоров'я людини, а й для рослин і тварин;
• виробництво й промислове використання фенолу тісно
пов'язане з питаннями екології, з охороною природи
від промислових відходів, що містять фенол;
13.
Вплив здоров’я людини• при вдиханні парів або проковтуванні уражаються
слизові оболонки травного тракту, верхніх дихальних
шляхів, очей;
• при попаданні на шкіру утворюється опік фенолом;
• при глибокому проникненні викликає некроз тканин;
• має виражену токсичну дію на внутрішні органи: при
ураженні нирок викликає пієлонефрит, руйнує
структуру еритроцитів, що призводить до кисневого
голодування, здатний викликати алергічний
дерматит;
• при вдиханні фенолу у великих концентраціях
порушується робота мозкової діяльності, може
призвести до зупинки дихання
14.
Застосування фенолу• як антисептик, консервант у вакцинах, протраву
для деревини, у косметології для пілінгу;
• у виробництві:
- пластмас, фенолформальдегідних смол, нейлону,
капрону;
- вибухових речовин (2,4,6-тринітрофенол);
- поверхнево-активних речовин (миючі засоби);
- ліків (ацетилсаліцилова кислота, антисептиків,
знеболюючих, антиагрегантів (розріджувачів крові);
- художніх фарб – гуаші;
- пестицидів, інсектицидів, гербіцидів, фунгіцидів
тощо
15.
Підсумки• Склад молекули фенолу розглядають як похідну бензену, у
молекулі якого один атом Гідрогену заміщений на
характеристичну гідроксильну групу -ОН
• Молекулярна формула фенолу С6Н5-ОН
• Фенол — безбарвна кристалічна речовина з характерним
запахом, отруйна, легкоплавка, добре розчиняється в гарячій
воді
• Фенолу властиві реакції заміщення, що відбуваються за
гідроксильною групою та в положеннях 2, 4, 6 у бензеновому
кільці. Це зумовлено впливом гідроксильної групи на
бензенове кільце
• Фенол і його похідні є загрозою для здоров'я та
працездатності людини, становлять значні екологічні
небезпеки














 Химия
Химия








