Похожие презентации:
Основные понятия химической термодинамики и химической кинетики
1.
СЕМИНАР № 4ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ
ТЕРМОДИНАМИКИ
И ХИМИЧЕСКОЙ КИНЕТИКИ
ПРЕЗЕНТАЦИЮ ПОДГОТОВИЛА доц. ИВАНОВА Е.А.,
доц. ТЮМЕНОВА С.И., доц. СОЛОДОВА Е.В.
2.
План семинараI.Теоретическая часть
Повторение и обобщение теоретического материала основных понятий
химической термодинамики и химической кинетики (Вопросы из раздела
курса, необходимого для подготовки к семинару)
II. Практическая часть
Решение задач по химической термодинамике
III. Самостоятельная работа студента (СРС)
Выполняется студентом самостоятельно дома.
Изучить теорию по следующим темам и решить самостоятельно задачи:
Скорость химических реакций. Химическое равновесие.
326,330,332,333,362,363,364 [3].
Химическая термодинамика. 306, 314, 318, 320, 321, 322 [3].
3.
I. ТЕОРЕТИЧЕСКАЯ ЧАСТЬДАЙТЕ ОПРЕДЕЛЕНИЕ ПОНЯТИЮ «ТЕРМОДИНАМИЧЕСКАЯ
СИСТЕМА»
4.
I. ТЕОРЕТИЧЕСКАЯ ЧАСТЬДАЙТЕ ОПРЕДЕЛЕНИЕ ПОНЯТИЮ «ТЕРМОДИНАМИЧЕСКАЯ
СИСТЕМА»
• Термодинамическая система – это
совокупность материальных объектов,
выбранных нами произвольно для изучения,
которая отделена от всего окружающего
(называемого внешней средой) некоторой
границей (условной или реальной).
5.
ДАЙТЕ ОПРЕДЕЛЕНИЕ ПОНЯТИЮ «ВНУТРЕННЯЯ ЭНЕРГИЯ»6.
ДАЙТЕ ОПРЕДЕЛЕНИЕ ПОНЯТИЮ «ВНУТРЕННЯЯ ЭНЕРГИЯ»Внутренней энергией (U) называется находящаяся в веществе или
системе в скрытом виде энергия, которая включает: внутриядерную
энергию, энергию движения электронов в атомах, энергию химических
связей между атомами, энергию внутримолекулярных колебаний
атомов и атомных групп, энергию поступательного и вращательного
движения молекул, т.е. все виды энергии, кроме кинетической и
потенциальной энергии системы в целом.
7.
ДАЙТЕ ОПРЕДЕЛЕНИЕ ПОНЯТИЮ «ЭНТАЛЬПИЯ»8.
ДАЙТЕ ОПРЕДЕЛЕНИЕ ПОНЯТИЮ«ЭНТАЛЬПИЯ»
Энтальпия (H) —
функция состояния термодинамической системы, она
определяется как сумма внутренней энергии и
произведения давления на объём.
H = U + p·V
9.
ПРИВЕДИТЕ ФОРМУЛИРОВКУЗАКОНА ГЕССА И СЛЕДСТВИЕ ИЗ
ЗАКОНА ГЕССА
10.
ПРИВЕДИТЕ ФОРМУЛИРОВКУЗАКОНА ГЕССА И СЛЕДСТВИЕ ИЗ
ЗАКОНА ГЕССА
• Тепловой эффект реакции не зависит от
промежуточных стадий процесса, а только от
начального и конечного состояния веществ
• Тепловой эффект реакции равен разности суммы
теплот образования продуктов реакции и суммы
теплот образования исходных продуктов
11.
ПРИВЕДИТЕ ФОРМУЛИРОВКУ ПЕРВОГОЗАКОНА ТЕРМОДИНАМИКИ
12.
ПРИВЕДИТЕ ФОРМУЛИРОВКУ ПЕРВОГОЗАКОНА ТЕРМОДИНАМИКИ
Первый закон термодинамики — это закон сохранения и
превращения энергии для термодинамической системы.
Изменение ΔU внутренней энергии неизолированной
термодинамической системы равно разности между количеством
теплоты Q, переданной системе, и работой A, совершенной
системой над внешними телами.
ΔU=Q−A
13.
ПРИВЕДИТЕ ФОРМУЛИРОВКУ ВТОРОГОЗАКОНА ТЕРМОДИНАМИКИ
14.
ПРИВЕДИТЕ ФОРМУЛИРОВКУ ВТОРОГОЗАКОНА ТЕРМОДИНАМИКИ
• Самопроизвольный процесс – это процесс, который может протекать
без затраты работы извне, причем в результате может быть получена
работа в количестве, пропорциональном произошедшему
изменению состояния системы. Самопроизвольный процесс может
протекать или обратимо, или необратимо.
• Вынужденный процесс – процесс, для протекания которого требуется
затрата работы извне в количестве, пропорциональном
производимому изменению состояния системы.
• Второе начало термодинамики накладывает ограничения на
направление термодинамических процессов, запрещая
самопроизвольную передачу тепла от менее нагретых тел к более
нагретым.
15.
ДАЙТЕ ОПРЕДЕЛЕНИЕ ПОНЯТИЮ«ЭНТРОПИЯ»
16.
ДАЙТЕ ОПРЕДЕЛЕНИЕ ПОНЯТИЮ«ЭНТРОПИЯ»
• Энтропия – это мера неупорядоченности состояния системы;
Измеряется энтропия в Дж/моль・К.
• Энтропия возрастает с увеличением движения частиц при
нагревании, испарении, плавлении, расширении газа, при
ослаблении или разрыве связей между атомами и т.п.
• Процессы, связанные с упорядоченностью системы
(конденсация, кристаллизация, сжатие, упрочнение связей,
полимеризация), сопровождаются уменьшением энтропии.
17.
ЭНЕРГИЯ ГИББСА И НАПРАВЛЕНИЕХИМИЧЕСКИХ РЕАКЦИЙ
18.
ЭНЕРГИЯ ГИББСА И НАПРАВЛЕНИЕХИМИЧЕСКИХ РЕАКЦИЙ
В химических процессах одновременно действуют два противоположных
фактора — энтропийный и энтальпийный. Суммарный эффект этих
противоположных факторов в процессах, протекающих при постоянном
давлении и температуре, определяет изменение энергии Гиббса
ΔG= ΔН − TΔS
Если
ΔG < 0 – Реакция идет
Если
ΔG > 0 – Реакция не идет
Если
ΔG = 0 – Система находится в состояние равновесия
19.
ДАЙТЕ ОПРЕДЕЛЕНИЕ ГОМОГЕННОЙ ИГЕТЕРОГЕННОЙ СИСТЕМЕ
20.
ГОМОГЕННАЯ И ГЕТЕРОГЕННАЯСИСТЕМА
Гомогенная система — однородная система, химический состав и физические свойства
которой во всех частях одинаковы или меняются непрерывно, без скачков (между частями
системы нет поверхностей раздела).
В гомогенной системе из двух и более химических компонентов каждый компонент
распределен в массе другого в виде молекул, атомов, ионов. Составные части гомогенной
системы нельзя отделить друг от друга механическим путем.
Гетерогенная система — неоднородная система, состоящая из однородных частей (фаз),
разделенных поверхностью раздела. Однородные части (фазы) могут отличаться друг от
друга по составу и свойствам. Число веществ (компонентов), термодинамических фаз и
степеней свободы связаны правилом фаз.
Примерами гетерогенных систем могут служить: жидкость — насыщенный пар; насыщенный
раствор с осадком; многие сплавы. Твердый катализатор в токе газа или жидкости тоже
гетерогенная система (гетерогенный катализ).
21.
ДАЙТЕ ОПРЕДЕЛЕНИЕ СКОРОСТИ ХИМИЧЕСКОЙРЕАКЦИИ
22.
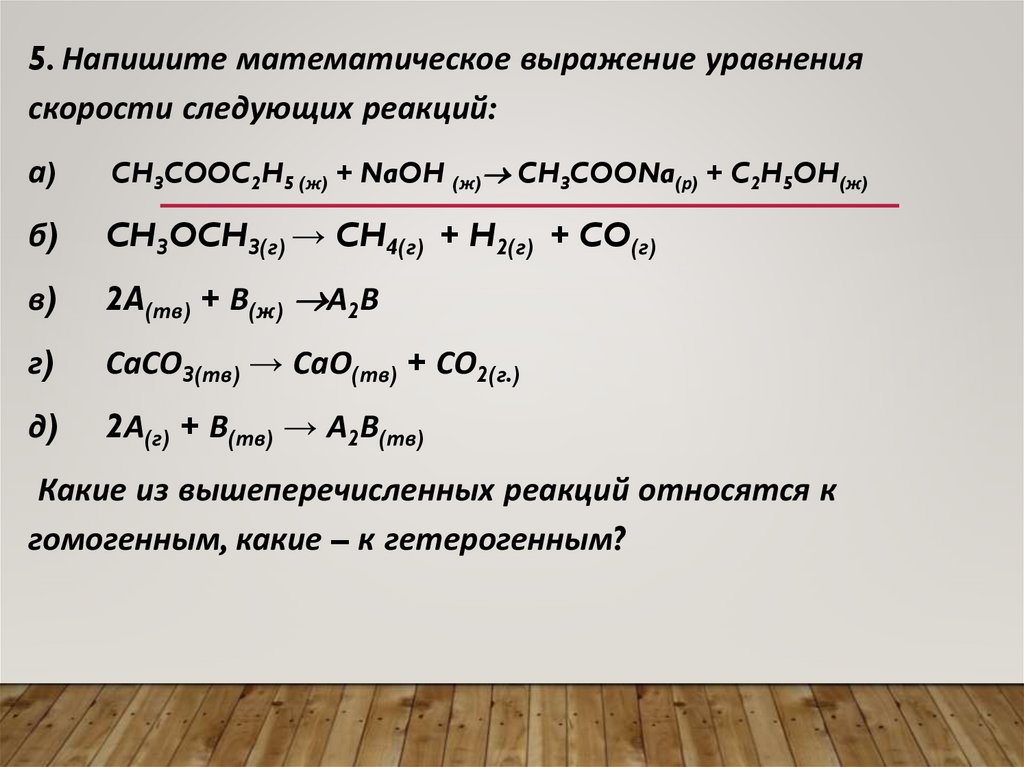
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИСкорость химической реакции показывает изменение
количества вещества в единицу времени, в единице
объёма или на единице поверхности раздела фаз.
aA +bB = cC + dD
23.
СФОРМУЛИРУЙТЕ ПРАВИЛО ВАНТ-ГОФФА24.
ПРАВИЛО ВАНТ-ГОФФАПовышение температуры на каждые 10оС приводит к
увеличению скорости химической реакции в 2-4 раза (эту
величину называют температурный коэффициент скорости
химической реакции γ). Точное значение температурного
коэффициента определяется для каждой реакции.
25.
ДАЙТЕ ОПРЕДЕЛЕНИЕ ЭНЕРГИИ АКТИВАЦИИ26.
ЭНЕРГИЯ АКТИВАЦИИЭнергия активации
Еа равна разности
энергий
переходного и
исходного
состояний:
Еа = Еперех.сост. Еисх.сост.
27.
ДАЙТЕ ОПРЕДЕЛЕНИЕ КАТАЛИЗАТОРАМИ ИНГИБИТОРАМ
28.
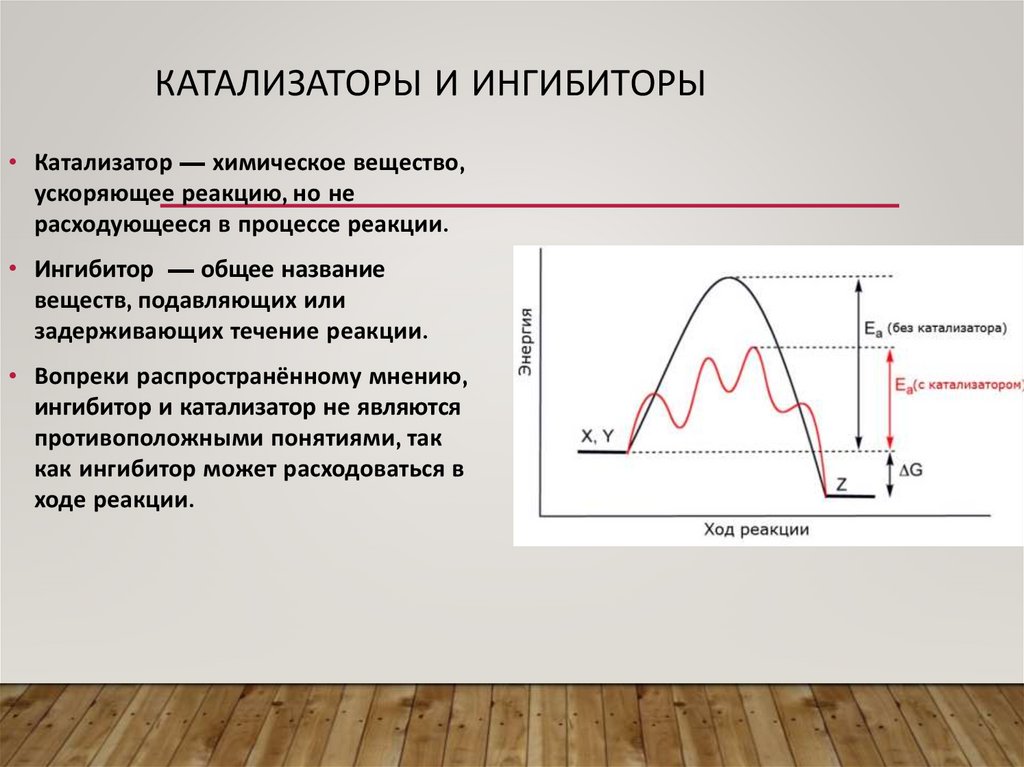
КАТАЛИЗАТОРЫ И ИНГИБИТОРЫ• Катализатор — химическое вещество,
ускоряющее реакцию, но не
расходующееся в процессе реакции.
• Ингибитор — общее название
веществ, подавляющих или
задерживающих течение реакции.
• Вопреки распространённому мнению,
ингибитор и катализатор не являются
противоположными понятиями, так
как ингибитор может расходоваться в
ходе реакции.
29.
ДАЙТЕ ОПРЕДЕЛЕНИЕ КОНСТАНТЕХИМИЧЕСКОГО РАВНОВЕСИЯ
30.
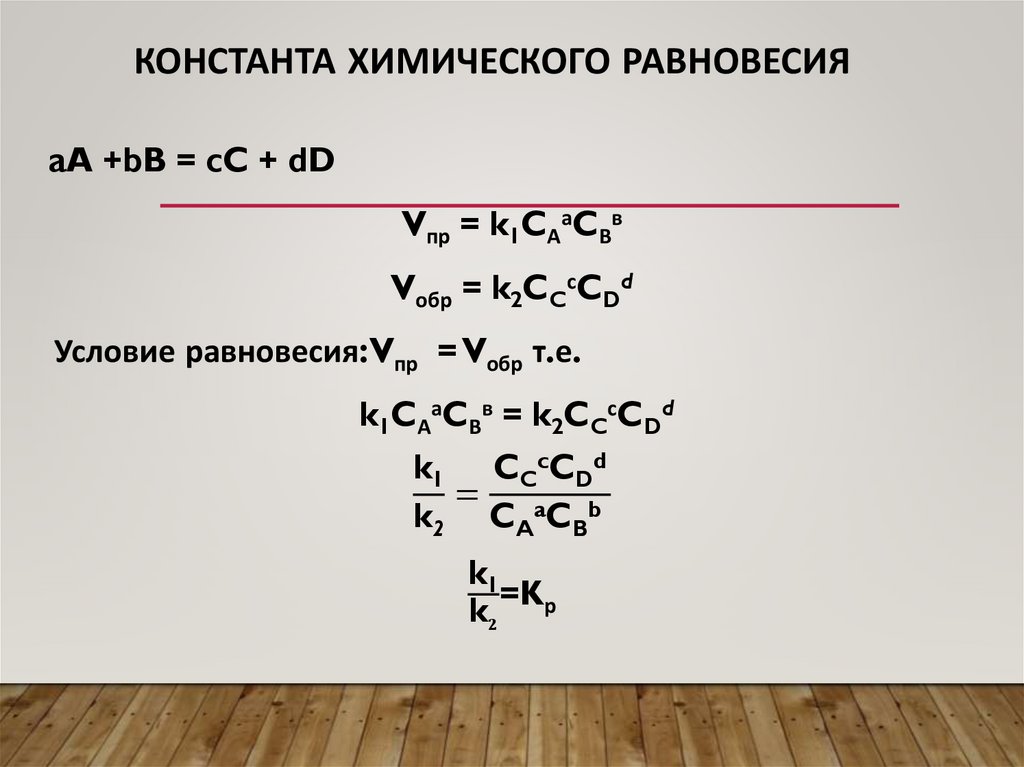
КОНСТАНТА ХИМИЧЕСКОГО РАВНОВЕСИЯaA +bB = cC + dD
Vпр = k1CАаCВв
Vобр = k2CCсCDd
Условие равновесия:Vпр = Vобр т.е.
k1CАаCВв = k2CCсCDd
k1 CCcCDd
=
k2 CAaCBb
k1
=K
k
















































 Химия
Химия








