Похожие презентации:
Основы химической термодинамики и кинетики химических реакций
1. ПСПбГМУ им. акад. И.П.Павлова кафедра общей и биоорганической химии
дисцисплина«ХИМИЯ»
12 лекций
Равновесия в водных
растворах
2. Лекция № 1
Основыхимической термодинамики и
кинетики химических реакций
3. Понятие о химической термодинамике
• Термодинамика – наука, изучающаявзаимные превращения различных видов
энергии
• Химическая термодинамика – это
раздел физической химии, изучающий
превращения различных видов энергии в
химических процессах
4.
Биоэнергетика изучает превращение энергии вбиосистемах
Энергия окисления пищевых продуктов, идет на
поддержание температуры тела и совершение
различных видов биологической работы
Переход энергии в биосистеме в теплоту и работу
осуществляется через образование промежуточных
продуктов.
Калорийность – энергия, выделяемая при полном
окислении 1г питательных веществ
5.
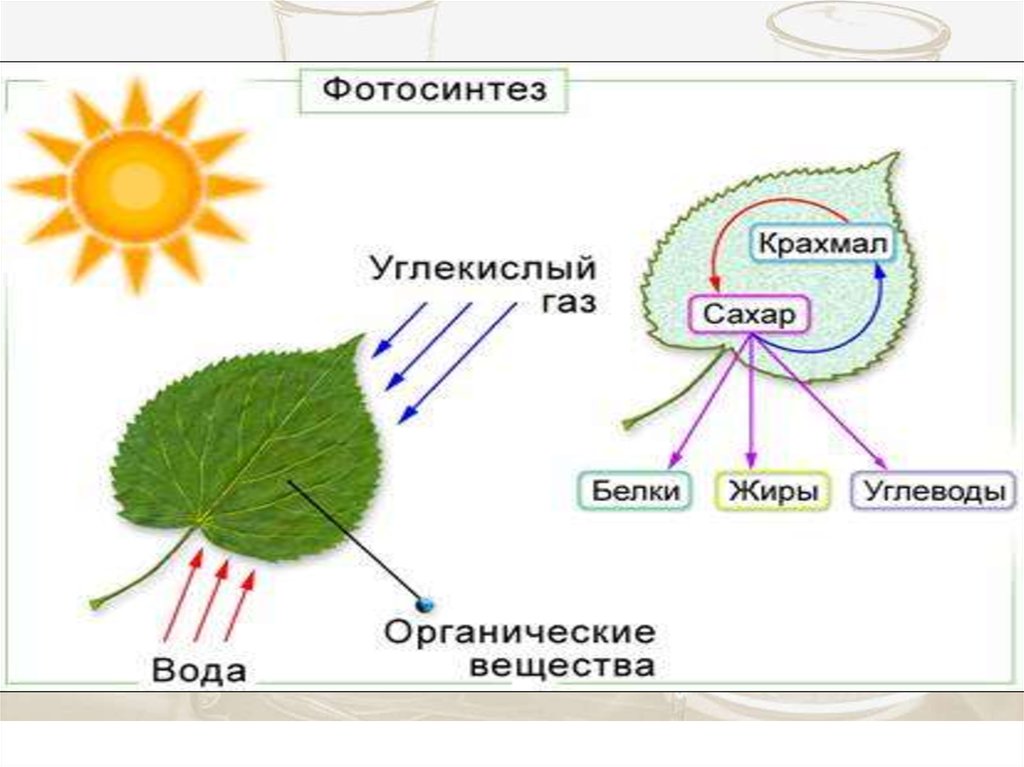
6.
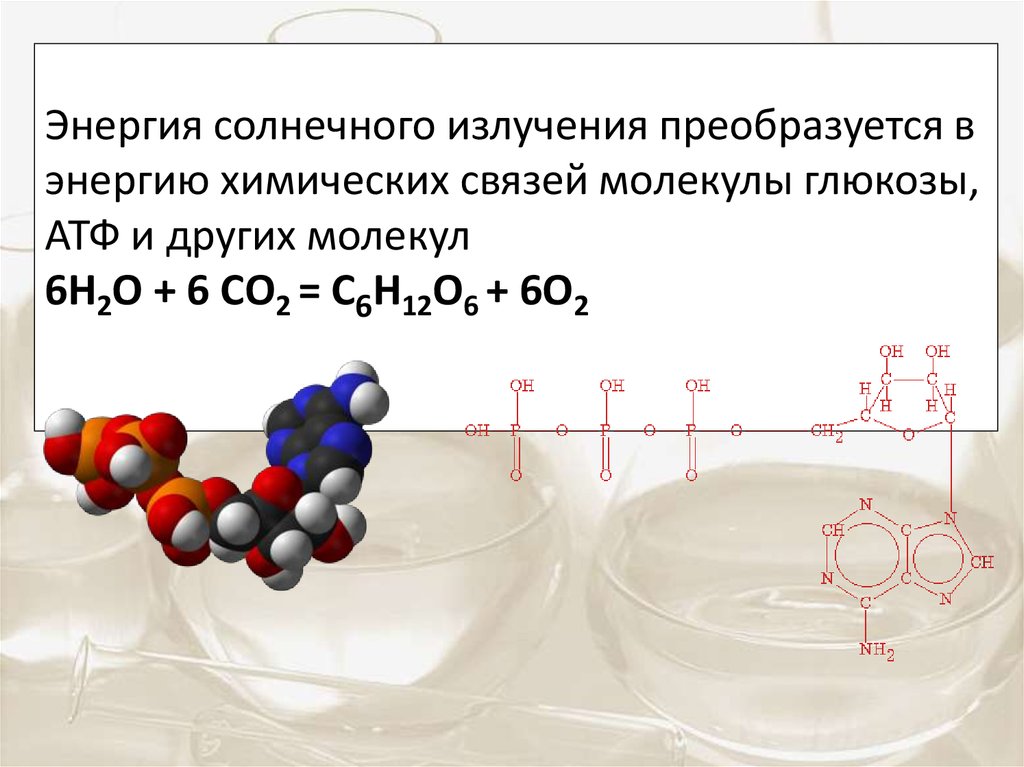
Энергия солнечного излучения преобразуется вэнергию химических связей молекулы глюкозы,
АТФ и других молекул
6Н2О + 6 СО2 = С6Н12О6 + 6О2
7.
30 ккалХодьба, 10 мин
110 ккал
Работа, 1 час
40 ккал
Еда, 30 мин
180 ккал
Подъем, 10 мин
70 ккал
Спуск, 5 мин
580 ккал
Сон, 8 ч
350 ккал
За рулем 2 ч
270 ккал
Глажение, 1 ч
250 ккал
Мытье окон, 1ч
560 ккал
Уборка, 2 ч
8.
ЗадачаПотребность в энергии у студентов составляет 11732
кДж в сутки. Можно ли рекомендовать студенту
следующий рацион питания:
• белки – 97 г,
• углеводы – 378 г,
• жиры – 103 г.
калорийность рациона:
• Углеводов = 16,7 кДж/г
• Жиров = 37,7 кДж/г
• Белков = 16,7 кДж/г
9. Термодинамическая система
• это тело или группа тел, отделенные от окружающейсреды реальной или воображаемой поверхностью
раздела.
• Однородная часть системы с одинаковыми
химическими и термодинамическими свойствами,
отделенная от других частей видимой поверхностью
раздела, называется фазой.
• Системы, состоящие только из одной фазы,
называются гомогенными (однородными).
• Системы, содержащие две или большее количество
фаз, называются гетерогенными (неоднородными).
10.
Термодинамические параметрыосновные
общие
Функции состояния
• давление
(Р)
• температура (Т)
• объем (V)
• внутренняя
измеряемые
(G)
Измеряются абсолютные
значения
энергия(E)
• энтальпия (Н)
• энтропия (S)
• свободная энергия Гиббса
неизмеряемые
Измеряются ∆H, ∆E, ∆G, ∆S
11. Первый закон термодинамики
• Подведенное к системе тепло идет наувеличение внутренней энергии системы и на
совершение внешней работы
Q = ∆Е + А
• В изолированной системе сумма всех видов
энергии есть величина постоянная
∆Е = 0 (в изолированной системе)
12.
Внутренняя энергия Е – сумма всехвидов энергии частиц,
составляющих систему.
Энтальпия Н – теплосодержание
системы.
Q = ∆Е + А
∆Н = ∆E + P∆V
Qр = ∆Н
13.
Основной закон термохимии –закон Гесса.
Тепловой эффект реакции не
зависит от пути протекания
реакции, а определяется только
исходным и конечным состоянием
системы
∆Н < 0 - экзотермическая реакция
∆Н> 0 - эндотермическая реакция
14.
Энтропия S– мера
хаотичности, беспорядка
Второй закон термодинамики:
В изолированных системах энтропия
самопроизвольно протекающего процесса
возрастает
∆S>0
Sт < Sж < Sгаз
15.
Энергия Гиббса GИзобарно-изотермический потенциал –
максимальная полезная работа, совершаемая
системой при постоянных давлении и
температуре.
∆G = ∆H - T ∆S
16.
Критерии самопроизвольности процесса∆Н< 0 - энтальпийный фактор
∆S> 0 – энтропийный фактор
∆G< 0 – универсальный критерий
∆G= 0 – термодинамическое равновесие
17.
Термодинамическое равновесноесостояние – постоянство свойств системы во
времени, потоки вещества и энергии
отсутствуют.
Стационарное состояние - постоянство
свойств системы во времени, которое
поддерживается обменом веществом, энергией,
информацией с окружающей средой
(гомеостаз)
18.
Факторы, определяющие ходпроцесса
G H T S
ΔH
–
ΔS
+
–
–
+
+
+
–
Возможность самопроизвольного процесса
Процесс идет самопроизвольно при любой температуре
Процесс может идти самопроизвольно при низких
температурах
Процесс может идти самопроизвольно при высоких
температурах
Процесс не идет самопроизвольно ни при какой температуре
19. Сопряженные реакции
Глюкоза+Фруктоза=Сахароза+Н2О +20,9кДж/моль,Эндергонический процесс ∆G > 0 ведомая реакция
АTФ + Н2О = AДФ + Н3РО4
-30,4кДж/моль,
Экзергонический процесс ∆G< 0 ведущая реакция
Суммарное уравнение
АТФ + Глюкоза + Фруктоза = Сахароза + AДФ+ Н3РО4
-9,5кДж/моль
∆G< 0
20.
Кинетика – учение оскоростях и механизмах
химических реакций.
21. Скорость реакции
Cv
число элементарных актов реакции,
происходящих в единицу времени
в единице объема (в случае
гомогенной реакции) или на единице
поверхности раздела фаз (в случае
гетерогенной реакции).
22. Обратимые реакции протекают одновременно в прямую и обратную стороны
v1H 2( г ) I 2 ( г ) 2 HI ( г )
v2
Необратимые реакции протекают в одну сторону
до полного израсходования исходных
продуктов
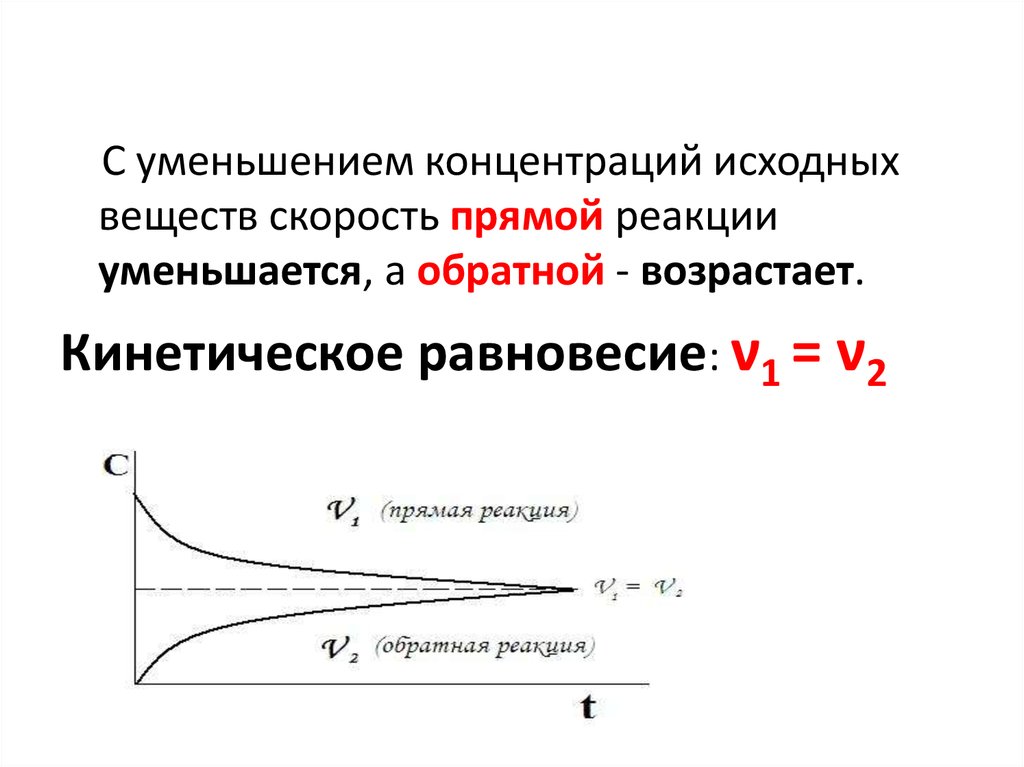
23.
С уменьшением концентраций исходныхвеществ скорость прямой реакции
уменьшается, а обратной - возрастает.
Кинетическое равновесие: ν1 = ν2
24. Скорость химической реакции зависит от
- природы реагирующих веществ;
- концентрации;
- температуры;
- давления (для газов);
- катализатора;
- площади соприкосновения в
гетерогенных реакциях.
25. Влияние концентрации Закон Гульдберга и Вааге (1867)
mA+nB=dDv kC C
m
A
n,
B
где: k – константа скорости реакции;
v – скорость реакции , моль/л*с;
С – молярные концентрации исходных веществ А
и В (моль/л);
m и n – стехиометрические коэффициенты
26. для гетерогенной реакции
• Горение угляС + О2 = СО2
ν = k[O2]
• Константа скорости реакции (k) численно равна
скорости реакции, когда концентрации
реагирующих веществ равны единице (1 моль/л),
27. Влияние давления
v1H 2( г ) I 2 ( г ) 2 HI ( г )
v2
v1 k1C H 2 C I 2
Р
С Н СI
2,
2
v2 k2C
ν1
2
HI
28. Влияние температуры. С увеличением Т скорость любой реакции возрастает Правило Вант – Гоффа
При повышении температуры на каждые 10 Cскорость реакции увеличивается в 2 – 4 раза
vt2 vt1
t 2 t1
10
,
где: t 2 и t1 – конечная и начальная температуры;
– температурный коэффициент реакции;
vt и vt – скорости реакции при t1 и t 2
1
2
29. Влияние катализатора
Катализаторы - вещества, влияющие на скоростьпротекания термодинамически возможных
химических реакций, но остающиеся
неизменными в результате этих реакций
Вещества, увеличивающие скорость
протекания процесса, называют
положительными катализаторами, а
уменьшающие – отрицательными
катализаторами (ингибиторами)
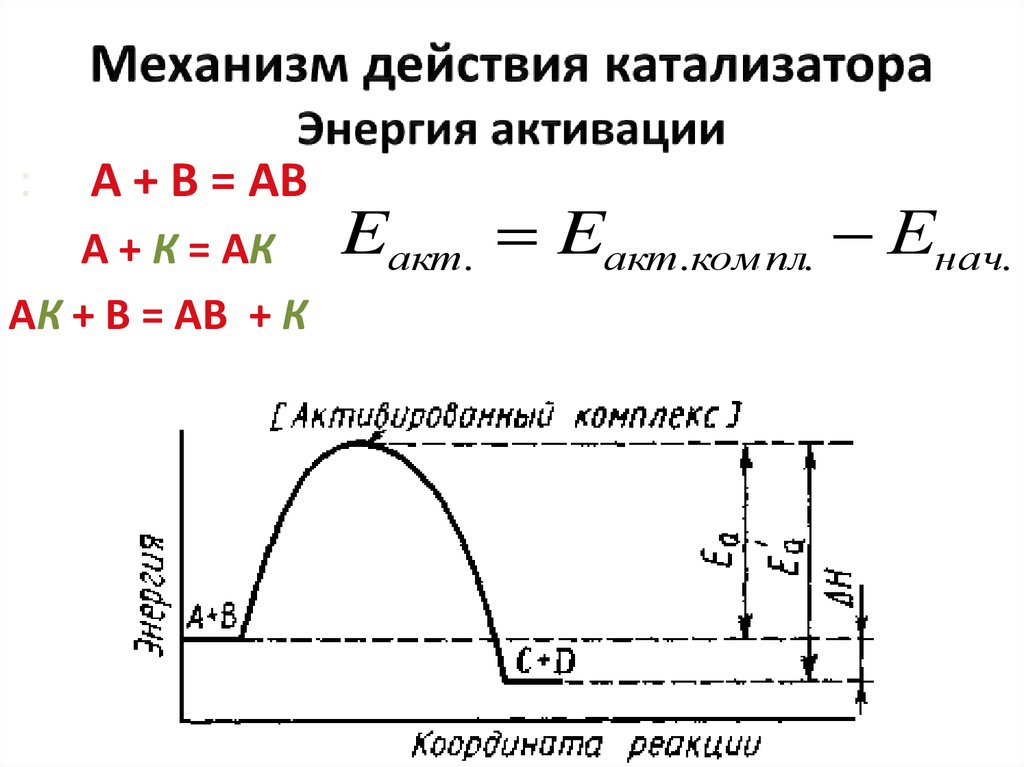
30. Механизм действия катализатора Энергия активации
:А + В = АВ
А + К = АК
АК + В = АВ + К
Eакт. Eакт.ком пл. Енач.
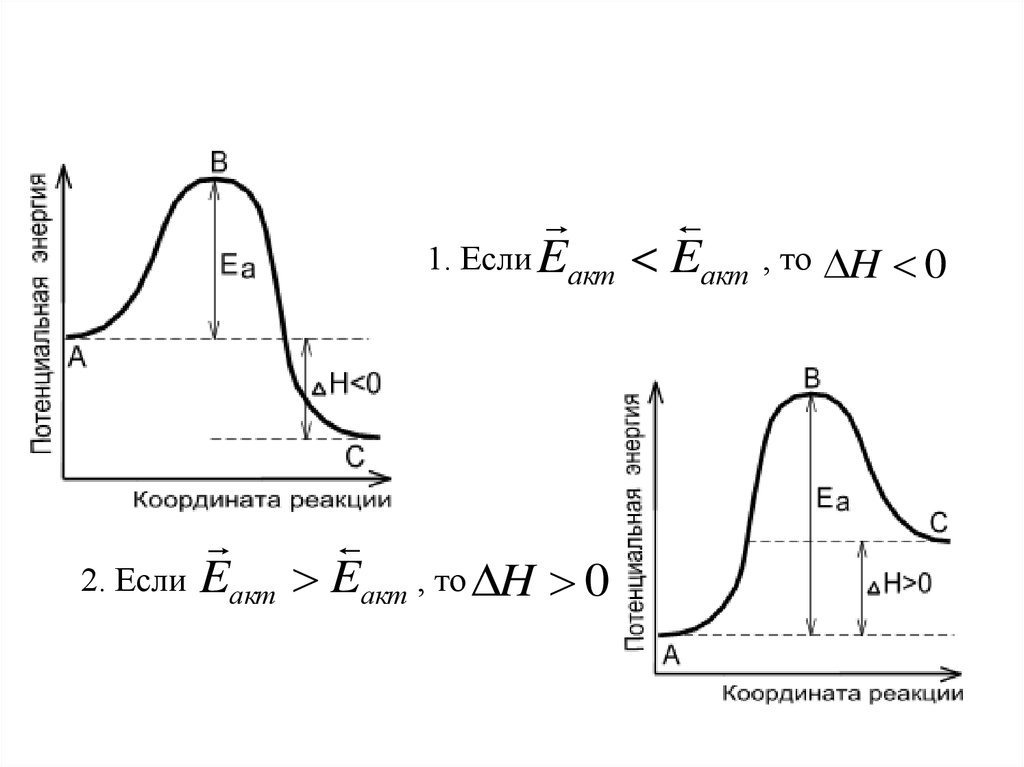
31.
1. Если Eакт Eакт , то H 02. Если Eакт Eакт , то H 0
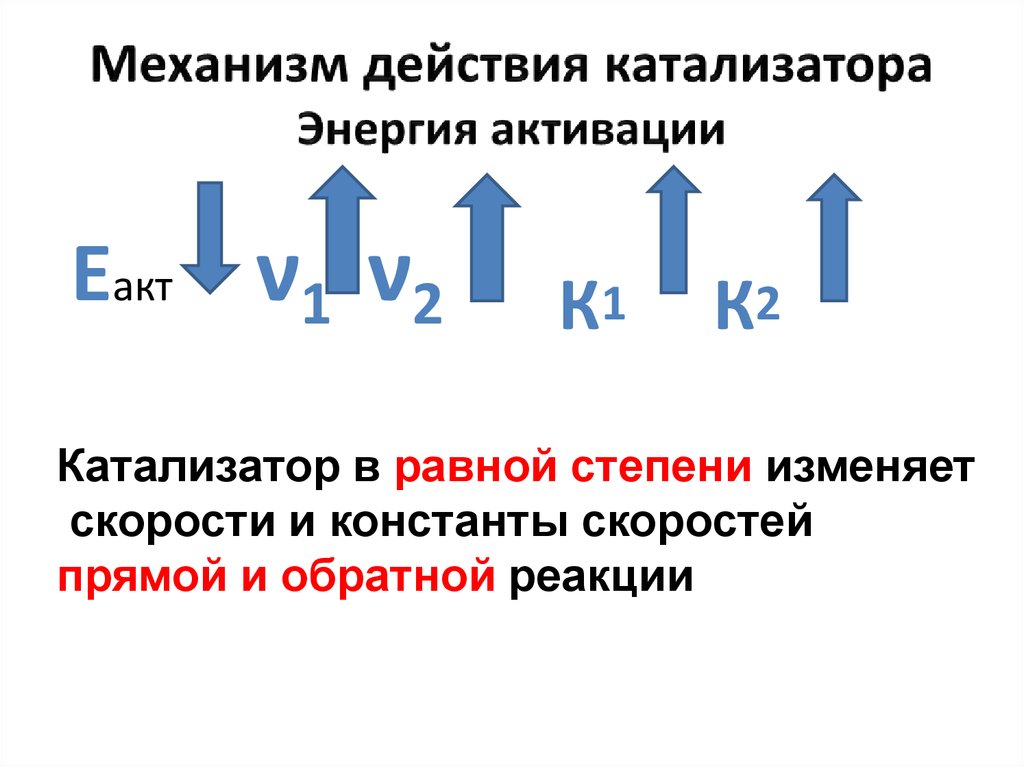
32. Механизм действия катализатора Энергия активации
Еакт ν1 ν2К1
К2
Катализатор в равной степени изменяет
скорости и константы скоростей
прямой и обратной реакции
33. Биокатализаторы
34. Особенности ферментов как биокатализаторов
1. Высокая эффективность действия;2. Избирательность (селективность);
3. Высокая чувствительность к
условиям среды (t, pH и др.);
4. Сложное строение (белковые
структуры).
35.
36.
Кинетические параметры:ν, k, Кравн.
Константа скорости реакции (k)
зависит от:
1.природы реагирующих веществ;
2.температуры;
3.катализатора (Еакт.)
37. Уравнение Аррениуса.
k A eEакт
RT
,
где: k – константа скорости реакции;
R – универсальная газовая постоянная (8,31 Дж/моль.К);
Т – абсолютная температура Кельвина(К);
Еакт – энергия активации (Дж/моль)
А – предэкспоненциальный коэффициент, учитывающий
вероятность и число столкновений;
е – основание натурального логарифма.
38. Константа равновесия
В условиях равновесия для любогообратимого гомогенного процесса
mA + nB pC + qD
k1 [C ] [ D]
K равн
m
n
k2 [ A] [ B]
p
q
Константа равновесия зависит от:
1. природы реагирующих веществ;
2.температуры.
39.
Кравн.k
V
-природа реагирующих веществ;
-температура;
- катализатор;
- концентрация;
- давление (для газов);
40. Принцип Ле - Шателье
Равновесие в системе всегда смещается всторону того процесса, протекание которого
уменьшает эффект внешнего воздействия на
систему.
На смещение влияют:
1.температура
2.концентрация
3.давление (для газов)
! Принцип Ле-Шателье не говорит об изменении
скоростей, констант скоростей и константы равновесия
41. Термодинамика химического равновесия
связь Кравн. со свободной энергией Гиббса:G 2,3 RT lg K равн.
0
G RT ln K равн.
0
G 0, K равн 1
0
G 0, K равн 1
самопроизвольный процесс
0
G 0, K равн 1
термодинамическое равновесие
0
реакция не протекает
42.
СПАСИБО ЗА ВНИМАНИЕПОЗДРАВЛЯЮ С ПОСТУПЛЕНИЕМ В ПСПБГМУ




































 Химия
Химия








