Похожие презентации:
Химическая кинетика и катализ
1.
Химическая кинетикаи катализ
1
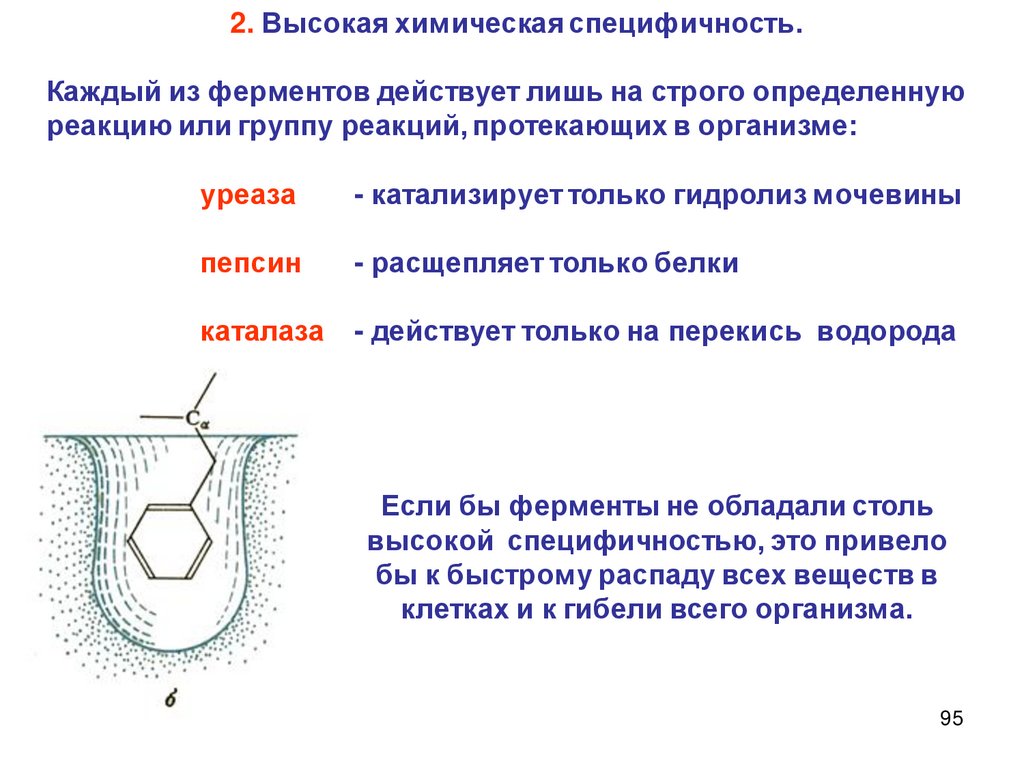
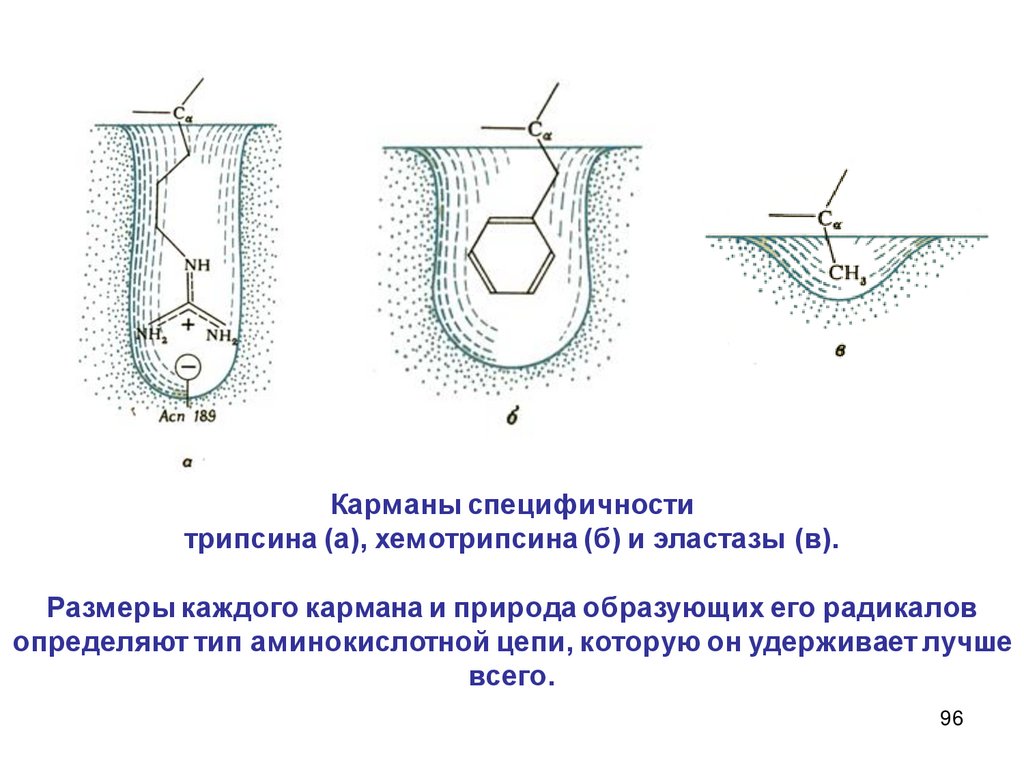
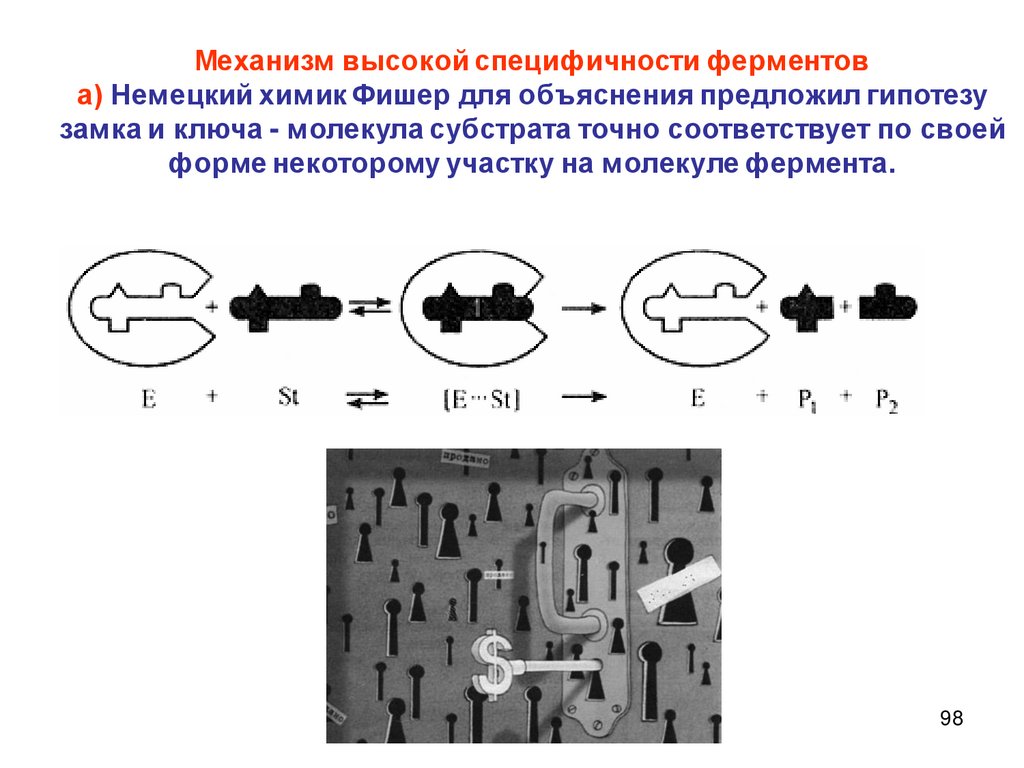
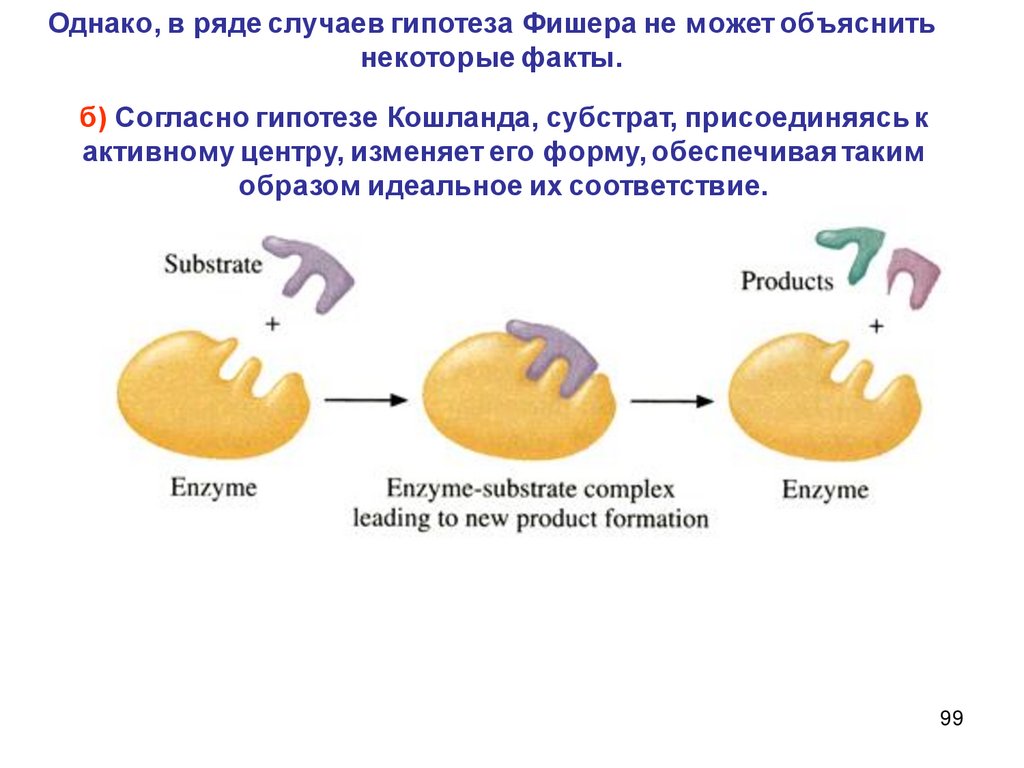
2.
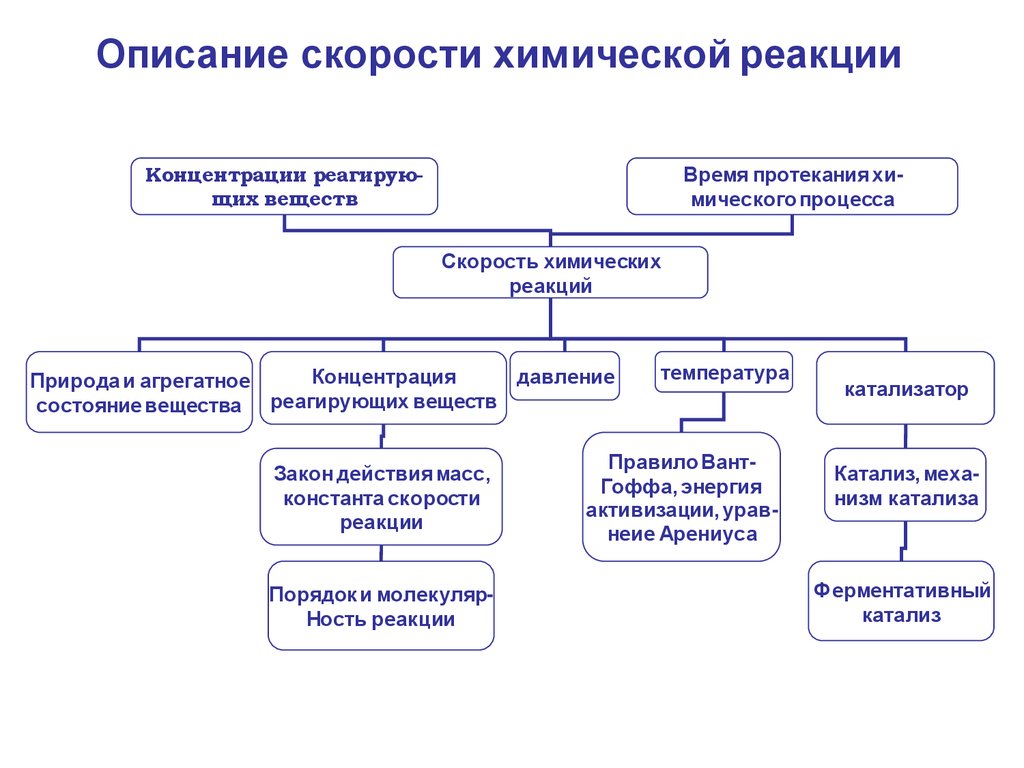
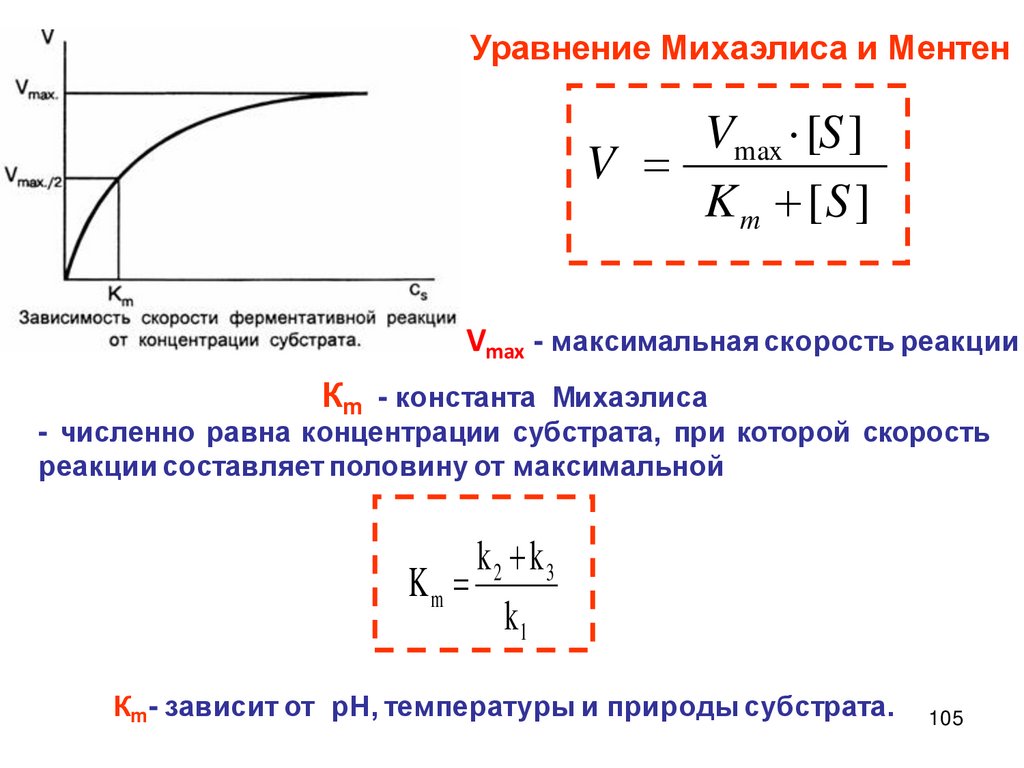
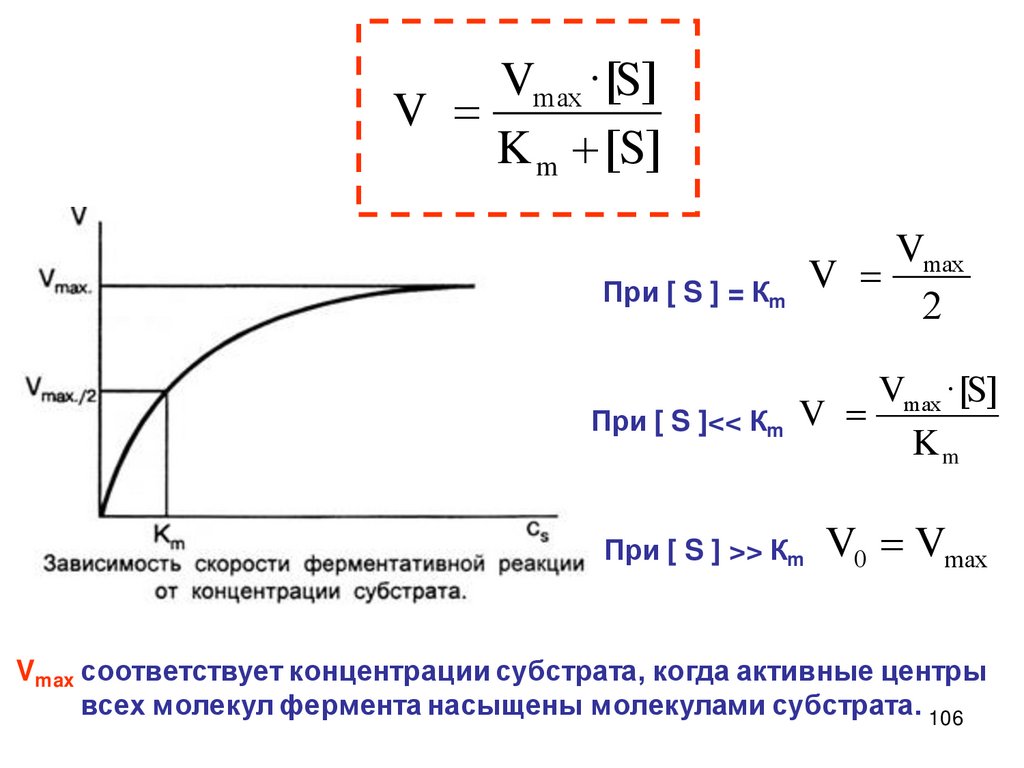
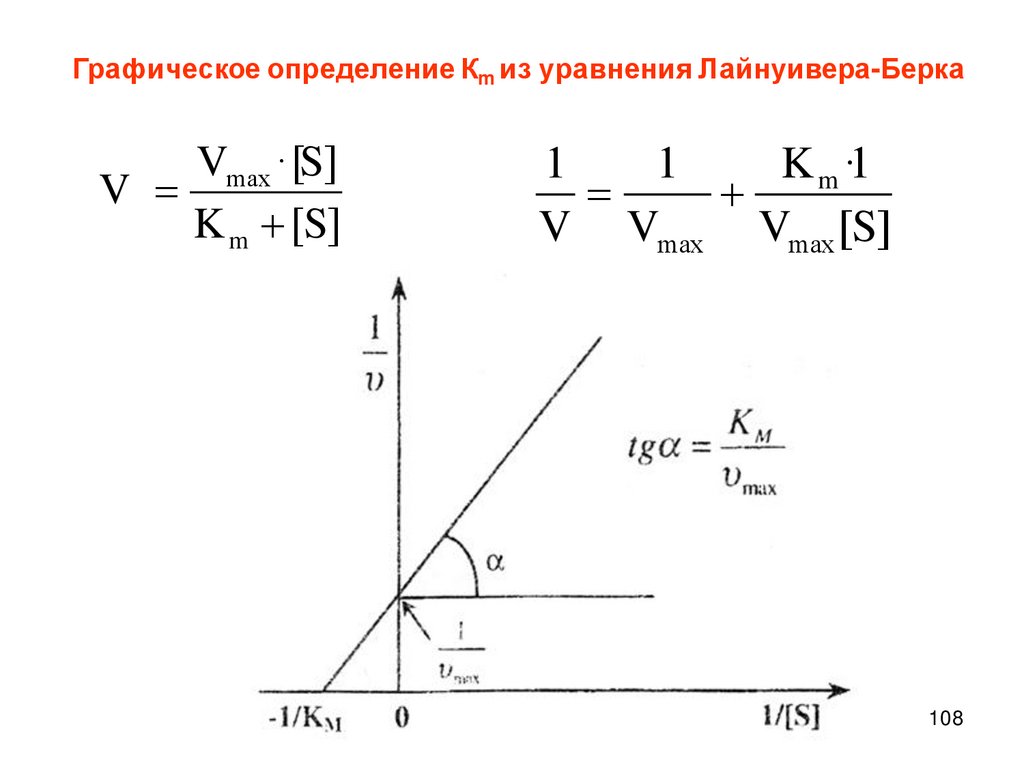
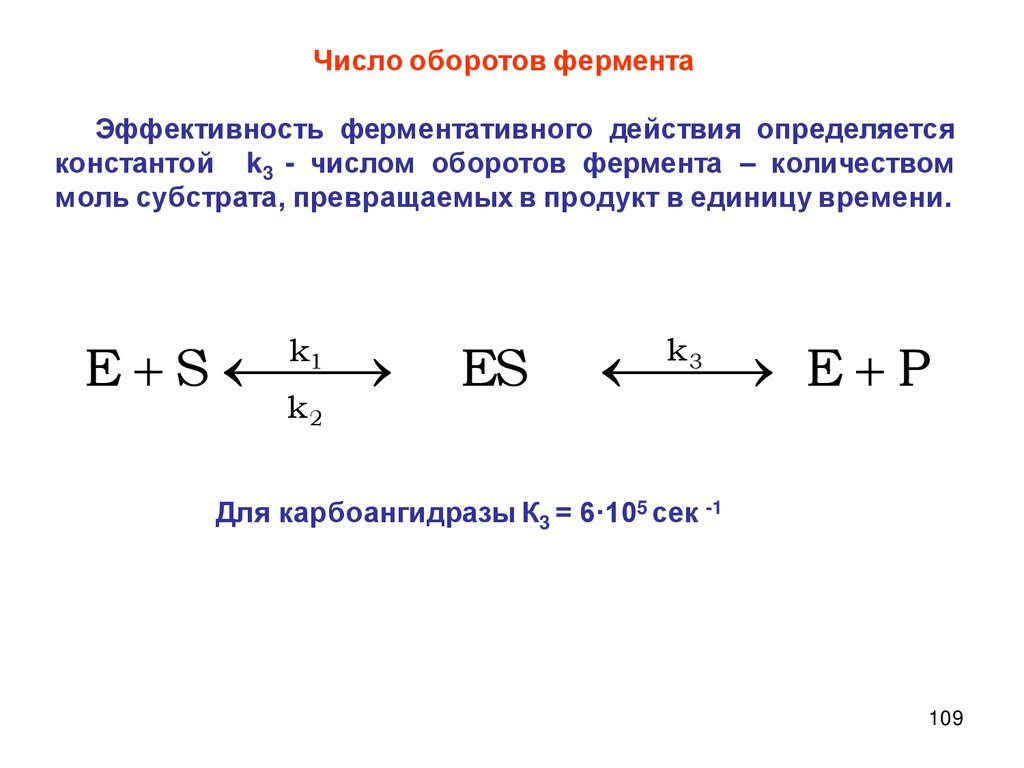
Описание скорости химической реакцииКонцентрации реагирующих веществ
Время протекания химического процесса
Скорость химических
реакций
давление
Концентрация
Природа и агрегатное
состояние вещества реагирующих веществ
Закон действия масс,
константа скорости
реакции
Порядок и молекулярНость реакции
температура
Правило ВантГоффа, энергия
активизации, уравнеие Арениуса
катализатор
Катализ, механизм катализа
Ферментативный
катализ
3.
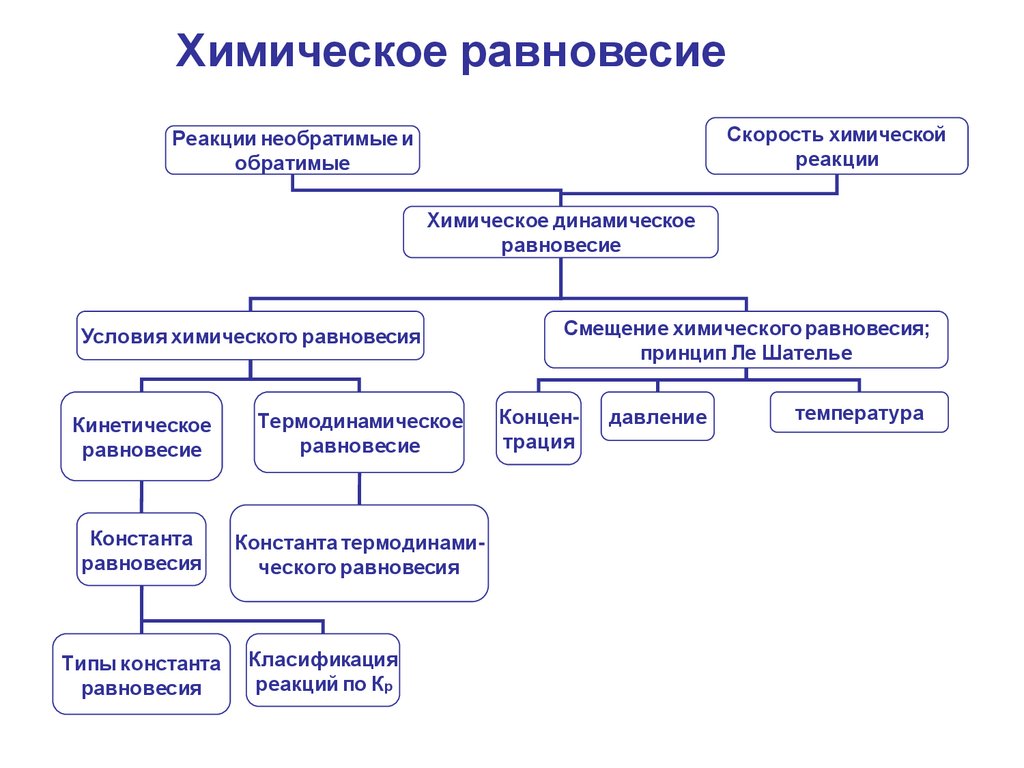
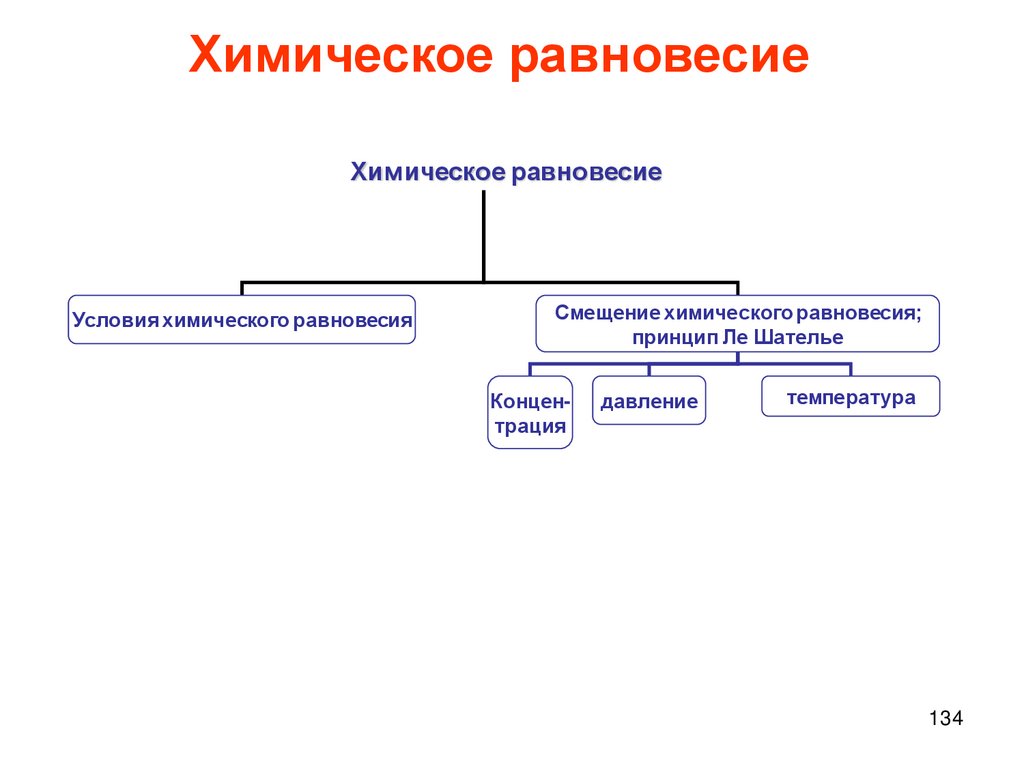
Химическое равновесиеСкорость химической
реакции
Реакции необратимые и
обратимые
Химическое динамическое
равновесие
Условия химического равновесия
Кинетическое
равновесие
Термодинамическое
равновесие
Константа
равновесия
Константа термодинамического равновесия
Типы константа
равновесия
Класификация
реакций по К р
Смещение химического равновесия;
принцип Ле Шателье
Концентрация
давление
температура
4.
ХИМИЧЕСКАЯ КИНЕТИКА И КАТАЛИЗХимическая кинетика - учение о скорости химических реакций
и зависимости ее от различных факторов - природы и
концентрации реагирующих веществ, давления, температуры,
катализаторов.
Взрыв тысячные доли
секунды
Ржавчина - несколько часов
Антрацит сотни,
тысячи лет.
Управление химическим процессом является главной задачей
химической кинетики.
5.
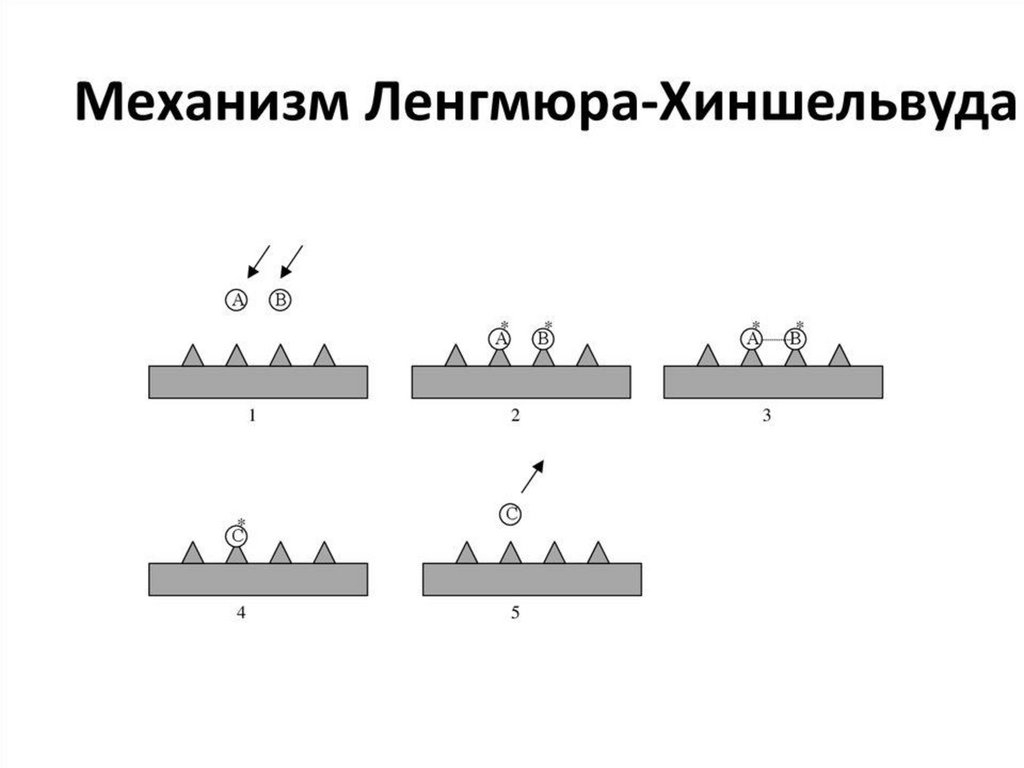
Механизм химических реакцийРеакции, в которых частицы исходных веществ превращаются в
частицы продуктов на молекулярном уровне непосредственно, без
участия промежуточных частиц, называются элементарными.
Большинство элементарных реакций является стадиями составных
реакций. Многие из них отдельно либо не осуществимы либо
осуществимы только в специальных условиях. Это является следствием
того, что промежуточные частицы, как правило, неустойчивы и имеют
высокую реакционную способность.
Реакции, идущие на молекулярном уровне в несколько стадий,
называются сложными или составными. Совокупность стадий,
составляющих сложную реакцию, называется ее молекулярным
механизмом
Br2 + H2
2HBr
6.
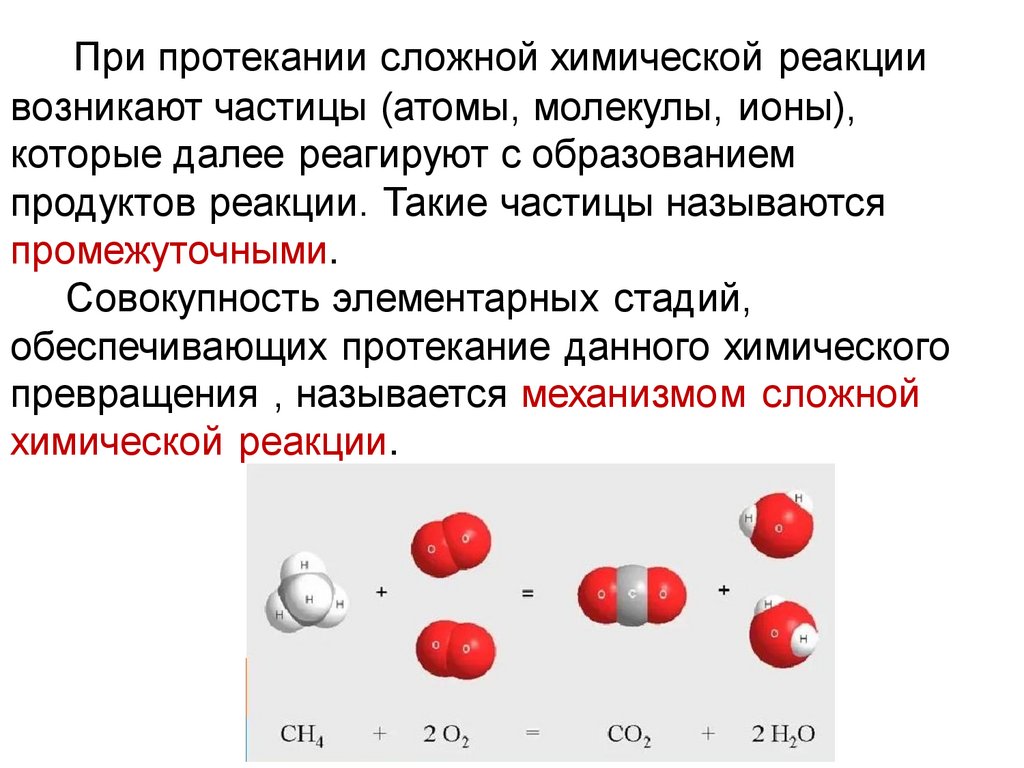
При протекании сложной химической реакциивозникают частицы (атомы, молекулы, ионы),
которые далее реагируют с образованием
продуктов реакции. Такие частицы называются
промежуточными.
Совокупность элементарных стадий,
обеспечивающих протекание данного химического
превращения , называется механизмом сложной
химической реакции.
7.
Реакционное пространствоПо агрегатному состоянию реакционной среды различают:
1) газовые реакции;
2) реакции в растворах;
3) Реакции твердых средах (твердофазные).
Если исходные вещества, продукты и среда образуют одну
фазу (жидкую или газообразную), и взаимодействие между
ними происходит в объеме фазы, то реакцию называют
гомогенной.
Если реагенты находятся в разных агрегатных состояниях,
или химическое превращение происходит на фазовой
границе, то это – гетерогенная реакция.
Например, реакция горения метана:
CH4(газ) + 2O2(газ) → CO2(газ) + 2H2O(газ)
– гомогенная реакция, протекающая в газовой фазе,
а взаимодействие известняка с соляной кислотой:
CaCO3 (Тв) + 2HCl (Р-р)→ CaCl2 (Р-р) + H2O (ж) + CO2 (г).
– гетерогенная реакция, идущая на границе твердое тело – жидкость.
8.
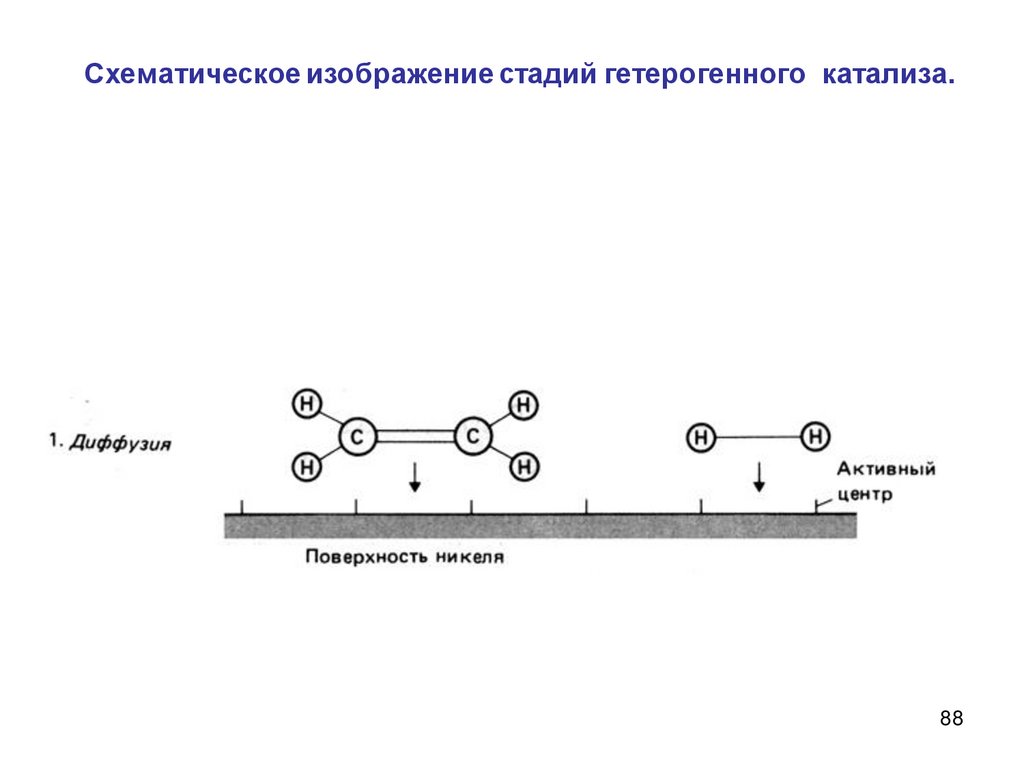
В гетерогенном процессе оба реагирующих веществамогут находиться в одной фазе.
Например, гидрирование этилена
С2Н4+ Н2→ С2Н6
идет на поверхности катализатора, например, никеля. Но
оба реагирующих вещества находятся в одной фазе (в
газовой фазе над поверхностью катализатора).
9.
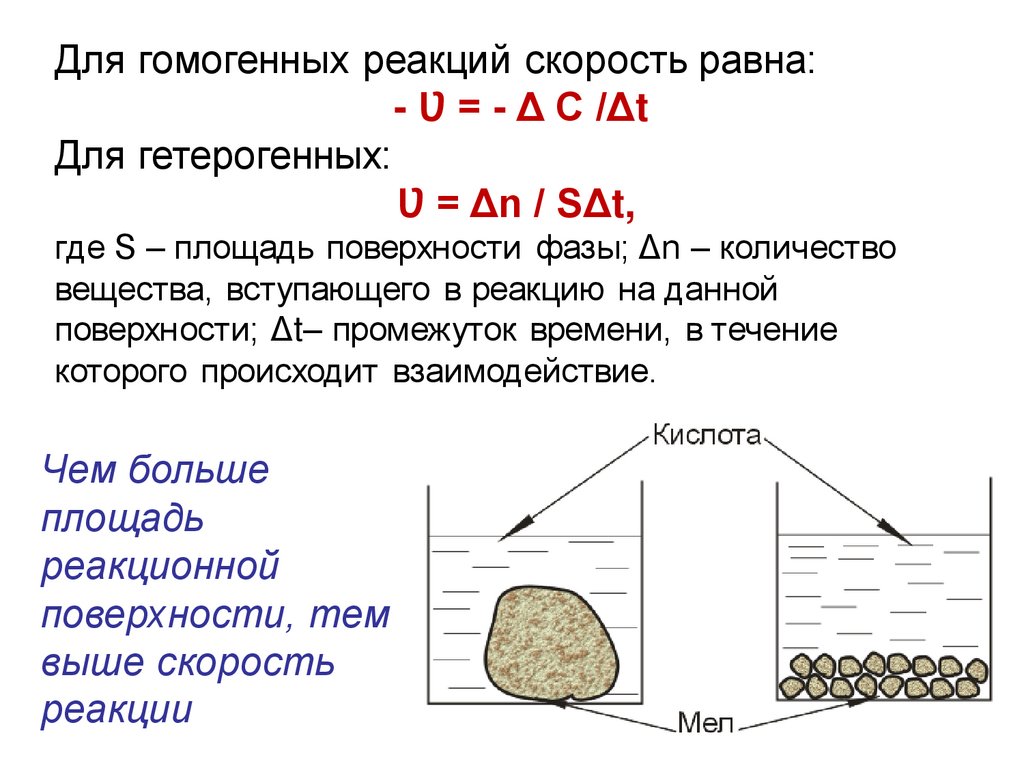
Для гомогенных реакций скорость равна:- Ʋ = - Δ С /Δt
Для гетерогенных:
Ʋ = Δn / SΔt,
где S – площадь поверхности фазы; Δn – количество
вещества, вступающего в реакцию на данной
поверхности; Δt– промежуток времени, в течение
которого происходит взаимодействие.
Чем больше
площадь
реакционной
поверхности, тем
выше скорость
реакции
10.
Гомофазным называется процесс, в котором всекомпоненты: исходные, промежуточные и конечные
вещества – находятся в пределе одной фазы.
Например, реакция нейтрализации кислоты щелочью в
растворе является гомогенным гомофазным процессом.
Гетерофазным называется процесс, в котором
компоненты образуют более чем одну фазу.
Например, гидрирование этилена на никелевом
катализаторе является гетерогенным гомофазным
процессом– процесс идет на границе фаз металла и газа,
а исходные вещества и продукт реакции находятся в
одной газовой фазе).
10
11.
Скорость химической реакцииОсновное понятие химической кинетики –
скорость химической реакции.
1 определение: Скорость химической
реакции есть число элементарных актов
химической реакции, происходящих в
единицу времени в единице объема (для
гомогенных реакций) или на единице
поверхности (для гетерогенных реакций).
11
12.
2 определение: Скорость реакции изменение концентрации реагирующихвеществ в единицу времени.
C
Vср
t
Моль/л·сек
За промежуток времени Δt = t2 - t1 концентрация
реагирующих веществ уменьшается на - ΔС = С1 - С2
12
13.
Средняя скорость не отражает истинной скорости в каждыймомент времени, поэтому мгновенную ( истинную ) скорость
реакции в данный момент принято выражать отношением
бесконечно малого изменения концентрации dC к бесконечно
малому отрезку времени dt, в течение которого произошло
изменение концентрации:
dC
v
dt
Моль/л·сек
13
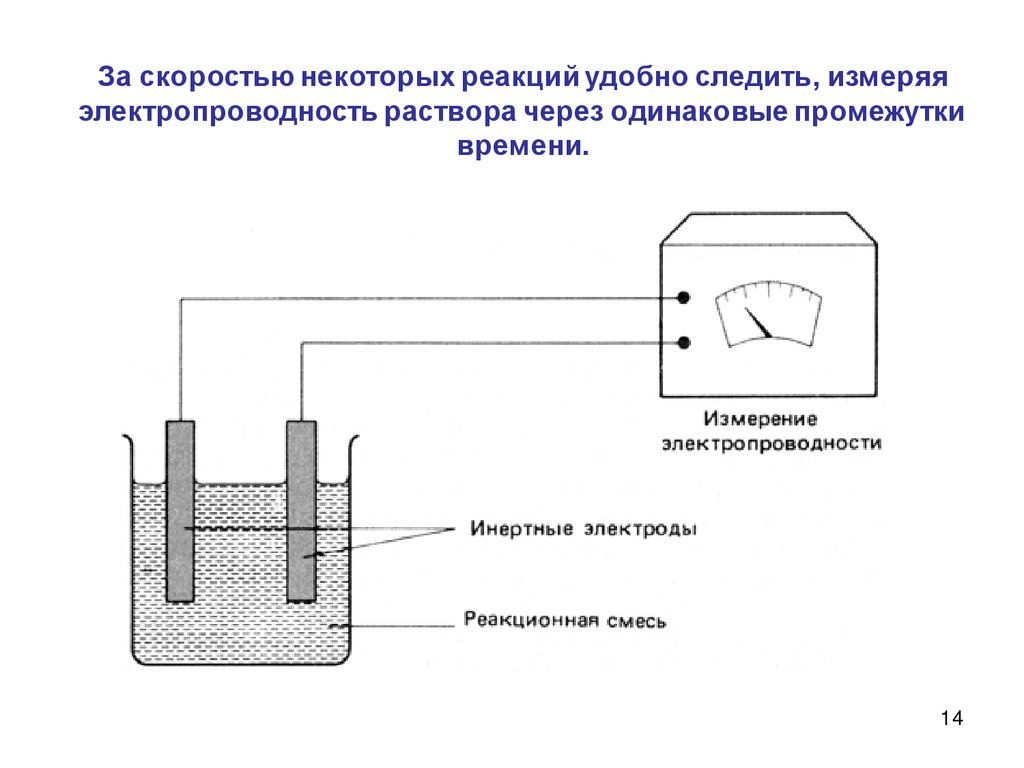
14.
За скоростью некоторых реакций удобно следить, измеряяэлектропроводность раствора через одинаковые промежутки
времени.
14
15.
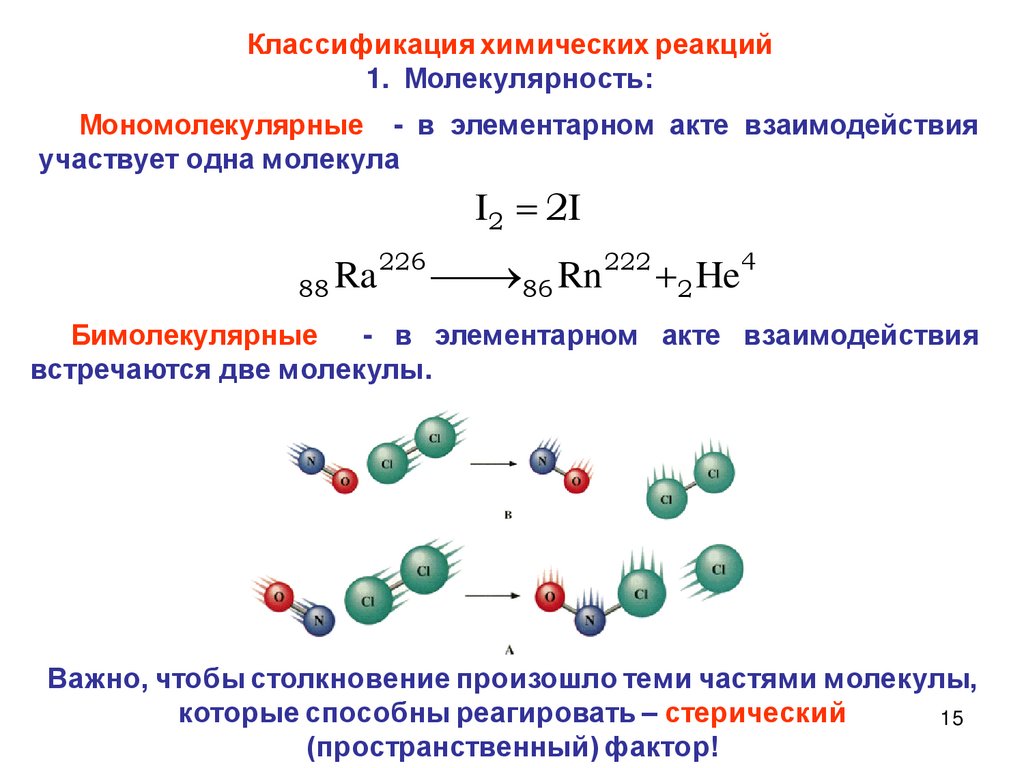
Классификация химических реакций1. Молекулярность:
Мономолекулярные - в элементарном акте взаимодействия
участвует одна молекула
I2 2I
226
222
4
Ra
Rn
He
88
86
2
Бимолекулярные
- в элементарном акте взаимодействия
встречаются две молекулы.
Важно, чтобы столкновение произошло теми частями молекулы,
которые способны реагировать – стерический
15
(пространственный) фактор!
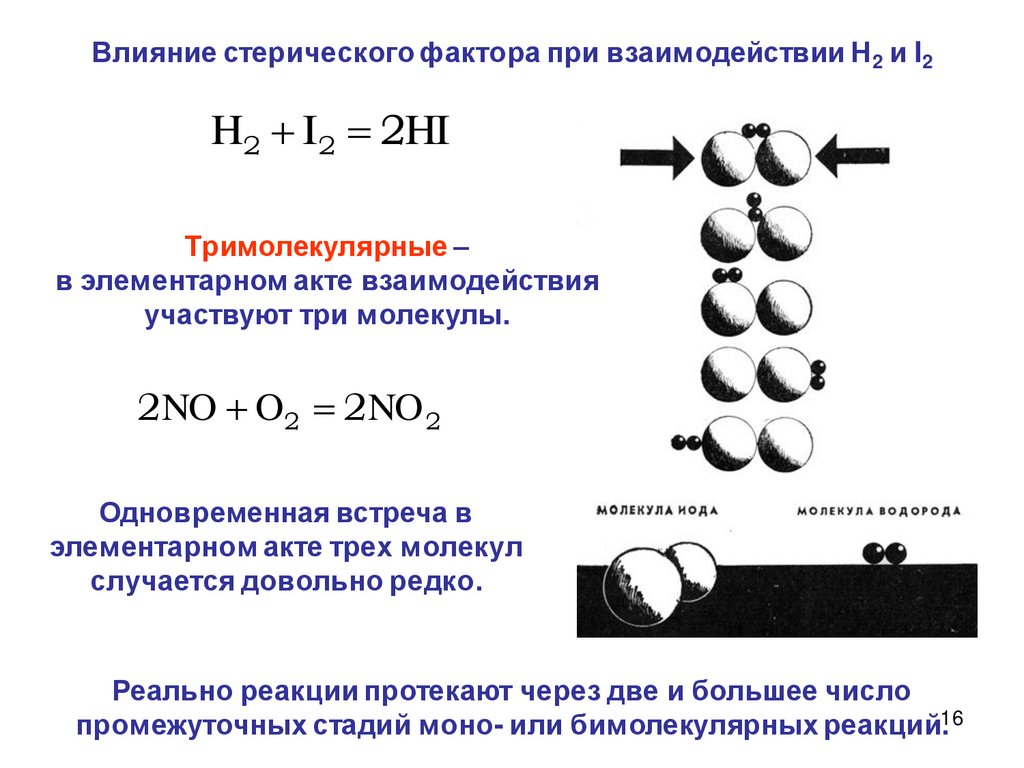
16.
Влияние стерического фактора при взаимодействии Н2 и I2H2 I2 2HI
Тримолекулярные –
в элементарном акте взаимодействия
участвуют три молекулы.
2NO O 2 2NO 2
Одновременная встреча в
элементарном акте трех молекул
случается довольно редко.
Реально реакции протекают через две и большее число
промежуточных стадий моно- или бимолекулярных реакций.16
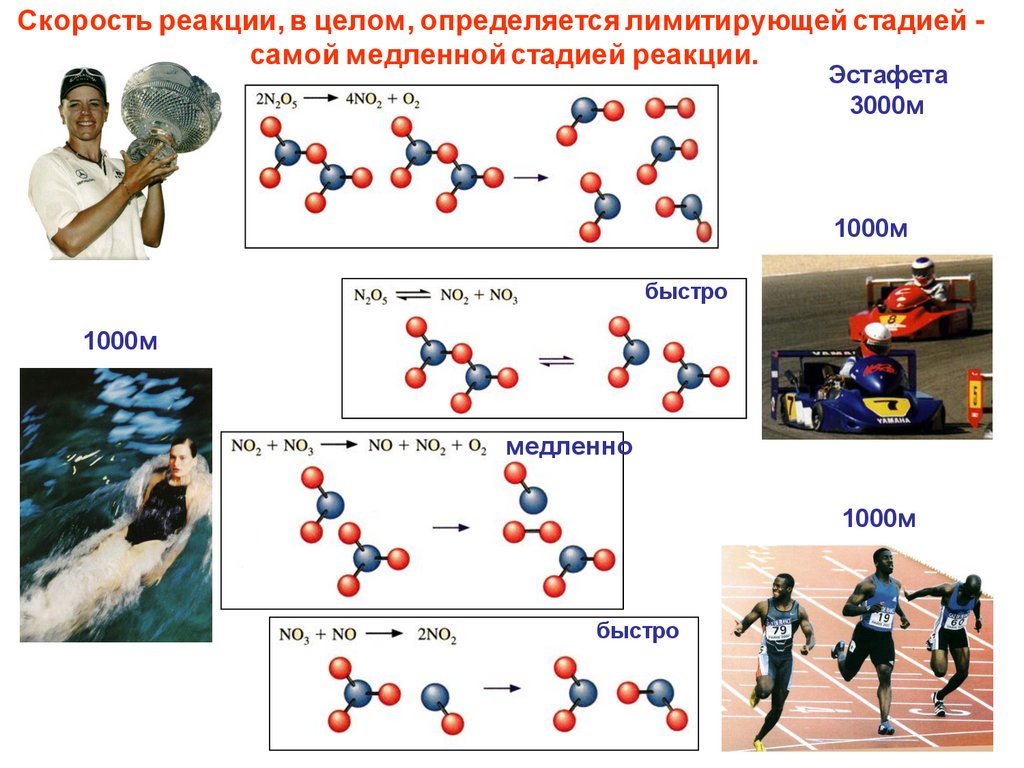
17.
Скорость реакции, в целом, определяется лимитирующей стадией самой медленной стадией реакции.Эстафета
3000м
1000м
быстро
1000м
медленно
1000м
быстро
17
18.
Классификация химических реакций по механизмуПоследовательные - идущие через
несколько различных промежуточных
стадий
(А В С D ...)
фотосинтез
биологическое окисление глюкозы
Сопряженные - идущие через общую
промежуточную стадию:
- окисление углеводов и липидов вызывает синтез
аденозинфосфорной кислоты (С), которая индуцирует
биосинтез белков и нуклеиновых кислот
18
19.
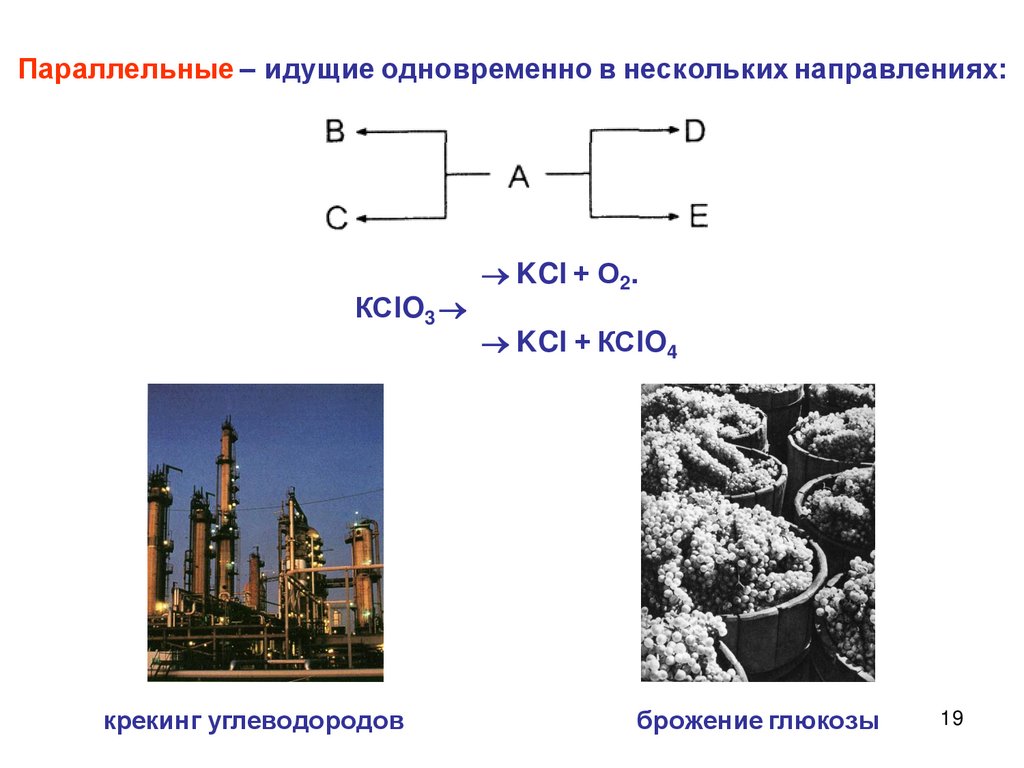
Параллельные – идущие одновременно в нескольких направлениях:КСlO3
крекинг углеводородов
KCl + О2.
KCl + КСlO4
брожение глюкозы
19
20.
Цепные - стадии превращенияисходных соединений в продукты
многократно повторяются:
Cl 2 Cl Cl
Cl H 2 HCl H
H Cl 2 HCl Cl
Cl Cl Cl 2 (обрыв цепи )
H H H 2 (обрыв цепи )
Окончил Петроградский университет в 1917 году.
Разработанная им теория цепных реакций
позволила управлять химическими процессами:
ускорять, замедлять, подавлять вовсе, обрывать на
Николай Семенов
любой желаемой стадии.
(15.04.1896 -25.09.1986)
Нобелевская премия (1956 г.).
20
21.
Общая схема образования свободных радикаловСвободнорадикальное окисление в организме приводит к
патологическим
биопроцессам - канцерогенезу, лучевой
болезни.
Радиоактивное, ультрафиолетовое и лазерное облучение,
шум, вибрация, способствуют накоплению свободных
радикалов в организме.
21
22.
Причины образования свободных радикалов22
23.
Избыточные свободные радикалы в организме являютсяпричиной огромного числа заболеваний:
• алкогольное поражение печени и
сердца
аутоиммунные заболевания
нарушения кровообращения
ишемическая болезнь сердца
эмфизема легких
воспалительные процессы
рассеянный склероз
преждевременное старение
заболевания сетчатки,
коллагенозы
артриты
артериосклероз
рак
катаракта
диабет
цирроз печени
малярия
порфири
болезнь Паркинсона
старческое слабоумие
23
24.
Кислородный стрессСвободные радикалы:
1. Разрушают цепи между
нуклеотидами, что приводит к
мутации клетки
24
25.
Кислородныйстресс
2. Повреждают мембраны
25
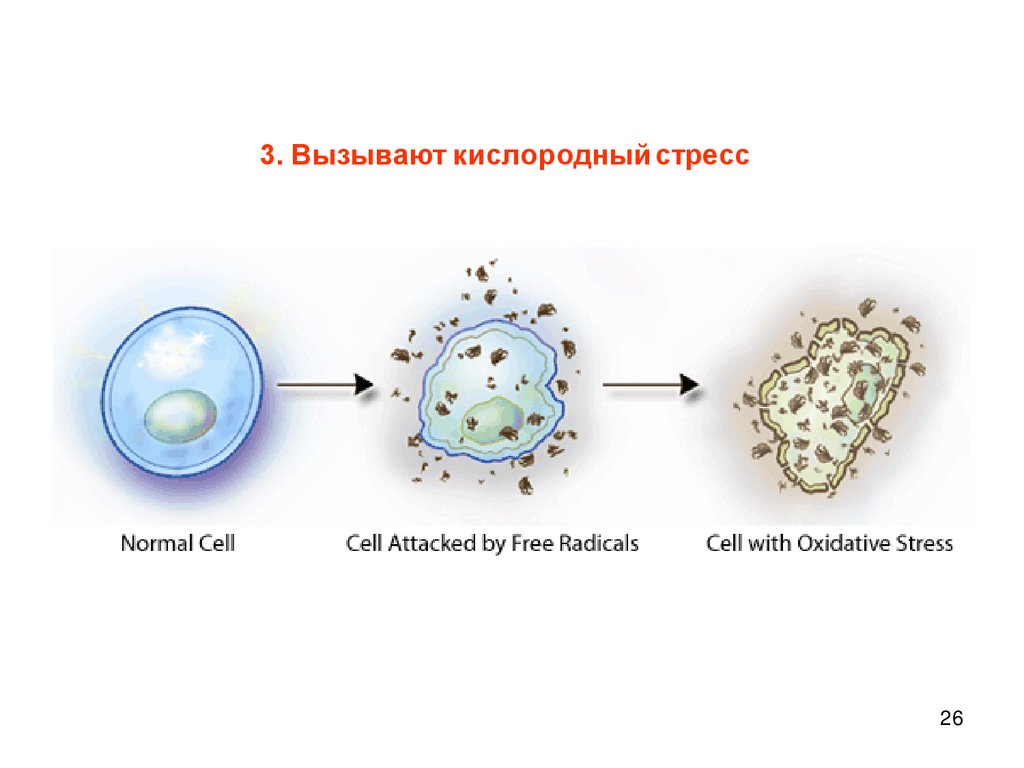
26.
3. Вызывают кислородный стресс26
27.
Антиоксиданты– вещества, обратимо реагирующие со свободными
радикалами и окислителями предохраняющие жизненно
важные метаболиты от их воздействия
Супероксиддисмутаза – СОД, цистеин, витамины С, К, Е, Р, В2,
В3, В6 -каротин, лютеин,ликопен, кофермент Q10
27
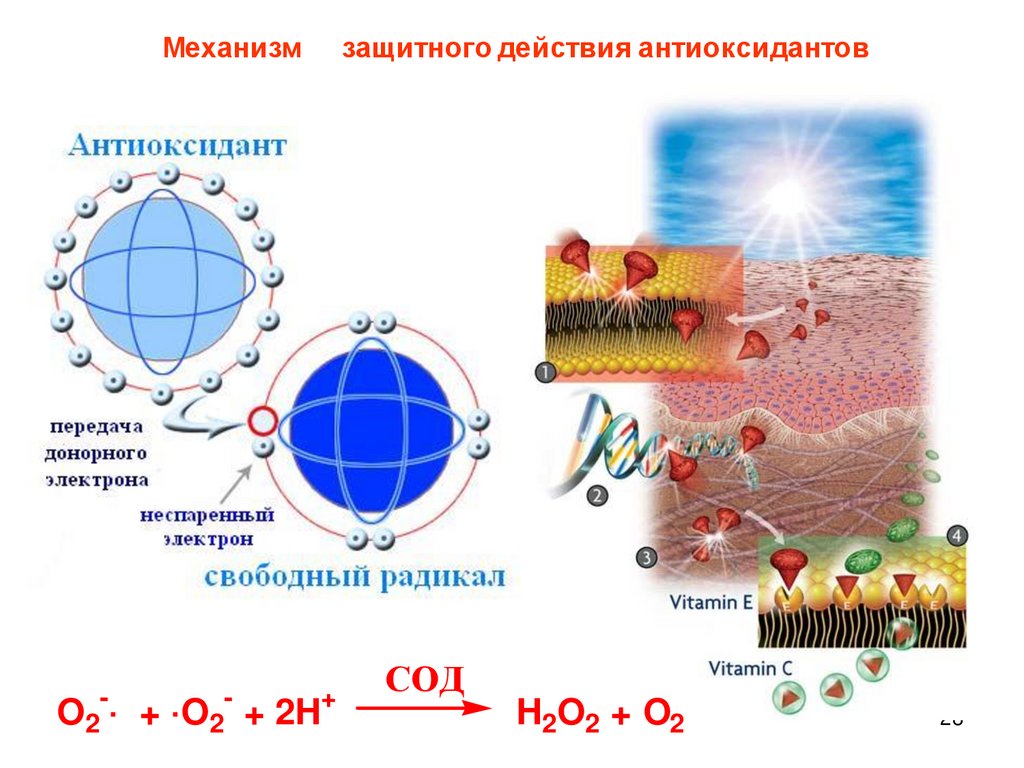
28.
МеханизмO2-·
+ ·O2- + 2H+
защитного действия антиоксидантов
СОД
H2O2 + O2
28
29.
250 лет мог бы работать человеческий мозг, если бысуществовала надежная защита от свободных радикалов!!!
29
30.
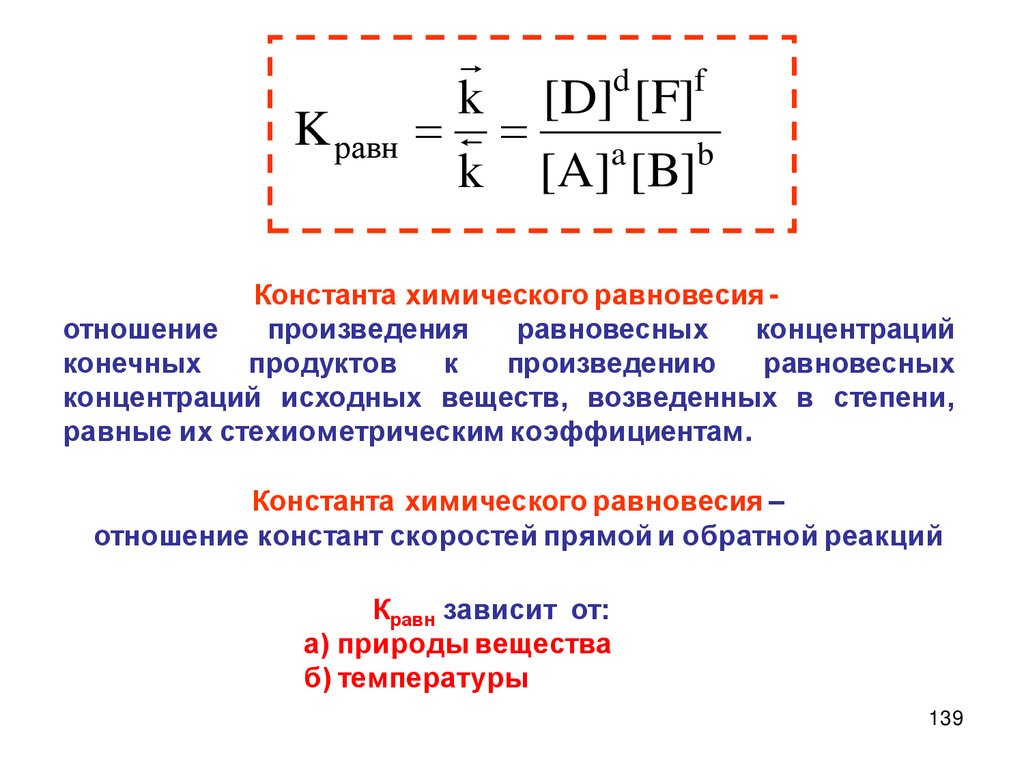
Закон действующих масс(ЗДМ)
Скорость гомогенной реакции при
постоянной
температуре
пропорциональна
произведению
молярных концентраций реагирующих
веществ.
aA bB dD fF
ГУЛЬДБЕРГ
Като Максимилиан
(2.08.1836-14.1.1902)
Основные научные
работы –
в области химической
кинетики и
термодинамики.
v k[A] [B]
a
b
k - константа скорости химической реакции
а – порядок реакции по реагенту А,
b – порядок реакции по реагенту В,
n = a + b – общий порядок реакции
30
31.
v k[A] [B]a
b
k - константа скорости химической реакции
(удельная скорость реакции) численно равна скорости
химической
реакции
при
концентрациях
всех
реагирующих веществ, равных 1 моль/л и зависит от:
природы реагирующих веществ
температуры
катализатора
k не зависит от концентрации реагирующих веществ!
Единицы измерения константы скорости
зависят от порядка реакции:
n=0, [k] = [моль/(л•с)]
n=1, [k]=[1/с],
n=2, [k] = [л/(с•моль)]
31
32.
Порядок реакцииПорядок реакции - сумма показателей степеней, с которыми
концентрации реагентов входят в экспериментально
найденное кинетическое уравнение
n1A n 2B n 3C n 4D
Общий порядок
n = n1 + n2
Стехиометрическое уравнение реакции описывает процесс в
целом и не отражает истинного механизма реакции.
32
33.
Важное замечание!Концентрация конденсированной фазы
не включается в выражение ЗДМ, т.к. она
является постоянной величиной.
Пример:
СаО (к) + СО2 (г) = СаСО3
ЗДМ должен быть записан Ʋ = k • ССО2 .
для реакции H2O (ж) + NH3 (г) = NH4OH
ЗДМ имеет вид Ʋ = k • СNH3
33
34.
СКОРОСТЬ РЕАКЦИИ МОЖЕТ ЗАВИСЕТЬ ОТКОНЦЕНТРАЦИЙ ОБОИХ РЕАГЕНТОВ, ИЛИ ТОЛЬКО ОТ
КОНЦЕНТРАЦИИ ОДНОГО РЕАГЕНТА, А МОЖЕТ И ВОВСЕ
НЕ ЗАВИСИТЬ ОТ КОНЦЕНТРАЦИЙ РЕАГЕНТОВ, ТОГДА
ПОРЯДОК БУДЕТ РАВЕН 0.
Порядок реакции указывает на сложность ее механизма:
чем больше порядок, тем сложнее механизм. При этом его
величина иногда бывает равна стехиометрическому
коэффициенту, но чаще всего она с ним не совпадает.
Например, для реакции 2N2O5 → 2N2O4 + O2
по ЗДМ порядок должен быть равен 2. Однако
экспериментальные данные о скорости данной реакции дают
порядок 1
Ʋ = k • СN2О5
Поэтому порядок реакции всегда определяют только
34
экспериментально.
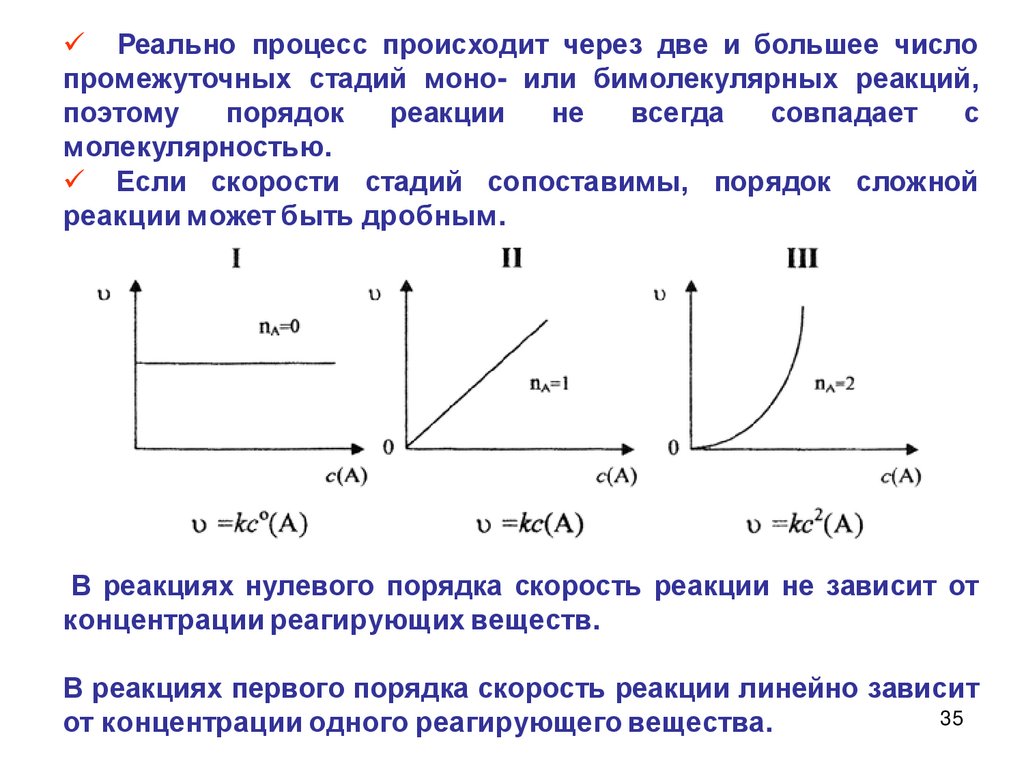
35.
Реально процесс происходит через две и большее числопромежуточных стадий моно- или бимолекулярных реакций,
поэтому
порядок
реакции
не
всегда
совпадает
с
молекулярностью.
Если скорости стадий сопоставимы, порядок сложной
реакции может быть дробным.
В реакциях нулевого порядка скорость реакции не зависит от
концентрации реагирующих веществ.
В реакциях первого порядка скорость реакции линейно зависит
35
от концентрации одного реагирующего вещества.
36.
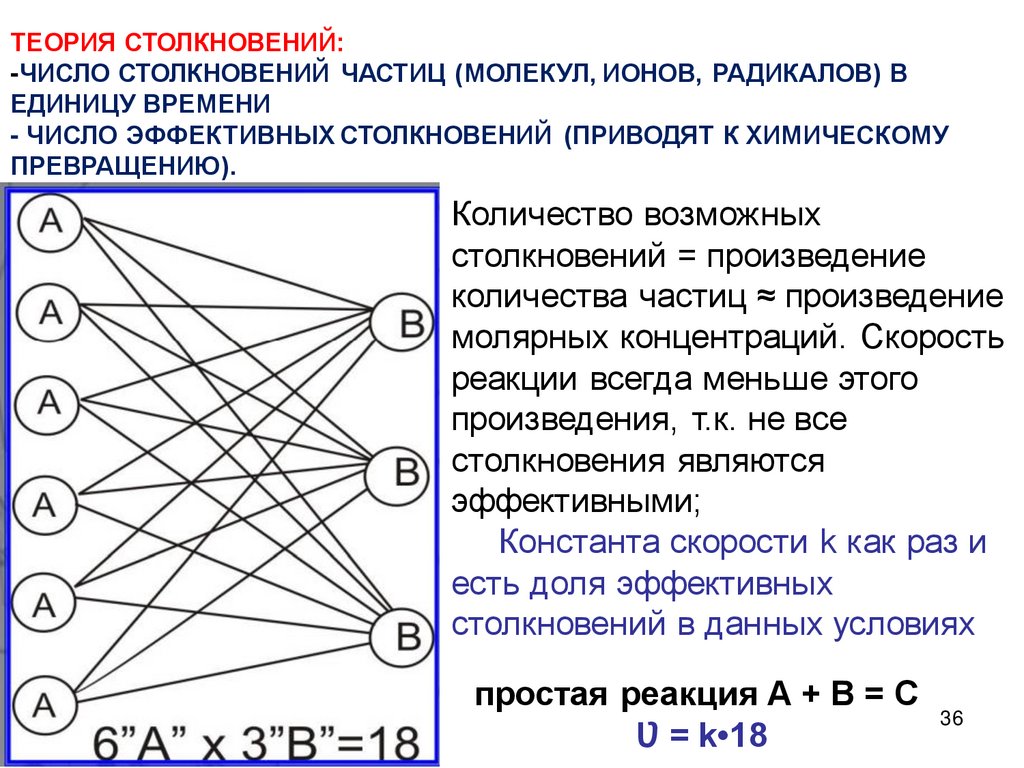
ТЕОРИЯ СТОЛКНОВЕНИЙ:-ЧИСЛО СТОЛКНОВЕНИЙ ЧАСТИЦ (МОЛЕКУЛ, ИОНОВ, РАДИКАЛОВ) В
ЕДИНИЦУ ВРЕМЕНИ
- ЧИСЛО ЭФФЕКТИВНЫХ СТОЛКНОВЕНИЙ (ПРИВОДЯТ К ХИМИЧЕСКОМУ
ПРЕВРАЩЕНИЮ).
Количество возможных
столкновений = произведение
количества частиц ≈ произведение
молярных концентраций. Скорость
реакции всегда меньше этого
произведения, т.к. не все
столкновения являются
эффективными;
Константа скорости k как раз и
есть доля эффективных
столкновений в данных условиях
простая реакция А + В = С
36
Ʋ = k•18
37.
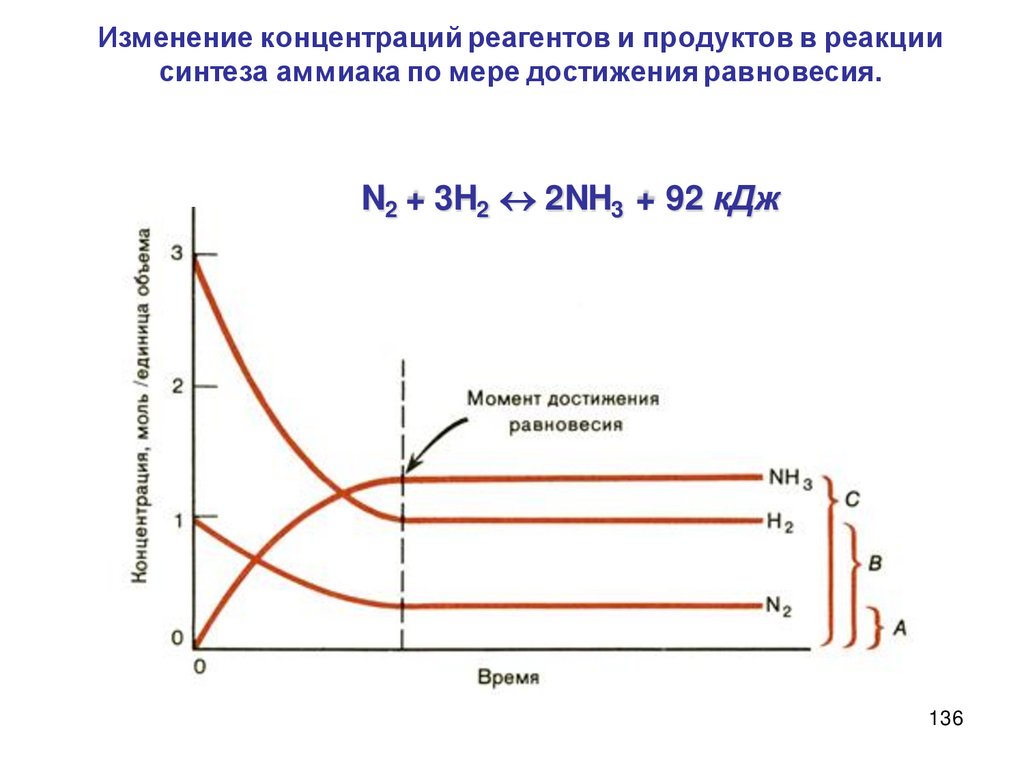
Кинетические кривые для исходныхвеществ (А) и продуктов реакции (В)
37
38.
Скорость химической реакции – изменениеконцентрации исходных реагентов или продуктов
за единицу времени:
аА + bB → cC + dD
В замкнутом постоянном объеме реагенты А и В
будут исчезать со скоростью
Ʋ = - ΔСA/Δτ и Ʋ = - ΔСВ/Δτ,
а продукты С и D будут накапливаться со скоростью
Ʋ = ΔСС/Δτ и Ʋ = ΔСD/Δτ.
38
39.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬГОМОГЕННЫХ РЕАКЦИЙ
природа реагирующих веществ
концентрация реагентов
температура
катализатор
39
40.
ВЛИЯНИЕ ПРИРОДЫ РЕАГИРУЮЩИХ ВЕЩЕСТВСкорость химической реакции зависит от
природы химических соединений, подобно тому,
как
скорость
физических
процессов
определяется свойствами веществ. Например,
скорость истечения жидкостей зависит от их
вязкости.
40
41.
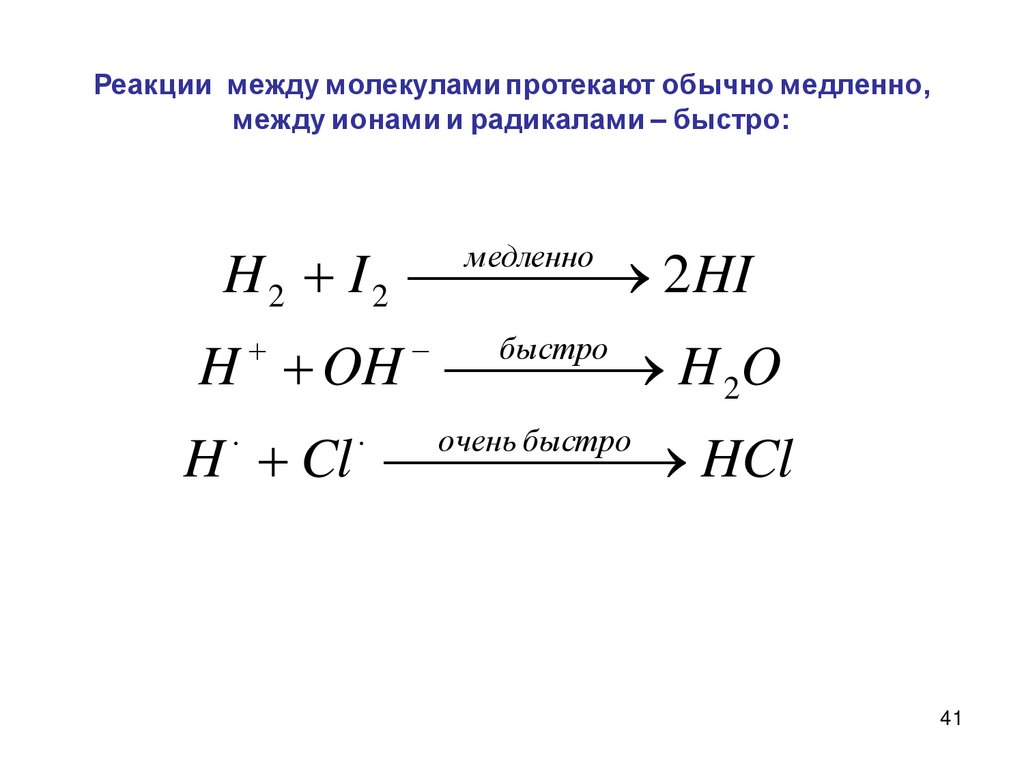
Реакции между молекулами протекают обычно медленно,между ионами и радикалами – быстро:
H 2 I 2
2 HI
медленно
H OH H 2O
быстро
H Cl
HCl
очень быстро
41
42.
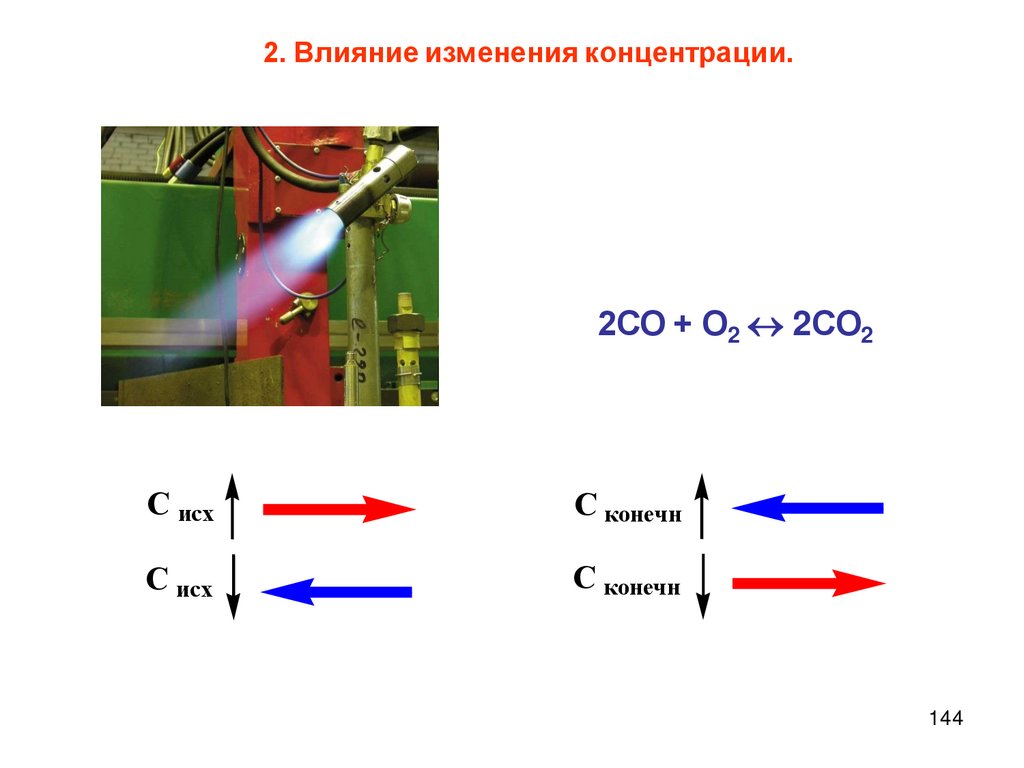
Влияние концентрации реагентовСкорость
химической
реакции
зависит от концентрации реагирующих
веществ - чем выше концентрация, тем
больше скорость реакции, что связано
с увеличением числа эффективных
соударений молекул.
42
43.
Концентрации твердых веществ вгетерогенных системах не входят в
выражение константы химического
равновесия, так как они учитываются
величинами константы скорости
гетерогенной реакции:
CaCO 3 (тв)
СaO(тв) CO2 (г)
v k
- реакция нулевого порядка
v k[CO2 ] - реакция первого порядка
Вместе с тем, чем больше поверхность
соприкосновения, тем быстрее протекает реакция.
Поверхность твердых веществ может быть увеличена
путем их измельчения, а для растворимых веществ путем их растворения.
43
44.
Кинетическое уравнение химическойреакции. Порядок реакции
Одна из задач химической кинетики –
определение состава реакционной смеси (т.е.
концентраций всех реагентов) в любой момент
времени, для чего необходимо знать зависимость
скорости реакции от концентрации.
В общем случае, чем больше концентрации
реагирующих веществ, тем больше скорость
химической реакции.
44
45.
Константы скорости реакций различного порядкаимеют разные единицы измерения и являются
разными физическими величинами, сопоставление
их абсолютных значений лишено какого бы то ни
было смысла.
Зависимость скорости реакции от концентраций
реагирующих веществ определяется
экспериментально и называется кинетическим
уравнением химической реакции.
Чтобы записать кинетическое уравнение,
необходимо экспериментально определить
величину константы скорости и показателей
степени при концентрациях реагирующих веществ.
45
46.
Показатель степени при концентрации каждого из реагирующихвеществ в кинетическом уравнении химической реакции есть
частный порядок реакции по данному компоненту.
Сумма показателей степени в кинетическом уравнении
химической реакции представляет собой общий порядок
реакции. Порядок реакции определяется только из
экспериментальных данных и не связан со стехиометрическими
коэффициентами при реагентах в уравнении реакции.
Стехиометрическое уравнение реакции представляет собой
уравнение материального баланса и не может определять
характера протекания этой реакции во времени.
В химической кинетике принято классифицировать
реакции по величине общего порядка реакции.
Рассмотрим зависимость концентрации реагирующих
веществ от времени для необратимых (односторонних)
46
реакций нулевого, первого и второго порядков.
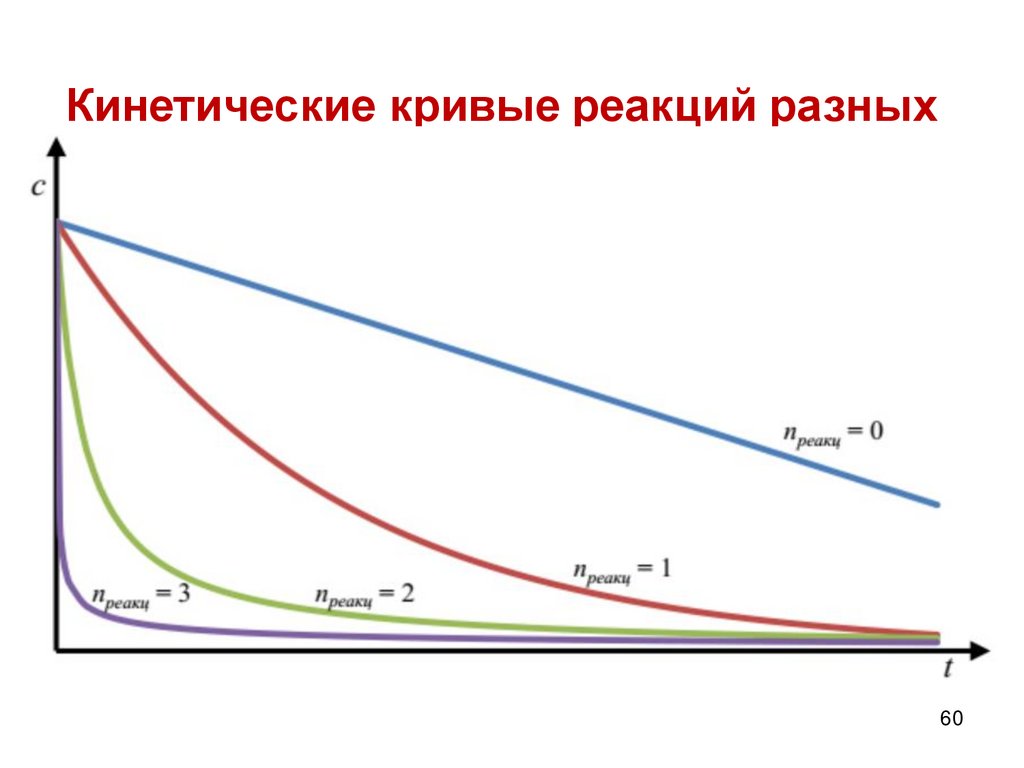
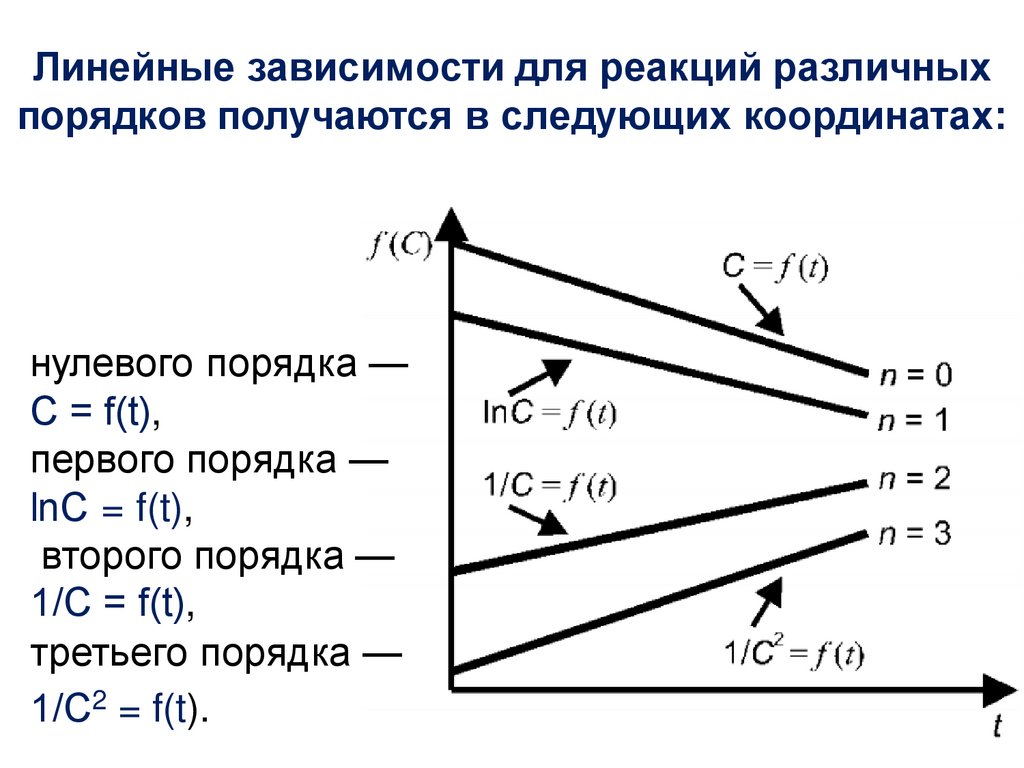
47.
Реакции нулевого порядкаДля реакций нулевого порядка кинетическое
уравнение:
Ʋ=k0
Скорость реакции нулевого порядка постоянна во
времени и не зависит от концентраций реагирующих
веществ.
Нулевой порядок характерен для многих
гетерогенных (идущих на поверхности раздела фаз)
реакций в том случае, когда скорость диффузии
реагентов к поверхности меньше скорости их
химического превращения.
47
48.
Реакции 0 порядка – скорость независит от концентрации:
48
49.
4950.
Константу интегрирования g определим изначальных условий:
в момент времени t=0 концентрация С равна
начальной концентрации С0
Следовательно g = lnС0 .
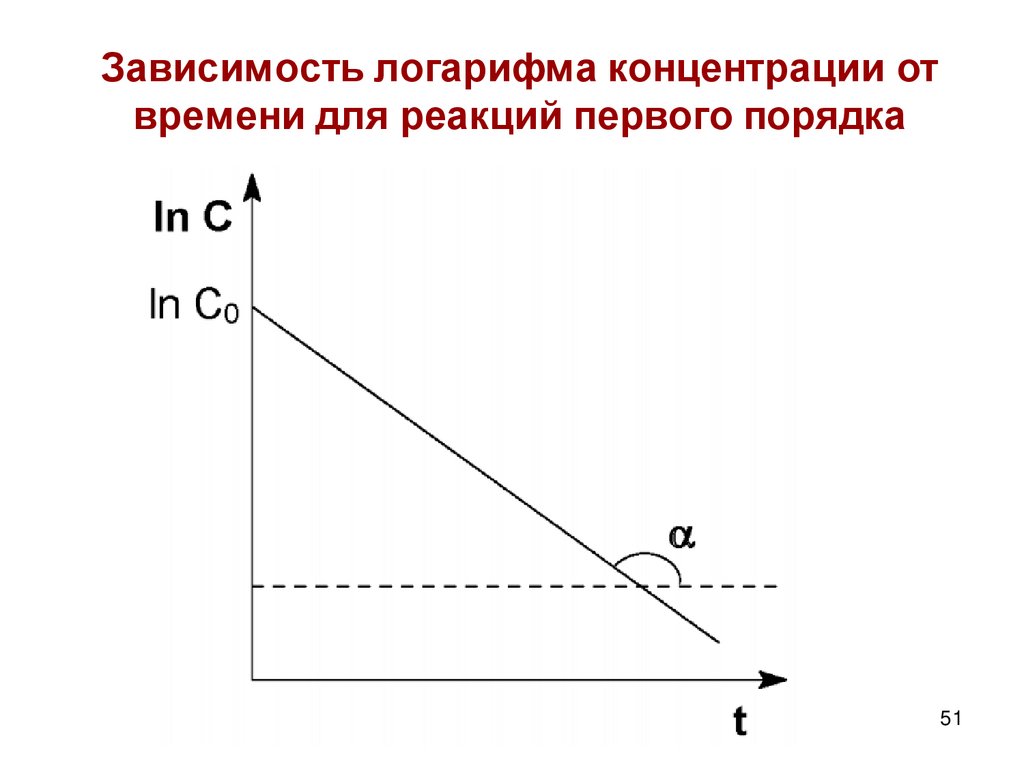
Получаем: lnC = lnС0 –k1t
Следовательно, логарифм концентрации для
реакции первого порядка линейно зависит от
времени и константа скорости численно равна
тангенсу угла наклона прямой к оси времени.
k1=-tgα
50
51.
Зависимость логарифма концентрации отвремени для реакций первого порядка
51
52.
5253.
5354.
5455.
5556.
Зависимость обратной концентрации от временидля реакций второго порядка























































































 Химия
Химия








