Похожие презентации:
13 группа (B, Al, Ga, In, Tl)
1.
III группа: В, Аl, Ga, In, Tl• В невозбужденном состоянии конфигурация
внешнего уровня …ns2np1,
• в возбужденном состоянии …ns1np2
2s
22p1
B:
2s
5
12p2
B:
2s
5
2p
2.
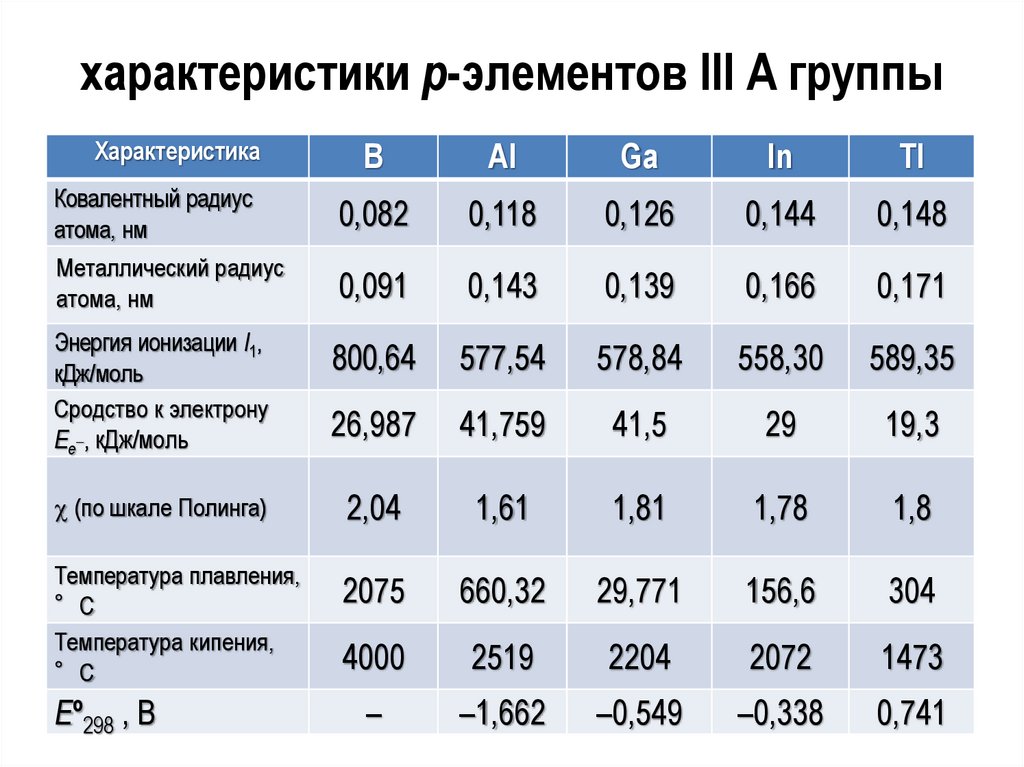
характеристики р-элементов III А группыХарактеристика
B
Al
Ga
In
Tl
Ковалентный радиус
атома, нм
Металлический радиус
атома, нм
0,082
0,118
0,126
0,144
0,148
0,091
0,143
0,139
0,166
0,171
Энергия ионизации I1,
кДж/моль
Сродство к электрону
Ее_, кДж/моль
800,64
577,54
578,84
558,30
589,35
26,987
41,759
41,5
29
19,3
(по шкале Полинга)
2,04
1,61
1,81
1,78
1,8
Температура плавления,
°С
Температура кипения,
°С
2075
660,32
29,771
156,6
304
4000
2519
2204
2072
1473
–
–1,662
–0,549
–0,338
0,741
Еº298 , В
3.
Природные соединения бораКислородные соединения: борная кислота H3BO3 и
бура Na2B4O7 · 10H2O
Бор – кристаллическое вещество, черного цвета,
тугоплавкое.
Кристаллический
бор
–
полупроводник;
электропроводность возрастает с повышением
температуры.
Аморфная
модификация
бора
более
реакционноспособна.
4.
Получение бора• Нагреванием борную кислоту переводят в
борный ангидрид, В2О3 восстанавливают:
t
3MgO + 2B
В2О3 + 3Mg
(с примесью боридов магния);
t
B2O3 + 3C 3CO + 2B
(с примесью карбидов бора)
• Восстановление из хлорида бора:
t
2BCl3 + 3Zn
3ZnCl2 + 2B
5.
Получение бора• Очень чистый бор можно получить термическим
разложением паров ВВr3 на нагреваемой
электрическим током танталовой проволоке в
присутствии водорода:
t
2BBr3 + 3H2 6HBr + 2B.
• Разложением водородных соединений:
t
B2H6 2B + 3H2
6.
Химические свойства бора2B + 3F2 = 2BF3;
t 2B O ;
4B + 3O2
2 3
t
2B + N2
2BN
t
4B + 3C
B4C3
2B + 3H2SO4(конц) = 2H3BO3 + 3SO2↑;
B + 3HNO3(конц) = H3BO3 + 3NO2↑;
B + HNO3(конц) + 4HF = HBF4 + NO↑ + 2H2O
7.
Химические свойства бора• Со щелочами реагирует только в присутствии
сильных окислителей:
2B + 2NaOH + 3H2O2 = 2NaBO2 + 4H2O
• Аморфный бор может реагировать со щелочами
при кипячении:
t
2NaBO + 3H
2B(аморф) + 2NaOH + 2H2O
2
2
8.
Бориды• формально отвечают валентностям:
MnB, MnB2, CrB, CrB2, MoB2, WB2, VB, TiB
• Составы ряда боридов можно отобразить общими
формулами:
M4B (M = Mn),
M2B (M = Na, Mo, W),
MB (M = Ti, Hf, V, Cr, Mo, Mn, Fe, Ni),
M3B4 (M = V, Nb, Cr, Mn),
MB6 (M = La)
9.
БоридыОбразуются при сплавлении простых веществ:
t MgB
Mg + 2B
2
Твердые, электропроводны. Многие имеют очень
высокие температуры плавления:
ZrB2 – 3040ºС, HfB2 – 3250ºС. Многие устойчивы по
отношению к кислотам. Устойчивость возрастает в
ряду:
MgB2 < VB2 < CrB2 < ZrB2 < TiB2 < NbB2 < TaB2
MgB2 разлагается любыми кислотами и водой на
TaB2 (tпл = 3200ºС) не действует даже царская водка
10.
Галогениды бораBF3
BCl3
газ
газ
Ecвязи, кДж
644
443
Устойчивость падает
BBr3
BI3
жидкость
376
твердый
284
BI3 под действием света разлагается уже при обычных условиях.
11.
ВF3• Тип гибридизации sp2:
B*
F
F
F
12.
Кислоты Льюиса• молекулы BГ3 могут быть акцепторами
электронной пары и участвовать в образовании
связей по донорно-акцепторному механизму:
• BF3 + F– = BF4– (валентность бора = 4);
• BF3 + NH3 = BF3 ˑ NH3
(BF3 – кислота Льюиса).
Ион BF4– имеет тетраэдрическую структуру (sp3гибридизация).
13.
Галогениды борапредставляют собой бесцветные вещества,
дымящие во влажном воздухе, кислотный
характер :
BCl3 + 3H2O = H3BO3 + 3HCl
BF3 + 3H2O = H3BO3 + 3HF;
BF3 + HF = H[BF4] (тетрафтороборная кислота);
4BF3 + 3H2O = 3H[BF4] + H3BO3
14.
Тетрафтороборная кислота, тетрафторобораты• H[BF4] устойчива только в растворе, ее
кислотные свойства выражены сильнее, чем у
HF.
Большинство
из
солей
HBF4
(тетрафтороборатов) бесцветны и хорошо
растворимы в воде.
• Кислотные галогениды бора реагируют с
основными галогенидами:
ВF3 + NaF = Na[BF4]
15.
Нитрид бора BN• Соединения бора с азотом являются аналогами
углерода. Нитрид бора существует в двух
модификациях: «белый графит» и «боразон»
или «эльбор», по твердости равный алмазу.
16.
Белый графит — белый, похожий на талькпорошок,
имеет
графитоподобную
кристаллическую
структуру,
t плавления 3000 °C, полупроводник, применяется
в качестве твёрдой высокотемпературной смазки.
17.
Бораны (бороводороды , гидриды бора)Общая формула
BnH(n+4) или BnH(n+6) ( n = 2‒10)
Моноборан ВН3 неустойчив (ΔG°f,298 = 109
кДж/моль). В молекуле ВН3 атомы бора
координационно ненасыщены. Молекула ВН3 легко
присоединяет частицы – доноры электронных пар
(Н3В · NH3), либо образует димер (В2Н6).
Простейшим
устойчивым
водородным
соединением бора является диборан В2Н6.
18.
Получение В4Н106MgВ2 + 12НCl = В4Н10 + 6MgCl2 + Н2 + 8В
• По физическим свойствам бораны похожи на
углеводороды
и
силаны.
С
увеличением
молекулярной массы увеличиваются температуры их
плавления и кипения.
19.
Строение боранов. Электронодефицитная или«банановая связь».
«Банановая связь» образуется в результате перекрывания двух sp3гибридных орбиталей атомов бора и одной s-орбитали атома водорода.
Каждый мостиковый атом водорода образует с двумя атомами бора
общую двухэлектронную трехцентровую связь В – Н – В. Атомы бора и
крайних водородов расположены в одной плоскости, а водородные
мостики – перпендикулярно к ней:
20.
Химические свойства боранов• Бораны похожи на силаны: при обычных
условиях неустойчивы, получаемая при
разложении кислотами сплавов бора с магнием
газовая смесь на воздухе самовоспламеняется:
2В4Н10 + 11О2 = 4В2О3 + 10Н2О
• Горение боранов сопровождается выделением
огромного количества тепла (используются как
реактивное топливо).
21.
• Бораны разлагаются водой:В2Н6 + 6Н2О = 2Н3ВО3 + 6Н2
• тетрагидридобораты М[BH4] (боргидриды, или
боронаты) - производные диборана, аналогичные
фтороборатам. Водород в анионе [BH4] отрицателен
аналогично атомам галогенов.
• NaBH4 устойчив при обычных условиях и хорошо
растворим в воде.
• Взаимодействие диборана с порошком гидрида лития
в кипящем эфире ведет к образованию
тетрагидридобората лития:
2LiH + В2Н6 = 2Li[ВН4]
22.
ТетрагидридоборатыТетрагидридобораты щелочных металлов имеют
характер типичных солей. При растворении в воде
взаимодействют с ней:
MеBH4 + 4H2O = 4H2 + MеOH + H3BO3
Скорость гидролиза уменьшается в ряду
Li >> Na > K, боргидриды Na и K разлагаются
холодной водой очень медленно. В кислой среде
разложение их идет очень быстро:
2MеBH4 + 2HСl = 2MеСl + H2 + B2H6
23.
Широкоеиспользование
находят
тетрагидридобораты в органической химии как
восстановители альдегидов и кетонов до
соответствующих спиртов. С помощью NaBH4
удобно получать летучие гидриды Ge, Sn, As и Sb
из их хлоридов.
Из LiBH4 можно получить большое количество
водорода.
24.
Получение боранов• восстановление соединений бора водородом:
t, кат. Cu-Al
2BCl3 + 6H2
В2Н6 + 6HCl
• Восстановление галогенидов бора гидридами:
о
35
С, эфир
2BF3 + 6LiH
В2Н6 + 6LiF
25.
Оксид бора B2O3• Стеклообразный оксид бора имеет слоистую
структуру (sp2-гибридизация орбиталей атомов
бора), в слоях атомы бора расположены внутри
равносторонних треугольников ВО3.
• получают при нагревании бора на воздухе при
700°C или обезвоживанием H3BO3 :
t
4В + 3О2
2В2О3
t
2H3BO3
В2О3 + 3Н2О
26.
• Кристаллический В2О3 существует в двухмодификациях , его получают осторожным
отщеплением воды от метаборной кислоты
НВО2. Борный ангидрид гигроскопичен, бурно
растворяется в воде.
• В расплавленном состоянии B2O3 хорошо
растворяет оксиды многих элементов, образуя
соли:
t
В2О3 + CaO
Ca(BO2)2.
27.
• B2O3 является кислотным оксидом:В2О3 + 2NaOH t 2NaBO2 + Н2О.
• B2O3 проявляет очень слабые признаки
амфотерности:
2В2О3 + 2P2О5 t 4ВPО4
В2О3 + 6HF t 2BF3 + 3Н2О
28.
Ортоборная кислота H3BO3• Слабая кислота. Бесцветное кристаллическое
вещество в виде чешуек без запаха, имеет
слоистую решетку (sp2-гибридизация орбиталей
атома бора), в которой молекулы H3BO3
соединены водородными связями в плоские
слои,
слои
соединены
между
собой
межмолекулярными связями.
29.
Метаборная кислота (HBO2)n• является
полимерным
соединением,
представляет собой бесцветные кристаллы,
которые в растворе легко гидратируются с
образованием ортоборной кислоты.
30.
При нагревании ортоборная кислота теряет воду исначала переходит в метаборную кислоту, затем в
тетраборную H2B4O7. При дальнейшем нагревании
обезвоживается до В2О3:
H3BO3 ⇄ HBO2 + H2O
4НВО2 ⇄ Н2В4О7 + Н2О
Н2В4О7 ⇄ 2В2О3 + Н2О
В водном растворе все кислоты бора превращаются в
H3BO3:
HBO2 + H2O = H3BO3
H2B4O7 + 5H2O = 4H3BO3
31.
Ортоборная кислота в водном растворе неотщепляет Н+, а вызывает смещение равновесия
диссоциации воды, присоединяя за счет донорноакцепторного взаимодействия OH‒, выступает в
роли одноосновной кислоты:
B(OH)3 + H2O ⇄ B(OH)4– + H+;
Кдис = 5,8 · 10-10
32.
• Стабильными являются соли мета- итетраборной кислот. Так, при действии на
раствор ортоборной кислоты гидроксидом
натрия образуется не ортоборат, а тетраборат
натрия (при недостатке NaOH) или метаборат (в
избытке NaOH):
2NaOH(нед) + 4H3BO3 = Na2B4O7 + 7H2O;
NaOH(изб) + H3BO3 = NaBO2 + 2H2O.
33.
• Кислотный гидролиз тетрабората натрияприводит к образованию ортоборной кислоты:
Na2B4O7 + 2HCl + 5H2O = 2NaCl + 4H3BO3
• Тетраборат натрия в избытке щелочи
превращается в метаборат натрия:
Na2B4O7 + 2NaOH(изб) = 4NaBO2 + H2O
34.
При нагревании борная кислота растворяетоксиды металлов, образуя соли.
Со спиртами в присутствии H2SO4 конц. образует
эфиры:
H3BO3 + 3CH3OH = 3H2O + B(OCH3)3
Образование борнометилового эфира В(ОСН3)3
является качественной реакцией на Н3ВО3 и соли
борных кислот, при поджигании борнометиловый
эфир горит красивым ярко-зеленым пламенем.
35.
НN
НB
BН
НN
NН
B
Н
Нагревание H3N · BH3 в запаянной трубке до
270°С ведет к образованию триборинтриимина
(боразола или боразина) В3N3H6.
Боразол представляет собой бесцветное жидкое
вещество (tпл = 56°С, tкип = 55°С). Молекула
В3N3H6 изоэлектронна молекуле бензола.
36.
Применение• 10 B – поглотитель нейтронов. При авариях на
атомных станциях сбрасывают борную к-ту с
изотопом 10 B..
• H3BO3 – при варке жаропрочного стекла пирекс.
• Бораты: в составе стиральных порошков,
моющих средств (пероксидные соединения).
37.
• Бура Na2B4O7 10H2O применяется при пайкеметаллов. Бура в расплавленном состоянии
растворяет оксиды металлов:
t
Na2B4O7 + CuO 2NaBO2 + Cu(BO2)2
(Na2O · 2B2O3)
Расплав буры, растворяя оксиды металлов,
образует т.н. перлы буры, прим. при получении
глазурей.
38.
• Пе́рлы — разноцветные стекловидныесплавы оксидов металлов с бурой Na2B4O7·10H2O.
• Образуются
при
сплавлении
порошка минералов с бурой, например, в процессе
быстрого аналитического определения минералов.
Боратные стекла, окрашенные ионами ряда
металлов, имеют характерный цвет.
39.
Перлы буры40.
Алюминий*
1
2
13Al : 3s 3p
3s
3p
3d
валентность IV (Na[Al(OH)4]) и VI (Na3[Al(OH)6])
41.
Нахождение в природе• Al2O3 nH2O – боксит,
• Al2O3 – корунд,
• Al2O3 2SiO2 2H2O – каолинит,
• Na3AlF6 – криолит,
• Na(K)2O Al2O3 2SiO2 – нефелин.
42.
Физические свойства• Серебристо-белый пластичный металл, с
высокой тепло- и электропроводностью, очень
легкий (плотность 2,7 г/см3), но механически
прочный, плавится при температуре 660°С.
43.
Получение• Электролизом расплава Al2O3 в присутствии
криолита
Na3[AlF6],
введение
которого
существенно снижает температуру плавления.
Температура плавления чистого Аl2O3 равна
2072°С. Использование криолита позволяет
проводить электролиз при сравнительно низкой
температуре – менее 1000°С.
44.
Получение Al• Растворенный в криолите оксид алюминия
диссоциирует:
Al2O3 AlO+ + AlO2–
• На электродах протекают следующие процессы:
катод ⊝: 2AlO+ + 3e– = Al + AlO2– ;
анод ⊕: 2AlO2– – 4e– = O2 + 2AlO+;
электролиз 4Al + 3O
2Al2O3
2
45.
• Криолита Na3AlF6 в природе содежитсянедостаточное количество, поэтому его готовят
искусственно путем совместного растворения
Al(OH)3 и соды в плавиковой кислоте HF:
3Na2CO3+2Al(OH)3+12HF = 2Na3AlF6+3CO2+9H2O
46.
• Для выделения чистого Аl2O3 боксит сначалаобжигают, при этом удаляется содержащаяся в
нем вода, затем его сплавляют с содой:
Аl2O3 + Na2CO3 = 2NaAlO2 + СO2
• сплав алюмината натрия растворяют в воде, при
этом примеси Fe(ОН)3 и другие выпадают в
осадок, который отделяют. Затем в раствор
алюмината натрия пропускают СO2 и получают
чистый Аl(ОН)3, при прокаливании которого
образуется Аl2O3:
2NaAlO2 + СO2 + 3Н2O = 2Аl(ОН)3 + Na2CO3
47.
Химические свойства• 2Al + 3Сl2 2AlCl3 (хлорид)
t
• 2Al + 3S
Al2S3 (сульфид)
t
• 2Al + N2
2AlN (нитрид)
t
• Al + P
AlP (фосфид)
t
• 4Al + 3C
Al4C3 (карбид)
• 2Al + 6H2O = 2Al(OH)3 + 3H2↑ (снять Al2O3 )
• 2Al + 6HCl = 2AlCl3 + 3H2↑
• 2Al + 3CuSO4 = Al2(SO4)3 + 3Сu
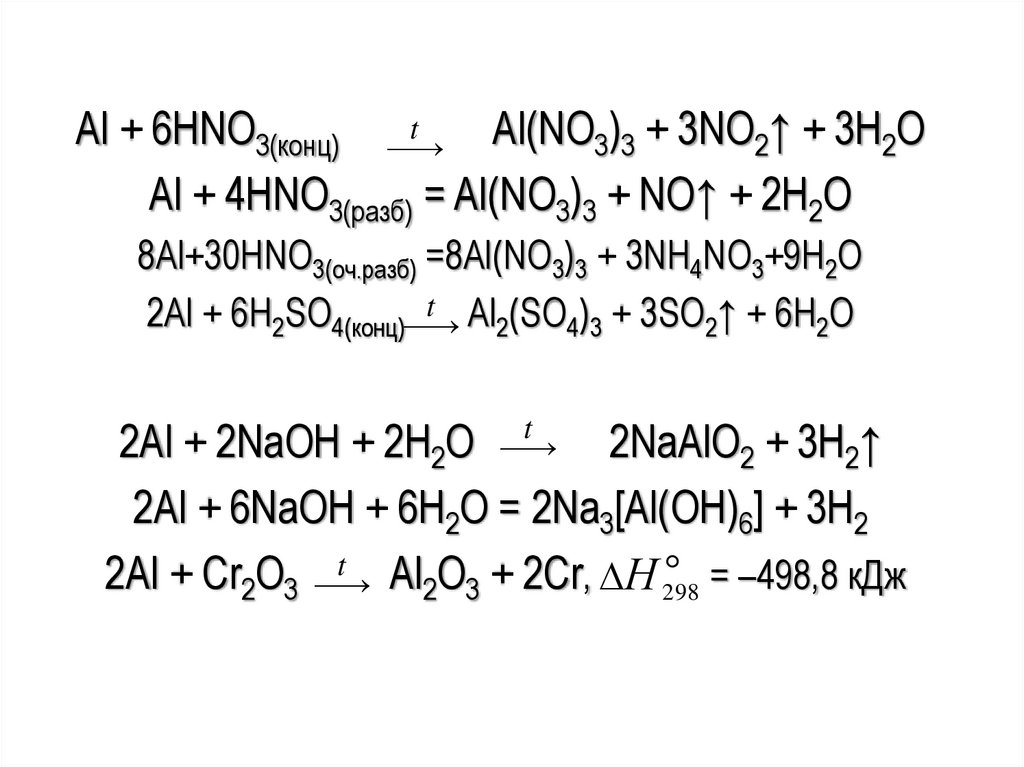
48.
tAl + 6HNO3(конц)
Al(NO3)3 + 3NO2↑ + 3H2O
Al + 4HNO3(pазб) = Al(NO3)3 + NO↑ + 2H2O
8Al+30HNO3(оч.разб) =8Al(NO3)3 + 3NH4NO3+9H2O
t Al (SO ) + 3SO ↑ + 6H O
2Al + 6H2SO4(конц)
2
4 3
2
2
2Al + 2NaOH + 2H2O
2NaAlO2 + 3H2↑
2Al + 6NaOH + 6H2O = 2Na3[Al(OH)6] + 3H2
t Al O + 2Cr, Н = –498,8 кДж
2Al + Cr2O3
298
2 3
t
49.
карбиды• Al4C3 – метанид, Al2(C2)3 – ацетиленид.
Ацетиленид можно получить по реакции:
2Al + 3C2H2 = Al2(C2)3 + 3H2
• Карбиды и нитриды – солеподобные вещества,
разлагаются водой:
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4;
Al2(C2)3 + 6H2O = 2Al(OH)3 + 3C2H2;
AlN + 3H2O = Al(OH)3 + NH3
50.
• Нитрид может быть получен при пропусканиичерез алюминий аммиака:
t
2Al + 2NH3 2AlN + 3H2
• Гидрид алюминия AlH3 получают косвенным
путем.
• AlH3 – бесцветное или белое твёрдое вещество,
имеющее полимерную структуру: (AlH3)n.
51.
AlH3Разлагается водой, при нагревании выше 100°C
2AlH3 + 3H2O = Al(OH)3 + 3H2↑
t
2AlH3 2Al + 3H2↑
AlH3 взаимодействует с основными гидридами в
эфирном
растворе
с
образованием
гидридоалюминатов:
AlH3 + LiH = Li[AlH4]
Медленно вступает в реакцию с дибораном, образуя
борогидрид алюминия:
2AlH3 + 3B2H6 = 2Al(BH4)3
52.
Al2O3•Al2O3 – твердое тугоплавкое вещество;
существует в нескольких кристаллических
модификациях. Наиболее известен -Al2O3
(корунд): белое, тугоплавкое, химически инертное
вещество. Химическая стойкость, термическая
устойчивость Al2O3 объясняются прочностью
связей Al–O.
• Сильно прокаленный Al2O3 называется алундом,
он используется при изготовлении тиглей и
огнеупорных материалов.
53.
Al(OH)3• твердое вещество белого цвета, нерастворимое в
воде. Формула Al(ОН)3 условна, точнее Al2О 3 nН2О.
Химические свойства
• Al2O3 + H2O ≠
• Al2O3 + 6HCl = 2AlCl3 + 3H2O
• Al2O3 + 6NaOH + 3H2O = 2Na3[Al(OH)6]
t
2NaAlO + H O;
• Al2O3 + 2NaOH
2
2
t 2NaAlO + CO
• Al2O3 + Na2CO3
2
2
54.
• Al2O3 + СаO t Сa(AlO2)2• Al2O3 + 3SO3 = Al2(SO4)3
• Al(OH)3 + 3HCl = AlCl3 + 3H2O
• Al(OH)3 + NaOH = Na[Al(OH)4]
• Al(OH)3 + 3NaOH = Na3[Al(OH)6]
• Al(OH)3 + NaOH t NaAlO2 + 2H2O
• 2Al(OH)3 + СaO t Сa(AlO2)2 + 3H2O
• 2Al(OH)3 + 3SO3 = Al2(SO4)3 + 3H2O
• 2Al(OH)3 t Al2O3 + 3H2O
55.
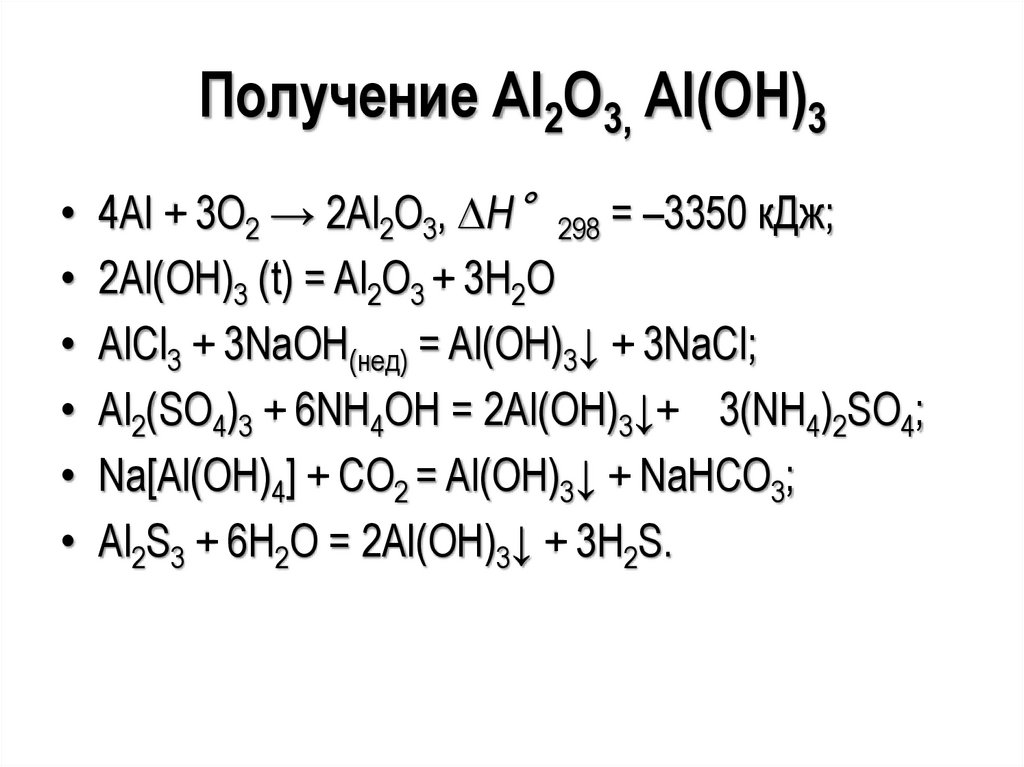
Получение Al2O3, Al(OH)3• 4Al + 3O2 → 2Al2O3, Н°298 = –3350 кДж;
• 2Al(OH)3 (t) = Al2O3 + 3H2O
• AlCl3 + 3NaOH(нед) = Al(OH)3↓ + 3NaCl;
• Al2(SO4)3 + 6NH4OH = 2Al(OH)3↓+ 3(NH4)2SO4;
• Na[Al(OH)4] + CO2 = Al(OH)3↓ + NaНCO3;
• Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S.
56.
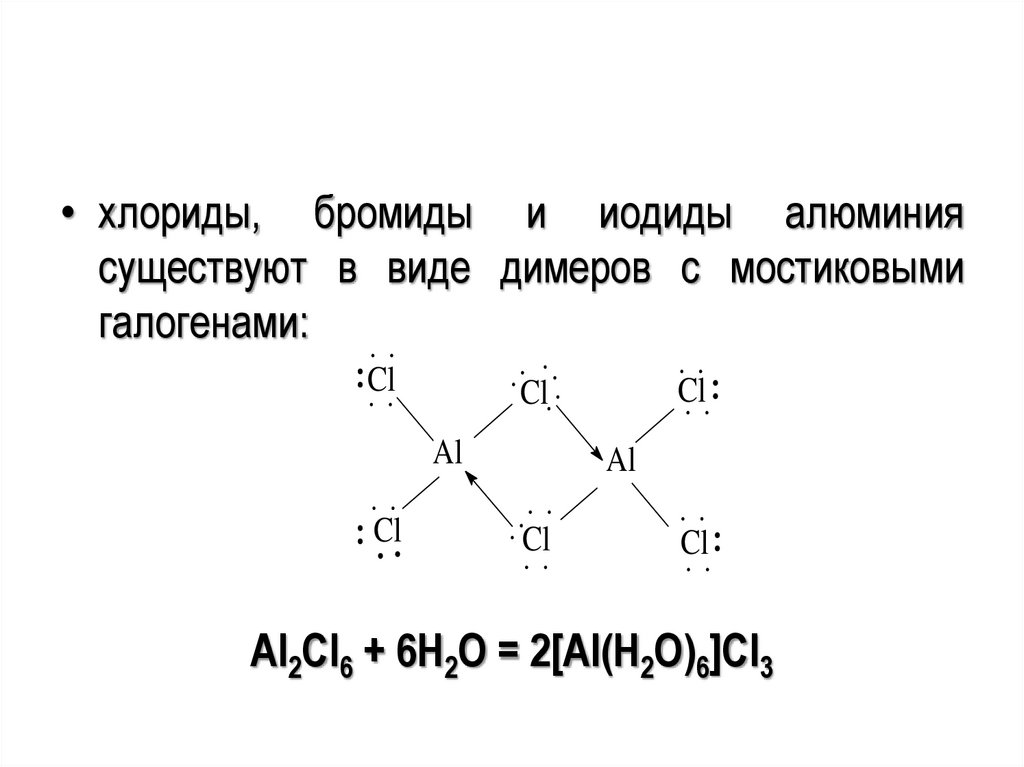
• хлориды, бромиды и иодиды алюминиясуществуют в виде димеров с мостиковыми
галогенами:
Cl
Al
Cl
Cl
Cl
Al
Cl
Cl
Al2Cl6 + 6H2O = 2[Al(H2O)6]Cl3
57.
• Алюминаты под действием воды практическиполностью разлагаются:
NaAlO2 + 2H2O = Al(OH)3 + NaOH.
• Алюминаты также разлагаются кислотами. Состав
продукта зависит от количественного соотношения
между солью и кислотой:
Na[Al(OH)4] + HCl(нед) = Al(OH)3↓ + NaСl + H2O
NaAlO2 + HCl(нед) + H2O = Al(OH)3↓ + NaСl
Na[Al(OH)4] + 4HCl(изб) = AlCl3 + NaСl + 4H2O
Na3[Al(OH)6] + 6HCl(изб) = AlCl3 + 3NaСl + 6H2O
NaAlO2 + 4HCl(изб) = AlCl3 + NaСl + 2H2O
58.
• Соли Al3+ выделяются из растворов в видекристаллогидратов: AlCl3 6H2O, Al(NO3)3 9H2O.
• Сульфаты алюминия с сульфатами щелочных
металлов образуют двойные соли – квасцы
(KAl(SO4)2 12Н2О – алюмокалиевые квасцы)
59.
• Все соли Al3+ растворимы, кроме AlPO4, AlF3. Вводных растворах соли Al+3 подвергаются
гидролизу:
Al2(SO4)3 + 2H2O ⇄ 2AlOHSO4 + H2SO4;
Al3+ + H2O ⇄ AlOH2+ + H+.
60.
• Соли алюминия, образованные слабымикислотами (сульфиды, сульфиты, карбонаты,
цианиды), не могут быть выделены из водных
растворов, так как полностью гидролизуются:
Al2(SO4)3 + 3Na2S + 6H2O = 2Al(OH)3↓ +
+ 3H2S↑ + 3Na2SO4
61.
Галлий, индий, таллий• Радиусы атомов и ионов растут от Ga к Тl,
соответственно с этим восстановительные
свойства
увеличиваются,
увеличивается
различие энергий связи s- и р-электронов
внешнего слоя и соответственно уменьшается
наиболее характерная степень окисления: для
Ga и In она равна +3, а для Тl – +1.
62.
63.
• галлий на воздухе покрывается плотнойоксидной пленкой Gа2О3 и поэтому практически
не изменяется. У Ga, как и у алюминия,
амфотерные
свойства,
реагирует
с
разбавленными кислотами и со щелочами в
присутствии окислителей (или при нагревании):
2Ga + 6HCl = 2GaCl3 + 3H2
2Ga + 6NaOH + 3H2O2 = 2Na3[Ga(OH)6]
2Ga + 6NaOH + 6H2O
t
2Na3[Ga(OH)6] + 3H2
64.
• Ga, In и Тl могут реагировать с галогенами:2Ga + 3Cl2 = 2GaCl3
Tl + 3Cl2 = TlCl3
2Tl + Cl2 = 2TlCl
• молекулы ЭГ3 димеризованы:
2GaCl3 ⇄ Ga2Cl6
• Известно соединение состава GaCl2, которое может
быть получено:
2GaCl3 + Ga = 3GaCl2
со смешанной степенью окисления Ga+ и Ga+3:
Ga[GaCl4]
65.
• По отношению к холодной воде галлий вполнеустойчив. Концентрированная серная и
концентрированная
азотная
кислоты
пассивируют алюминий, но взаимодействуют с
галлием, индием, таллием:
2Ме + 6H2SO4(конц) = Ме2(SO4)3 + 3SO2 + 6H2O;
2Tl + 2H2SO4(конц) = Tl2SO4 + SO2 + 2H2O
66.
• Реакция галлия с серной кислотой имеетособенность: выделяющаяся сера окутывает
поверхность галлия плотной пленкой и
препятствует его дальнейшему растворению:
2Ga + 4H2SO4 = Ga2(SO4)3 + S↓ + 4H2O.
• Гидроксид галлия амфотерен:
Ga(OH)3 + NaOH = Na[Ga(OH)4] (в растворе)
t
NaGaO + 2H O
Gа(ОН)3 + NaOH
2
2
67.
• Из гидроксида прокаливанием можно получитьоксид, который легко растворяется в воде:
t
2Gа(ОН)3 Gа2O3 + 3Н2О
Gа2O3 + 3Н2О = 2Gа(ОН)3
• Прямым синтезом могут быть получены
сульфид Ga2S3, а также являющиеся
полупроводниками фосфид GaP, арсенид GaAs,
антимонид GaSb.
68.
• Соли галлия хорошо растворимы в воде, приосаждении
из
растворов
выделяются
кристаллогидраты: Ga2(SO4)3 · 18H2O, Gа(NО3)3 ·
9Н2О
69.
• На воздухе индий покрывается плотной ипрочной оксидной пленкой, а таллий медленно
окисляется, и поэтому его хранят под слоем
кипяченой дистиллированной воды или
покрывают лаком. Оба металла мягкие и
хрупкие
с
хорошей
электрической
проводимостью. Для индия и таллия известны
два ряда соединений, соответствующих
степеням окисления +3 и +1.
70.
• При движении от Ga2O3 к Тl2O3 кислотные свойстваоксидов ослабевают, а основные усиливаются.
Тl2O3 не взаимодействует со щелочами.
Устойчивость оксидов сверху вниз падает. Тl2O3 при
небольшом
нагревании
разлагаетсяc
с
образованием Тl2O и O2. Тl2O растворяется в H2O:
Тl2O + H2O = 2TlOH
По размерам ион Тl+ близок к иону K+, отсюда
близость свойств их соединений.
71.
• Желтый оксид In2O3 может быть полученвзаимодействием
простых
веществ,
а
коричневый Tl2O3 – при окислении таллия
озоном:
2Tl + O3 = Tl2O3
• В воде оксиды практически нерастворимы, но
способны растворяться в кислотах:
In2O3 + 6НСl= 2InСl3 + 3Н2О;
Тl2O3 + 6НСl= 2ТlСl3 + 3Н2О
72.
• Основныесвойства
последовательно измененяются:
гидроксидов
Ga(ОН)3
In(ОН)3
ТlOН
амфотерный
гидроксид
амфотерный основание
сильное
гидроксид
средней силы основание
с более
(щелочь)
выраженными
основными
свойствами
Тl(ОН)3
73.
Применение Al• Алюминий используют для получения термита.
Теплоты, выделяющейся при сгорании термита,
достаточно для сварки железнодорожных
рельсов:
3Fe3O4 + 8Al (t)= 4Al2O3 + 9Fe
Корунд Al2O3 – абразивный материал
Квасцы – для очистки воды, производство бумаги
Галогениды Al - катализаторы






































































 Химия
Химия








