Похожие презентации:
Неметаллы IVA и IIIA групп Углерод, кремний , бор
1. Неметаллы IVA и IIIA групп Углерод, кремний , бор
Автор: к.х.н., доцентМартынова Т.В.
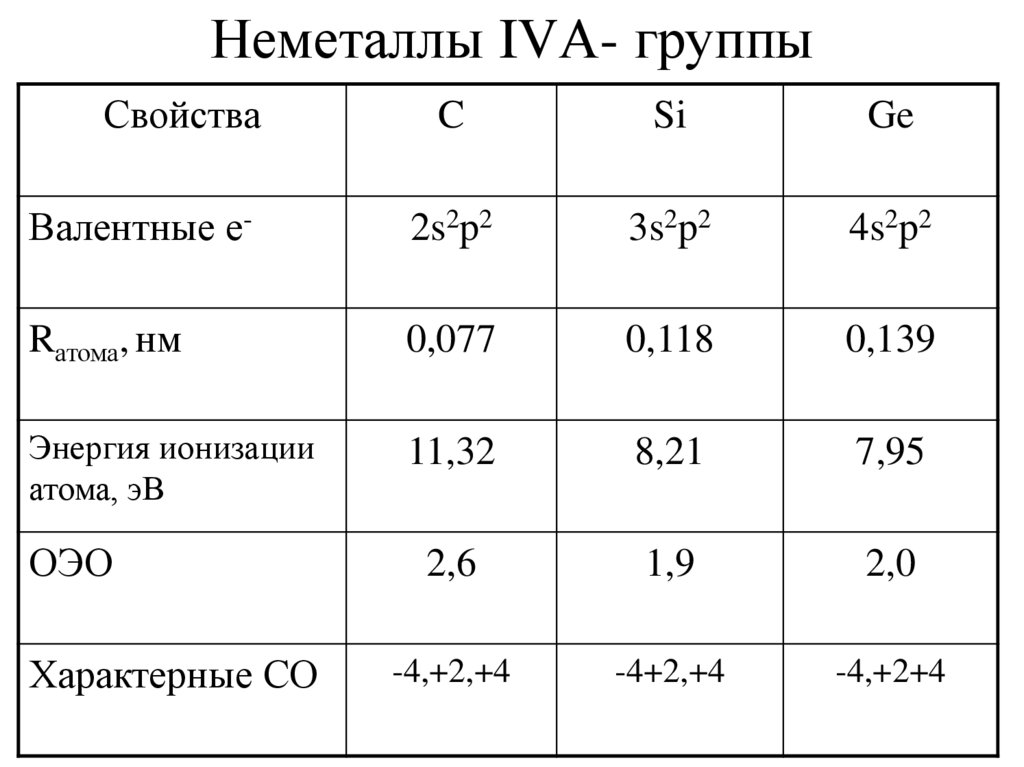
2. Неметаллы IVА- группы
СвойстваC
Si
Ge
Валентные е-
2s2p2
3s2p2
4s2p2
Rатома, нм
0,077
0,118
0,139
Энергия ионизации
атома, эВ
11,32
8,21
7,95
2,6
1,9
2,0
-4,+2,+4
-4+2,+4
-4,+2+4
ОЭО
Характерные СО
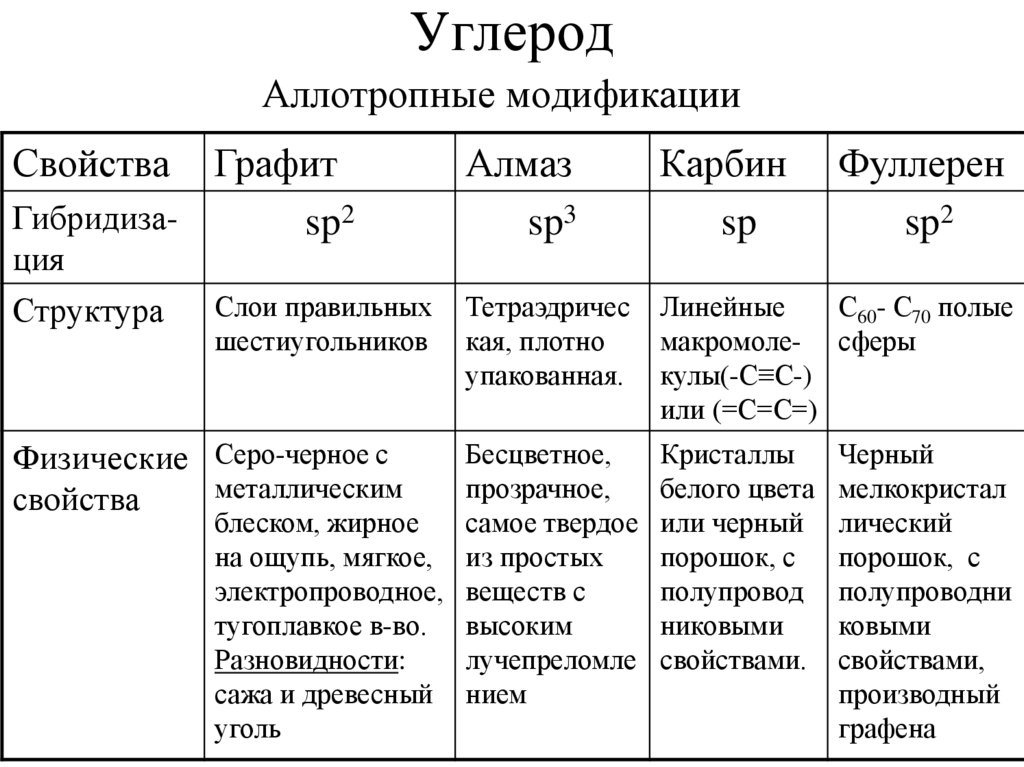
3. Углерод
Аллотропные модификацииСвойства
Графит
Гибридизаsp2
ция
Структура
Слои правильных
шестиугольников
Физические Серо-черное с
металлическим
свойства
Алмаз
sp3
Карбин
sp
Тетраэдричес
кая, плотно
упакованная.
Линейные
С60- С70 полые
макромоле- сферы
кулы(-С≡С-)
или (=С=С=)
Бесцветное,
прозрачное,
блеском, жирное
самое твердое
на ощупь, мягкое, из простых
электропроводное, веществ с
тугоплавкое в-во. высоким
Разновидности:
лучепреломле
сажа и древесный нием
уголь
Кристаллы
белого цвета
или черный
порошок, с
полупровод
никовыми
свойствами.
Фуллерен
sp2
Черный
мелкокристал
лический
порошок, с
полупроводни
ковыми
свойствами,
производный
графена
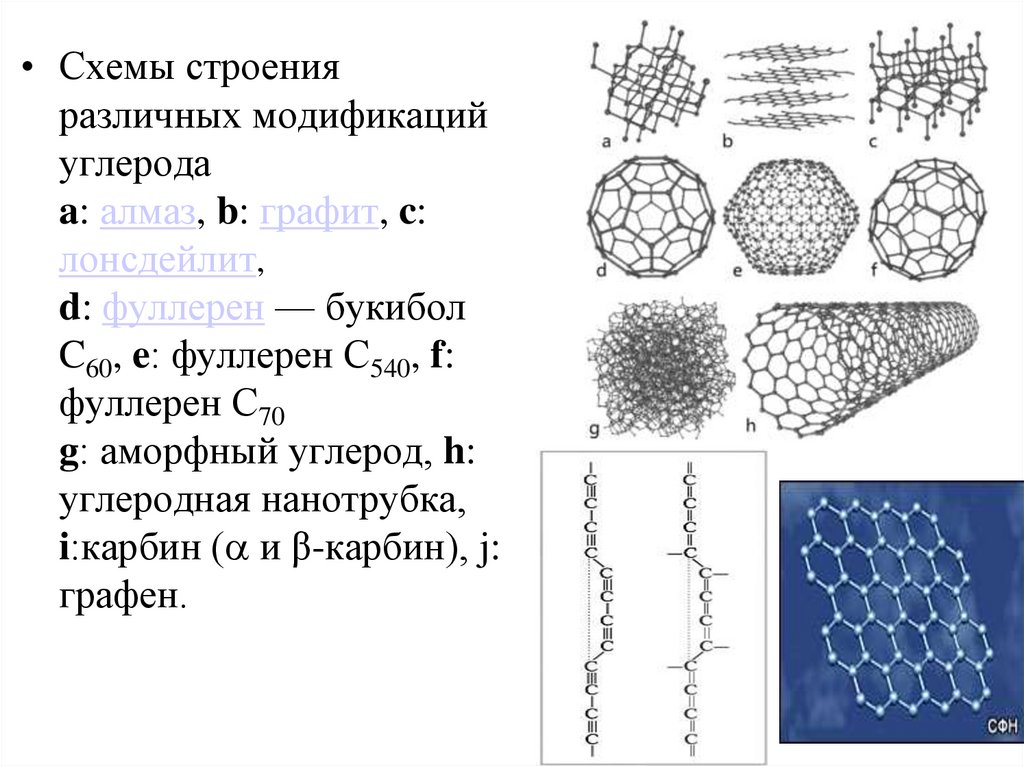
4.
• Схемы строенияразличных модификаций
углерода
a: алмаз, b: графит, c:
лонсдейлит,
d: фуллерен — букибол
C60, e: фуллерен C540, f:
фуллерен C70
g: аморфный углерод, h:
углеродная нанотрубка,
i:карбин ( и β-карбин), j:
графен.
5. Химические свойства углерода
При обычных температурах инертен. При
повышенных - проявляет восстановительные и
окислительные свойства.
Восстановительные свойства:
1. с H2O при 800-1000оС:
С+Н2О↔СО+Н2 – водяной газ;
2. с кислотами–окислителями:
C+4HNO3=CO2+2H2O+4NO2;
3. с кислородом и другими неметаллами:
С+О2=СО2;
4. с оксидами Ме: C+2PbO=2Pb+CO2.
6.
• Окислительные свойства.1. с Н2 (600оС, р, кат. Pt):
C+2H2 = CH4 (метан)
2. образует карбиды с Ме
3C+Fe=Fe3C
2C+Ca=CaC2
4Al+3C=Al4C3
7. Соединения углерода
• СО – оксид углерода (II) –бесцветный газ, тяжелеевоздуха, малорастворим в воде, ядовит.
• Получение: 2C+O2=t 2CO (при недостатке О2)
CO2+C=2CO
В лаборатории действием H2SO4 на муравьиную к-ту:
HCOOH→CO+H2O.
• Химические свойства - восстановитель:
• 2CO+O2=2CO2 (горение)
• CO+CuO=Cu+CO2 (получение металлов)
• CO+Cl2=COCl2 (фосген)
• Качественная р-ция (при комнатной t) :
I2O5+5СО=5СО2+I2.
• Образует комплексы с d-Ме: [Ni(CO)4], [Co2(CO)9],
[Fe(CO)5].
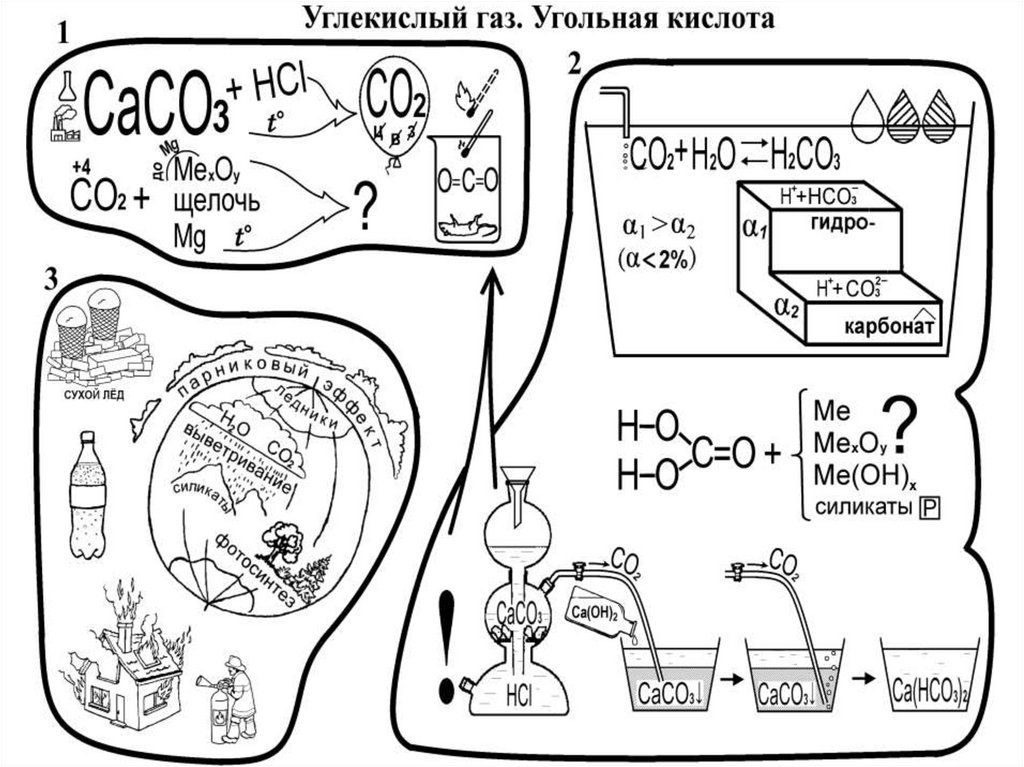
8. Соединения углерода +4
• CO2- оксид углерода (IV) (углекислый газ) –бесцветный, без запаха, тяжелее воздуха, легко
сжижается и кристаллизуется, мало растворим в воде.
• Получение: 1) С+О2=t СО2;
2) CaCO3→t CaO+CO2;
3) CaCO3+2HCl=CaCl2+H2O+CO2;
4)спиртовое брожение: C6H12O6=2C2H5OH+2CO2.
• Химические свойства.
1)окислительные: CO2+2Mg=C+2MgO;
2)кислотные: CO2+NaOH =NaHCO3; CO2+CaO=CaCO3;
гидрокарбонат
карбонат
CO2+H2O↔H2CO3↔H++HCO3-↔2H++CO32неустойчивое
рН<7
практически не идет
9. Соли угольной кислоты
• Растворимые карбонаты (гидрокарбонаты,карбонаты щелочных металлов и аммония).
подвергаются гидролизу:
Na2CO3+H2O=NaHCO3+NaOH
CO32- + H2O = HCO3- +OH• Многие карбонаты разлагаются под действием
нагревания и под действием сильных кислот (см.
способы получения СО2) :
10. Применение углерода и его соединений
• Алмазы –в ювелирных изделиях, при бурении скважиналмазными бурами, сверлении металлов, резании стекла
алмазными инструментами.
• Графит – изготовление: тиглей для плавки металлов,
электродов, карандашей, смазочных масел, черных
красок.
• Уголь – топливо; коксованием получают : кокс для
металлургии, светильный газ, каменноугольную смолу,
содержащую бензол, фенол, нафталин и др.
• СО2 – в производстве сахара, газированных напитков,
соды, при тушении пожаров.
• Na2CO3 – мыловарение, производство стекла.
11. Кремний
• В природе: 90% литосферы – соединения кремния оксиды, силикаты, алюмосиликаты в составе гранитов,гнейсов, базальтов; в продуктах их выветривания –
песке, гравии, глинах.
• Получение :
SiO2+2Mg=2MgO+Si;
чистый:
SiCl4+2Zn=2ZnCl2+Si,
SiH4 (силан)=Si+2H2
SiO2+2С=2СO+Si;
Физические свойства:
Крупнокристаллический - темно-серый, с
металлическим блеском, твердый, хрупкий,
непрозрачный, тугоплавкий, полупроводник.
Аморфный – бурый порошок, более активный.
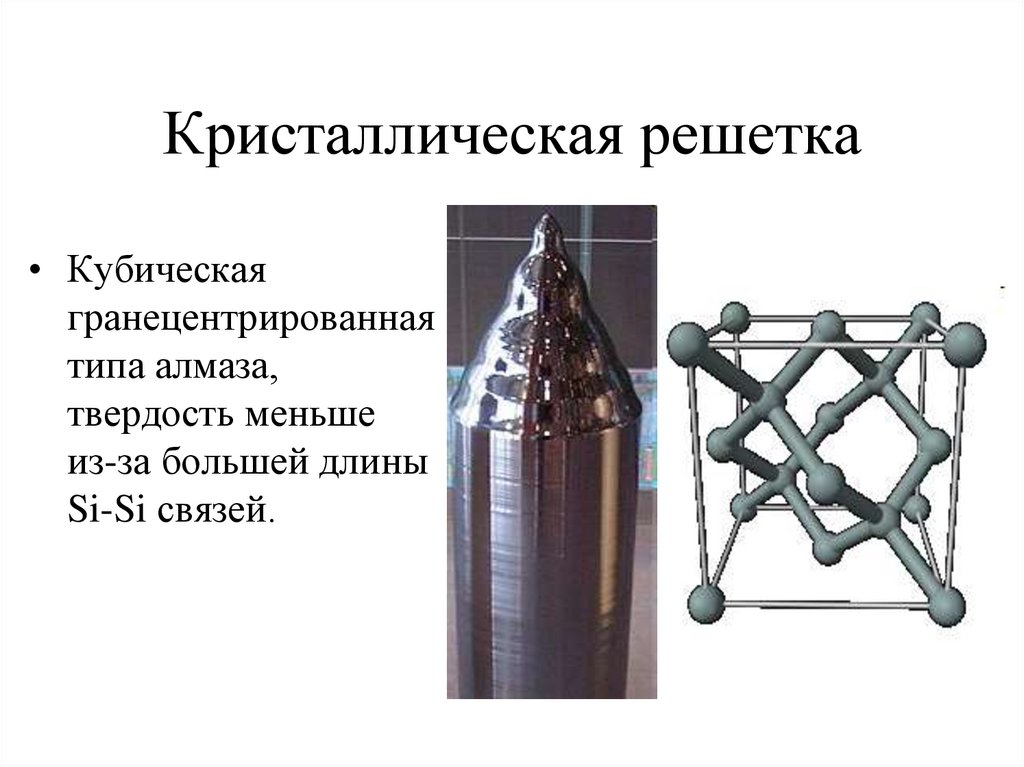
12. Кристаллическая решетка
• Кубическаягранецентрированная
типа алмаза,
твердость меньше
из-за большей длины
Si-Si связей.
13. Химические свойства кремния
• Окислитель в р-циях с Ме:Si+2Mg=Mg2Si (силицид магния)
• Восстановитель в р-циях с Немет:
(600оС) : Si+O2=SiO2+858 кДж.
(320оС) : Si+2Cl2=SiCl4
(1200-1300оС) : Si+C(графит) = SiC (карборунд)
• Si+2NaOH+H2O=Na2SiO3+2H2
• С кислотами не реагирует, растворяется только в
HF и смеси HF с HNO3:
Si+6HF=2H2+H2[SiF6].
14. Свойства водородных соединений кремния
• SiH4- моносилан - первый из силанов (SinH2n+2), гдеn=1-6.
• Получают косвенно: Mg2Si+2H2SO4=SiH4+2MgSO4 .
• Силаны – легколетучие вещества, ядовиты. Сильные
восстановители, воспламеняются на воздухе,
реагируют с H2O при комнатной t:
SiH4+2H2O=SiO2+4H2.
В щелочной среде образуют силикаты:
SiH4+2NaOH+H2O=Na2SiO3+4H2
С галогенами взаимодействует со взрывом:
SiH4+4Cl2=SiCl4+4HCl
15. Кислородные соединения кремния
• SiO – порошок темно-желтого цвета, изолятор.Получен искусственно восстановлением SiO2
при 1350-1500оС углем:
SiO2+C=SiO+CO.
• Восстановитель, диспропорционирует при
медленном охлаждении:
2SiO=Si+SiO2.
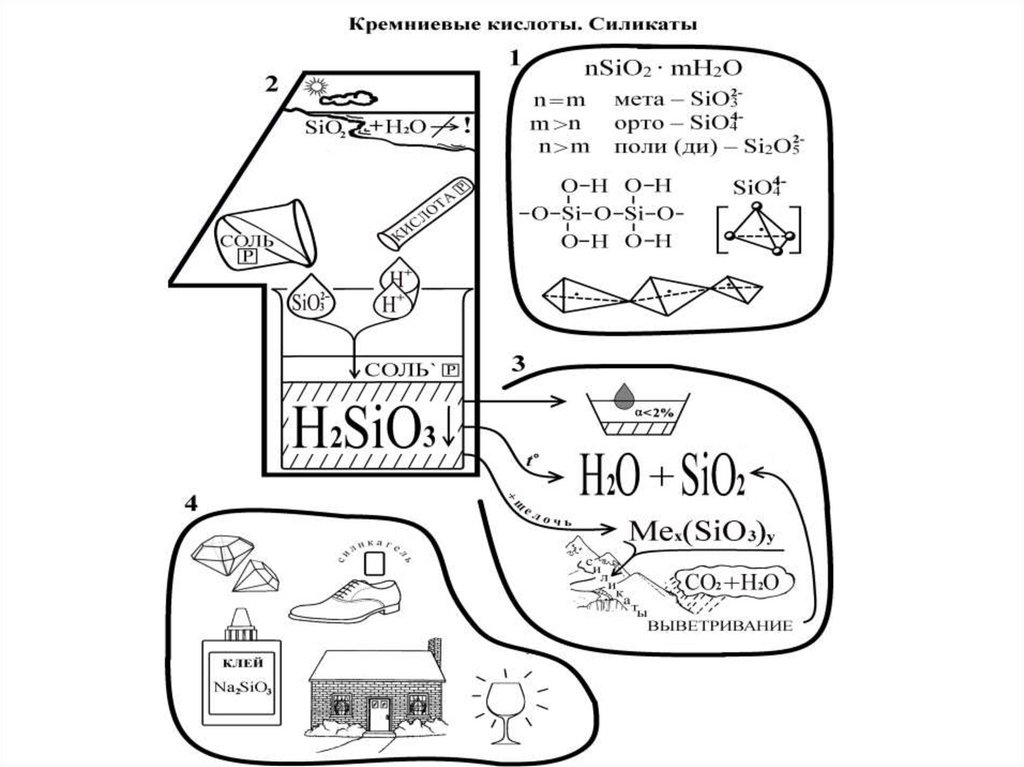
16. SiO2- кремнезем
Песок и кварц: горный хрусталь,раух-топаз (окраска - от серого
до коричневого), аметист
(фиолетовый), цитрин (желтолимонный), розовый кварц.
Структура –гигантская
полимерная молекула, состоящая
из отдельных тетраэдров, где
атом Si окружен 4-мя атомами О.
Каждый О связан с 2-мя атомами
Si.
17.
• SiO2 обладает большой твердостью, tпл=1728оС,tкип =2950оС, при охлаждении расплава
образуется стекловидная форма.
Химически стоек, из кислот реагирует с HF:
SiO2+4HF=SiF4+2H2O;
SiF4+2HF=H2[SiF6];
• Кислотный оксид при сплавлении :
SiO2+2NaOH=t Na2SiO3+H2O;
SiO2+Na2CO3=t Na2SiO3+CO2↑;
PbO+SiO2=t PbSiO3..
18. Кремниевые кислоты и их соли
• nSiO2·mH2O –кислоты слабые, малорастворимые.• H2SiO3 - метакремниевая кислота полимеризуется из
пересыщенных растворов, образуя: коллоидные растворы → гель
→ силикагель (осушитель и адсорбент).
Получение :
SiCl4+3H2O = H2SiO3+4HCl
• Силикаты. Растворимые соли гидролизуются:
Na2SiO3+H2O=NaHSiO3+NaOH
SiO32- +H2O= HSiO3 -+ OH• Силикаты в природе:
• полевые шпаты – K2O·Al2O3·6SiO2 (ортоклаз),
Nа2O·Al2O3·6SiO2 (альбит);
• глины - Al2O3·2SiO2·2H2O (каолин);
• слюды (K2O·3Al2O3·6SiO2·2H2O);
• тальк (3MgO·4SiO2·H2O);
• асбесты (3MgO·2SiO2·2H2O).
19. Стекло, керамика, цемент
• Стекло – прозрачные аморфные сплавы, не имеющиечетких температур плавления и затвердевания.
Оконное стекло: Na2O·CaO·6SiO2.
Получение - сплавление известняка, соды, песка:
CaCO3+Na2CO3+6SiO2= Na2O·CaO·6SiO2+2CO2↑
• Керамика – материалы и изделия из огнеупорной глины,
карбидов и оксидов некоторых металлов. При обжиге
изделий в результате химических твердофазных реакций
происходит спекание:
3[Al2O3·2SiO2·2H2O]=3Al2O3·2SiO2 +4SiO2+6H2O
• Цемент – продукт обжига глины с известняком,
содержащий силикаты и алюминаты кальция.
20. Бор
• Электронное строение валентногоуровня: 2s2p1.
• C.O. : +3 (BF3,B2O3), -3 (Mg3B2, B3H6)
• Аллотропические модификации:
1) аморфная – порошок бурого цвета;
2) кристаллическая – гранатово-красные
кристаллы, по твердости близкие к
алмазу, c полупроводниковыми св-ми.
Химически инертное вещество.
• В природе: Na2B4O7·10 H2O – бура,
H3BO3- борная кислота и ее соли.
• .
21. Химические свойства бора
• При обычных условиях инертен: не взаимодействует сH2O, HГал к-тами. Кислоты-окислители окисляют его
до борной кислоты:
2B+3H2SO4=2H3BO3+3SO2
B+3HNO3=H3BO3+3NO2
С концентрированными растворами щелочей:
2B+2KOH+2H2O=3H2↑+2KBO2 (метаборат калия).
22. Получение и применение бора
• Аморфный :3Mg+B2O3=t 2B +3MgO
• Кристаллический:
2 BBr3+3H2=t 2B+6HBr
• Применение: легирование сплавов (уменьшает
размер зерен сплавов); повышение твердости и
коррозионной стойкости сплавов в результате
борирования поверхности стальных изделий; в
атомных реакторах для защиты от нейтронов
(высокое сечение захвата нейтронов)
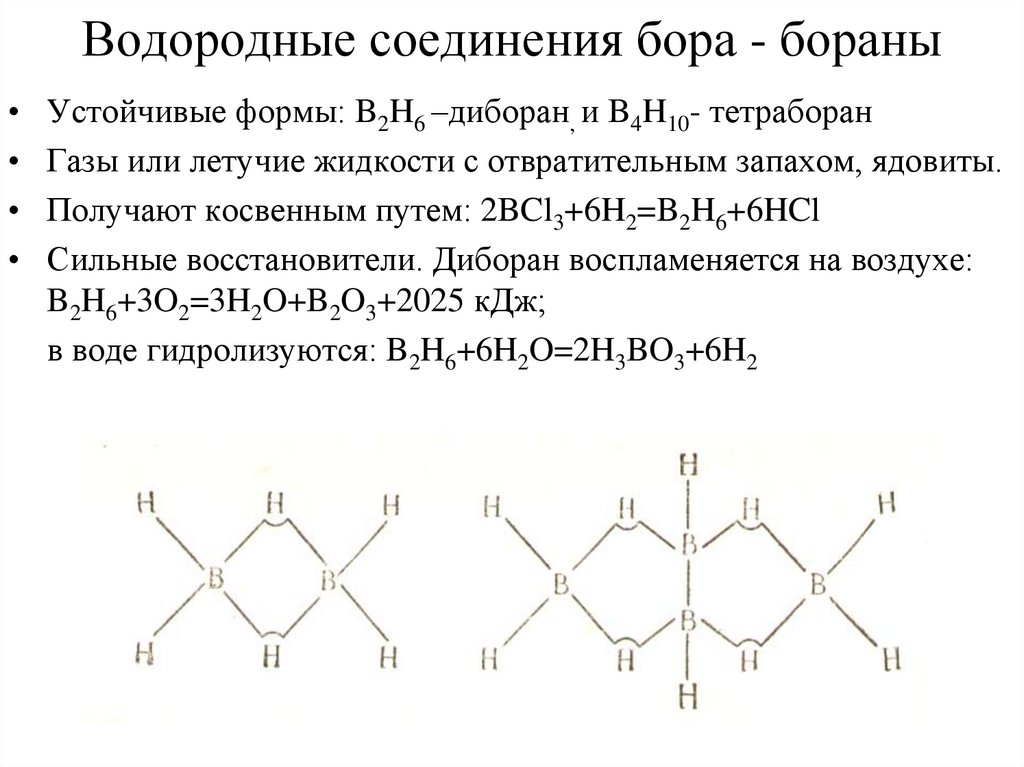
23. Водородные соединения бора - бораны
Устойчивые формы: B2H6 –диборан, и B4H10- тетраборан
Газы или летучие жидкости с отвратительным запахом, ядовиты.
Получают косвенным путем: 2BCl3+6H2=B2H6+6HCl
Сильные восстановители. Диборан воспламеняется на воздухе:
B2H6+3O2=3H2O+B2O3+2025 кДж;
в воде гидролизуются: B2H6+6H2O=2H3BO3+6H2
24. Кислородные соединения бора
• В2О3 – оксид бора, бесцветное кристаллическоевещество, при охлаждении расплава переходит в
стеклообразное состояние. Используется в эмалях и
глазурях, специальных сортах стекла.
Ангидрид борной кислоты:
B2O3+3H2O=2H3BO3
• H3BO3 – ортоборная кислота, бесцветные слоистые
кристаллы. Молекулы в плоскостях связаны
водородными связями, а между слоями – слабые силы
Ван-дер-Ваальса. В водных растворах - слабая
одноосновная кислота, образует гидроксокомплекс:
B(OH)3+H2O=H[B(OH)4].
• При нагревании дает метаборную кислоту
H3BO3=t HBO2+ Н2О.
25. Бораты, бориды
• Соли тетраборной кислоты (H2B4O7),неизвестной в свободном состоянии:
4H3BO3+2NaOH=Na2B4O7+7H2O
• подвержены гидролизу:
Na2B4O7+3H2O=2NaBO2+2H3BO3
• Cr4B, CrB, Cr3B, CrB2 – бориды d-металов,
кристаллические в-ва, с высокой твердостью,
тугоплавкие, химически инертные.
Используются для изготовления
высокоогнеупорных деталей.
26. BN – нитрид бора
- белый порошок, огнеупорный, расслаиваетсяна чешуйки, химически инертен, с
кристаллической структурой аналогичной
графиту (sp2-гибридизация, π – связь между
слоями) «белый графит». Используется как
изолятор и высокотемпературная смазка.
• При t=1400оС и р=62000 ат «белый графит»
переходит в боразон, имеющий кубическую
алмазоподобную структуру (sp3-гибр., 3 связи
по обменному и одна по донорно-акцепторному
механизму), обладающий близкой к алмазу
твердостью. Применяется в буровых работах.





















 Химия
Химия








