Похожие презентации:
Лекция 28. Тема 6. Атомная физика
1.
Лекция 286. Атомная физика
6.2. Квантовая теория
Квантовые числа. Эффект Зеемана. Опыт Штерна и
Герлаха. Спин. Орбитали. Правило отбора. Принцип
Паули. Распределение электронов в атоме. Таблица
Менделеева. Спонтанное и вынужденное излучение.
Инверсная заселенность уровней. Метастабильные
уровни. Отрицательная абсолютная температура.
Квантовые генераторы и усилители излучения.
2.
Квантовые числа1. n = 1, 2, 3, … — главное квантовое число — номер орбиты
(энергетического уровня), энергия электрона, радиус орбиты.
me Z 2e 4 1
1
Wn
W1 2
2 2 2
n
8 0 h n
0h2 2
2
rn
n
r
n
1
2
m
Ze
e
2. l = 0, 1, 2, …, n–1 — азимутальное квантовое число — момент
импульса (количества движения), форму орбиты. Всего n значений.
По Бору:
L
h
n n
2
h
l 1 l 1
L
2
Квантовая теория:
L
h
l l 1 l l 1
2
3.
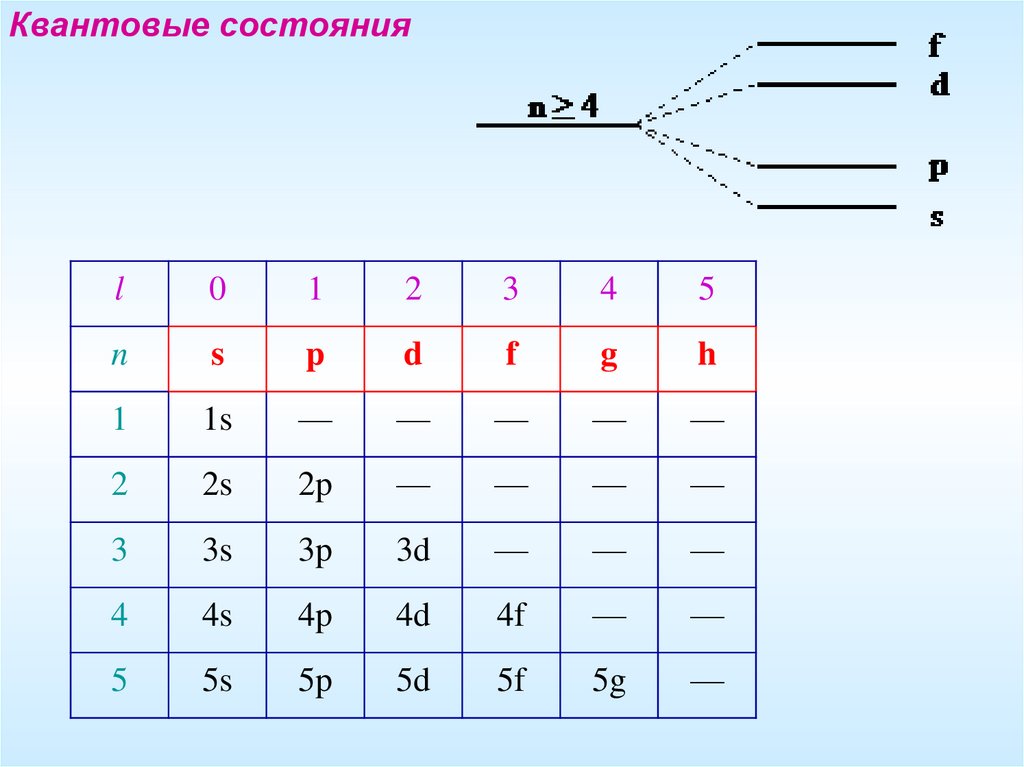
Квантовые состоянияl
0
1
2
3
4
5
n
s
p
d
f
g
h
1
1s
—
—
—
—
—
2
2s
2p
—
—
—
—
3
3s
3p
3d
—
—
—
4
4s
4p
4d
4f
—
—
5
5s
5p
5d
5f
5g
—
4.
Квантовые числа3. m = – l , …, 0, …, + l — магнитное квантовое число — проекция
момента импульса на заданное (выделенное) направление в
пространстве, ориентация орбиты. Всего (2 l +1) значений.
Заданным называют направление, выделенное физически,
например, путем создания магнитного или электрического поля.
Различные состояния атома (электрона) с одинаковой энергией
называются вырожденными, а их число – кратностью вырождения
соответствующего энергетического уровня.
n 1
h
Lz m
m
2
e
ev
pm IS S
r 2
T
2 r
e vr e me vr
eL
pm
2
2me
2me
2
2
l
1
n
l 0
5.
Эффект Зеемана (1896)Эффе́кт Зеема́на — расщепление энергетических
уровней
в магнитном поле. В присутствии магнитного
B электрон, обладающий магнитным моментом
поля
p m приобретает дополнительную энергию E pm B.
Приобретённая энергия приводит к снятию вырождения
атомных состояний по магнитному квантовому числу и Питер Зееман
расщеплению атомных спектральных линий.
1865-1943
Ноб. лаур. 1902
Простой или
нормальный эффект Зеемана —
расщепление линий на 3 уровня,
качественно можно объяснить
классически (Х.Лоренц 1897).
e B
e B
, ,
2me
2me
Сложный или аномальный эффект
Зеемана – несинглетные линии
расщепляются больше чем на 3, а
величина расщепления сложно
зависит от квантовых чисел.
6.
7.
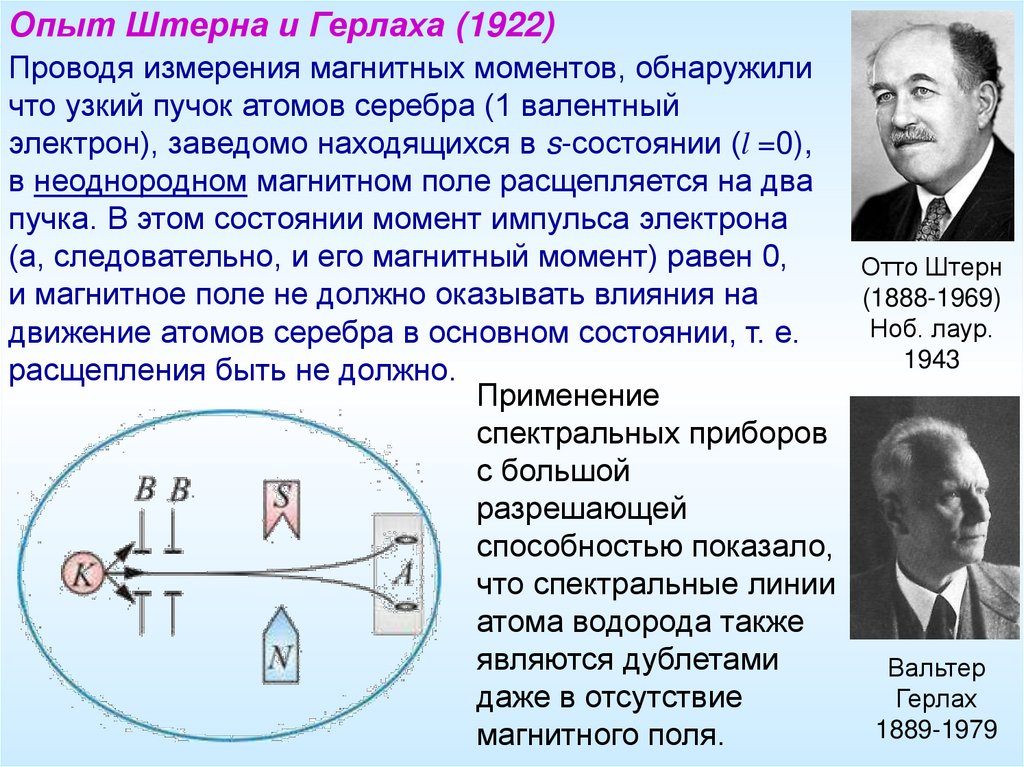
Опыт Штерна и Герлаха (1922)Проводя измерения магнитных моментов, обнаружили
что узкий пучок атомов серебра (1 валентный
электрон), заведомо находящихся в s-состоянии (l =0),
в неоднородном магнитном поле расщепляется на два
пучка. В этом состоянии момент импульса электрона
(а, следовательно, и его магнитный момент) равен 0,
Отто Штерн
и магнитное поле не должно оказывать влияния на
(1888-1969)
Ноб. лаур.
движение атомов серебра в основном состоянии, т. е.
1943
расщепления быть не должно.
Применение
спектральных приборов
с большой
разрешающей
способностью показало,
что спектральные линии
атома водорода также
являются дублетами
Вальтер
даже в отсутствие
Герлах
1889-1979
магнитного поля.
8.
Спин электрона (Уленбек, Гаудсмит 1925)Спином назвали собственный механический момент
импульса электрона, не связанный с его движением.
Соответственно, электрон обладает и собственным
магнитным моментом. Это внутреннее свойство,
присущее электрону (наряду с зарядом и массой).
Существование спина подтверждается большим числом
опытов и может считаться доказанным. Кроме того, все
его свойства автоматически вытекают из уравнений
П.Дирака (1926 г.) квантовой механики.
По аналогии с орбитальным моментом импульса:
h
h
s ( s 1) s ( s 1)
L
l l 1 l l 1 LS
2
2
а число его проекций на заданное направление ( 2 s 1) .
Раз расщепление на дублет, то ( 2 s 1) 2
s 1/ 2
а составляющая момента по заданному направлению
S z mS где mS s – ½, + ½
— спиновое магнитное квантовое число.
Джордж
Юджин
Уленбек
(1900-1988)
Сэмюэл
Абрахам
Гаудсмит
1902-1978
9.
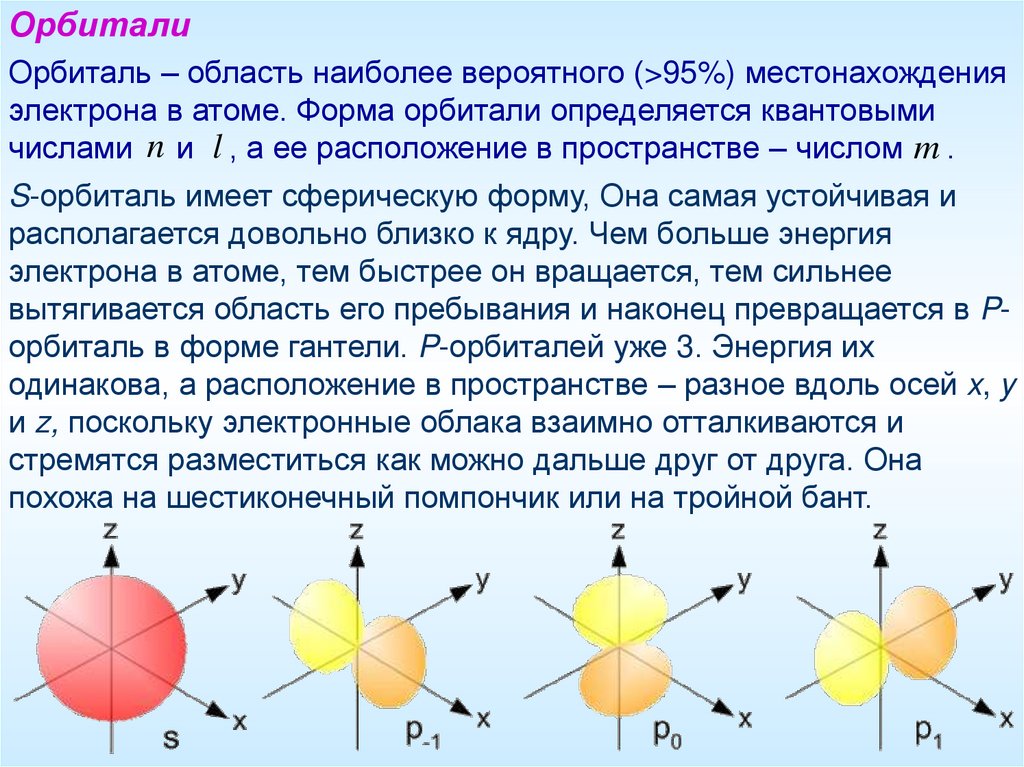
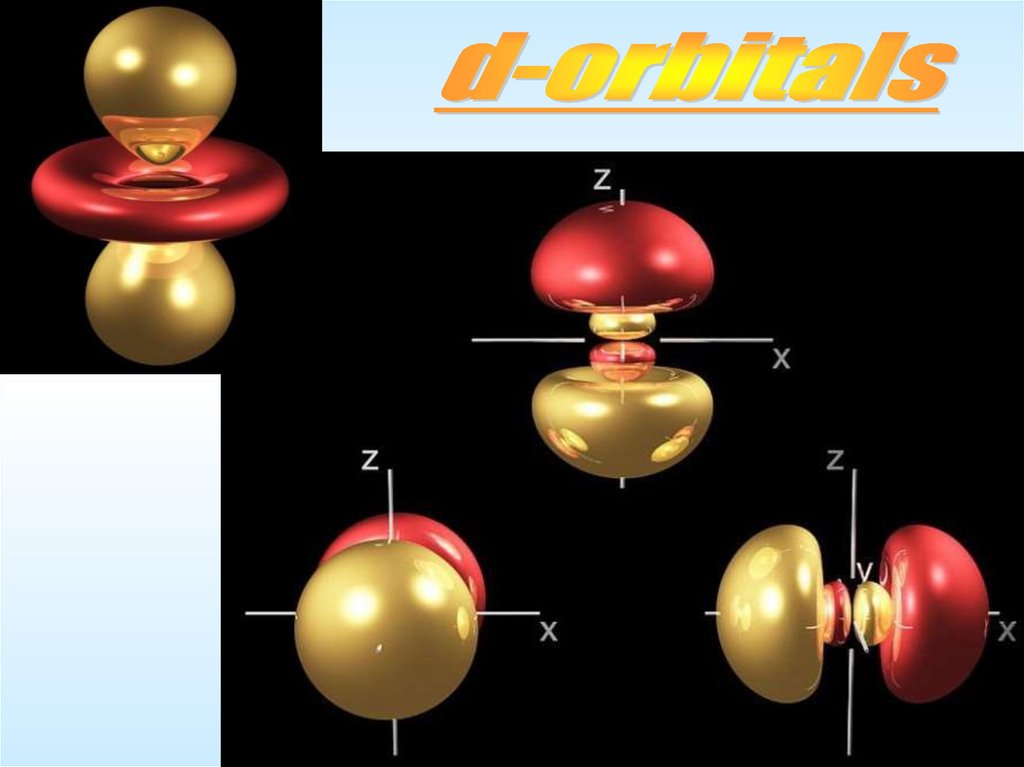
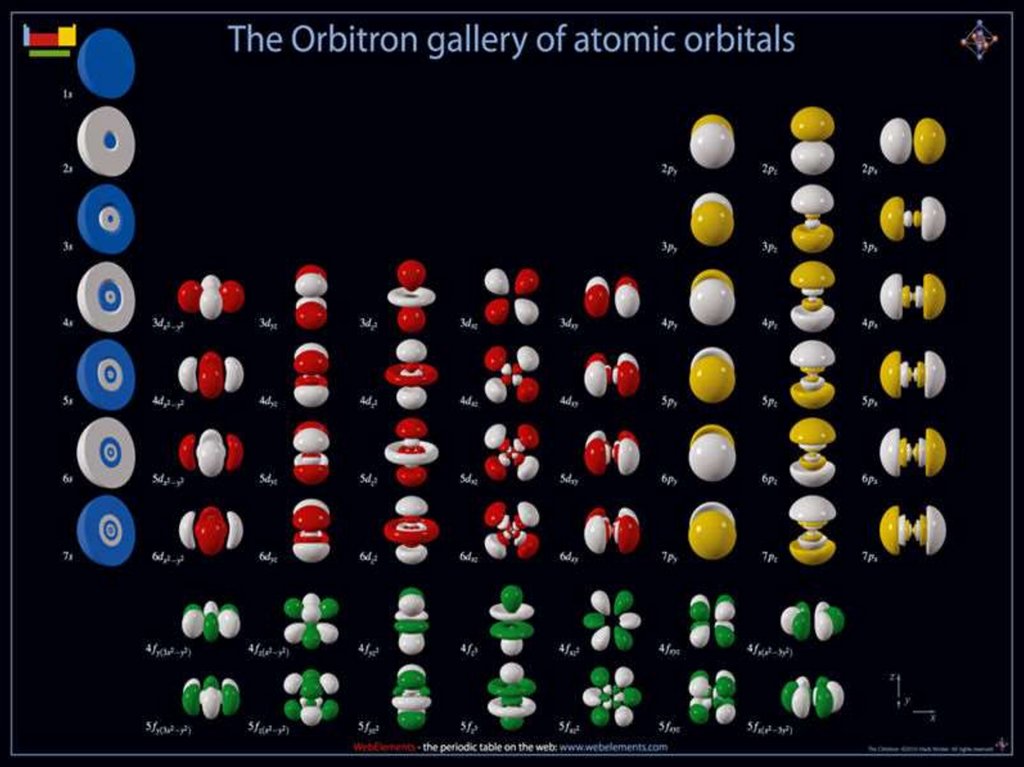
ОрбиталиОрбиталь – область наиболее вероятного (>95%) местонахождения
электрона в атоме. Форма орбитали определяется квантовыми
числами n и l , а ее расположение в пространстве – числом m .
S-орбиталь имеет сферическую форму, Она самая устойчивая и
располагается довольно близко к ядру. Чем больше энергия
электрона в атоме, тем быстрее он вращается, тем сильнее
вытягивается область его пребывания и наконец превращается в Pорбиталь в форме гантели. P-орбиталей уже 3. Энергия их
одинакова, а расположение в пространстве – разное вдоль осей x, y
и z, поскольку электронные облака взаимно отталкиваются и
стремятся разместиться как можно дальше друг от друга. Она
похожа на шестиконечный помпончик или на тройной бант.
10.
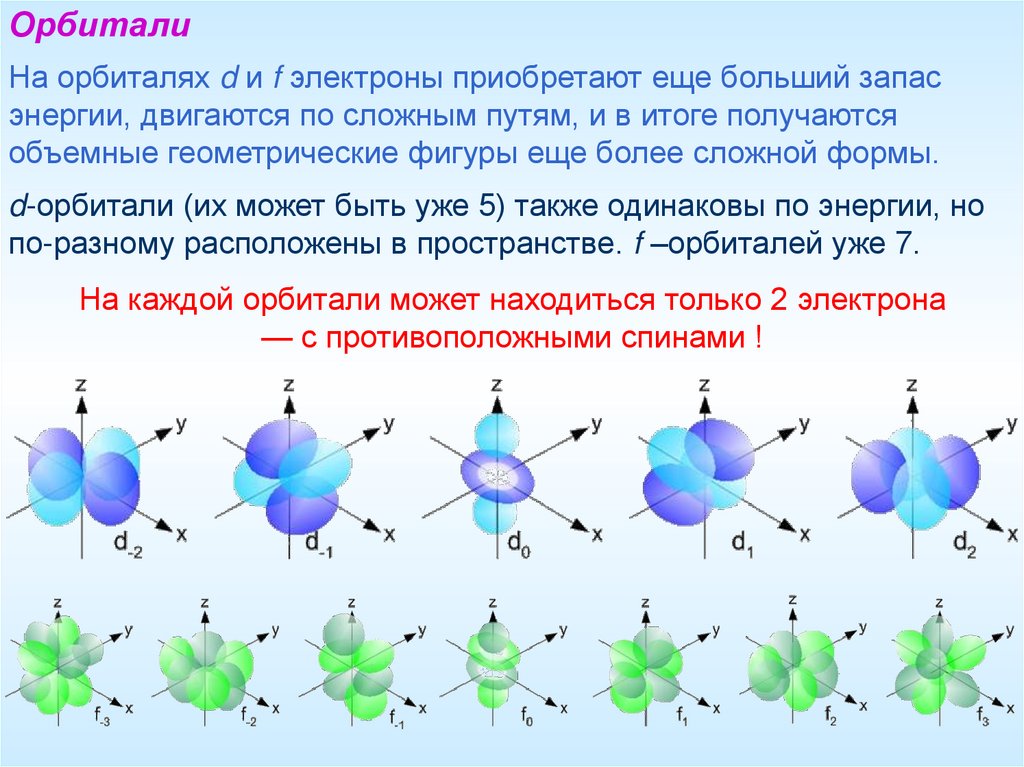
ОрбиталиНа орбиталях d и f электроны приобретают еще больший запас
энергии, двигаются по сложным путям, и в итоге получаются
объемные геометрические фигуры еще более сложной формы.
d-орбитали (их может быть уже 5) также одинаковы по энергии, но
по-разному расположены в пространстве. f –орбиталей уже 7.
На каждой орбитали может находиться только 2 электрона
— с противоположными спинами !
11.
12.
13.
14.
Заполнение орбиталейЭлектроны всегда занимают более низкие энергетические уровни.
Там, где есть выбор, они заполняют орбитали по отдельности
(правило Ф.Хунда, 1925 г.). У s-орбитали энергия обычно меньше,
чем у р, поэтому они заполняются раньше.
Более энергетически выгодны
оказываются те состояния, для
которых сумма главного и
орбитального квантовых чисел
(n l ) имеет меньшее
значение (правило
В.М.Клечковского, 1951 г.).
Поэтому 4s-орбитали (4 0) 4
энергетически выгоднее, чем
3d-орбитали (3 2) 5 и
заполняются первыми, а затем
уже все 3d- и 4p-орбитали.
Аналогично атомные орбитали
4f не заполняются, пока не
будут заняты все места на 6s.
15.
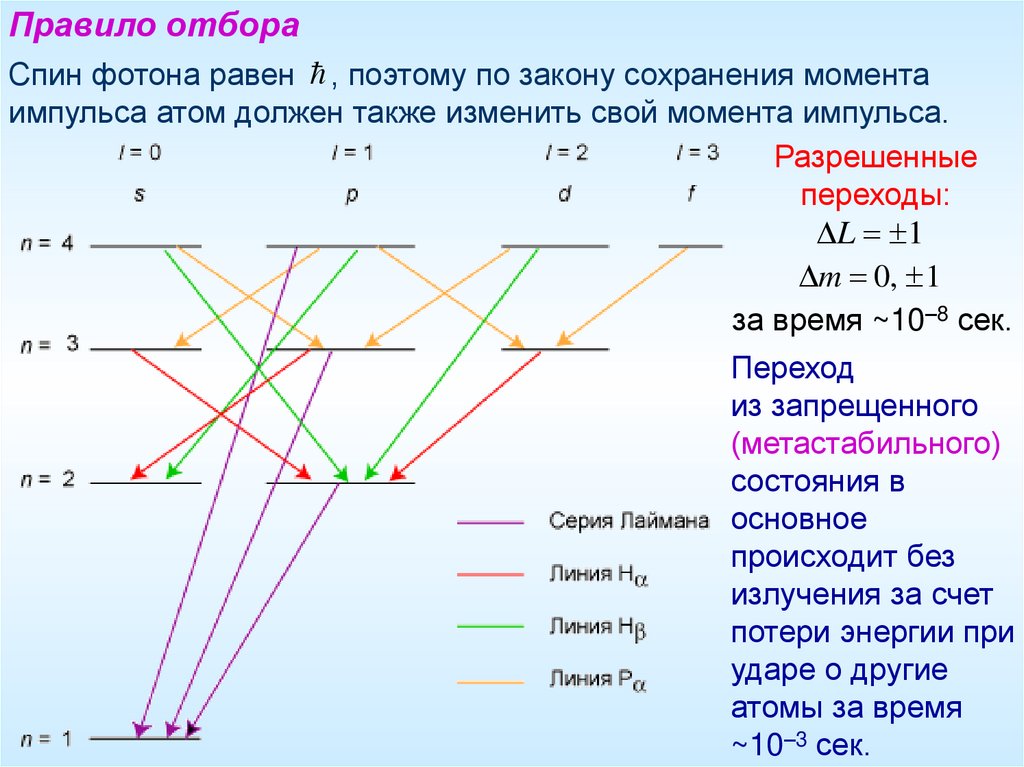
Правило отбораСпин фотона равен , поэтому по закону сохранения момента
импульса атом должен также изменить свой момента импульса.
Разрешенные
переходы:
L 1
m 0, 1
за время ~10–8 сек.
Переход
из запрещенного
(метастабильного)
состояния в
основное
происходит без
излучения за счет
потери энергии при
ударе о другие
атомы за время
~10–3 сек.
16.
Принцип ПаулиВ пределах одной квантовой системы, в данном
квантовом состоянии, может находиться только один
электрон (фермион), состояние другого должно
отличаться хотя бы одним квантовым числом.
На одном и том же энергетическом уровне может
находиться не более 2 фермионов с противоположными Вольфганг
Эрнст Паули
спинами.
(1900-1958)
Ноб. лаур.
1945
Следствием принципа
является наличие
электронных
оболочек в структуре
атома, из чего, в свою
очередь,
следует разнообразие
химических элементов
и их соединений.
17.
Распределение электронов по уровням1s:
2s:
2p:
n = 1;
n = 2;
n = 2;
3s:
3p:
3d:
n = 3;
n = 3;
n = 3;
4f:
5g:
n = 4;
n = 5;
l = 0;
l = 0;
l = 1;
l = 0;
l = 1;
l = 2;
l = 3;
l = 4;
l
0
1
2
3
4
n
s
p
d
f
g
2n2
1
2
—
—
—
—
2
2
2
6
—
—
—
8
3
2
6
10
—
—
18
4
2
6
10
14
—
32
5
2
6
10
14
18
50
m = 1; s = ± 1/2
m = 1; s = ± 1/2
m = 0, 1, –1; s = ± 1/2
m = 1; s = ± 1/2
m = 0, 1, –1; s = ± 1/2
m = 0, 1, –1, 2, –2; s = ± 1/2
m = 0, 1, –1, 2, –2, 3, –3; s = ± 1/2
m = 0, 1, –1, 2, –2, 3, –3; 4, –4; s = ± 1/2
18.
19.
Периодическая таблица Менделеева (1869)1) Водород (1): 1s1
2) Гелий (2): 1s2 — инертный газ
3) Литий (3): 1s2 2s1 — щелочной металл
4) Бериллий (4): 1s2 2s2 — металл
5) Бор (5): 1s2 2s2 2p1 — не металл
6) Гелий (10): 1s2 2s2 2p6 — инертный газ
7) Натрий (11): 1s2 2s2 2p6 3s1— щелочной металл
8) Магний (12): 1s2 2s2 2p6 3s2— металл
9) Алюминий (13): 1s2 2s2 2p6 3s2 3p1— металл
10) Аргон (18): 1s2 2s2 2p6 3s2 3p6 — инертный газ
11) Калий (19): 1s2 2s2 2p6 3s2 3p6 4s1 — щелочной металл
12) Кальций (20): 1s2 2s2 2p6 3s2 3p6 4s2 — металл
13) Скандий (21): 1s2 2s2 2p6 3s2 3p6 4s2 3d1 — металл
14) Цинк (30): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 — металл
15) Галлий (31): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p1 — металл
16) Криптон (36): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 — инертный газ
20.
Периодическая таблица Менделеева (1869)Рубидий (37): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1
Стронций (38): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
Иттрий (38): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d1
Кадмий (48): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10
Индий (49): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p1
Ксенон (54): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6
Цезий (55): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s1
Барий (56): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2
Лантан (57): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 5d1
Церий (58): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 5d1 4f1
Лютеций (71): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 5d1 4f14
Гафний (72): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d2
Ртуть (80): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10
Таллий (81): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p1
Радон (86): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6
Франций(87):1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s1
21.
Периодическая таблица Менделеева (1869)Радий (88): 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s2
Актиний (89): 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s2 6d1
Торий (90): 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s2 6d15f1
Уран (92): 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s2 6d15f3
Плутоний (94): 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s2 6d15f5
Лоуренсий (103): 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s2 6d15f14
Резерфордий (104): 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s2 5f146d2
Коперниций (112): 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s2 5f146d10
Нихоний (113): 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s2 5f146d10 7p1
Флёровий (114): 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s2 5f146d10 7p2
Московий (115): 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s2 5f146d10 7p3
Ливерморий (116): 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s2 5f146d10
7p4
Теннессин (117):1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s2 5f146d107p5
Оганессон (118): 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s2 5f146d10
7p6
22.
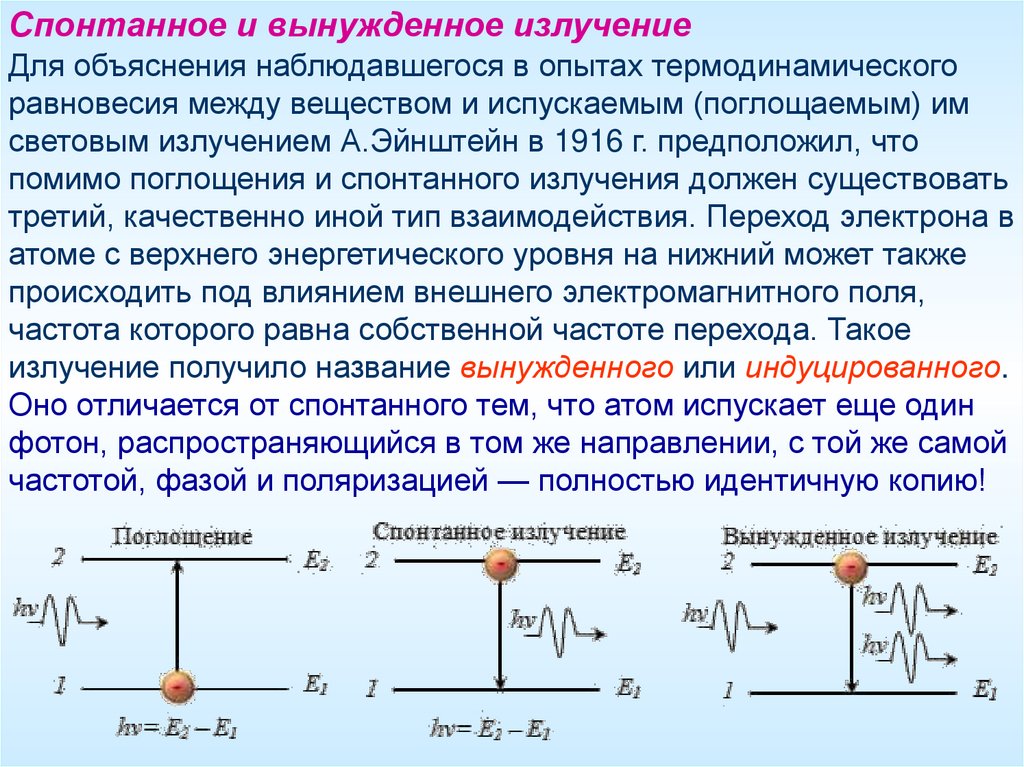
Спонтанное и вынужденное излучениеДля объяснения наблюдавшегося в опытах термодинамического
равновесия между веществом и испускаемым (поглощаемым) им
световым излучением А.Эйнштейн в 1916 г. предположил, что
помимо поглощения и спонтанного излучения должен существовать
третий, качественно иной тип взаимодействия. Переход электрона в
атоме с верхнего энергетического уровня на нижний может также
происходить под влиянием внешнего электромагнитного поля,
частота которого равна собственной частоте перехода. Такое
излучение получило название вынужденного или индуцированного.
Оно отличается от спонтанного тем, что атом испускает еще один
фотон, распространяющийся в том же направлении, с той же самой
частотой, фазой и поляризацией — полностью идентичную копию!
23.
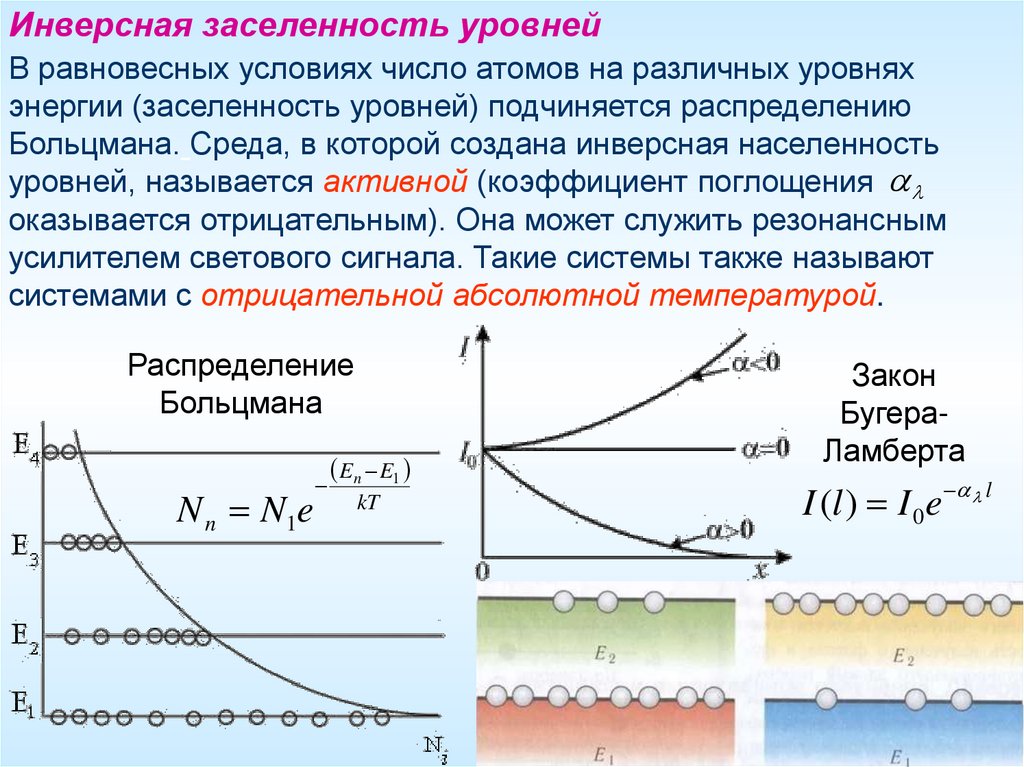
Инверсная заселенность уровнейВ равновесных условиях число атомов на различных уровнях
энергии (заселенность уровней) подчиняется распределению
Больцмана. Среда, в которой создана инверсная населенность
уровней, называется активной (коэффициент поглощения
оказывается отрицательным). Она может служить резонансным
усилителем светового сигнала. Такие системы также называют
системами с отрицательной абсолютной температурой.
Распределение
Больцмана
N n N1e
En E1
kT
Закон
БугераЛамберта
I (l ) I 0 e l
24.
Квантовый генератор излучения (Лазер)Light Amplification by Stimulated Emission of Radiation
Любой лазер состоит из: 1) рабочей среды (газовые,
твердотельные, жидкостные, полупроводниковые).
2) системы накачки (оптическая, электрический разряд,
электрический ток, химические реакции) для перевода
атомов среды в возбужденное инверсное состояние за Басов Николай
счет внешнего источника энергии.
Геннадиевич
(1922-2001)
3) оптического резонатора.
В 2-х уровневой системе инверсия невозможна.
Басов и Прохоров в 1955 г. предложили 3-х уровневую
схему: при накачке электроны переходят с 1-го
энергетического уровня на 3-й. Затем через короткое
время (t =10-8 сек) они спонтанно переходят на 2-й
уровень, который является метастабильным (t =10-3
сек). Таким образом создается инверсная
Прохоров
заселенность 2-го уровня по сравнению с 1-м. Теперь, Александр
при попадании на систему кванта, равного разности
Михайлович
1916-2002
энергий между 2-м и 1-м уровнями, произойдет
Ноб. прем. 1964
индуцированный переход с испусканием света.
25.
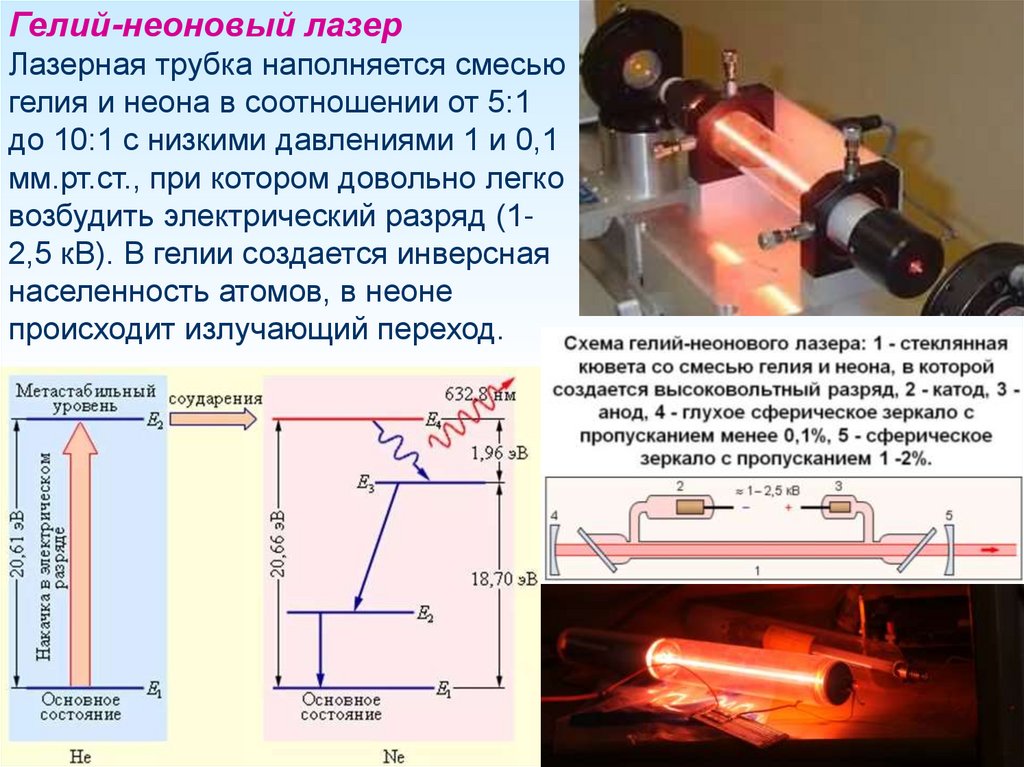
Гелий-неоновый лазерЛазерная трубка наполняется смесью
гелия и неона в соотношении от 5:1
до 10:1 с низкими давлениями 1 и 0,1
мм.рт.ст., при котором довольно легко
возбудить электрический разряд (12,5 кВ). В гелии создается инверсная
населенность атомов, в неоне
происходит излучающий переход.
26.
Рубиновый лазер (Теодор Мейман, 1960)Рубин – прозрачный, бесцветный кристалл окиси алюминия
AI2O3 (корунд) и хрома Cr (0,05%), Используются 3 атомных
уровня хрома: основной, 1-й (метастабильный 3 мс) и 2-й.
Импульсная
ксеноновая или
ртутная лампа
10–3 сек, 107 Вт
D = 0,4-2,5 см, L до 20 см.
















 Физика
Физика








