Похожие презентации:
Атомная физика
1. АТОМНАЯ ФИЗИКА
раздел физики, изучающийстроение и свойства атомов.
2. Модель атома Томсона
В 1898г.Атом –
в виде положительно
заряженного шарика
радиусом порядка 10-10 м, в который
вкраплены отдельные электроны,
нейтрализующие положительный
разряд.
3. Планетарная модель атома.
В 1911г. Э.Резерфорд провел рядэкспериментов
4. ВЫВОД:
Атомное ядро с зарядом Z.Z равно
порядковому номеру
элемента.
Вокруг ядра вращается Z
электронов.
В целом атом нейтрален.
5. Сложности планетарной модели атома:
Согласно теории Максвелла, электрон,движущийся вокруг ядра, должен
непрерывно излучать
электромагнитные волны.
Такая модель неустойчива, вследствие
излучения электрон теряет энергию и
неизбежно падает на ядро
Но этого в природе не наблюдается.
6. ПОСТУЛАТЫ Н.БОРА.
Электроны могут двигаться в атометолько по определенным орбитам,
находясь на которых они, несмотря
на наличие у них ускорения, не
излучают.
Атом излучает или поглощает квант
электромагнитной энергии при
переходе из одного стационарного
состояния в другое.
7.
Еm E n
h
- для излучения.
E m E n
- m, n - номера орбит
(состояния) - главное
квантовое число.
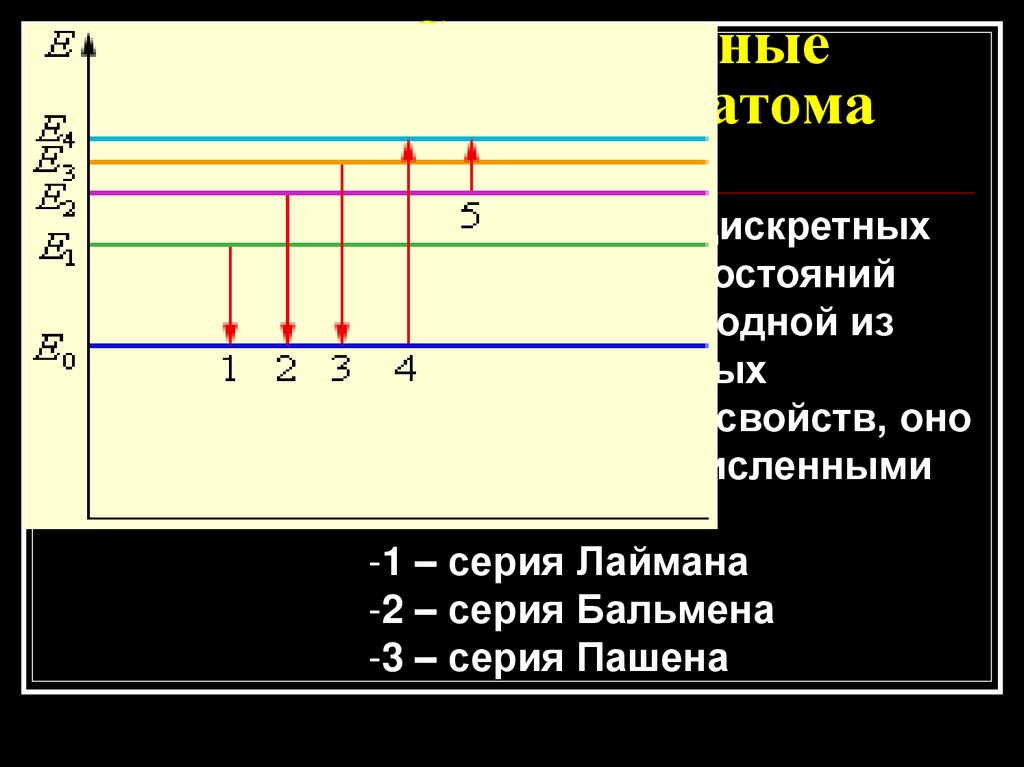
8. Стационарные состояния атома водорода.
Существование дискретныхэнергетических состояний
атомов является одной из
самых характерных
особенностей их свойств, оно
доказано многочисленными
опытами.
-1 – серия Лаймана
-2 – серия Бальмена
-3 – серия Пашена
9. Н. Бор в 1913 г. предложил модель атома водорода, в основе которой лежат данные постулаты.
Постулаты Бора определили принципиальнуюособенность внутриатомного мира - квантовый
характер происходящих в нем процессов.
Условие Бора позволило отобрать возможные
круговые орбиты электронов в атоме водорода и
объяснить спектр излучения атома водорода.
Метод квантования Бора был обобщен А.
Зоммерфельдом, который показал, что квантовых
условий должно быть столько, сколько степеней
свободы имеет рассматриваемый тип движения.








 Физика
Физика








