Похожие презентации:
Классификация и номенклатура неорганических веществ. Лекция №1
1.
Классификация иноменклатура
неорганических веществ
Литература:
1. О.С. Габриелян. Химия. Учебник для
общеобразовательных учебных
заведений., Москва, 2002 г.
2. Химия. Пособие-репетитор для
поступающих в Вузы. Под редакцией А.С.
Егорова. Ростов-на-Дону, изд. «Феникс»,
2003 г.
2. Наука, включающая в себя химию и физику, изучает природу и свойства материи и энергии в неживых системах.
• три фундаментальных вида материи:• Вещество, обладающее определённой массой в
состоянии покоя, представляет собой наиболее
распространённый вид. Оно может состоять из частиц,
молекул, атомов, а также их соединений, которые
образуют физическое тело.
• Химия изучает вещество
• Физическое поле - это особая материальная
субстанция, которая призвана обеспечивать
взаимодействие объектов (веществ)
• Физическое поле – предмет изучения физики.
• Физический вакуум - является материальной средой с
наименьшим уровнем энергии.
3. Вещества, изучаемые химией — вещества, состоящие из атомов. Вещества, в которых выделение атомов невозможно или теряет
Вещества, изучаемые химией —вещества, состоящие из атомов.
Вещества, в которых выделение
атомов невозможно или теряет
физический смысл
(например, плазма или звёздное
вещество), к предмету рассмотрения
химией не относят. Состоящее из
атомов вещество- основной объект
изучения химии.
4. Вещества
Простыесостоят из атомоводного химического
элемента.
Сложныесостоят из атомов
разных элементов
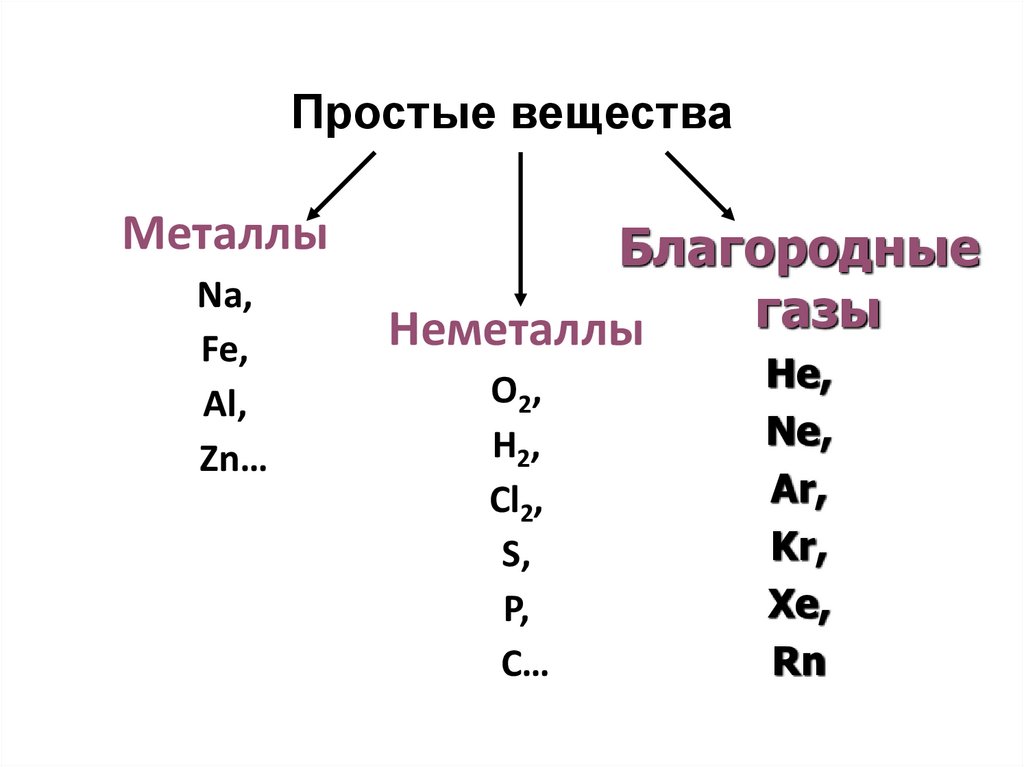
5. Простые вещества
МеталлыNa,
Fe,
Al,
Zn…
Благородные
газы
Неметаллы
O2,
H2,
Cl2,
S,
P,
C…
He,
Ne,
Ar,
Kr,
Xe,
Rn
6.
Сложные веществаБинарные соединения – это соединения, в
состав которых входят два химических
элемента
Примеры
Гидриды – соединения водорода с металлами - ЭHх
Карбиды- соединения углерода с металлами
Нитриды – соединения азота с металлами и неметаллами
например, нитрид бора, ВN или нитрид алюминия AlN
Сульфиды – соединения серы с металлами и водородом
Оксиды – соединения кислорода с металлами и
неметаллами
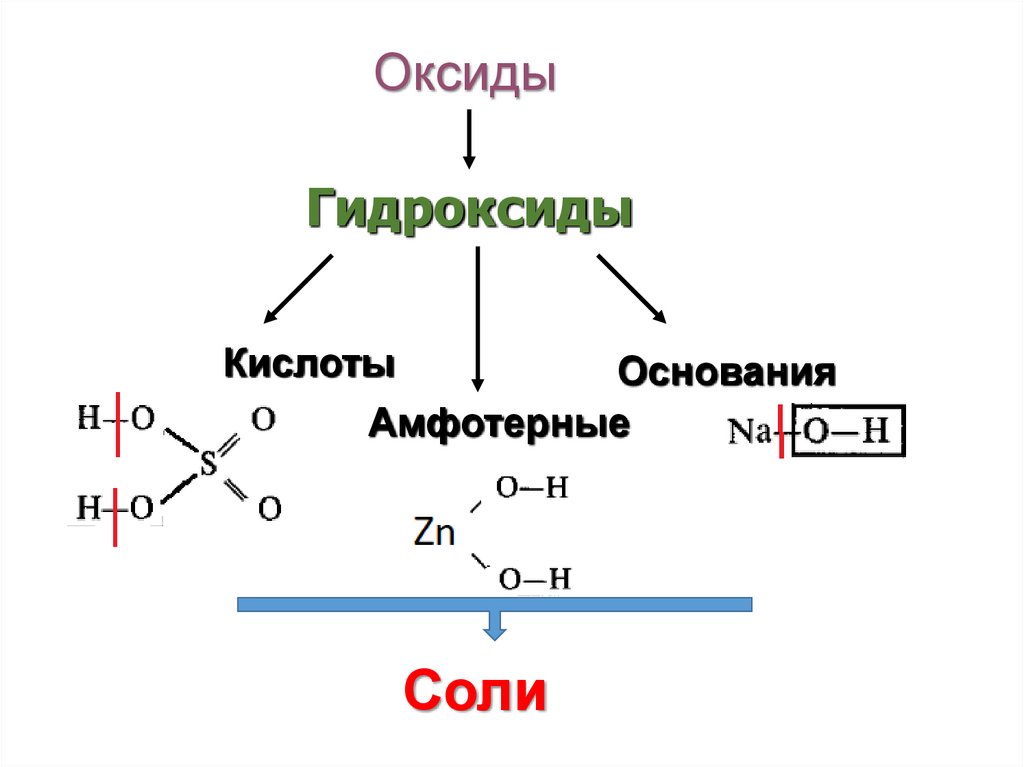
7.
ОксидыГидроксиды
Кислоты
Основания
Амфотерные
Соли
8.
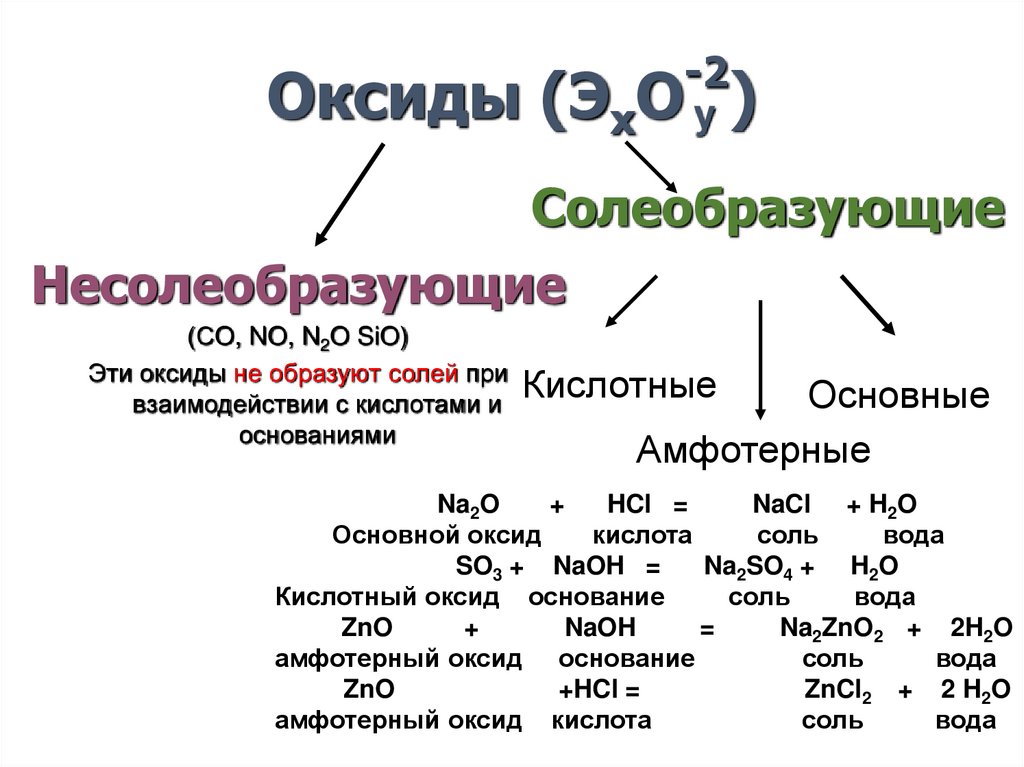
-2Оксиды (ЭхО y )
Солеобразующие
Несолеобразующие
(СO, NO, N2O SiO)
Эти оксиды не образуют солей при
Кислотные
взаимодействии с кислотами и
основаниями
Основные
Амфотерные
Na2O
+
HCl =
NaCl + H2O
Основной оксид
кислота
соль
вода
SO3 + NaOH =
Na2SO4 + H2O
Кислотный оксид основание
соль
вода
ZnO
+
NaOH
=
Na2ZnO2 + 2H2O
амфотерный оксид основание
соль
вода
ZnO
+HCl =
ZnCl2 + 2 H2O
амфотерный оксид кислота
соль
вода
9. По какому признаку солеобразующие оксиды делят на три вида?
• Основной оксид• Гидрат оксида – основание
→
соль
N a 2O N a O H N a C l
• Амфотерный оксид—амфотерный гидроксид--- соль
ZnO Zn OH 2 H 2 ZnO 2 Na 2 ZnO 2
ZnO Zn ( OH ) 2 ZnCl 2
• Кислотный оксид--- кислота--- соль
6
6
6
S O3 H 2S O4 CaS O4
10. Кислотные оксиды
Оксиды неметаллов:SO2
SO3
CO2
P2O5
SiO2
N2O3
N2O5
Оксиды металлов со
степенью окисления
+6, +7
СrO3
Mn2O7
11. Основные оксиды-
Основные оксидыоксиды металловсо степенью окисления +1, +2
Na2O
Li2O
K 2O
MgO
CaO
BaO
CrO
FeO
NiO
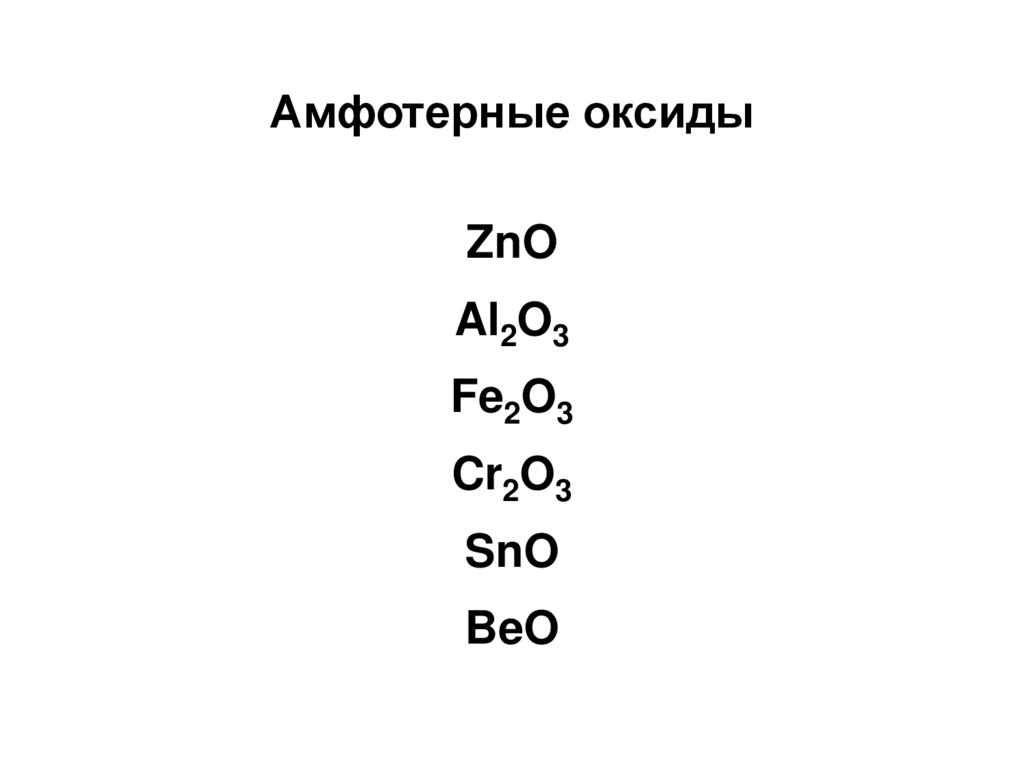
12. Амфотерные оксиды
ZnOAl2O3
Fe2O3
Cr2O3
SnO
BeO
13.
Кислоты – это сложные вещества,содержащие атомы водорода,
которые могут замещаться атомами
металлов.
Общая формула кислот – НхАс
Ас – кислотный остаток.
Число атомов водорода определяет основность кислоты
Кислоты, содержащие один атом водорода –
одноосновные кислоты
Кислоты, содержащие более одного атома водорода –
многоосновные кислоты
НСl – одноосновная кислота
H2SO4 - двухосновная кислота
H3PO4 – трехосновная кислота
14. Классификация кислот
По содержанию кислородаКислородосодержащие
Бескислородные
(оксокислоты)
(H2SO4, HNO3)
(HCl, HF, H2S)
По основности
Одноосновные
Двухосновные
Трехосновные
(HCl, HBr, HNO3)
(H2SO4, H2CO3)
(H3PO4)
По силе
Сильные
(HBr, HCl, HNO3)
Средние
Слабые
(H3PO4, HNO2)
(H2CO3,H2SiO3)
15. Кислоты (НхАс)
БескислородныеHCl – соляная
(хлороводородная)
• HF - фтороводородная
• HI – иодоводородная
• HBr – бромоводородная
• H2S – сероводородная
Кислородсодержащие
HNO3 – азотная
HNO2 – азотистая
H2SO4 – серная
H2SO3 – сернистая
H3PO4 – фосфорная
H3PO3 - фосфористая
HMnO4 - марганцовая
H2CrO4 – хромовая
HClO4 –хлорная
НСlO3 - хлорноватая
HClO2 - - хлорная
H2SiO3 – кремниевая
HClO – хлорноватистая
H2СO3 – угольная
CH3COOH - уксусная
16. Соответствие кислот и оксидов
SO2 –SO3 –
CO2 –
P2O5 –
SiO2 –
N 2O 3 –
N 2O 5 –
СrO3 –
Mn2O7 –
H2SO3
H2SO4
H2CO3
H3PO4
H2SiO3
HNO2
HNO3
H2CrO4
HMnO4
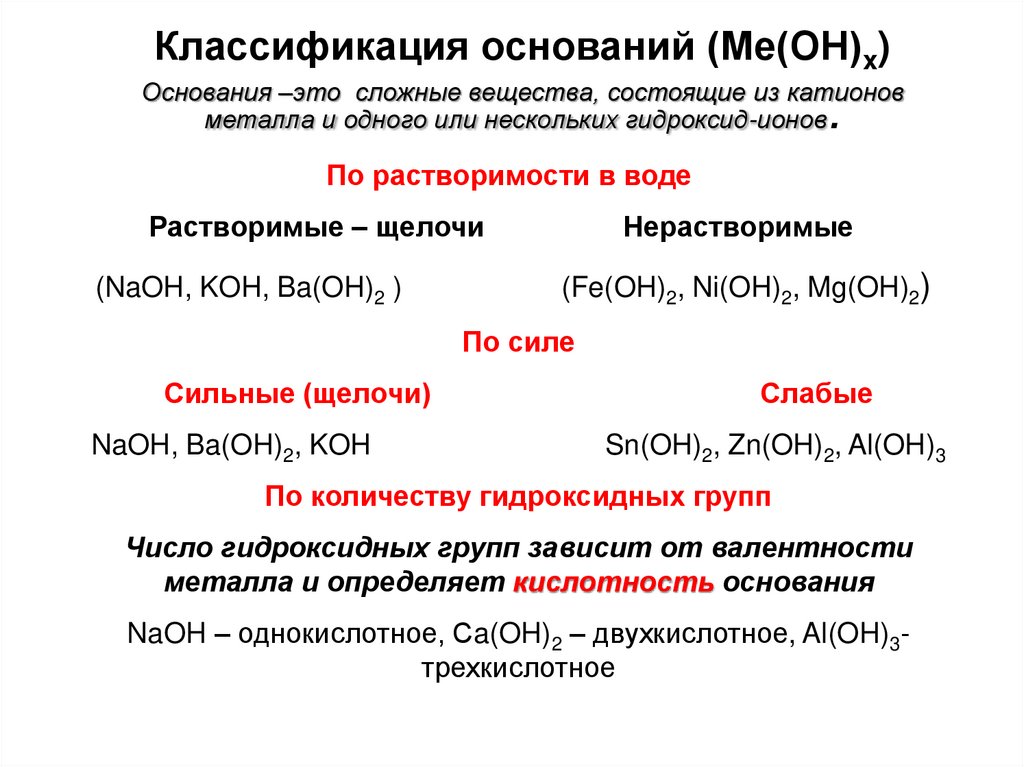
17. Классификация оснований (Ме(ОН)x) Основания –это сложные вещества, состоящие из катионов металла и одного или нескольких
гидроксид-ионов.
По растворимости в воде
Растворимые – щелочи
(NaOH, KOH, Ba(OH)2 )
Нерастворимые
(Fe(OH)2, Ni(OH)2, Mg(OH)2)
По силе
Сильные (щелочи)
NaOH, Ba(OH)2, KOH
Слабые
Sn(OH)2, Zn(OH)2, Al(OH)3
По количеству гидроксидных групп
Число гидроксидных групп зависит от валентности
металла и определяет кислотность основания
NaOH – однокислотное, Сa(OH)2 – двухкислотное, Al(OH)3трехкислотное
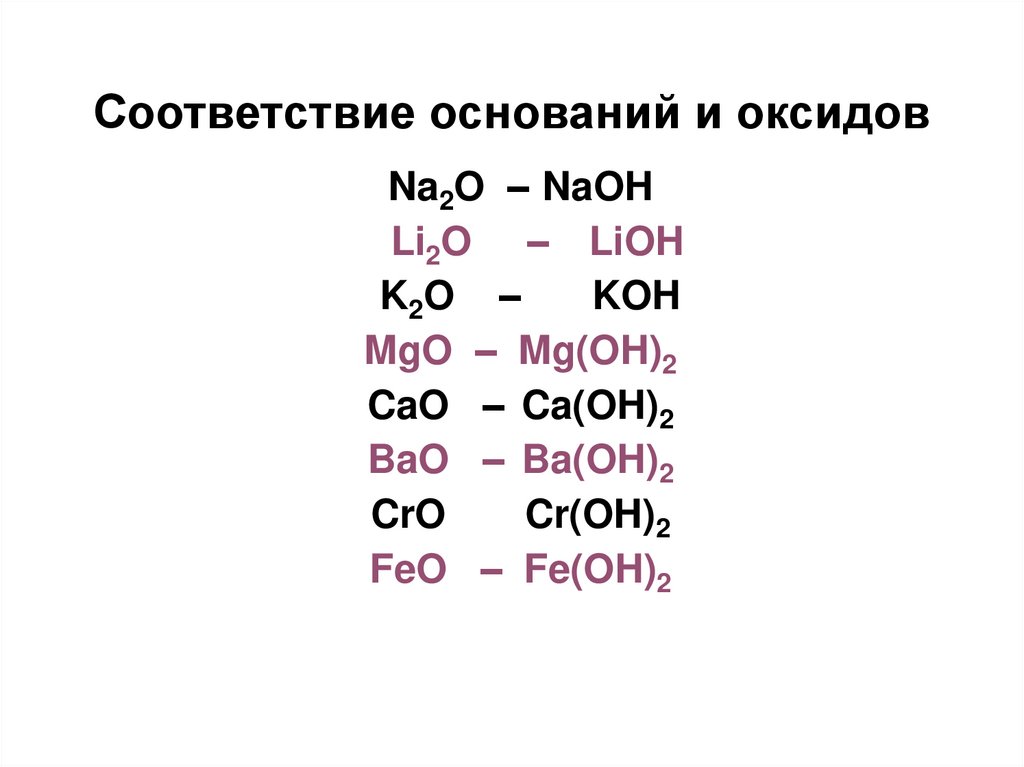
18. Соответствие оснований и оксидов
Na2O – NaOHLi2O – LiOH
K2O –
KOH
MgO – Mg(OH)2
CaO – Ca(OH)2
BaO – Ba(OH)2
CrO
Cr(OH)2
FeO – Fe(OH)2
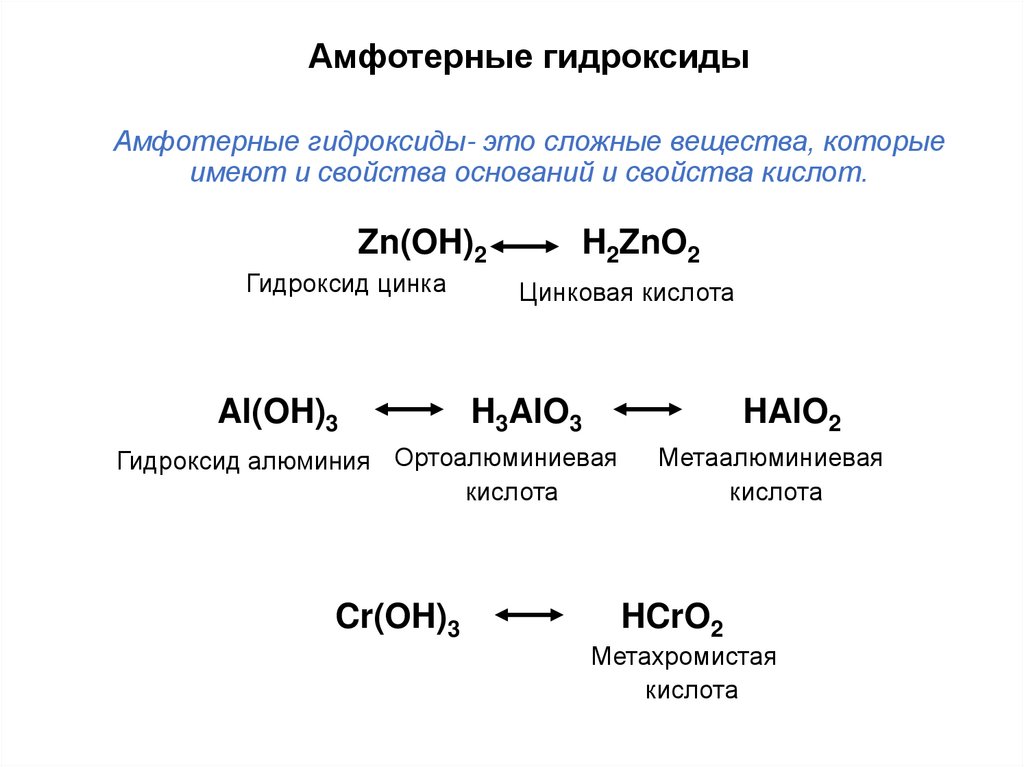
19. Амфотерные гидроксиды Амфотерные гидроксиды- это сложные вещества, которые имеют и свойства оснований и свойства кислот.
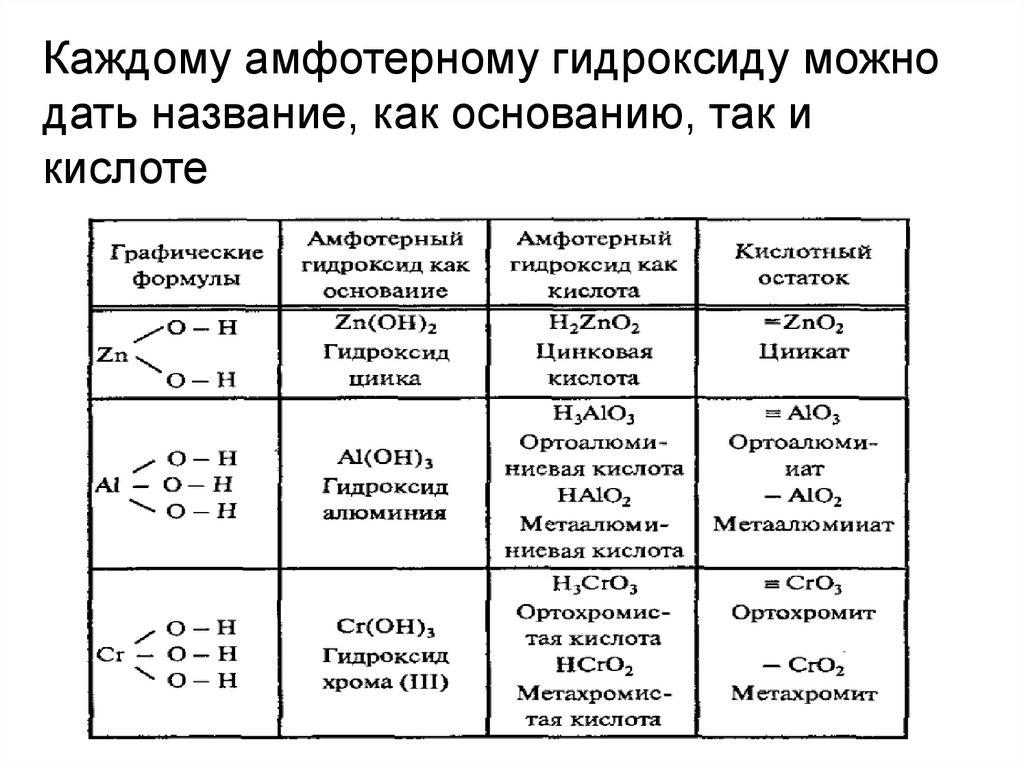
Zn(OH)2Гидроксид цинка
Al(OH)3
H2ZnO2
Цинковая кислота
H3AlO3
HAlO2
Гидроксид алюминия Ортоалюминиевая
кислота
Cr(OH)3
Метаалюминиевая
кислота
HCrO2
Метахромистая
кислота
20.
СолиСоли –это сложные вещества, являющиеся
продуктами замещения атомов водорода атомами
металла в молекулах кислот или продуктами
замещения гидроксидных групп в молекулах
оснований кислотными остатками.
21. Классификация солей
Нормальные (средние)NaCl, Na2SO4, Na3PO4
Кислые
NaHSO4, Na2HPO4, NaH2PO4
Основные
MgOHCl, Al(OH)2NO3
Двойные (смешанные)
KAl(SO4)2, Fe(NH4)2(SO4)2
Комплексные
Na2[Zn(OH)4], K3[Fe(CN)6]
22.
Номенклатура неорганических соединенийОксиды
Название оксида
«Оксид» + название элемента в родительном падеже +
валентность
элемента (римскими цифрами)
Примеры: СО – оксид углерода (II)
СО2 – оксид углерода (IV)
Fe2O3 – оксид железа (III)
SO3 – оксид серы (VI)
Если элемент имеет постоянную валентность,
ее в названии оксида не указывают
Примеры: Na2O – оксид натрия
Al2O3 – оксид алюминия
23.
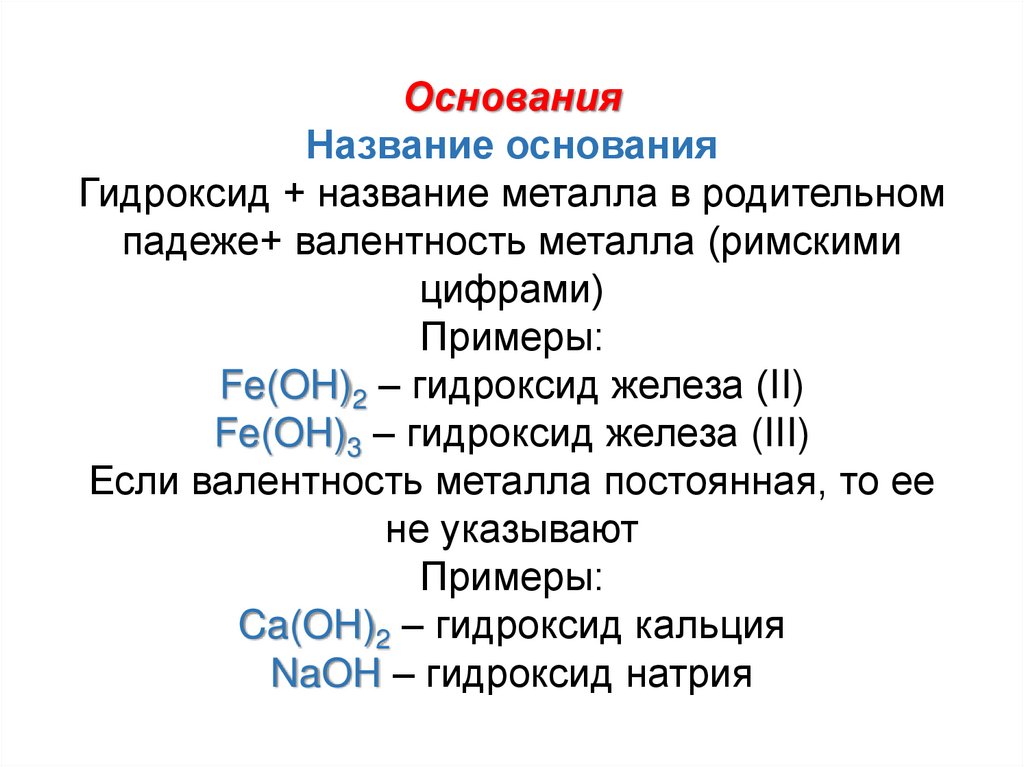
ОснованияНазвание основания
Гидроксид + название металла в родительном
падеже+ валентность металла (римскими
цифрами)
Примеры:
Fe(OH)2 – гидроксид железа (II)
Fe(OH)3 – гидроксид железа (III)
Если валентность металла постоянная, то ее
не указывают
Примеры:
Ca(OH)2 – гидроксид кальция
NaOH – гидроксид натрия
24.
Номенклатура кислот25.
26.
Оксокислоты.Названия некоторых оксокислот и
кислотных остатков
27.
Номенклатура амфотерныхгидроксидов
28.
Каждому амфотерному гидроксиду можнодать название, как основанию, так и
кислоте
29.
Соли. Номенклатура.Нормальные (средние) соли – это продукты
полного замещения атомов водорода в молекуле кислоты
или гидроксидных групп в молекуле основания
кислотными остатками..
В молекуле нормальной соли сумма валентностей металлов
равна сумме валентностей кислотных остатков.
30.
Кислые соли– это продукты неполного замещения
атомов водорода в молекулах
многоосновных кислот атомами металла.
31.
32.
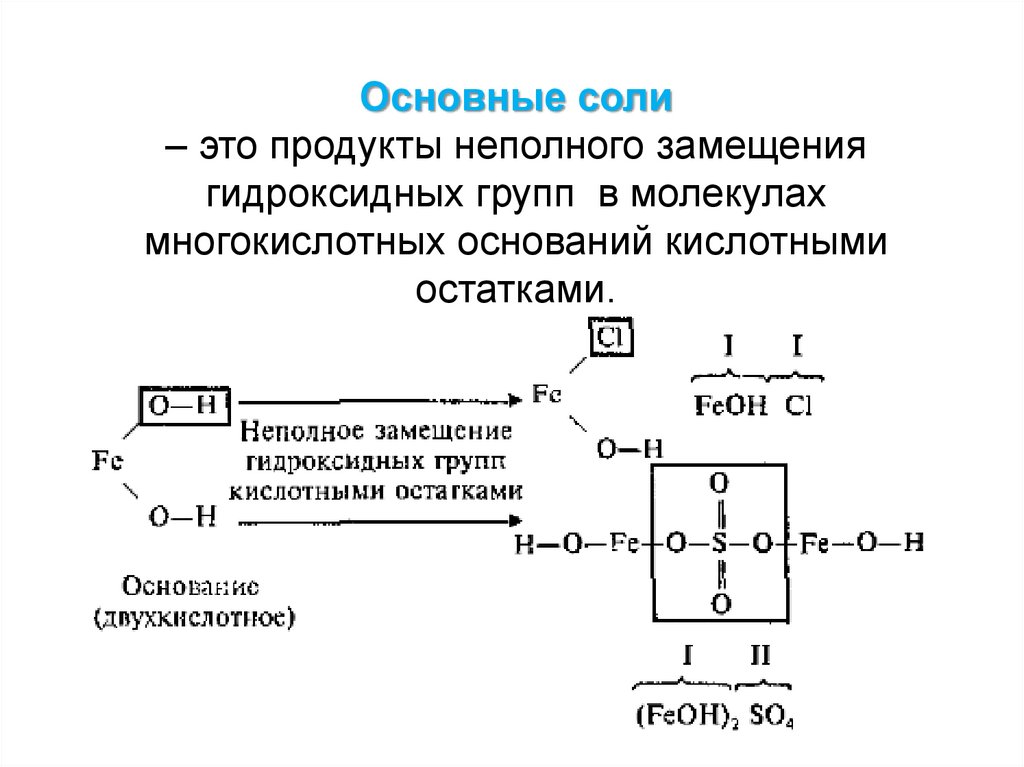
Основные соли– это продукты неполного замещения
гидроксидных групп в молекулах
многокислотных оснований кислотными
остатками.
33.
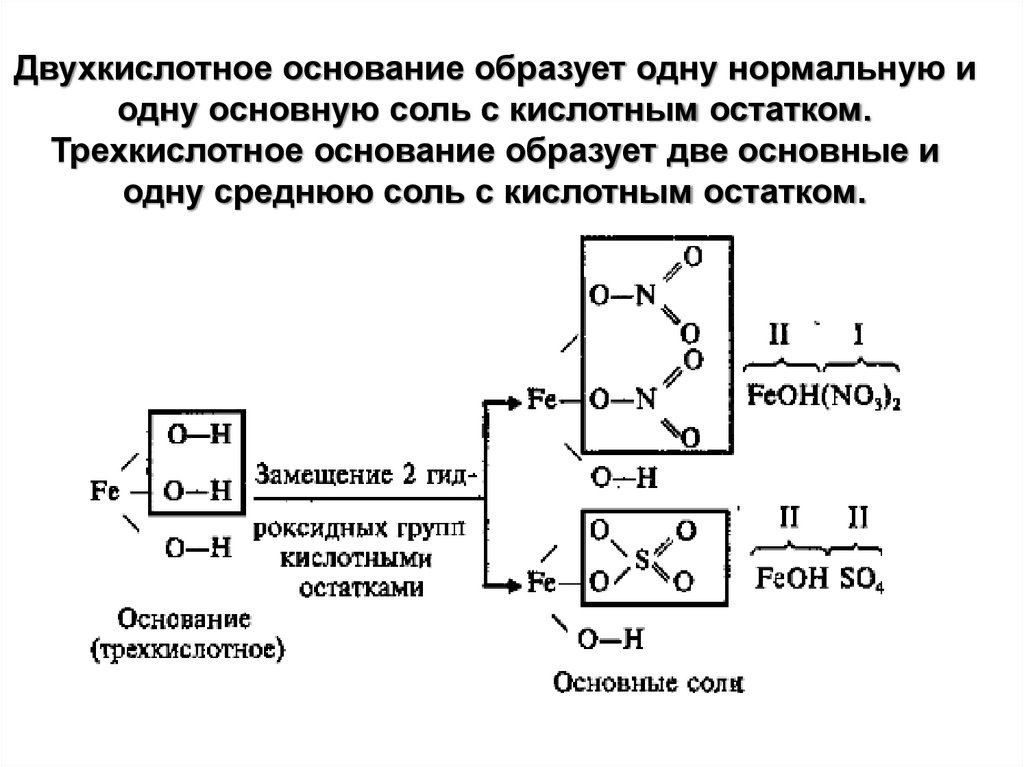
Двухкислотное основание образует одну нормальную иодну основную соль с кислотным остатком.
Трехкислотное основание образует две основные и
одну среднюю соль с кислотным остатком.
34.
НоменклатураНазвание соли = Название кислотного остатка +
притсавка «гидроксо- или дигидроксо- + название
металла в родительном падеже + валентность
металла ( в скобках, римскими цифрами)
Примеры :
CuOHCl – хлорид гидроксомеди (II)
Fe(OH)2Br – бромид дигдроксожелеза (III)
[Al(OH)2 ]SO4 – сульфат дигидроксоалюминия.
Алюминий имеет постоянную валентность III,
поэтому ее можно не указывать.
35.
Модель решения1. Средние соли –
а)BaSO4 – сульфат бария
б)AlPO4 – фосфат алюминия
2. Кислые соли –
а)Ca(HS)2 – сульфид кальция
б)NaH2PO4 – дигидрофосфат натрия
3. Основные соли
а)FeOHCl2 – хлорид гидроксожелеза (III)
б)Mn(OH)NO3 – нитрат гидроксомарганца (II)
в)(СuOH)2SO4 – cульфат гидроксомеди (II)*
*Примечание: в данном случае значение валентности не
солей не образует.
обязательно, поскольку Cu(I) основных
























 Химия
Химия








