Похожие презентации:
Относительные атомная и молекулярная массы. Массовая доля элемента в соединении (8 класс)
1.
Как измерить массу атомов и молекул?Какие единицы измерения массы будут
удобны?
2.
Масса атома водорода0,000 000 000 000 000 000 000 001 674 г
Удобно ли пользоваться таким числом?
3.
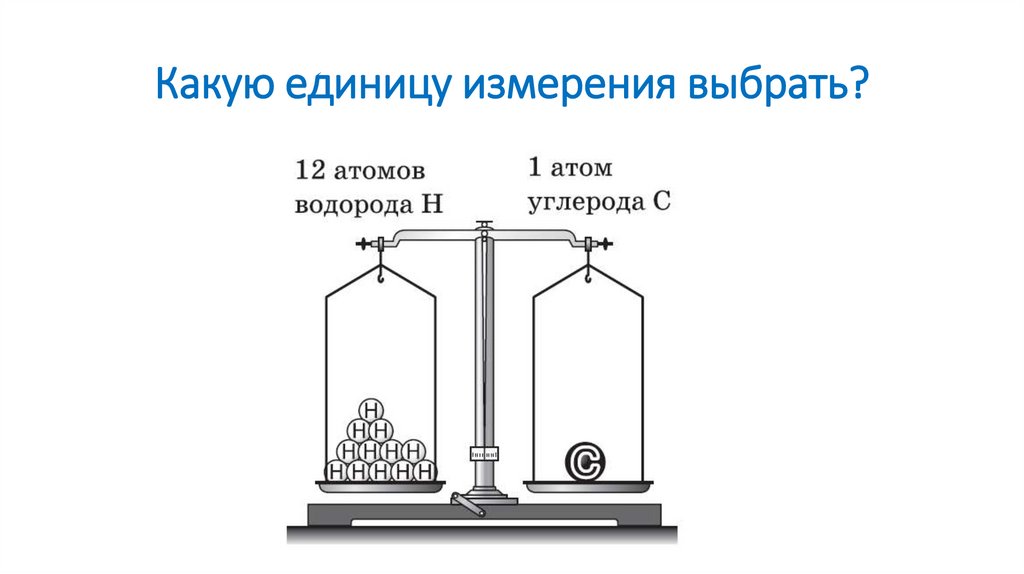
Какую единицу измерения выбрать?4.
Тема урока:Относительные атомная
и молекулярная массы.
Массовая доля элемента
в соединении
5.
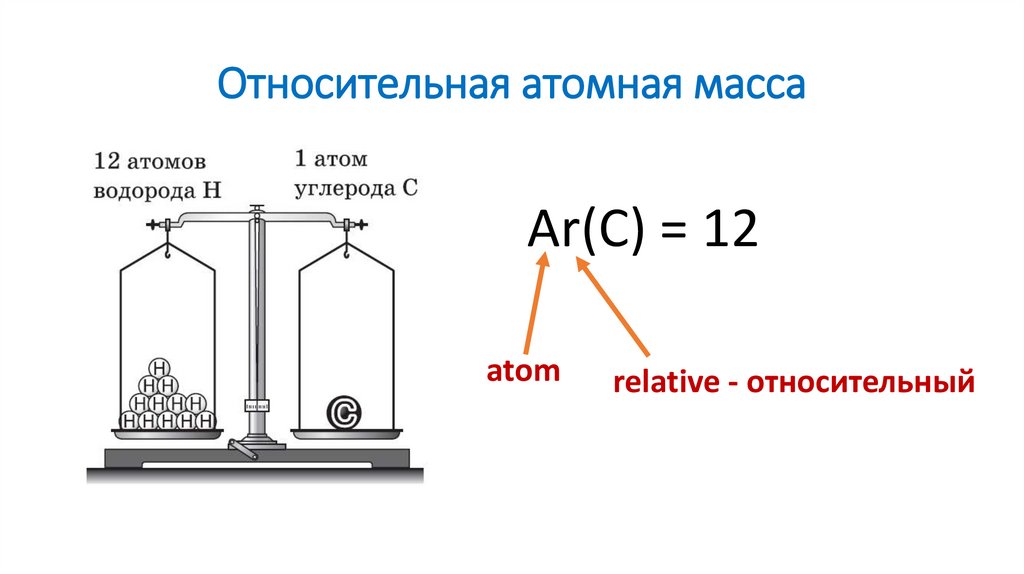
Относительная атомная массаAr(C) = 12
atom
relative - относительный
6.
Как узнать относительную атомную массу?7.
Определите относительные атомные массыэлементов (стр.35 табл.1)
Ar (N)=
Ar(Al) =
и т.д.
8.
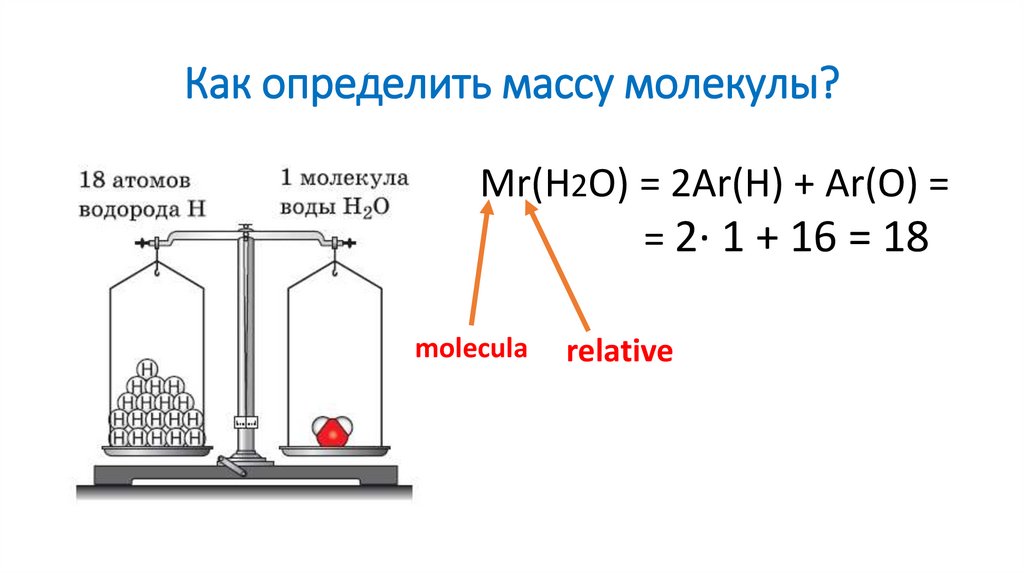
Как определить массу молекулы?Mr(H2O) = 2Ar(H) + Ar(O) =
= 2∙ 1 + 16 = 18
molecula
relative
9.
Прочитайте формулы и вычислите MrCO2, HNO3, K3PO4, CaS, AgCl
Пример: Mr(CO2) = Ar(C) + 2Ar(O) = 12 + 2 ∙ 16 = 44
10.
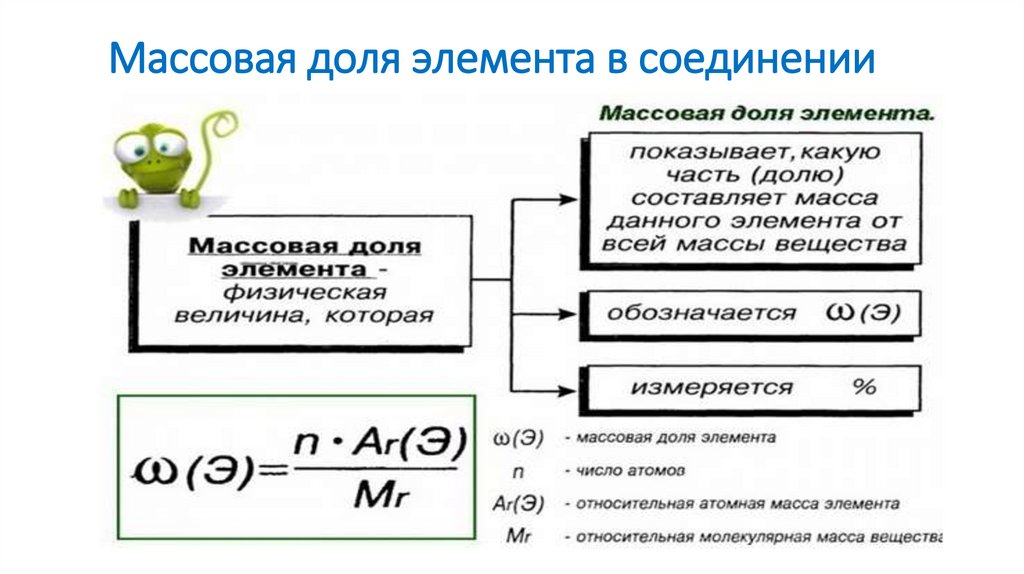
Массовая доля элемента в соединении1. Что такое процент?
2. Что такое доля?
11.
Массовая доля элемента в соединении12.
Пример: рассчитайте массовые доли элементов:углерода и кислорода в углекислом газе СО2
13.
Рассчитайте массовые доли элементов вследующих веществах
Н2О, SO2, Na2SO4.
14.
Подведем итогиПо химической формуле можно определить:
1) Какое это вещество ( дать название);
2) Тип вещества (простое или сложное);
3) Состав вещества ( качественный и количественный);
4) Относительную молекулярную массу;
5) Массовые доли элементов в соединении.
15.
Домашнее задание§ 5-7, повторить, с.41 упр. 5 – письменно.
16.
Рефлексия1) Что вам было интересно на уроке?
2) Что вы запомнили?
3) Что показалось трудным?
17.
СПАСИБО ЗА ВНИМАНИЕ!МОЛОДЦЫ!













 Химия
Химия








