Похожие презентации:
Формулы веществ. Относительная атомная масса. Относительная молекулярная масса. Массовая доля элементов в сложных веществах
1. Формулы веществ. Относительная атомная масса Относительная молекулярная масса. Массовая доля элементов в сложных веществах.
Формулы веществ.атомная
молекулярная
Массовая доля
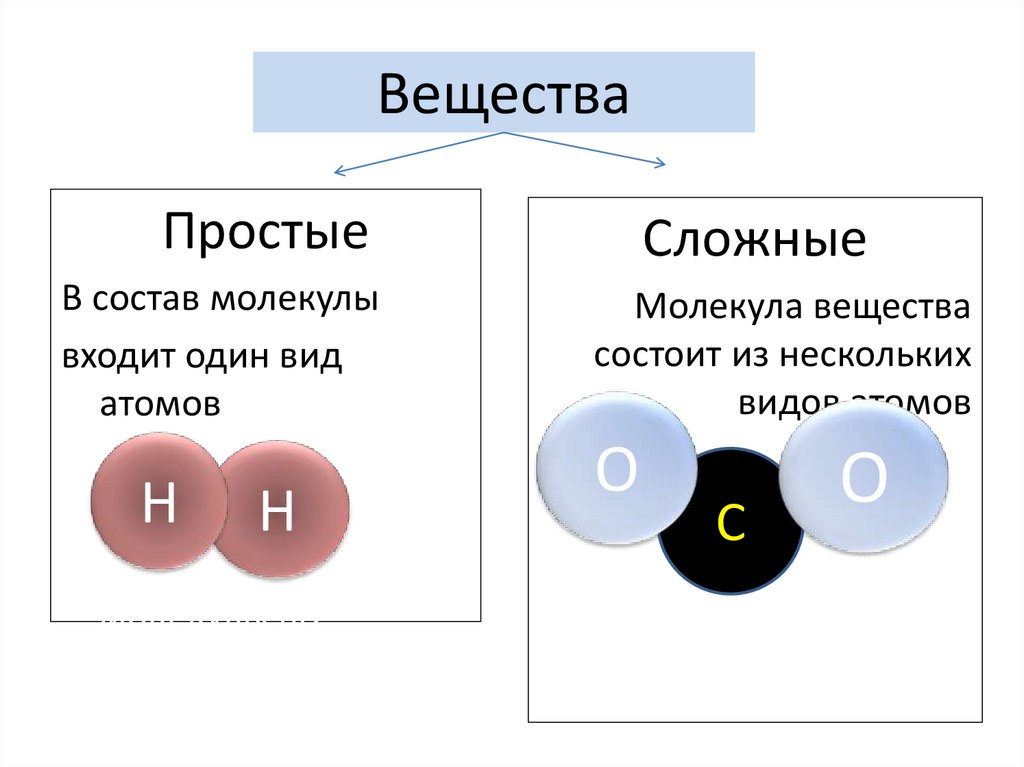
2. Вещества
ПростыеВ состав молекулы
входит один вид
атомов
H молекулы
H
• в состав
веществв состав
молекулы вD
• ещества входит один
вид атомов
Сложные
Молекула вещества
состоит из нескольких
видов атомов
O
C
O
3.
4. Формулы веществ
Химическая формула – этоусловная запись состава
вещества, посредствам
химических знаков и символов.
5. Для записи формул веществ:
1.знаки химических элементов2. индекс
3. коэффициент
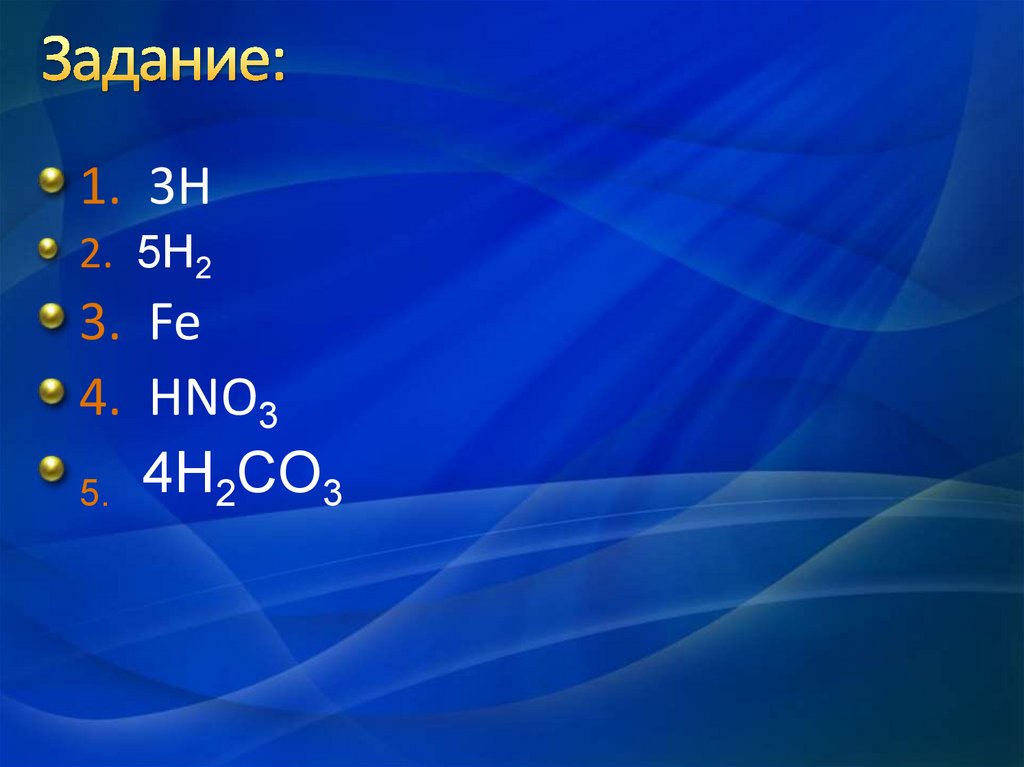
6. Задание:
1. 3H2. 5H2
3. Fe
4. HNO3
5. 4H2СO3
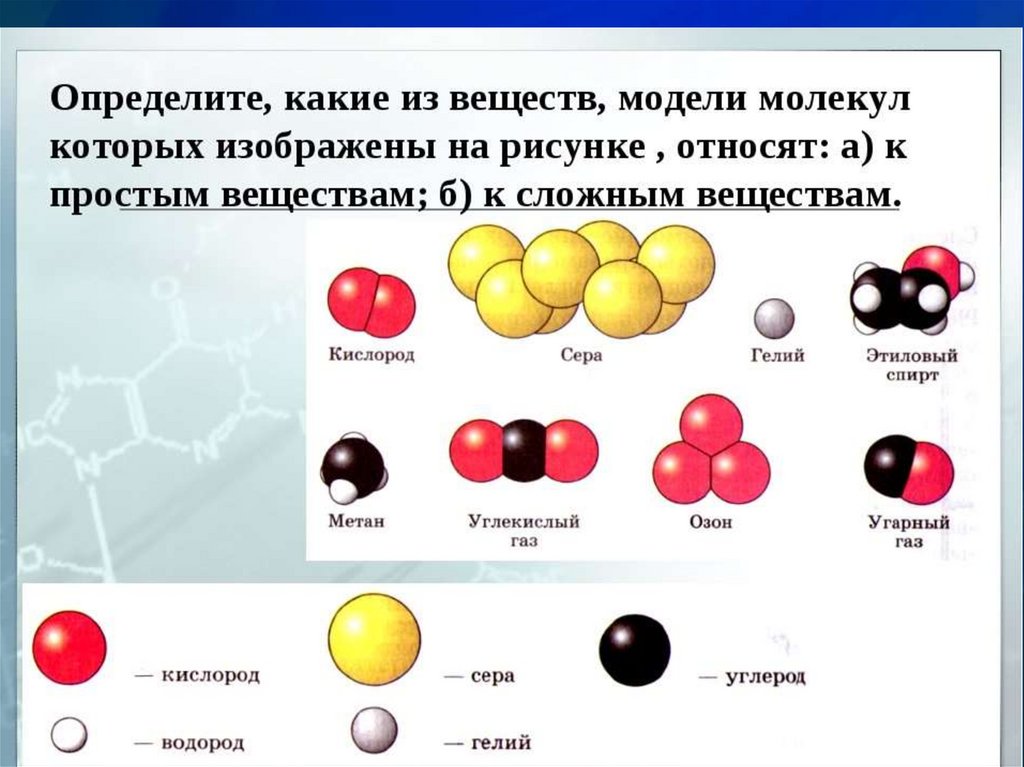
7. Напишите формулы:
1. 5атомов меди2. атом серы
3. молекула кислорода, состоящая
из двух атомов
4. три молекулы кислорода
5. две молекулы углекислого газа,
каждая из них состоит из 1 атома
углерода и двух атомов кислорода
8.
5H2СO3Индекс – показывает число
атомов в молекуле.
Знаки химических элементов.
Коэффициент - показывает число
молекул или атомов
9. Задание: Переведите текстовую информацию в символическую:
1).Две молекулы озона. В состав каждоймолекулы входят 3 атома кислорода
2). Пять молекул сернистого газа, в состав
молекулы входит 1 атом серы и 2 атома кислорода
3).Три атома железа.
4).Молекула фосфорной кислоты, в состав её
входит 3 атома водорода, 1 атом фосфора и 4
атома кислорода.
5). Вычислите молекулярную массу соды, если в
составе молекулы 1 атом натрия, 1 атом водорода,
1 атом углерода и 3 атома кислорода.
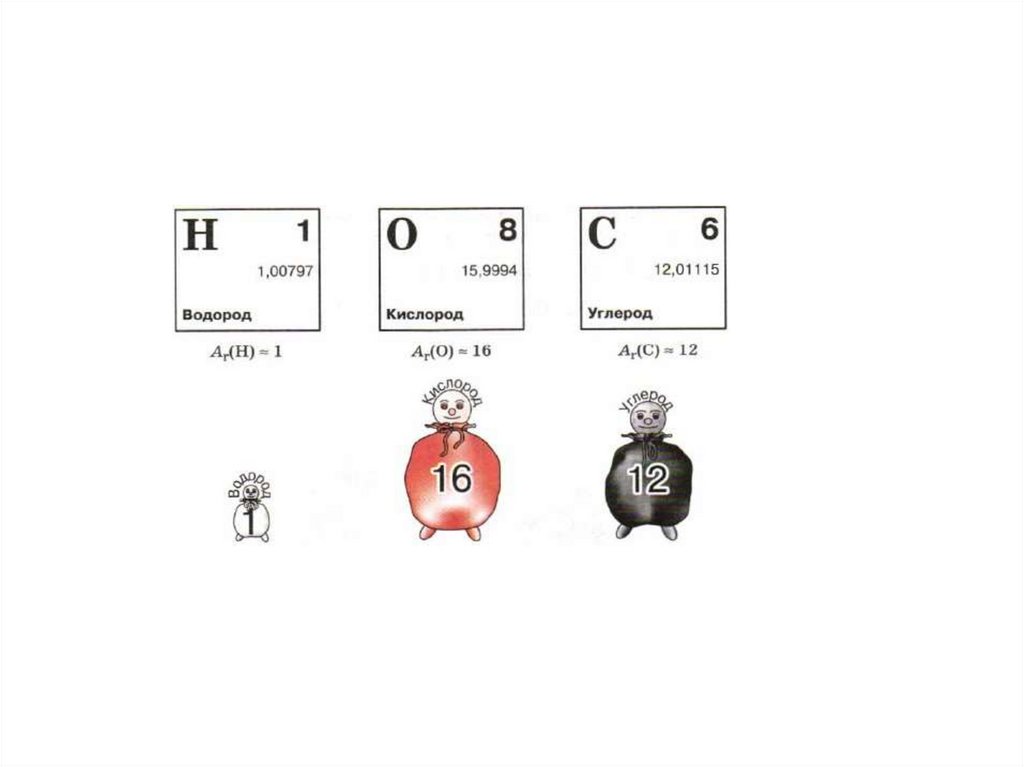
10. Относительная атомная масса Ar Относительная молекулярная масса Mr
11. Относительная масса атома
• mат (Н) = 0,000 000 000 000 000 000 000 001674 г = 0,1674∙10-23 г• mат (О) = 0,000 000 000 000 000 000 000 026667 г = 2,6667∙10-23 г
• mат (C) = 0,000 000 000 000 000 000 000 01993 г = 1,993∙10-23 г
-Ar – относительная атомная масса
1 а.е.м. – величина равная 1/12 массы атома углерода.
1 а.е.м. = mат(C)/12 = 1,674 ∙ 10-24г
1а.е.м. = = 1,993∙10-23 г/ 12 = 1,674 ∙ 10-24г
• Относительная атомная масса – это величина,
показывающая, во сколько раз масса атома больше
1/12 массы атома углерода
12.
mат (Н) = 0,000 000 000 000 000 000 000 001674 г = 0,1674∙10-23 гmат (О) = 0,000 000 000 000 000 000 000 026667 г = 2,6667∙10-23 г
mат (C) = 0,000 000 000 000 000 000 000 01993 г = 1,993∙10-23 г
2,6667 10 г
16
Аr(О) =
- 23
0,1674 10 г
-23
1,993 10-23 г
12
Аr(C) =
-23
0,1674 10 г
13.
14.
II. Нахождение Ar с помощью периодическойсистемы.
Правила округления:
- если после запятой стоит цифра меньше 5, то число остается без
изменения.
- если после запятой стоит цифра 5 или больше 5 , то число
увеличивается на единицу.
Пример:
Fe
Ar(Fe)=56
55,847
Cu
63,546
Pb
Ar(Pb)=207
207,19
Ar(Fe)=64
Ag
107,868
Ar(Ag)=108
15.
Мr(Н2О) = 2∙Ar(H) + A r(O) = 2∙1 + 16 = 18Мr(Н2SО4) = ?
Мr(Ca(OH)2 = 40 + 2(16 +1) = 74
Mr(Ca(OH)2 = 40 + 16 ∙2 +1 ∙2 =74
Мr(СuOH)2CO3 = ?
Мr(HNO3) = ?
16.
17. Вычисление массовых долей элементов в сложных веществах
Задача №1 . Вычислить массовые долиэлементов в серной кислоте
18. Задача №2
Для получения железа (выплавки)используют железные руды: магнитный
железняк Fe3O4 , красный железняк Fe2O3
Какая руда содержит больше железа?
Задача №3
Определите массовую долю железа в
серном колчедане (пирите) FeS2
Задача №4
Определите массовые доли элементов в
речном песке SiO2
19. Домашнее задание:
Решить задачи №3, №4 (см. предыдущийслайд)
Подготовиться к проверочной работе по
темам:
1. знаки химических элементов, индекс,
коэффициент
2.что означает запись? (чтение химических
формул)
3. запись химических формул по данному
тексту















 Химия
Химия








