Похожие презентации:
Регистрация лекарственных средств в соответствии с правилами Евразийского экономического союза
1.
Методика регистрации лекарственныхсредств в соответствии с правилами
Евразийского экономического союза
Научный руководитель: Е.Г. Хомутова
Добавь еще 4 слайда по основной части,
Студент: Дмитриев Д.А.
2.
Цель и задачи работыЦель исследования – составление перечня необходимых действий для успешной
регистрации лекарственных средств, произведенных в Российской Федерации, в Мексике.
Для достижения этой цели поставлены следующие задачи:
1. Выполнить сравнительный анализ законодательства по регистрации лекарственных средств
в Российской Федерации и Мексике.
2. Определить перспективы вывода лекарственных средств, произведенных в Российской
Федерации, на рынок Мексики.
3. Составить перечень действий, необходимых для успешного вывода лекарственных средств,
произведенных в Российской Федерации, на рынок Мексики.
4. Разработать методику регистрации лекарственных средств в соответствии с правилами
Евразийского экономического союза.
3.
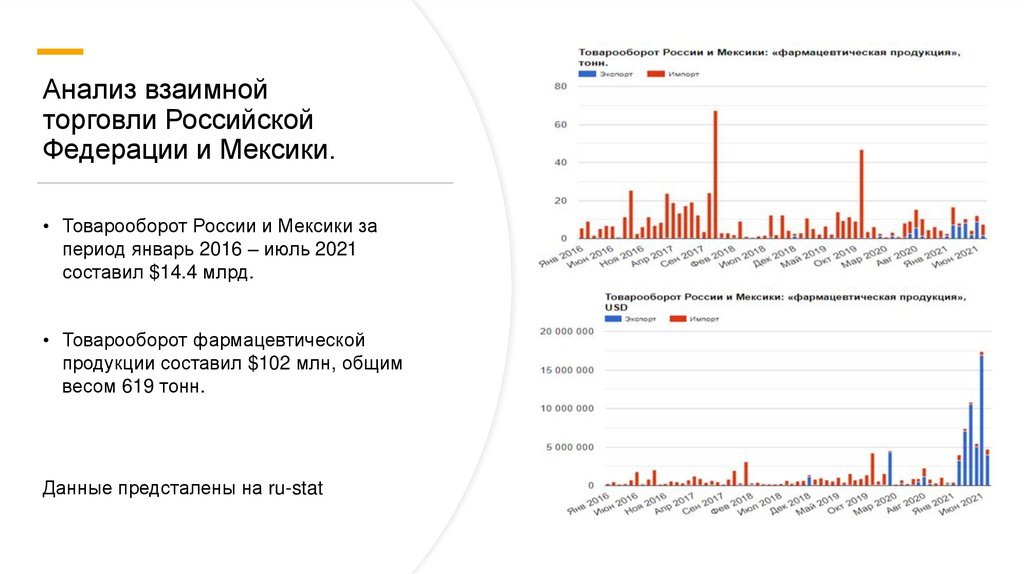
Анализ взаимнойторговли Российской
Федерации и Мексики.
• Товарооборот России и Мексики за
период январь 2016 – июль 2021
составил $14.4 млрд.
• Товарооборот фармацевтической
продукции составил $102 млн, общим
весом 619 тонн.
Данные предсталены на ru-stat
4.
Сравнительный анализ законодательстварегистрации л.с. РФ и Мексики.
• COFEPRIS - регулирующий орган системы здравоохранения Мексики;
- Общее законодательство в области здравоохранения Мексики (Ley - General de Salud);
- Соглашение о признании эквивалентности требований (ACUERDO por el que se reconocen
como equivalents);
• Министерство Здравоохранения;
- Федеральный закон от 27.11.2011 N 323 – ФЗ (ред. От 11.06.2022, с изм. от 13.07.2022) “Об
основах охраны здоровья граждан в Российской Федерации”
- Решение Совета Евразийской экономической комиссии от 3 ноября 2016 г. N 78 “О Правилах
регистрации и экспертизы лекарственных средств для медицинского применения»
5.
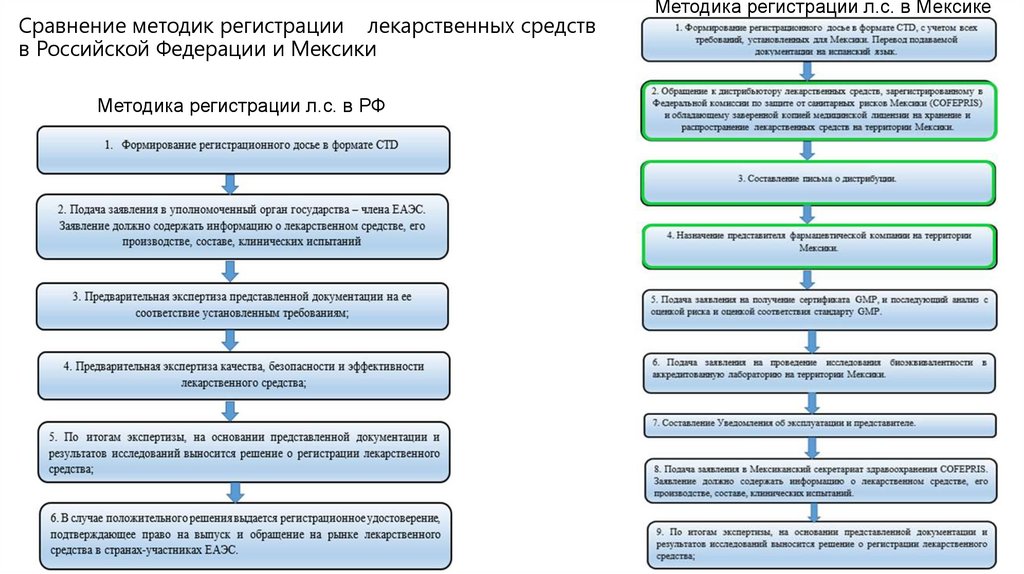
Сравнение методик регистрации лекарственных средствв Российской Федерации и Мексики
Методика регистрации л.с. в РФ
Методика регистрации л.с. в Мексике
6.
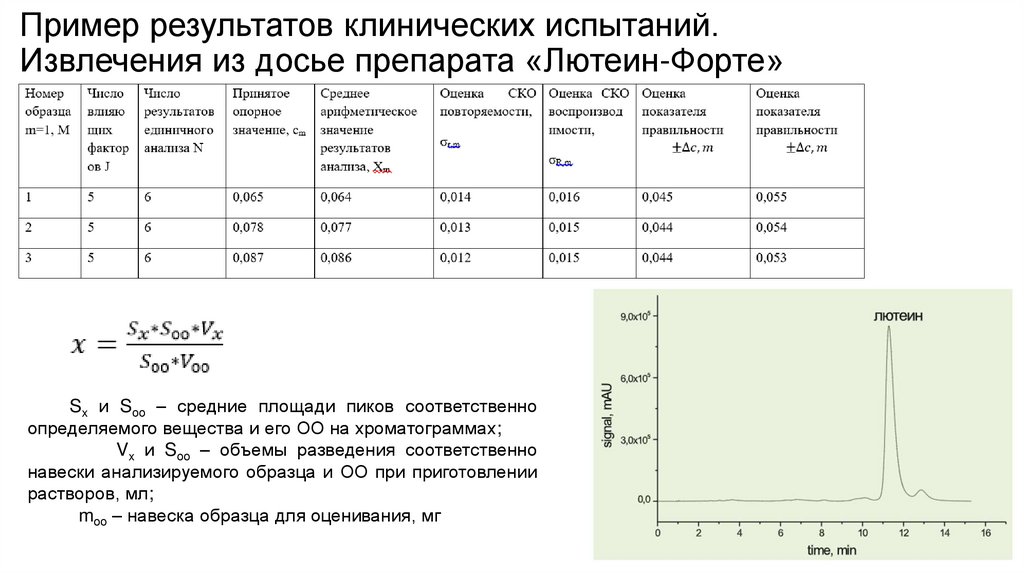
Пример результатов клинических испытаний.Извлечения из досье препарата «Лютеин-Форте»
Sx и Sоо – средние площади пиков соответственно
определяемого вещества и его ОО на хроматограммах;
Vx и Sоо – объемы разведения соответственно
навески анализируемого образца и ОО при приготовлении
растворов, мл;
mоо – навеска образца для оценивания, мг
7.
Действия, необходимые для успешного выводал.с. РФ на рынок Мексики.
• Формирование регистрационного досье в формате CTD;
• Обращение к дистрибьютору и составление письма о дистрибуции;
• Назначение представителя
• Подача заявки на получение сертификата GMP;
• Подача заявки на исследование биоэквивалентности;
8.
Методика регистрации лекарственныхсредств в соответствии с правилами
Евразийского экономического союза
1. Формирование регистрационного досье в формате CTD;
2. Подача заявления в уполномоченный орган государства - члена ЕАЭС. Заявление должно
содержать информацию о лекарственном средстве, его производстве, составе, клинических
испытаний;
3. Предварительная экспертиза представленной документации на ее соответствие установленным
требованиям;
4. Предварительная экспертиза качества, безопасности и эффективности лекарственного средства;
5. По итогам экспертизы, на основании представленной документации и результатов исследований
выносится решение о регистрации лекарственного средства;
6. В случае положительного решения выдается регистрационное удостоверение, подтверждающее
право на выпуск и обращение на рынке лекарственного средства в странах-участниках ЕАЭС.
9.
Выводы1.
Изучено состояние рынка лекарственных средств Мексики
2.
Получены результаты сравнительного анализа законодательства по регистрации
лекарственных средств в Российской Федерации и Мексике, которые показали, которые
показали, что методика регистрации лекарственных средств, принятая в ЕЭАС не
является прямо применимой в Мексике.
3.
Определены перспективы вывода лекарственных средств, произведенных в
Российской Федерации, на рынок Мексики
4.
Определены действия, необходимые для успешного вывода лекарственных средств,
произведенных в Российской Федерации, на рынок Мексики, и составлены
рекомендации.
5.
Разработана методика регистрации лекарственных средств в соответствии с
правилами Евразийского экономического союза и ее применение в рамках вывода
лекарственных средств, произведенных в Российской Федерации, на рынок Мексики.
10.
Публикации автораДмитриев Д.А., Хомутова Е.Г. Регистрация в Мексике
лекарственных средств, произведенных в Российской
Федерации. Сборник трудов Национальная научнотехническая конференция с международным участием
"Перспективные материалы и технологии" ("ПМТ - 2023").
(в печати).







 Медицина
Медицина








