Похожие презентации:
Биоэнергетика
1.
БИОЭНЕРГЕТИКА2.
Биоэнергетика–
раздел
биохимии,
занимающийся вопросами преобразования и
использования энергии.
3.
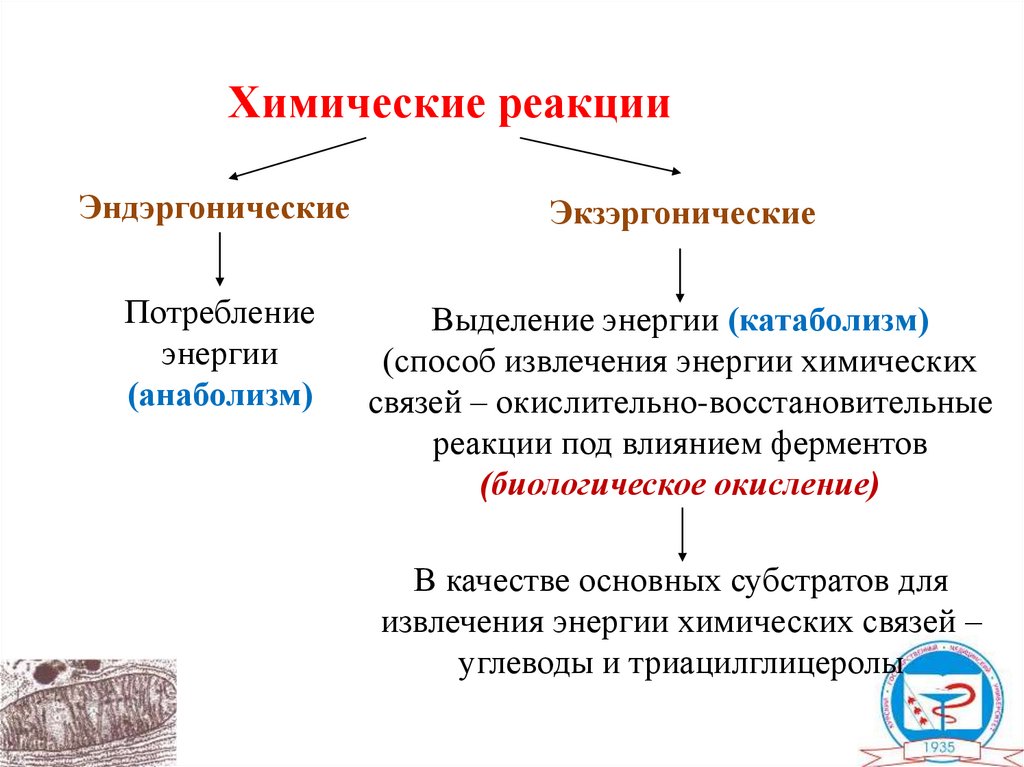
Химические реакцииЭндэргонические
Экзэргонические
Потребление
энергии
(анаболизм)
Выделение энергии (катаболизм)
(способ извлечения энергии химических
связей – окислительно-восстановительные
реакции под влиянием ферментов
(биологическое окисление)
В качестве основных субстратов для
извлечения энергии химических связей –
углеводы и триацилглицеролы
4.
Внутренняя энергияСвободная
(работа производится
при постоянной t и p)
Идет на обеспечение различных видов
биологической полезной работы
(синтез, механическое движение, осмос,
транспорт через мембрану, передача нервных импульсов)
5.
Утилизация энергии в видемакроэргических связей
1.
При разрыве макроэргической связи образуется более 30 кДж/моль свободной
энергии (выполнение биологической работы);
2.
Для синтеза макроэргической связи надо столько же энергии;
3.
Свободную энергию используют ферменты в реакциях химического сопряжения
(экзо- и эндоэргические реакции)
Глю + Фн → глю-6ф + Н2О + 13,8 кДж/моль
(самопроизвольно не протекает)
АТФ + Н2О → АДФ + Фн – 30,5 кДж/моль
Глю + АТФ → (гексокиназа) → глю-6ф + АДФ – 16,7 кДж/моль
-----------------------------------------------------------------------------------------------------------------------------------------------
Все макроэргические соединения в клетке можно разделить на 3 группы:
Высокоэргические – фосфоенолпируват (61,9 кДж/моль ), 1,3-дифосфоглицерол (54,3 кДж/моль );
Низкоэргические – глю-6ф (13,8 кДж/моль ), глю-1ф (20,9 кДж/моль);
АТФ (30,5 кДж/моль).
6.
7.
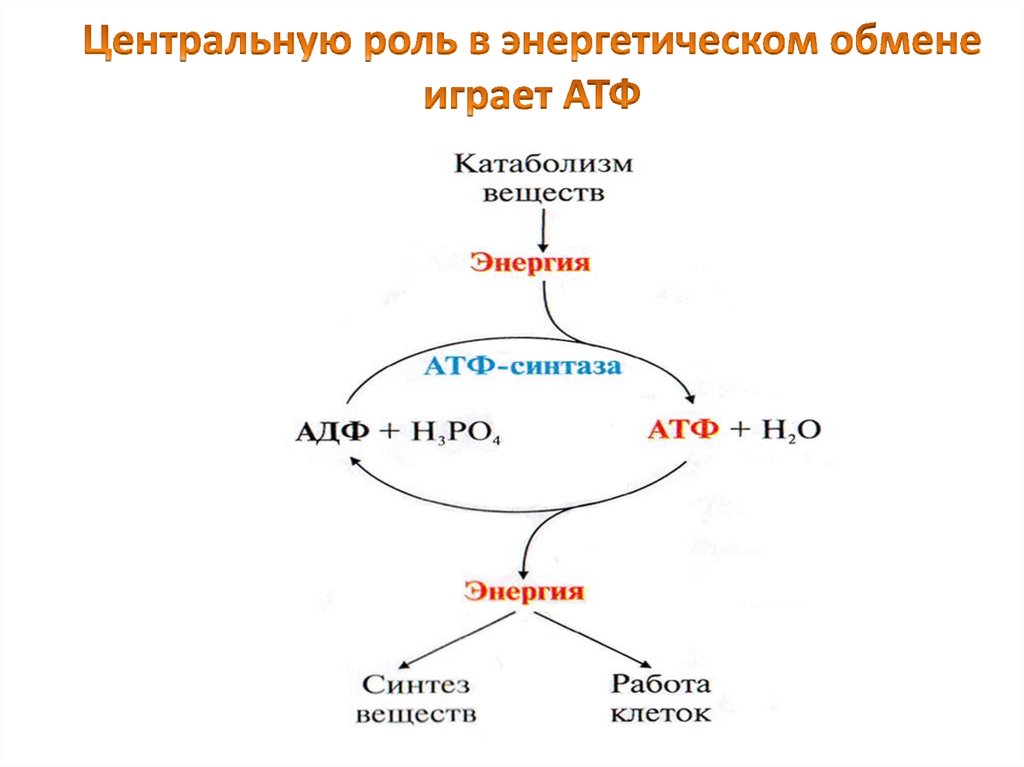
АТФфункционирует
как
общий
промежуточный
продукт,
переносящий
энергию от реакций, сопровождающихся
выделением свободной энергии, с теми, в
которых потребляется энергия.
За сутки в организме образуется и распадается
около 60 кг АТФ. Однако в клетке АТФ не
накапливается, а расходуется в течении 1 минуты,
после образования, что требует ее непрерывно
пополнения (АТФ – АДФ цикл)
8.
Биологическое окисление способ извлечения энергии химических связей(окислительно-восстановительные реакции под влиянием
ферментов)
Сходство между окислением вне организма
и биологическим окислением
1. В результате образуются одинаковые конечные продукты
(СО2 и Н2О);
2. Выделяется одинаковое количество энергии.
9.
Особенности процессабиологического окисления
• Протекает постепенно, через многочисленные
промежуточные стадии;
• Требует участия ферментов;
• Происходит многократная передача протонов Н+
и электронов ē или только ē от донора к акцептору;
• Освобождение Е в живой клетке осуществляется
постепенно;
• Е может аккумулироваться в виде АТФ;
• Основная реакция – дегидрирование.
10.
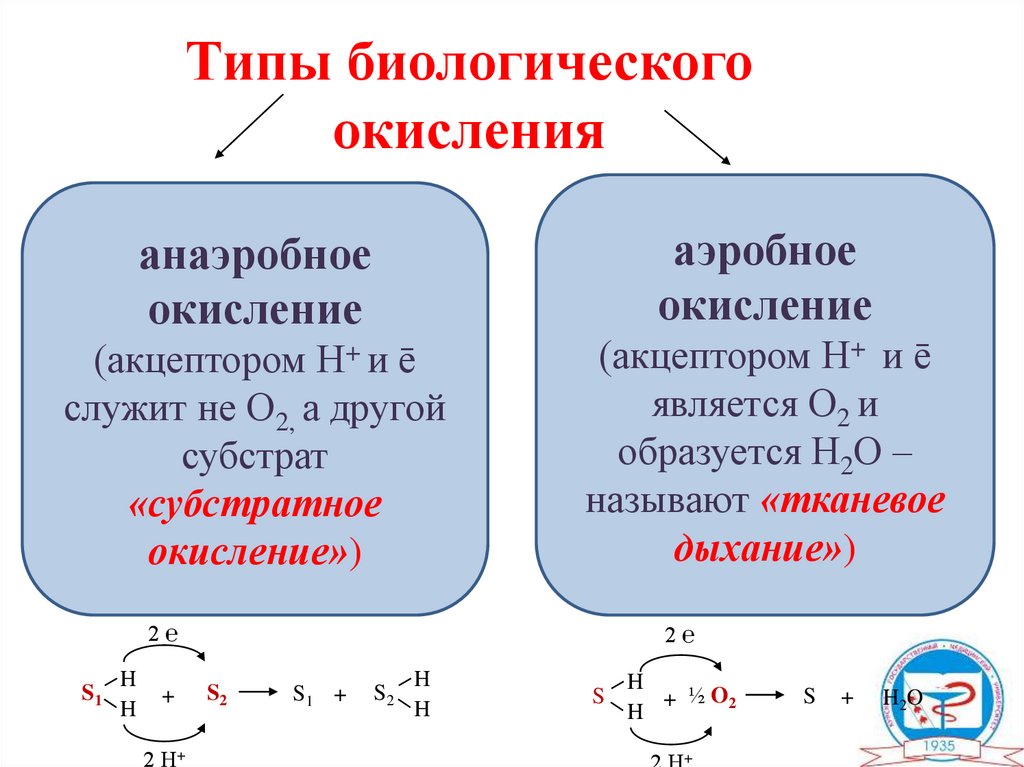
Типы биологическогоокисления
аэробное
окисление
анаэробное
окисление
(акцептором Н+ и ē
служит не О2, а другой
субстрат
«субстратное
окисление»)
(акцептором Н+ и ē
является О2 и
образуется Н2О –
называют «тканевое
дыхание»)
2℮
S1
H
H
+
2 Н+
2℮
S2
S1 +
S2
H
H
S
H
+ ½ O2
H
+
S
+
H2O
11.
12.
Первичные акцепторы водородаПиридин (NAD, NADF) – зависимые
дегидрогеназы
(находятся в матриксе митохондрий или в цитозоле)
- NAD (NADF) непрочно связан с ферментом: в
восстановленной форме он отделяется от
апофермента и служит донором водорода для
другого фермента
- Обратимость многих дегидрогеназных реакций;
- Возможность участия в таких реакциях множества
субстратов;
- Благодаря
этим
свойствам
NAD-зависимые
дегидрогеназы - связывающее звено между
катаболизмом и анаболизмом.
SH2 + E (NAD), (NADF) →
S + E (NADH H+), ( NADFH H+)
13.
Первичные акцепторы водородаФлавопротеиды – небелковая часть FAD
В отличие от NAD FAD соединен прочно с белковой
частью (простетическая группа), поэтому реакции не
являются
легкообратимыми,
что
не
позволяет
флавопротеидам участвовать в реакциях восстановления.
SH2 + E (FAD) → S + E (FADH2)
Большинство FAD – зависимых дегидрогеназ – растворимые
белки, находящиеся в матриксе
митохондрий. Исключение
сукцинатдегидрогеназа (СДГ), находящаяся во внутренней
мембране митохондрий.
14.
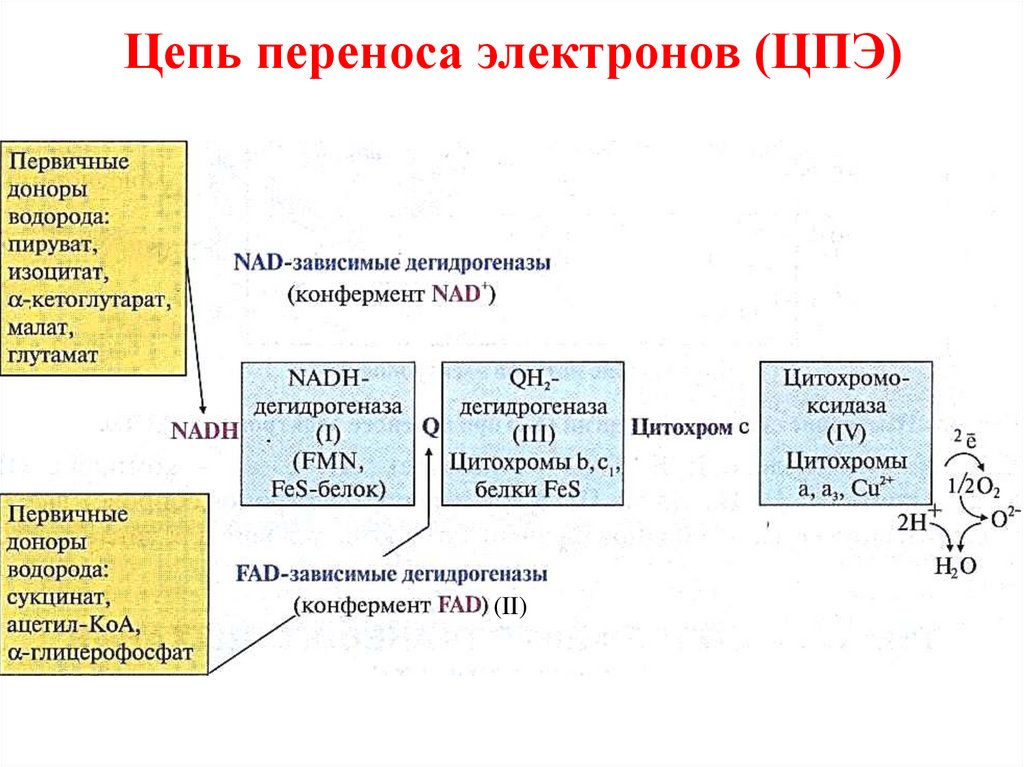
• NADH – дегидрогеназа (комплекс I)• Сукцинатдегидрогеназа – (FAD кофермент) (комплекс II)
• QH2 – дегидрогеназа (комплекс III)
• цитохромоксидаза (комплекс IV)
• низкомолекулярные переносчики
(кофермент Q и цитохром с)
15.
NAD-дегидрогеназа (комплекс I) – несколькополепептидных цепей, роль простетической группы
выполняет FMN. Донором водорода является
NADH∙H+
NADH∙H+ + E (FMN) → NAD+ + E (FMNH2)
Затем электроны переносятся на 5 железо-серных
белков
(FeS),
играющих
роль
второй
простетической группы в NAD-дегидрогеназы.
16.
Сукцинатдегидрогеназа - СДГ (FAD – зависимаядегидрогеназа) (комплекс II)
SH2 + СДГ (FAD) → S + СДГ (FADH2)
СДГ
находится
во
внутренней
мембране
митохондрий, передает электроны, минуя I комплекс
ЦНЭ, сразу на коэнзим Q (низкомолекулярный
переносчик электронов)
17.
Низкомолекулярные переносчикиэлектронов
Убихинон (коэнзим Q10).
Бензохиноновое соединение локализуется во внутренней
мембране митохондрий и собирает Н2 с комплекса I и со
всех FAD-зависимых ферментов, в т.ч. с СДГ (комплекс
II) .
Обладает небольшой ММ, растворим в липидной части
внутренней мембраны митохондрий, это позволяет ему быть
подвижным переносчиком между комплексом I, FADзависимыми ферментами и цитохромами.
Q + E (FMNH2) (FADH2) → QH2 + E (FMN) (FAD)
18.
QH2 (коэнзим Q –дегидрогеназа)(комплекс III)
Состоит из 2-типов цитохромов (b и с1) и железосерного белка (FeS).
Внутри комплекса III электроны передаются от
цитохрома b на FeS, затем на цитохром с1.
В конечном итоге с QH2 электроны передаются
на цитохром с (низкомолекулярный переносчик
электронов).
19.
Низкомолекулярные переносчики электроновЦитохром с
• водорастворимый мембранный белок;
• ММ 12,5 кД, одна полипептидная цепь из 100
аминокислотных остатков, соединенных с гемом
ковалентно;
• передает электроны с комплекса III на комплекс
IV цепи переноса электронов (ЦПЭ).
20.
Цитохромоксидаза (цит а/а3)(комплекс IV)
Это сложный гемопротеид, несколько
белковых частей, 2 химически различных
гема, длинная боковая углеводородная
цепочка, 2 атома Cu2+.
Уникальность в том, что а3 взаимодействует с О2, при этом участвует 2 атома
меди с изменением их валентности (Cu+ →
Cu2+).
21.
Цепь переноса электронов (ЦПЭ)(II)
22.
- Передача ℮ c цитохромоксидазы на О2 –сложный процесс, при этом должно быть
одновременно передано 4 ℮ на О2 с
образованием 2 молей Н2О (4 Н+ потребляется
из водной среды).
- При
неполном
восстановлении
О2
(присоединение 2 ℮) образуется Н2О2, или
супероксидный радикал :О2- (присоединение
1 ℮) – сильнейшие окислители.
Клетки имеют систему защиты:
2О2- + 2Н+
СОД
супероксиддисмутаза
2Н2О2
Каталаза
2Н2О + О2
23.
Какие факторы свидетельствуют офункционировании переносчиков электронов
в дыхательной цепи в определенной
последовательности?
1. В этой последовательности располагаются значения их
нормальных (стандартных) редокс-потенциалов (Е0);
Е0 – это способность каждой окислительно-восстановительной пары
обратимо отдавать электроны.
2. Каждое звено дыхательной цепи специфично в
отношении определенного донора и акцептора;
3. Из митохондриальных мембран удалось выделить
структурно обособленные комплексы переносчиков ℮,
функционально связанных между собой.
24.
Е0- 0,4
- 0,25
+ 0,1
+ 0,3
+ 0,8
S
-0,4
НАД
-0,32
ФМН
-0,12
ФАД Q
-0,03 +0,04
Цит b
+0,07
Цит с
+0,22
Цит
a/a3
+0,55
О2
+0,82
25.
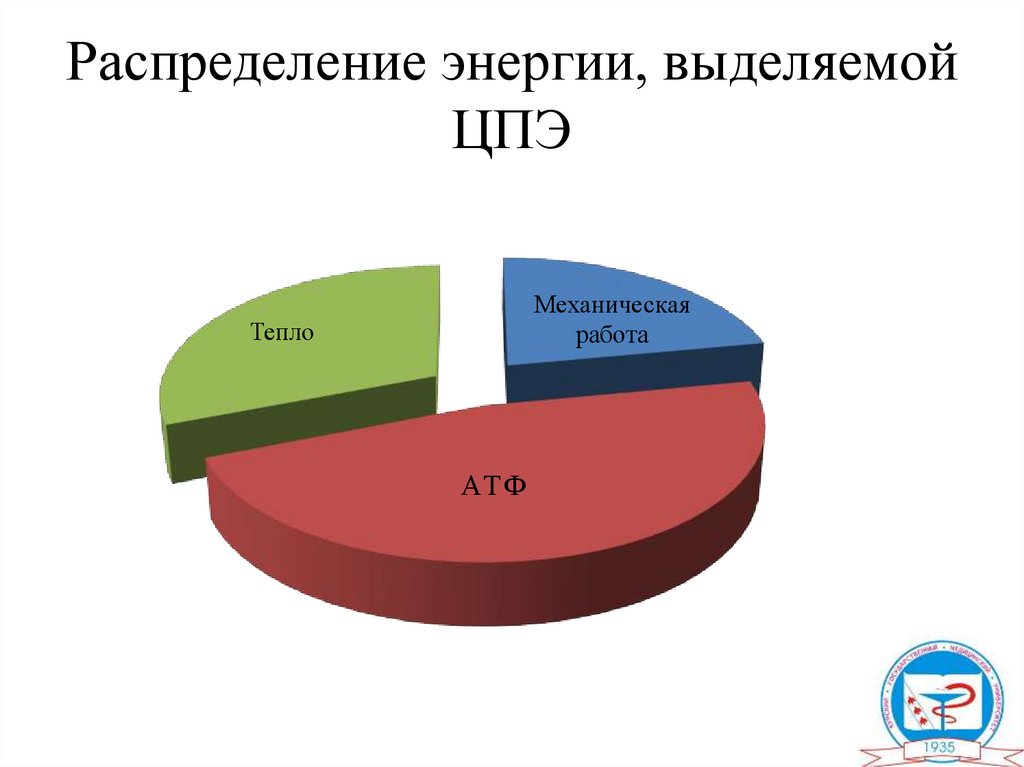
Распределение энергии, выделяемойЦПЭ
Механическая
работа
Тепло
АТ Ф
26.
Синтез АТФ из АДФ и Н3РО4 за счет энергиивыделяющейся при тканевом дыхании,
называется
окислительным фосфорилированием.
27.
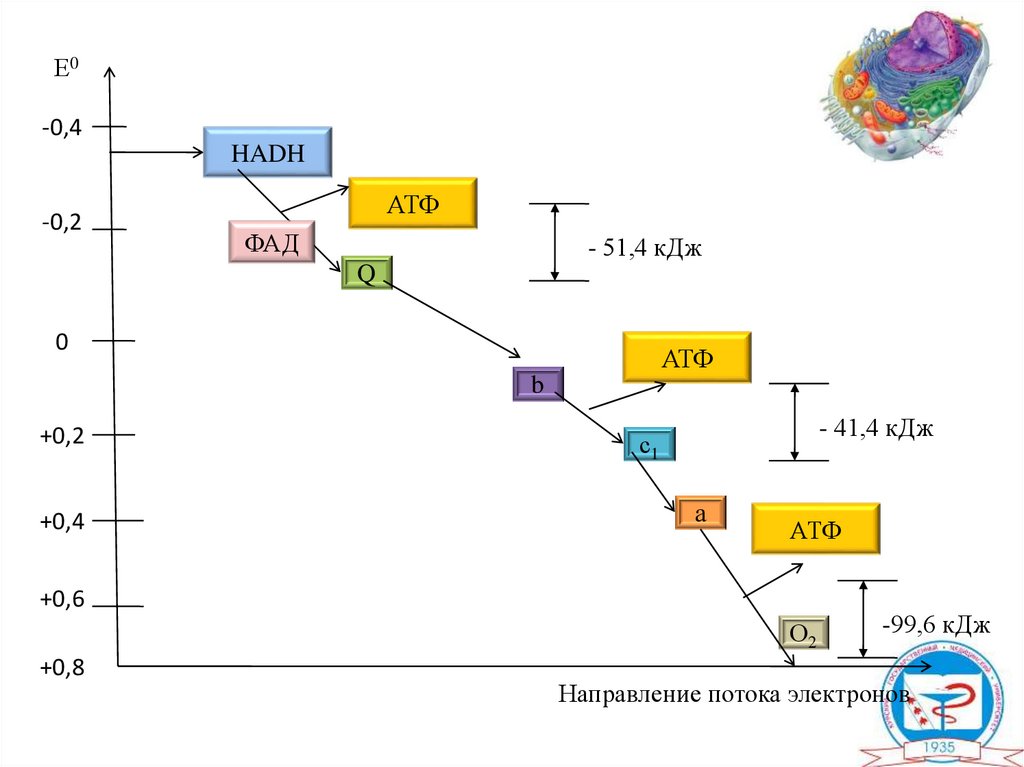
Е0-0,4
HADH
-0,2
АТФ
ФАД
- 51,4 кДж
Q
0
АТФ
b
+0,2
+0,4
- 41,4 кДж
с1
а
АТФ
+0,6
О2
+0,8
-99,6 кДж
Направление потока электронов
28.
НАД-Н+ + ½О23АДФ + 3Н3РО4
ФАДН2 + ½О2
2АДФ + Н3РО4
НАД+ + Н2О
3АТФ + Н2О
ФАД + Н2О
2АТФ + 2Н2О
Р/О = 3
Р/О = 2
Коэффициент окислительного фосфорилирования
29.
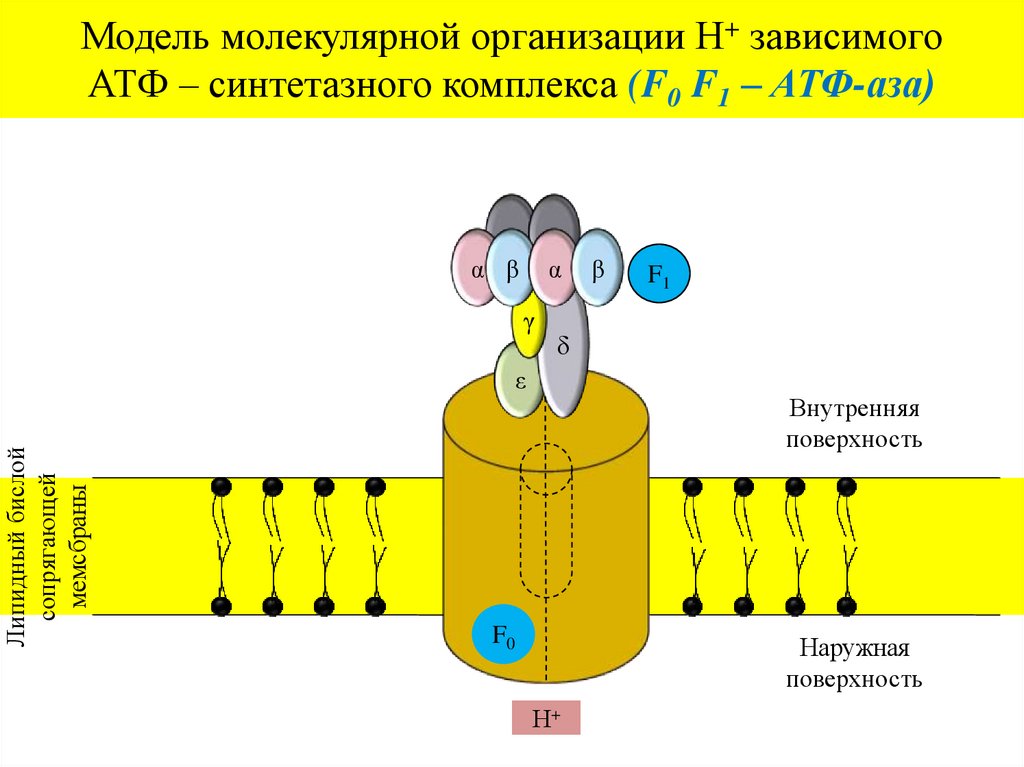
Модель молекулярной организации Н+ зависимогоАТФ – синтетазного комплекса (F0 F1 – АТФ-аза)
α β
α
γ
F1
δ
ε
Липидный бислой
сопрягающей
мемсбраны
β
Внутренняя
поверхность
F0
Наружная
поверхность
Н+
30.
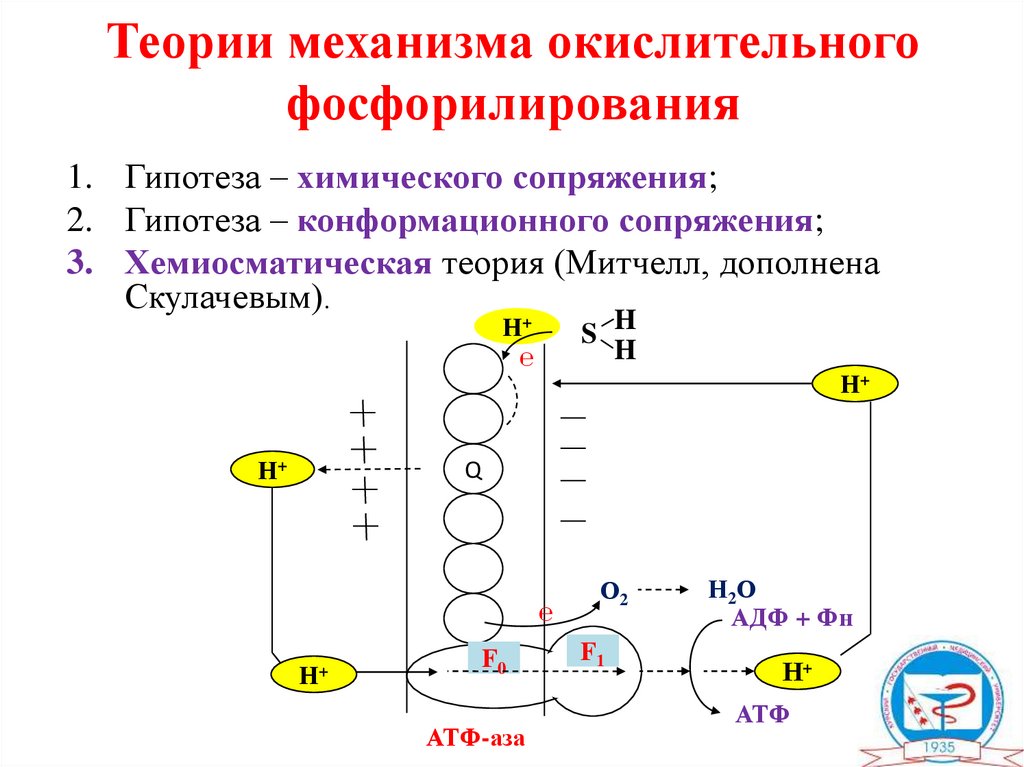
Теории механизма окислительногофосфорилирования
1. Гипотеза – химического сопряжения;
2. Гипотеза – конформационного сопряжения;
3. Хемиосматическая теория (Митчелл, дополнена
Скулачевым).
S H
H
Н+
℮
Н+
Н+
Q
℮
Н+
F0
АТФ-аза
О2
F1
Н2О
АДФ + Фн
Н+
АТФ
31.
Протонныйэлектрохимический
потенциал - ∆µН+
∆µН+ = ∆рН + ∆Ψ = 0,05 + 0,20 = 0,25 В
∆Ψ – электрический потенциал
∆рН – химический потенциал
32.
Трансформация энергии электронов вмакроэргические связи АТФ
Митохондрии
Перенос электронов с окисляемых субстратов
на кислород (дыхание)
Перенос протонов их матрикса митохондрий в
межмембранное пространство и образование
трансмембранного электрохимического
потенциала
Цитоплазма
Синтез АТР за счет потока протонов из
межмембранного пространства в матрикс
Н3РО4
Н2О
ADP
ATP
ADP
ATP
Н3РО4
Н2О
33.
Доказательства1. Не обнаружены «высокоэнергетические»
посредники;
2. Протекает только при целостной внутренней
мембране митохондрий, которая
непроницаема для ионов Н+, OH-, K+, Cl-;
3. Предотвращается с помощью разобщающих
агентов (изменение протонного потенциала).
- протонофоров;
- ионов - липофильных соединений
связывающих катионы (К+, Na+ и др.)
34.
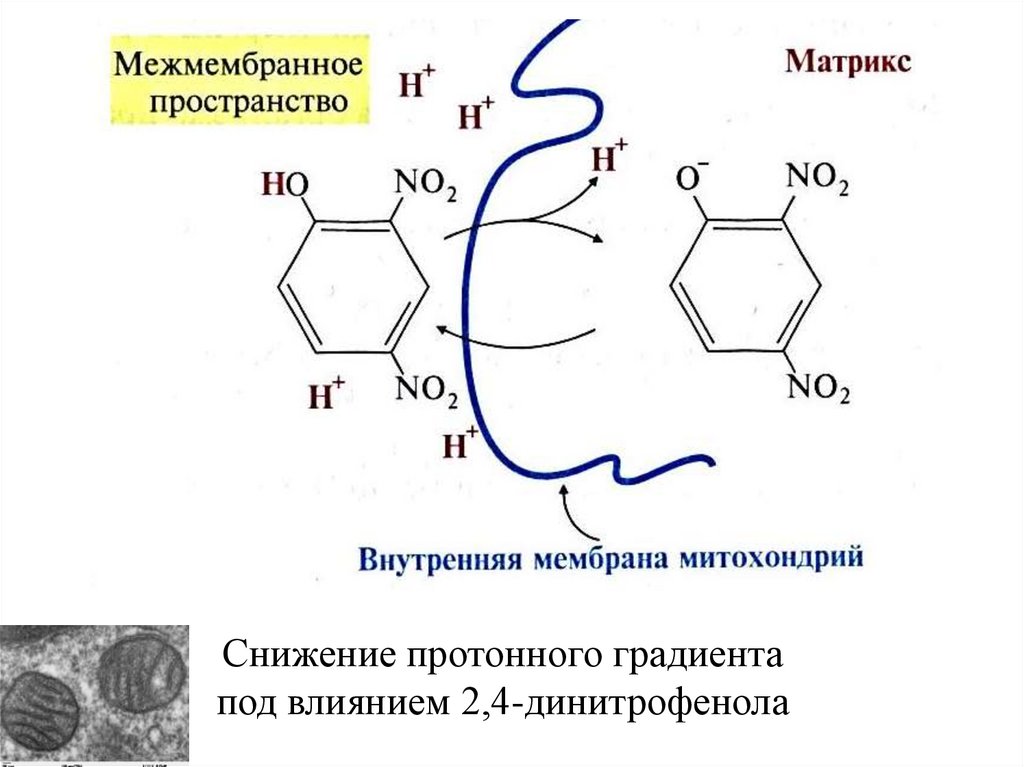
Снижение протонного градиентапод влиянием 2,4-динитрофенола
35.
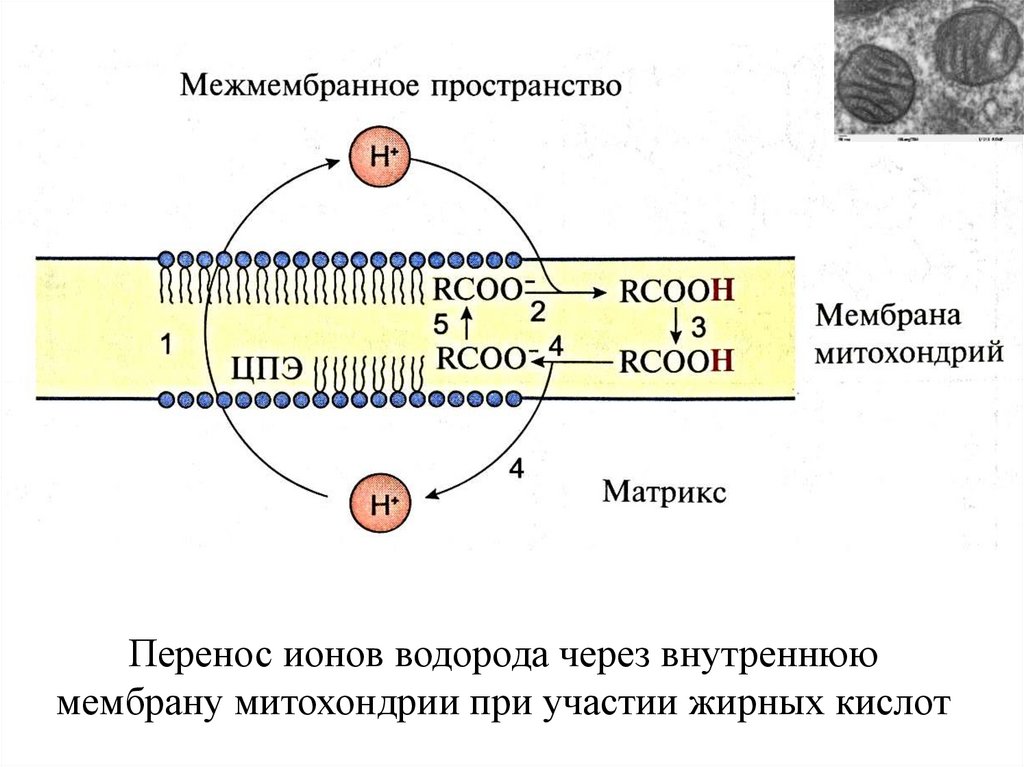
Перенос ионов водорода через внутреннююмембрану митохондрии при участии жирных кислот
36.
Причины нарушения окислительногофосфорилирования
При этом тканевое дыхание усиливается, но идет рассеивание
энергии в виде тепа – свободное окисление.
• Набухание митохондрий;
• Эндогенные разобщители (гормоны щитовидной железы,
жирные кислоты с длинной углеводородной цепью, билирубин
–действуют при высоких концентрациях), у новорожденных и
зимнеспящих животных – белок бурого жира термогенин;
• Экзогенные разобщители: 2-4-динитрофенол, в больших
дозах:
антикоагулянты
производные
дикумарина,
стрептомицин, грамицидин, валиномицин;
• Ингибиторы АТФ-синтазы (олигомицин, рутамицин).
37.
Причины нарушения биологическогоокисления
1. Недостаток субстрата (голодание, пищеварение, межуточное нарушение обменов
белков, углеводов, липидов);
2. Недостаток О2 (при заболеваниях: сердечнососудистых, крови, легких);
3. Недостаточная активность ферментов
дыха-тельной цепи (генетические дефекты
апофер-ментов,
синтеза
кофакторов,
недостаток железа, гиповитаминоз);
4. Ингибиторы дыхания.
38.
Ингибиторы ферментов ЦПЭ подавляютактивность ферментных комплексов I, III, и IV.
Скорость восстановления коферментов NAD+ и
FAD+ при этом снижается, что уменьшает скорость
окислительных процессов, потребления кислорода и
коэффициент Р/О:
• ингибиторы NADH-дегидрогеназы – лекарственные препараты со снотворным действием –
барбитураты (веронал, гексенал, нембутал, амитал); ротенон водорослей;
• ингибиторы QH2-дегидрогеназы – антимицин
А (антибиотик);
• ингибиторы цитохромоксидазы – угарный газ
(СО), цианиды (СN-), сероводород (Н2S).
39.
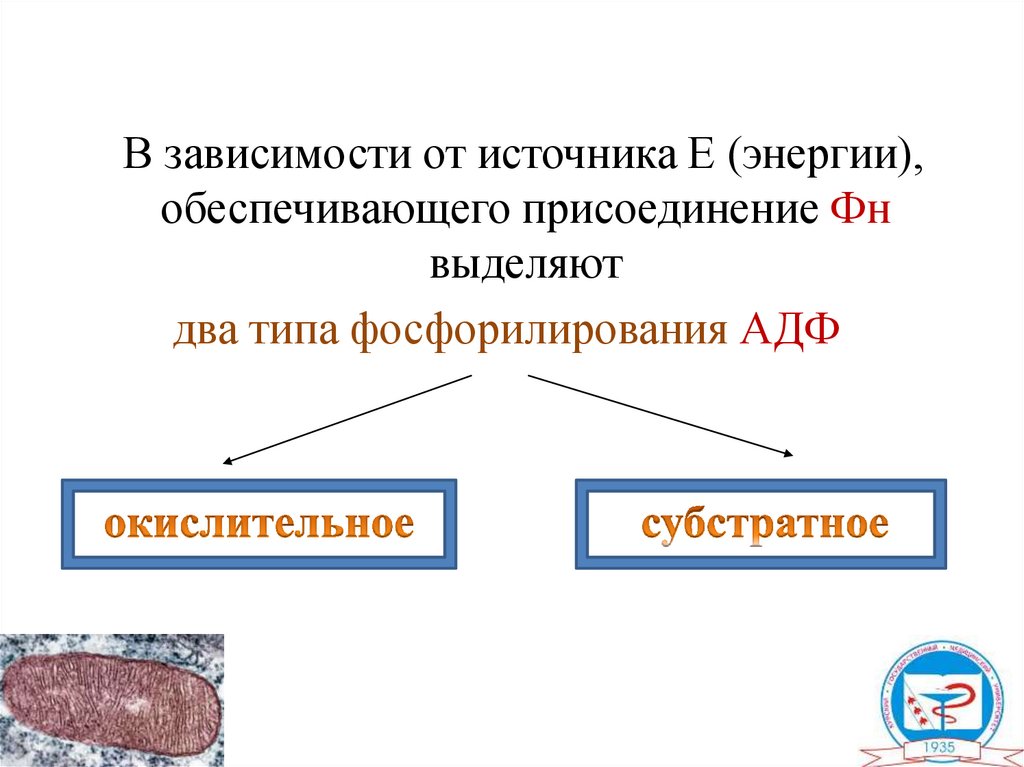
В зависимости от источника Е (энергии),обеспечивающего присоединение Фн
выделяют
два типа фосфорилирования АДФ
40.
Субстратное фосфорилированиеАДФ
S-O~PO3H2
киназа
АДФ
S-OH
АТФ
происходит за счет энергии
макроэргических связей некоторых
соединений (1,3-бисфосфоглицерат, ФЕП,
сукцинил-КоА, креатинфосфат)
41.
Особенности субстратногофосфорилирования
процесс может идти в матриксе митохондрий и в
цитоплазме;
не зависит от присутствия О2;
используется
реже,
чем
окислительное
фосфорилирование.






























 Биология
Биология








