Похожие презентации:
Лекция 5. Красные пигменты
1. Лекция 5
Красные пигменты2. Красная охра
природный пигмент, цветпридают соединения Fe (III).
Красные железоокисные
пигменты получают также
прокаливанием желтых охр при
высоких температурах.
Пигмент термически устойчив
при нагревании до 1000°С и не
меняет окраску.
Плохо растворяется в
кислотах. Для растворения
частицу пигмента нагревают в
конц. HCl.
Раствор анализируют на Fe3+
(см. берлинскую лазурь).
2
3. Сурик свинцовый
смешанный оксид Рb (II) иРb (IV) 2РbО·РbО2 хорошо
растворяется в кислотах при
нагревании.
При взаимодействии с HCl
образуется белый
творожистый осадок РbСl2.
При T 600° сурик
переходит в желтый PbO.
Микрохимическое
определение сурика
заключается в
обнаружении в растворе
иона Рb2+ (см. свинцовые
белила).
3
4. Киноварь
природный минерал илиискусственно
получаемый сульфид
ртути HgS
стойка по отношению к
кислотам и щелочам и
растворяется только в
царской водке (смесь
одного объема конц.
HNO3 с тремя объемами
конц. НСl).
4
5. Красные пигменты
Свинцовый сурикКиноварь
5
6. Красные пигменты
Реальгар (природныйминерал состава As4S4)
с трудом растворяется в
концентрированных
кислотах и щелочах.
Сурьмяная красная
(искусственный пигмент
состава Sb2S3) плохо
растворима в кислотах.
6
7. Красные пигменты
Киноварь, реальгар, и сурьмяная красная, являясьсульфидами, под действием кислот выделяют H2S,
обнаруживаемый по запаху и с помощью
микрохимических реакций (см. ультрамарин).
При прокаливании реальгар и киноварь возгоняются, а
сурьмяная красная разлагается с образованием
желтого Sb2O5. Между собой эти пигменты
различаются катионами:
Для идентификации киновари необходимо установить
присутствие иона Hg2+,
реальгара – иона As3+,
сурьмяной красной – иона Sb3+.
7
8. Красные пигменты
Для перевода в раствор:киноварь растворяют в царской водке при
нагревании,
сурьмяную красную – в концентрированной HCl
при нагревании,
реальгар – в концентрированной HNO3.
8
9. Красные пигменты: обнаружение Hg2+
К капле раствора, содержащегоHg2+, прибавляют каплю смеси
конц. растворов NH4CNS и
Co(NO3)2 – образуются темносиние
кристаллы Co[Hg(CNS)4] в виде
игл, призм, сростков.
При работе с малыми
количествами вещества, каплю
раствора выпаривают досуха, а
затем смачивают реагентом.
Предел обнаружения 0,04 мкг Hg
(II), предельное разбавление
1:25000.
9
10. Красные пигменты
Обнаружение As(V):к капле раствора, содержащего As(V), добавляют
каплю HNO3 и крупинку молибдата аммония –
образуется желтый кристаллический осадок
(NH4)3AsO4·12MoO3 в виде мелких кубов и октаэдров.
Предел обнаружения 0,2 мкг As (V), предельное
разбавление 1:15000.
Обнаружение Sb (III):
В каплю исследуемого раствора вводят кристаллик KI
и через некоторое время кристаллик CsCl –
образуются оранжево-красные кристаллы Cs2SbI5.
Предел обнаружения 0,01 мкг Sb (III), предельное
разбавление 1:100000.
10
11. Красный кадмий
твердый раствор сульфида иселенида кадмия CdS·n(CdSe)
не растворяется в разб.
минеральных кислотах, а
конц. растворяют пигмент с
выделением H2S и H2Se. Чем
больше в пигменте CdSe, тем
более красный оттенок он
приобретает
Сухую частицу испытывают
на S2- (см. ультрамарин).
В растворе проводят
обнаружение ионов Cd2+ и
Se2-.
11
12. Красные пигменты
Обнаружение Cd2+:в каплю нейтрального раствора помещают крупинку
щавелевой кислоты или оксалата аммония – образуется
бесцветный кристаллический осадок оксалата кадмия
CdC2O4·3H2O в виде призм и ромбов.
Предел обнаружения 0,35 мкг Cd2+, предельное
разбавление 1:3000.
Обнаружение Se2-:
На фильтровальную бумагу помещают немного порошка
тиомочевины, затем каплю исследуемого раствора –
образуется оранжево-красный элементарный Se.
Реакции мешают NO3-.
Предел обнаружения 0,05 мкг Se2-, предельное
разбавление 1:1000000.
12
13. Элементарный Se
Медленнаякристаллизация
Аморфная
структура
13
14. Красный хром
основной хромат свинцаРbСrО4·РbО меняет цвет от
светлооранжевого до красного в
зависимости от дисперсности
частиц: чем больше размер
частиц, тем темнее цвет.
Термостоек до 600°.
В неорг. кислотах и конц.
щелочах растворяется
полностью, к действию
разбавленных щелочей стоек.
После растворения в кислоте
проводят обнаружение ионов Рb2+
(см. свинцовые белила) и Сг2О72-.
14
15. Обнаружение Сr2О72-
Обнаружение Сr2О72частицу пигмента
растворяют в 30%-ной
CH3COOH, в полученный
раствор вводят кристалл
AgNO3 – образуются краснооранжевые кристаллы
дихромата серебра
Ag2Cr2O7.
Реакции мешают большие
количества Cl-. Предел
обнаружения 0,025 мкг
Сг2О72-, предельное
разбавление 1:80000.
Ag2CrO4
Ag2Cr2O7
15
16. Зеленые пигменты
17. Глауконит
натуральный пигментK+(Fe3+, Fe2+, Al, Mg)2х
3[Si3(Si,Al)O10]·[OH]2·H2O
при прокаливании меняет
окраску на красно-бурую,
растворяется в конц. HCl
при нагревании.
Раствор анализируют на
ионы Fe3+ (см. берлинскую
лазурь).
17
18. Ярь-медянка
ацетаты меди различногохимического состава и оттенков:
зеленого, зелено-синего, голубого.
Хорошо растворяется в разб.
минеральных кислотах.
Щелочи образуют с ярь-медянкой
Cu(OH)2 синего цвета.
Масла, смолы, протеины –
зеленые соли жирных кислот,
резинаты и протеинаты.
По составу многочисленные типы
ярь-медянки можно разделить на
две группы: основную и
нейтральную (среднюю).
Нейтральная ярь-медянка
Сu(СН3СОО)2·Н2O.
18
19. Малахит CuCO3·Cu(OH)2
под действием минеральныхкислот вспенивается, выделяя
CO2, что отличает его от всех
медных зеленых пигментов.
использовался целый ряд
различных минералов меди:
атакамит и паратакамит
CuCl2·Cu(OH)2
псевдомалахит Cu5(PO4)2(OH)4
хальконантронит
Na2Cu(CO3)2·Н2O
калюметит Сu(ОН,Сl)2·Н2О
антлерит CuSO4·Cu(OH)2
боталлокит
CuCl2·3Cu(OH)2·3H2O
герхардит Cu2(OH)3NO3
познякит Cu4SO4(OH)6·H2O
19
20. Медьсодержащие зеленые пигменты
Определение пигментов, содержащихмедь, предполагает:
проведение микрохимических реакций
на ион Сu2+ (см. Синие пигменты),
на ионы Cl-, РО43-, SO42-.
Обнаружение Сl-: к капле азотнокислого
раствора анализируемого пигмента
добавляют кристалл AgNO3 – выпадает
белый осадок AgCl.
20
21. Зеленая Шееле
Оливенит – основнойметаарсенит меди
Сu(AsO2)3·nCu(OH)2·m
H2O, где n = 1, 2, 3, а
содержание воды
изменяется в
определенных
пределах)
легко растворяется в
кислотах и щелочах.
21
22. Швейнфуртская зелень
арсенит-ацетат меди Сu(СН3СОО)2·ЗСu(AsO2)2легко растворима в кислотах и щелочах.
22
23. Медьсодержащие зеленые пигменты
Все медные зеленые пигменты при нагревании довысоких температур разлагаются c образованием
CuO черного цвета;
растворы их дают положительную реакцию на Сu2+.
Для идентификации зеленой Шееле необходимо
определить As (III) (см. реальгар);
ярь-медянки – CH3COO-;
швейнфуртской зеленой – и As (III), и СН3СОО-.
23
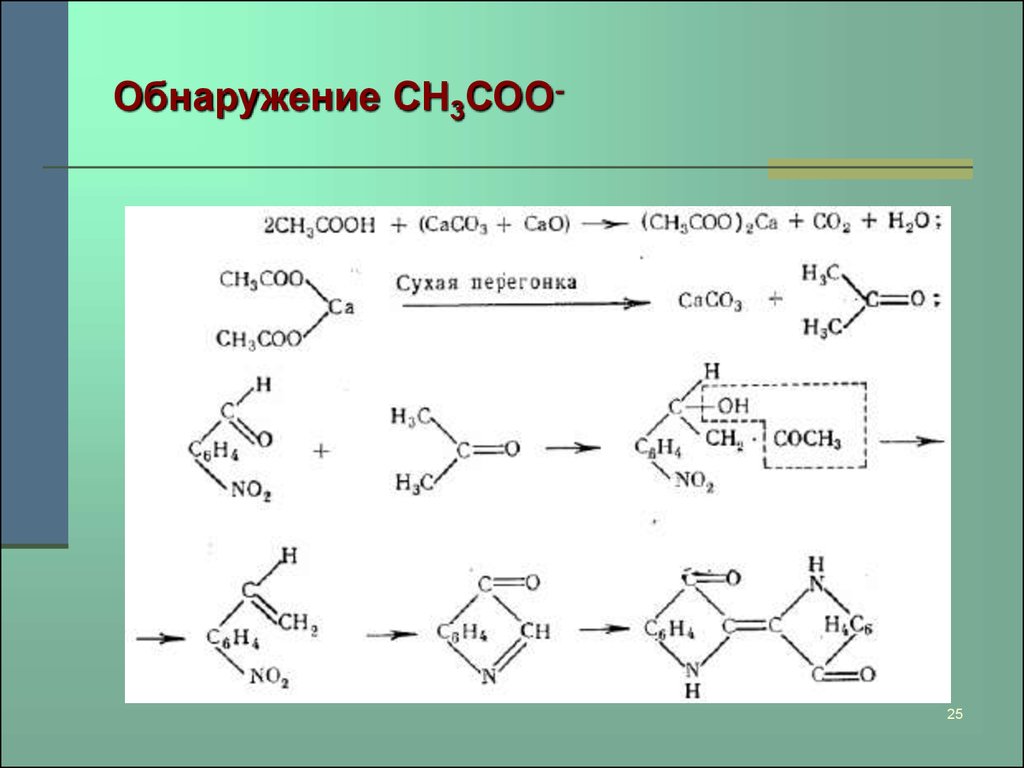
24. Зеленые пигменты
Обнаружение СН3СОО-:частицу пигмента смешивают со смесью равных
частей CaO и CaCO3, помещают в стеклянную трубку,
запаянную с одного конца;
открытый конец трубки накрывают фильтровальной
бумагой, пропитанной свежеприготовленным
щелочным раствором ортонитробензальдегида, и
постепенно нагревают трубку.
В присутствии CH3COO- бумага становится синей или
сине-зеленой. При малых количествах рекомендуется
после перегонки смочить бумагу каплей 2 моль/л
соляной кислоты.
24
25. Обнаружение СН3СОО-
2526. Зеленый кобальт
искусственный пигмент –твердый раствор оксида
кобальта Со (II) в оксиде
цинка СоO·ZnO
хорошо растворяется в
горячей H2SO4 и HCl.
Цвет пигмента зависит от
соотношения СоО и ZnO:
чем больше СоО, тем
темнее.
Определение пигмента
заключается в
обнаружении ионов Со2+
(см. смальту) и Zn2+ (см.
цинковые белила).
26
27. Хромовая зелень
оксид хрома Сг2О3 трудно растворимво всех кислотах и щелочах.
Для растворения пробу сначала
сплавляют с безводными К2СО3,
Na2CO3 и Na2O2 – образуется смесь
хроматов Na2CrO4 и К2СгО4, которую
обрабатывают раствором 2 моль/л
CH3COOH.
Полученный раствор исследуют на
присутствие Сг2О72- (см. красный
хром).
Изумрудная зелень (Сг2О3·2Н2О).
Микрохимическое определение
аналогично хромовой зеленой.
27

























 Химия
Химия








