Похожие презентации:
Ферменты
1.
Понятие о ферментахФерменты (энзимы, E) – биологические
реакции;
катализаторы, ускоряющие химические
Вещество, на которое действует фермент, называется субстратом (S);
Большинство ферментов – вещества белковой природы, но их активные центры часто
содержат неаминокислотные группы – ионы металлов, производные витаминов и др.;
В 80-х годах ХХ века обнаружено, что некоторые молекулы РНК обладают
каталитической активностью (рибозимы). Рибозимы были примитивными ферментами,
которые эволюционно были заменены более эффективными белковыми ферментами;
На сегодняшний день описано свыше 3000 различных ферментов, а по оценкам их
существует около 25000;
Ферменты осуществляют
метаболизма.
строгую
координированную
регуляцию
клеточного
1
2.
Понятие о ферментахБелковая природа ферментов идеально подходит для выполнения
функции биологических катализаторов, поскольку:
1. функциональные группы а.о. способны формировать специфические
участки связывания субстрата (и регуляторных молекул) и
каталитические центры;
2. достаточная гибкость белка способствует образованию и стабилизации
переходных состояний, индуцирует конформационные изменения,
влияющие на эффективность ферментативного катализа.
Белковая природа ферментов делает их крайне чувствительными к
влиянию рН, ионной силы, температуры, что обуславливает строго
определенные условия, необходимые для проявления высокой
каталитической активности ферментов.
2
3.
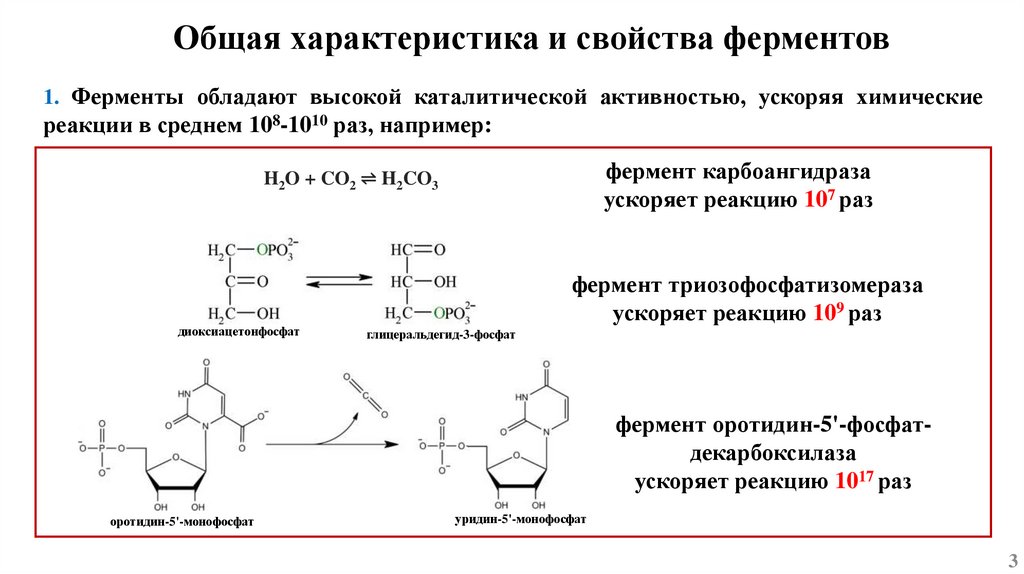
Общая характеристика и свойства ферментов1. Ферменты обладают высокой каталитической активностью, ускоряя химические
реакции в среднем 108-1010 раз, например:
фермент карбоангидраза
ускоряет реакцию 107 раз
H2O + CO2 ⇌ H2CO3
диоксиацетонфосфат
фермент триозофосфатизомераза
ускоряет реакцию 109 раз
глицеральдегид-3-фосфат
фермент оротидин-5'-фосфатдекарбоксилаза
ускоряет реакцию 1017 раз
оротидин-5'-монофосфат
уридин-5'-монофосфат
3
4.
Общая характеристика и свойства ферментов (продолжение)2. Ферменты специфичны:
Абсолютная субстратная специфичность – фермент действует только на единственный
субстрат (аргиназа, уреаза):
H2 O
+
Аргиназа
мочевина
L-аргинин
L-орнитин
H2 O
+
Уреаза
H2 O
+
4
5.
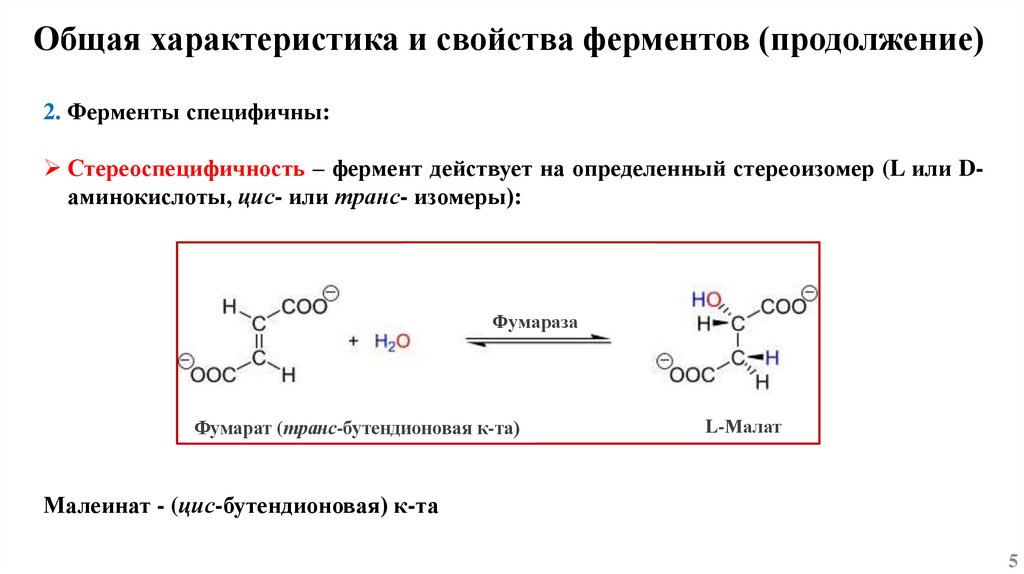
Общая характеристика и свойства ферментов (продолжение)2. Ферменты специфичны:
Стереоспецифичность – фермент действует на определенный стереоизомер (L или Dаминокислоты, цис- или транс- изомеры):
Фумараза
Фумарат (транс-бутендионовая к-та)
L-Малат
Малеинат - (цис-бутендионовая) к-та
5
6.
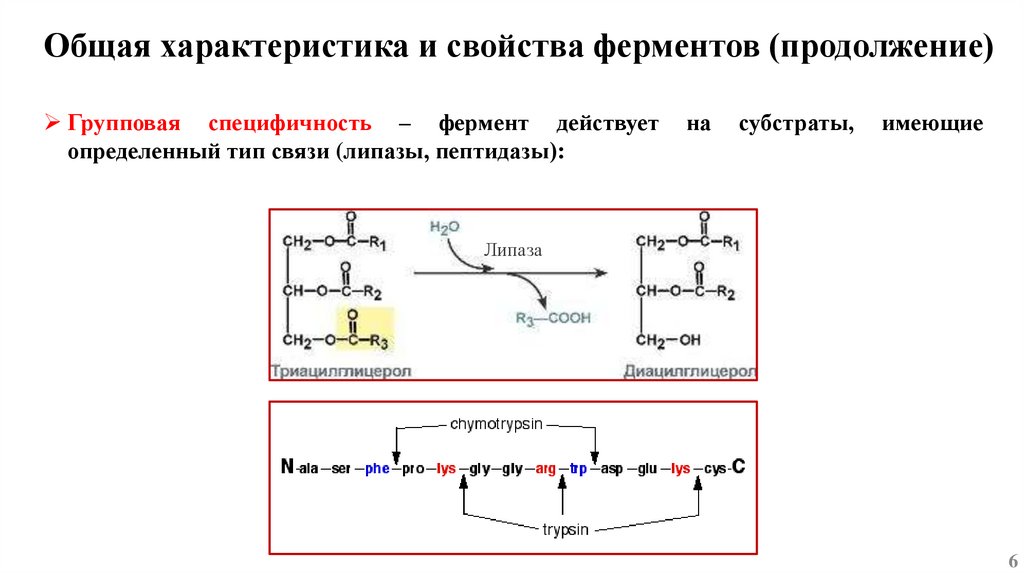
Общая характеристика и свойства ферментов (продолжение)Групповая специфичность – фермент действует
определенный тип связи (липазы, пептидазы):
на
субстраты,
имеющие
Липаза
6
7.
Общая характеристика и свойства ферментов (продолжение)3. Активность ферментов зависит от рН и температуры;
4. Как и химические катализаторы, ферменты не изменяются в процессе катализа (кроме
фермент-самоубийц);
5. Активность ферментов регулируется:
Уровнем экспрессии (количеством фермента);
Переходом из неактивного состояния в активное путем ограниченного протеолиза
(переход профермента в фермент);
Аллостерически;
Путем
обратимой
ковалентной
модификации
(фосфорилирование/дефосфорилирование);
Белок-белковыми взаимодействиями (глюкокиназа).
7
8.
Номенклатура ферментовНазвание ферментов может быть тривиальным (ацетилхолинэстераза, α-амилаза,
фумараза) и в соответствии с Международной классификацией: (ацетилхолинацетилгидролаза, 1,4-α- глюкан глюканогидролаза, L-малат – гидро-лиаза);
В соответствии с рекомендациями Комиссией по ферментам при Международном союзе
по Биохимии и Молекулярной биологии (Internatiol Union of Biochemistry and Molecular
Biology) ферменты подразделяются на 7 классов на основании типа катализируемой ими
химической реакции;
Каждый фермент имеет свой код по классификации (КФ или ЕС – Enzyme Commission
number):
КФ 1.1.1.1
Класс
Подкласс
Подподкласс
Номер фермента
8
9.
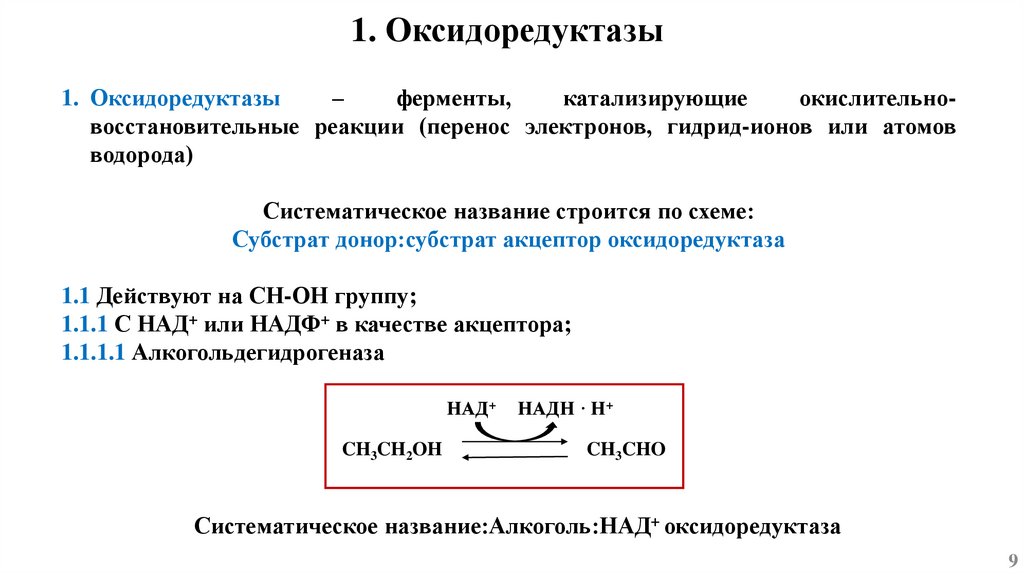
1. Оксидоредуктазы1. Оксидоредуктазы
–
ферменты,
катализирующие
окислительновосстановительные реакции (перенос электронов, гидрид-ионов или атомов
водорода)
Систематическое название строится по схеме:
Субстрат донор:субстрат акцептор оксидоредуктаза
1.1 Действуют на СН-ОН группу;
1.1.1 С НАД+ или НАДФ+ в качестве акцептора;
1.1.1.1 Алкогольдегидрогеназа
НАД+
CH3CH2OH
НАДН · Н+
CH3CHO
Систематическое название:Алкоголь:НАД+ оксидоредуктаза
9
10.
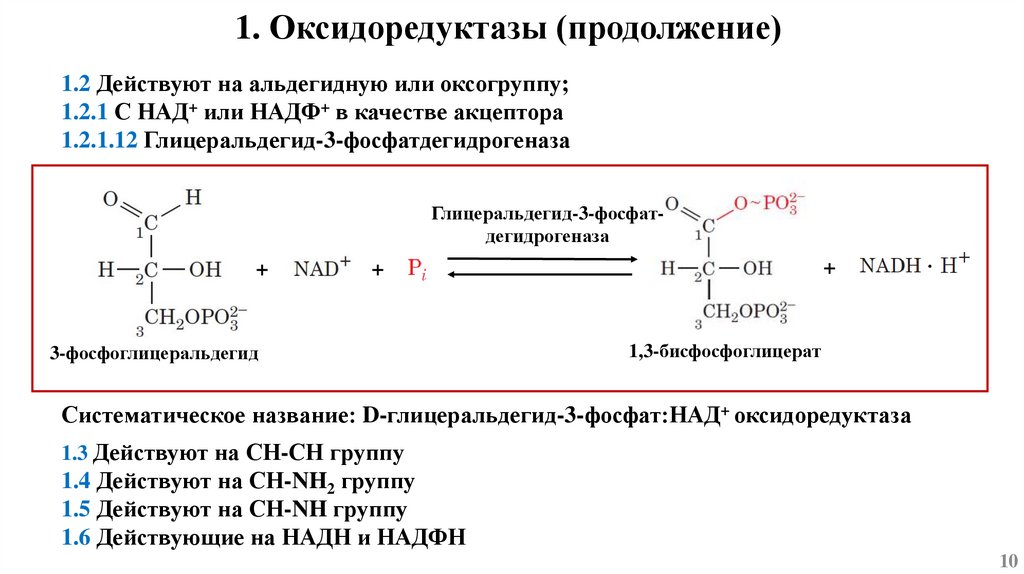
1. Оксидоредуктазы (продолжение)1.2 Действуют на альдегидную или оксогруппу;
1.2.1 С НАД+ или НАДФ+ в качестве акцептора
1.2.1.12 Глицеральдегид-3-фосфатдегидрогеназа
Глицеральдегид-3-фосфатдегидрогеназа
+
+
+
3-фосфоглицеральдегид
·
1,3-бисфосфоглицерат
Систематическое название: D-глицеральдегид-3-фосфат:НАД+ оксидоредуктаза
1.3 Действуют на СН-СН группу
1.4 Действуют на СН-NH2 группу
1.5 Действуют на СН-NH группу
1.6 Действующие на НАДН и НАДФН
10
11.
2. Трансферазы2. Трансферазы – ферменты, катализирующие перенос функциональных групп и
молекулярных остатков от одной молекулы к другой;
Систематическое название строится по схеме:
Субстрат донор:субстрат акцептор переносимая группа трансфераза
2.1 Переносящие одноуглеродные фрагменты
2.1.1 Метилтрансферазы
2.1.2 Трансферазы гидроксиметильных, формильных и родственных групп
2.1.2.1 Серин-гидроксиметилтрансфераза
N5,N10-Метилен-H4-фолат
H2O
H4-фолат
Систематическое название: 5,10-метилентетрагидрофолат:глицин гидроксиметилтрансфераза
11
12.
2. Трансферазы (продолжение)2.2 Переносящие альдегидные и кетонные группы
2.3 Ацилтрансферазы
2.4 Гликозилтрансферазы
2.5 Переносящие алкильные или арильные группы, кроме метильной
2.6 Переносящие азотсодержащие группы
2.6.1 Трансаминазы
2.6.1.2 Аланинаминотрасфераза
Систематическое название: L-аланин:2-оксоглутарат аминотрансфераза
12
13.
3. Гидролазы3. Гидролазы – ферменты, катализирующие гидролиз ковалентной связи;
Систематическое название строится по схеме:
Субстрат-отщепляемая группа гидролаза
3.1 Действующие на сложноэфирную связь (эстеразы)
3.1.1 Гидролазы эфиров карбоновых кислот
3.1.1.3 Липаза
Систематическое название: Триацилглицерол-ацилгидролаза
13
14.
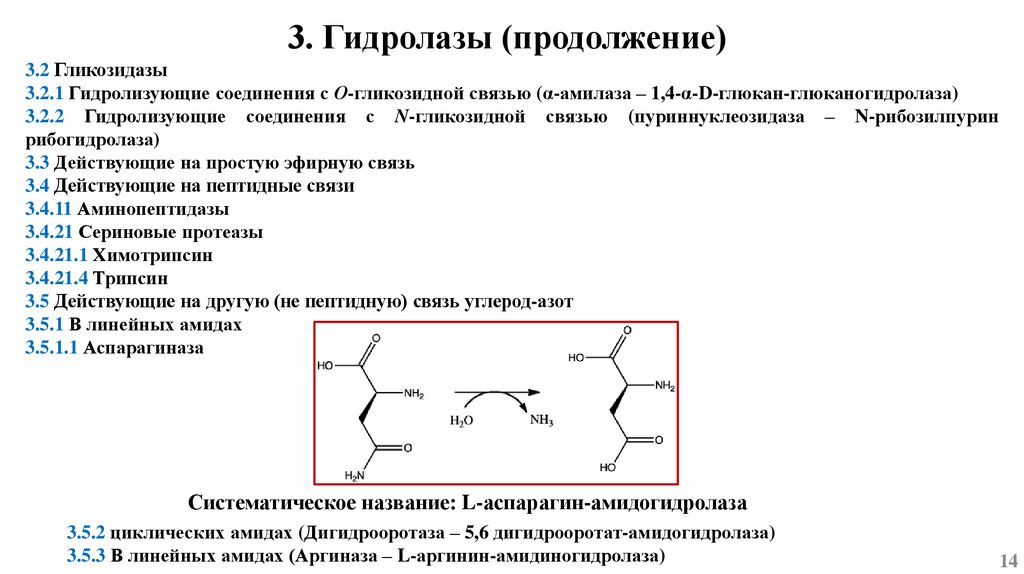
3. Гидролазы (продолжение)3.2 Гликозидазы
3.2.1 Гидролизующие соединения с О-гликозидной связью (α-амилаза – 1,4-α-D-глюкан-глюканогидролаза)
3.2.2 Гидролизующие соединения с N-гликозидной связью (пуриннуклеозидаза – N-рибозилпурин
рибогидролаза)
3.3 Действующие на простую эфирную связь
3.4 Действующие на пептидные связи
3.4.11 Аминопептидазы
3.4.21 Сериновые протеазы
3.4.21.1 Химотрипсин
3.4.21.4 Трипсин
3.5 Действующие на другую (не пептидную) связь углерод-азот
3.5.1 В линейных амидах
3.5.1.1 Аспарагиназа
Систематическое название: L-аспарагин-амидогидролаза
3.5.2 циклических амидах (Дигидрооротаза – 5,6 дигидрооротат-амидогидролаза)
3.5.3 В линейных амидах (Аргиназа – L-аргинин-амидиногидролаза)
14
15.
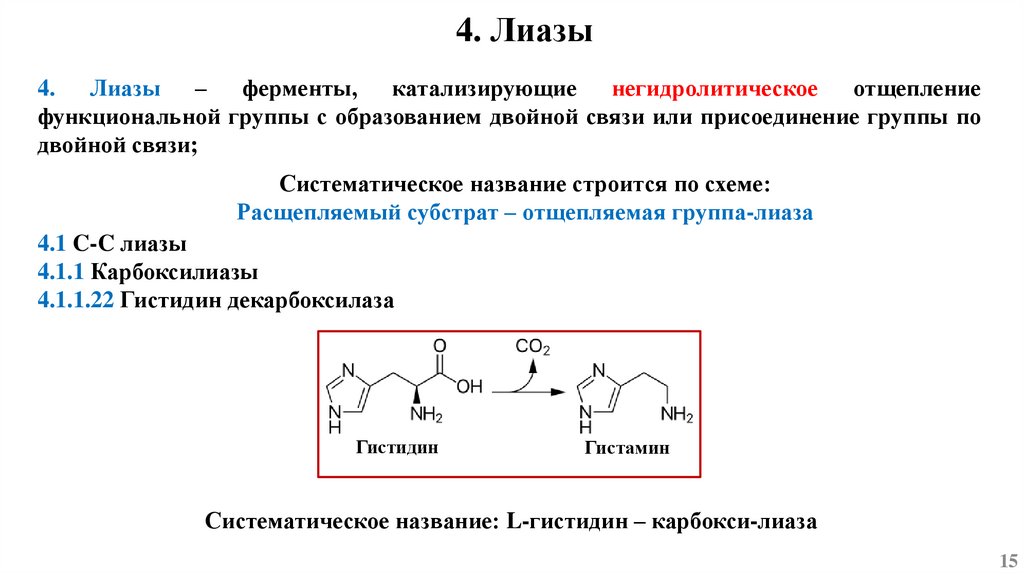
4. Лиазы4. Лиазы – ферменты, катализирующие негидролитическое отщепление
функциональной группы с образованием двойной связи или присоединение группы по
двойной связи;
Систематическое название строится по схеме:
Расщепляемый субстрат – отщепляемая группа-лиаза
4.1 C-C лиазы
4.1.1 Карбоксилиазы
4.1.1.22 Гистидин декарбоксилаза
Гистидин
Гистамин
Систематическое название: L-гистидин – карбокси-лиаза
15
16.
4. Лиазы (продолжение)4.1.3. Лиазы оксокислот
4.1.3.1 Изоцитрат-лиаза
4.2 C-O лиазы
4.2.1 Гидро-лиазы
4.2.1.2 Фумараза
Фумараза
Фумарат (транс-бутендионовая к-та)
L-Малат
Систематическое название: L-малат – гидро-лиаза
16
17.
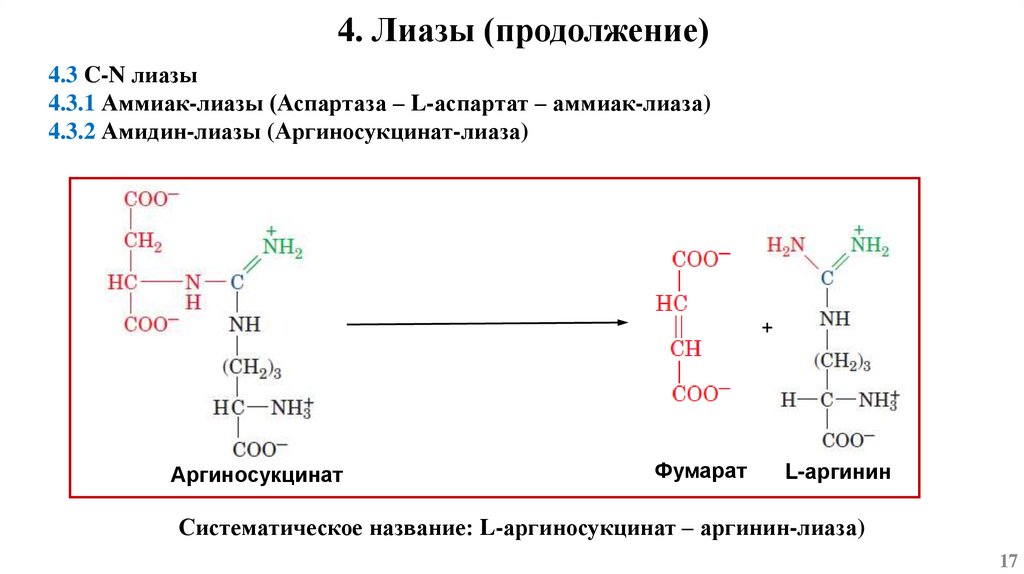
4. Лиазы (продолжение)4.3 C-N лиазы
4.3.1 Аммиак-лиазы (Аспартаза – L-аспартат – аммиак-лиаза)
4.3.2 Амидин-лиазы (Аргиносукцинат-лиаза)
+
Аргиносукцинат
Фумарат
L-аргинин
Систематическое название: L-аргиносукцинат – аргинин-лиаза)
17
18.
4. Лиазы (продолжение)4.4 C-S лиазы
4.5 C-Hal лиазы
4.6 P-O лиазы (на данный момент определен только подкласс)
4.6.1.1 Аденилатциклаза
АТФ
3ʹ,5ʹ-цАМФ
Систематическое название: АТФ - пирофосфат-лиаза (циклизующая)
18
19.
5. ИзомеразыИзомеразы – ферменты, катализирующие различные типы реакций изомеризации
(эпимеризации, цис-транс изомеризации, кето-енольные превращения);
Систематическое название строится по схеме:
Субстрат реакция, где-обозначение, отражающее суть реакции (номер изменяемого атома
углерода, изменение цис-транс, изменение кето-енол, изменение альдозо-кетозо)
5.1 Рацемазы и эпимеразы
5.1.3 Действующие на углеводы и их производные
5.1.3.1 Фосфопентозэпимераза
Рибулозо-5-фосфат
Ксилулозо-5-фосфат
Систематическое название: D-рибулозо-5-фосфат 3-эпимераза
19
20.
5. Изомеразы (продолжение)5.2 Цис-транс изомеразы
5.2.1.3 Ретиналь-изомераза
11-цис-ретиналь
11-транс-ретиналь
Систематическое название: Полностью-транс-ретиналь 11-цис-транс-изомераза
5.3 Внутримолекулярные оксидоредуктазы
5.3.1 Осуществляющие превращения альдоз и кетоз
5.3.1.1 Триозофосфатизомераза (D-глицеральдегид-3-фосфат альдозо-кетозо-изомераза)
5.3.2 Осуществляющие кетоенольные превращения
5.3.4 Переносящие S-S связи
5.3.4.1 Протеин – дисульфид-изомераза
20
21.
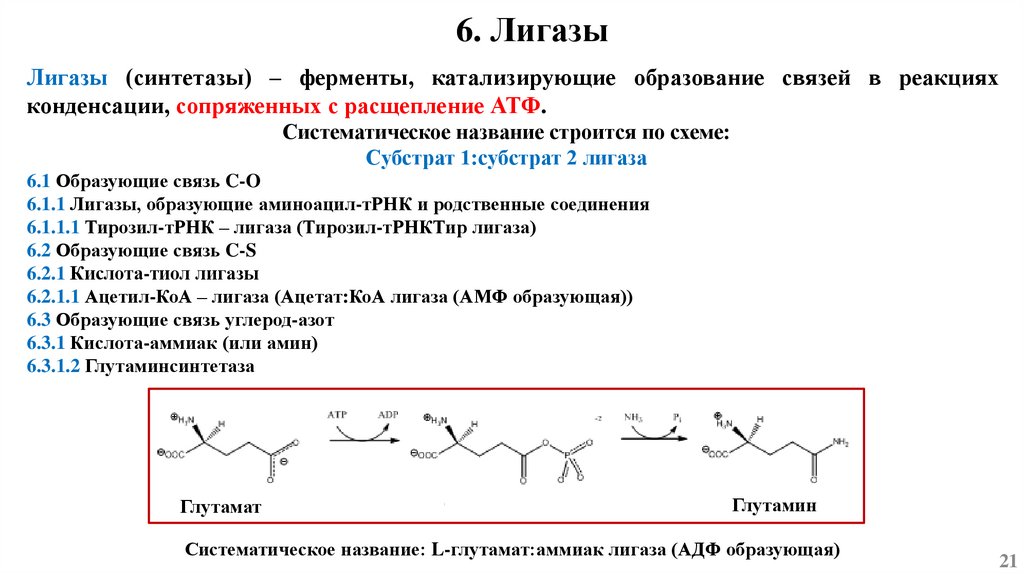
6. ЛигазыЛигазы (синтетазы) – ферменты, катализирующие образование связей в реакциях
конденсации, сопряженных с расщепление АТФ.
Систематическое название строится по схеме:
Субстрат 1:субстрат 2 лигаза
6.1 Образующие связь C-O
6.1.1 Лигазы, образующие аминоацил-тРНК и родственные соединения
6.1.1.1 Тирозил-тРНК – лигаза (Тирозил-тРНКТир лигаза)
6.2 Образующие связь C-S
6.2.1 Кислота-тиол лигазы
6.2.1.1 Ацетил-КоА – лигаза (Ацетат:КоА лигаза (АМФ образующая))
6.3 Образующие связь углерод-азот
6.3.1 Кислота-аммиак (или амин)
6.3.1.2 Глутаминсинтетаза
Глутамат
Глутамин
Систематическое название: L-глутамат:аммиак лигаза (АДФ образующая)
21
22.
6. Лигазы (продолжение)6.4 Образующие связь C-C
6.4.1.1 Пируваткарбоксилаза
Биотин
Пируват
Оксалоацетат
Систематическое название: Пируват:СО2 лигаза (АДФ образующая)
6.5 Образующие фосфодиэфирную связь
6.5.1.1 ДНК-лигаза (Поли(дезоксирибонуклеотид):полидезоксирибонуклеотид)
лигаза (АМФ образующая)
22
23.
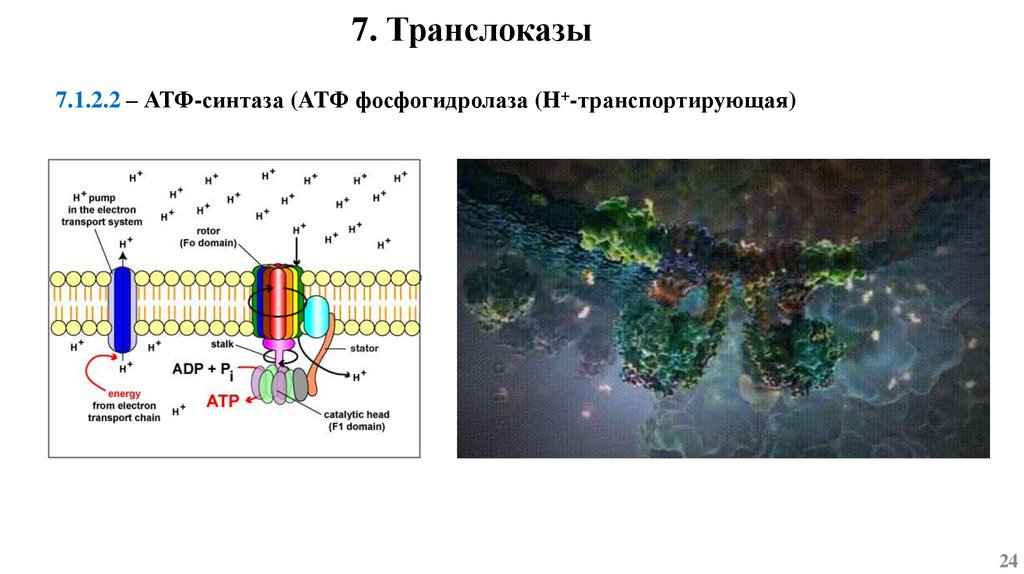
7. ТранслоказыТранслоказы – ферменты, катализирующие перенос ионов или молекул через мембраны,
сопряженный с иными реакциями.
7.1 ферменты, катализирующие транслокацию протонов;
7.2 ферменты, катализирующие транслокацию неорганических катионов и их хелатных
комплексов;
7.3 ферменты, катализирующие транслокацию неорганических анионов;
7.4 ферменты, катализирующие транслокацию аминокислот и пептидов;
7.5 ферменты, катализирующие транслокацию углеводов и их производных;
7.6 ферменты, катализирующие транслокацию иных соединений.
Деление на подподклассы:
7.Х.1 ферменты, катализирующие реакции транслокации, связанные с реакциями окислениявосстановления;
7.Х.2 ферменты, катализирующие реакции транслокации, связанные с гидролизом
нуклеозидтрифосфата;
7.Х.3 ферменты, катализирующие реакции транслокации, связанные с гидролизом дифосфата;
7.Х.4 ферменты, катализирующие реакции транслокации, связанные с реакцией
декарбоксилирования.
23
24.
7. Транслоказы7.1.2.2 – АТФ-синтаза (ATФ фосфогидролаза (H+-транспортирующая)
24
25.
Единицы ферментативной активностиМЕ (Международная единица) – количество фермента, катализирующего при
стандартных условиях* превращение 1 мкмоль субстрата за 1 минуту (мкмоль/мин);
Удельная активность фермента – количество МЕ, соотнесенное к 1 мг белка
(мкмоль/(мин мг));
Катал (кат, единица СИ) – количество фермента, катализирующего при стандартных
условиях превращение 1 моль субстрата за 1 секунду (моль/с);
1 кат = 6 · 107 МЕ
1 МЕ = 16,67 · 10-9 кат (16,67 нкат)
* Стандартные условия:
1) t = 25ºС;
2) Оптимум рН для конкретного фермента;
3) Насыщающая концентрация субстрата;
4) Наличие активатора или кофактора.
25
26.
Единицы ферментативной активностиМолекулярная
активность
–
количество
молекул
субстрата,
превращающегося при стандартных условиях* 1 молекулой фермента за 1
минуту (мин-1);
Активность каталитического центра (число оборотов) – количество молекул
субстрата, претерпевающих при стандартных условиях* превращение в
одном каталитическом центре фермента за 1 минуту (мин-1).
* Стандартные условия:
1) t = 25ºС;
2) Оптимум рН для конкретного фермента;
3) Насыщающая концентрация субстрата;
4) Наличие активатора или кофактора.
26
27.
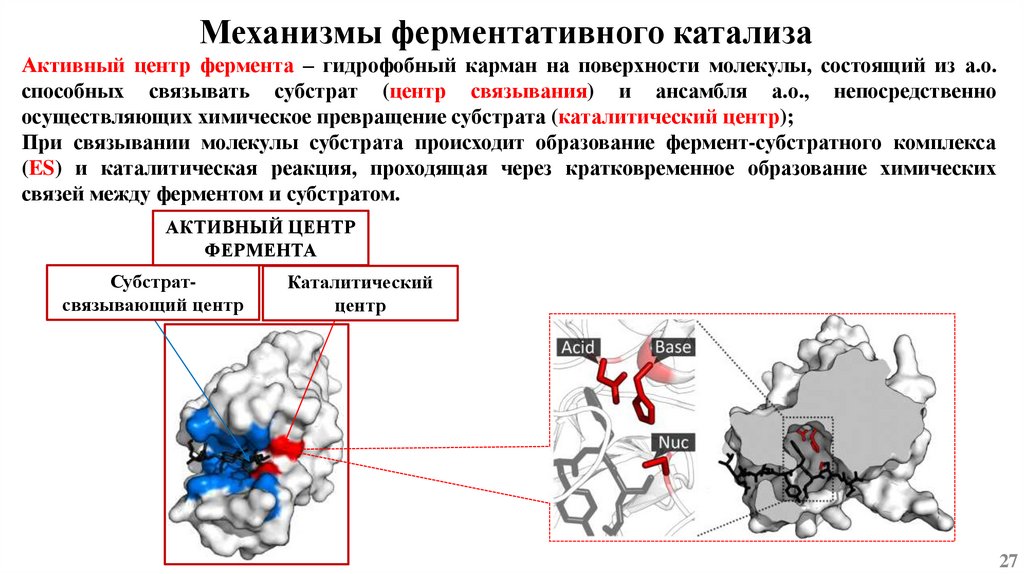
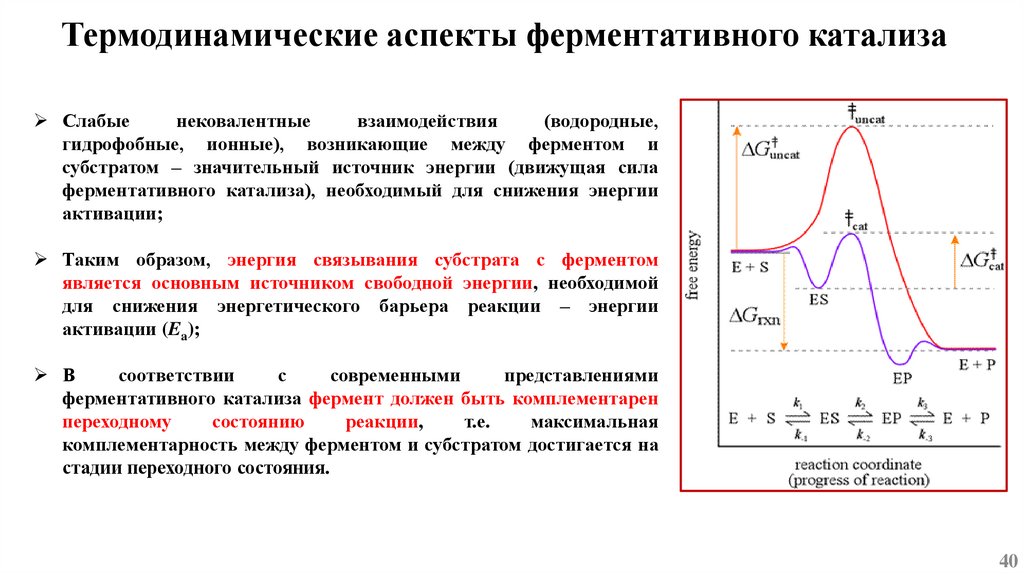
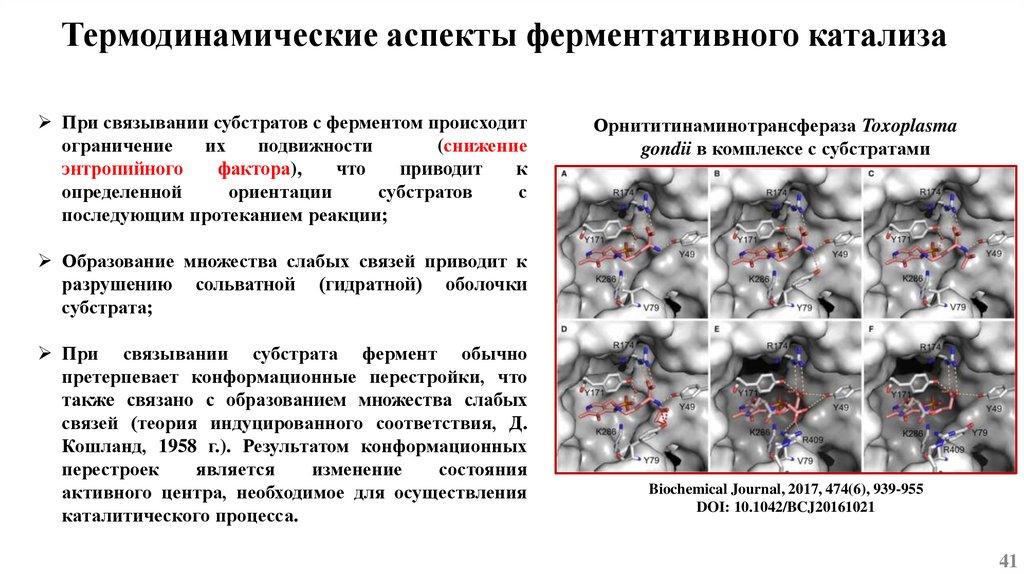
Механизмы ферментативного катализаАктивный центр фермента – гидрофобный карман на поверхности молекулы, состоящий из а.о.
способных связывать субстрат (центр связывания) и ансамбля а.о., непосредственно
осуществляющих химическое превращение субстрата (каталитический центр);
При связывании молекулы субстрата происходит образование фермент-субстратного комплекса
(ES) и каталитическая реакция, проходящая через кратковременное образование химических
связей между ферментом и субстратом.
АКТИВНЫЙ ЦЕНТР
ФЕРМЕНТА
Субстратсвязывающий центр
Каталитический
центр
27
28.
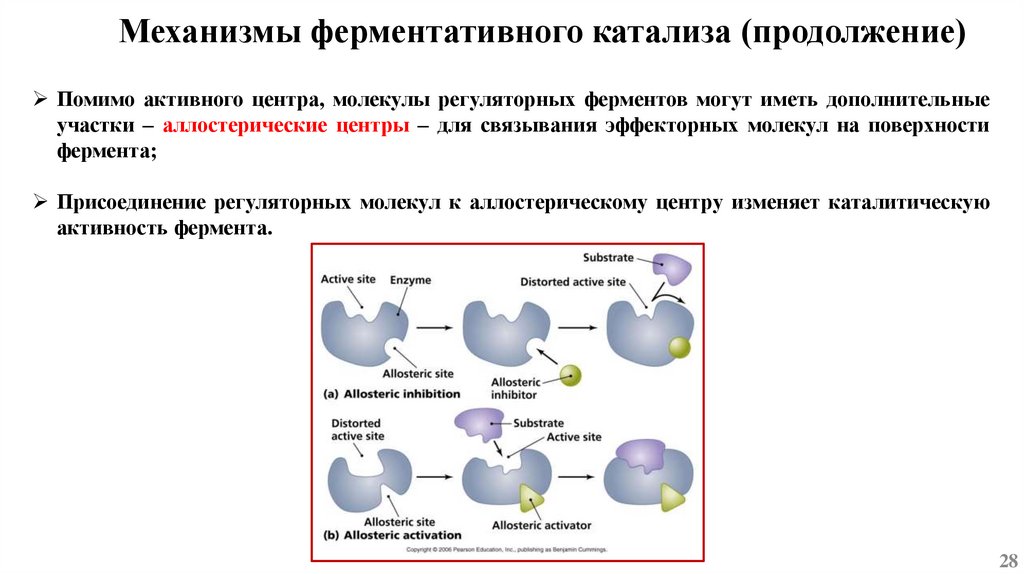
Механизмы ферментативного катализа (продолжение)Помимо активного центра, молекулы регуляторных ферментов могут иметь дополнительные
участки – аллостерические центры – для связывания эффекторных молекул на поверхности
фермента;
Присоединение регуляторных молекул к аллостерическому центру изменяет каталитическую
активность фермента.
28
29.
Роль специфических групп в ферментативном катализеОбщий кислотно-основный катализ
Многие ферментативные реакции протекают через образование неустойчивых заряженных интермедиатов,
которые могут быть стабилизированы путем протонирования или депротонирования интермедиата, что
сдвигает равновесие реакции в сторону образования продуктов реакции (реакции, протекающие по
механизму общего кислотно-основного катализа);
В ферментативных реакция в общем кислотно-основном катализе участвуют аминокислотные остатки белка:
А.о.
в ферменте
Сопряженная
кислота
Сопряженное
основание
29
30.
Роль специфических групп в ферментативном катализе(продолжение)
Специфический кислотно-основный катализ
В
специфическом
кислотно-основном
катализе в перенос протонов (H+) участвует
либо компоненты воды, либо другие слабые
акцепторы и доноры протонов;
Специфический кислотно-основный катализ
в
большей
степени
характерен
для
неферментативных реакций.
30
31.
Роль специфических групп в катализеКовалентный катализ
Ковалентный катализ характеризуется образованием ковалентной связи между ферментом и
субстратом;
В ковалентном катализе участвуют как радикалы аминокислотных остатков молекулы фермента,
так и коферменты небелковой природы;
Осуществляется нуклеофильными группами а.о. фермента (основания Льюиса): ОН-группа серина
(сериновые протеазы, холинэстеразы, липазы, кислая и щелочная фосфатазы), тиольная группа
цистеина (глицеральдегид-3-фосфатдегидрогеназа, папаин), имидазольный радикал гистидина
(фосфоглицератмутаза,
сукцинил-КоА-синтетаза),
аминогруппа
лизина
(ацетоацетатдекарбоксилаза, альдолаза), а также коферментами, связанными с молекулой
фермента: тиаминпирофосфат (коферментная форма витамина В1) (пируватдегидрогеназа,
транскетолаза), биотин (пируваткарбоксилаза, пропионил-КоА-карбоксилаза).
Катализ ионами металлов
Ионы металлов, участвующие в ферментативном катализе способствуют правильной ориентации
субстрата в активном центре фермента, а также стабилизируют заряженную молекулу субстрата в
переходном состоянии или обеспечивают протекание окислительно-восстановительных реакций.
***
Большинство ферментов катализируют реакции с использованием нескольких типов катализа
31
32.
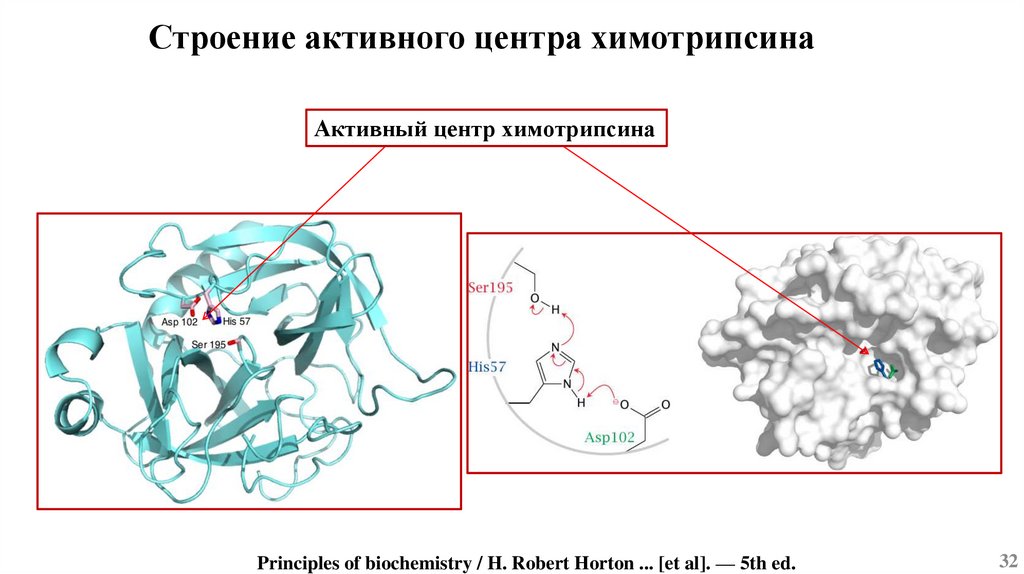
Строение активного центра химотрипсинаАктивный центр химотрипсина
Principles of biochemistry / H. Robert Horton ... [et al]. — 5th ed.
32
33.
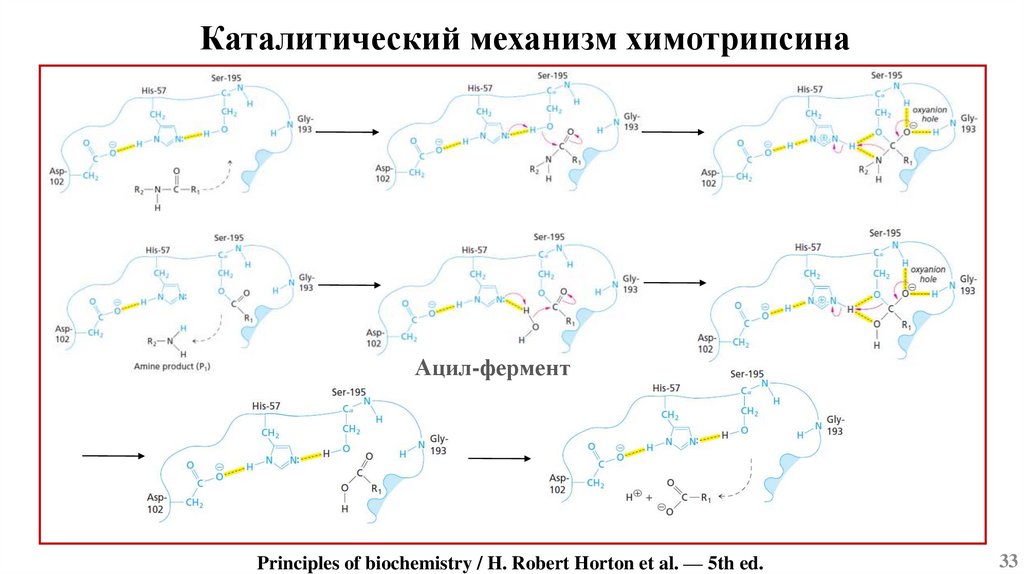
Каталитический механизм химотрипсинаАцил-фермент
Principles of biochemistry / H. Robert Horton et al. — 5th ed.
33
34.
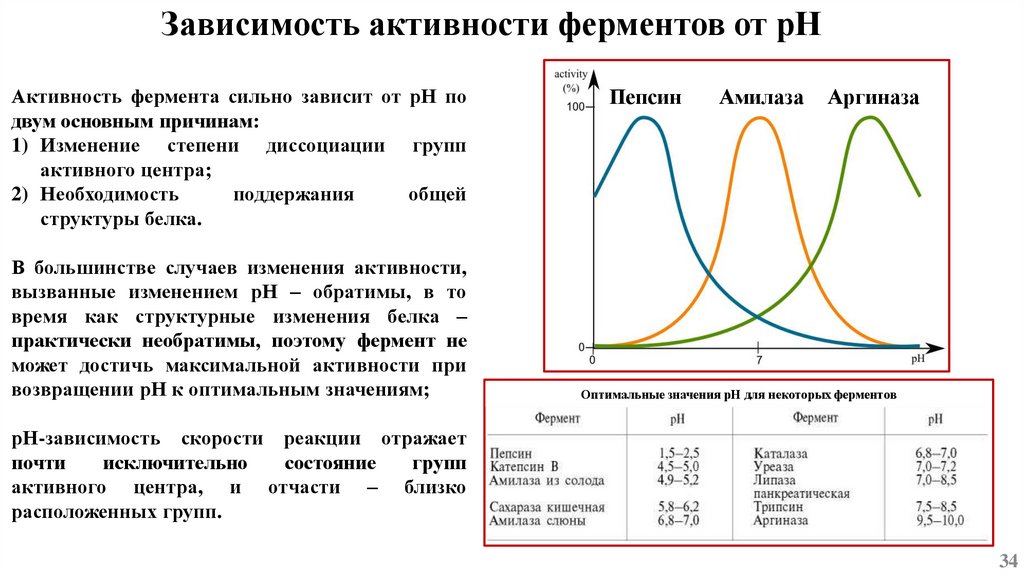
Зависимость активности ферментов от рНАктивность фермента сильно зависит от рН по
двум основным причинам:
1) Изменение степени диссоциации групп
активного центра;
2) Необходимость
поддержания
общей
структуры белка.
В большинстве случаев изменения активности,
вызванные изменением рН – обратимы, в то
время как структурные изменения белка –
практически необратимы, поэтому фермент не
может достичь максимальной активности при
возвращении рН к оптимальным значениям;
Пепсин
Амилаза
Аргиназа
Оптимальные значения рН для некоторых ферментов
рН-зависимость скорости реакции отражает
почти
исключительно
состояние
групп
активного центра, и отчасти – близко
расположенных групп.
34
35.
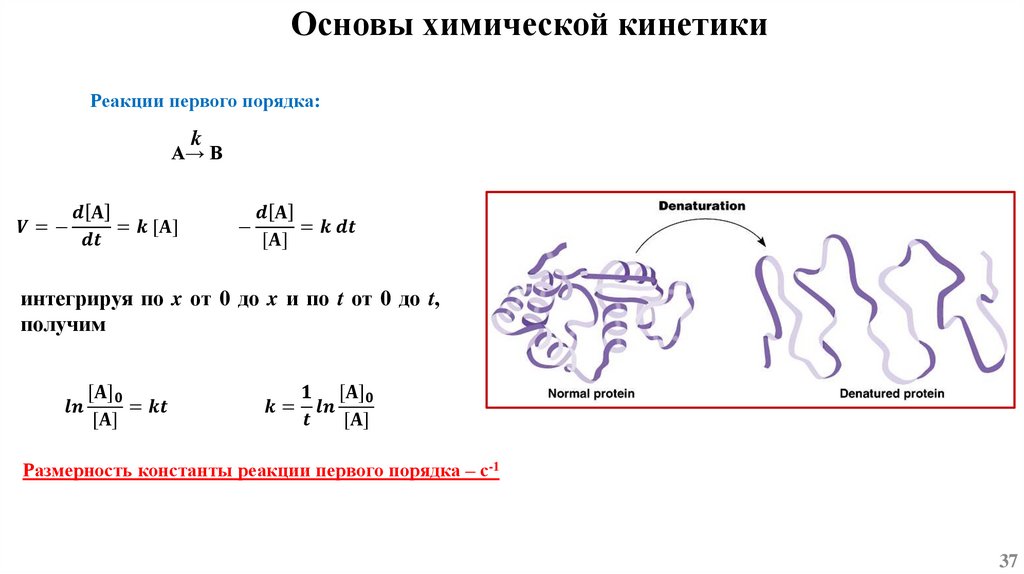
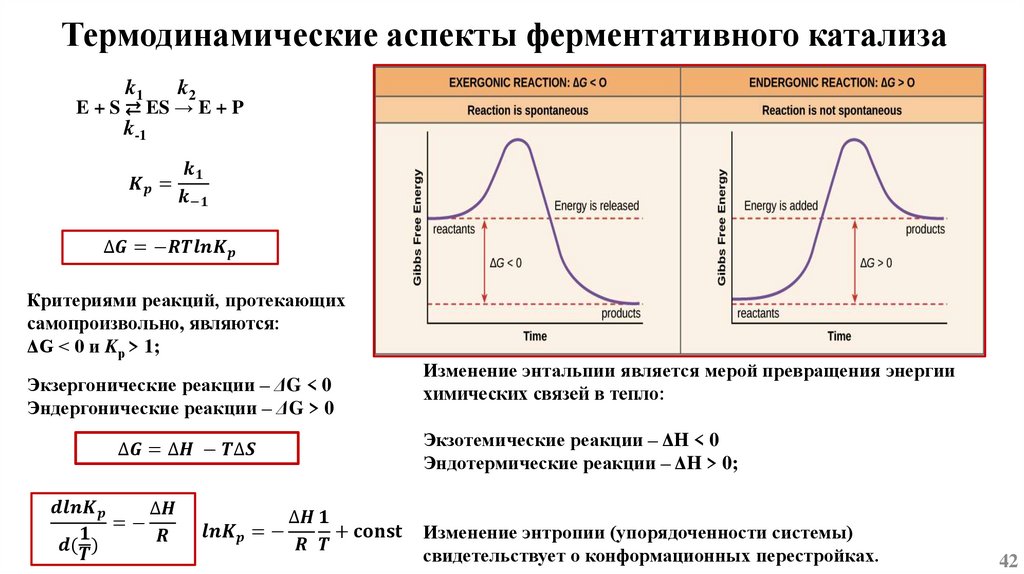
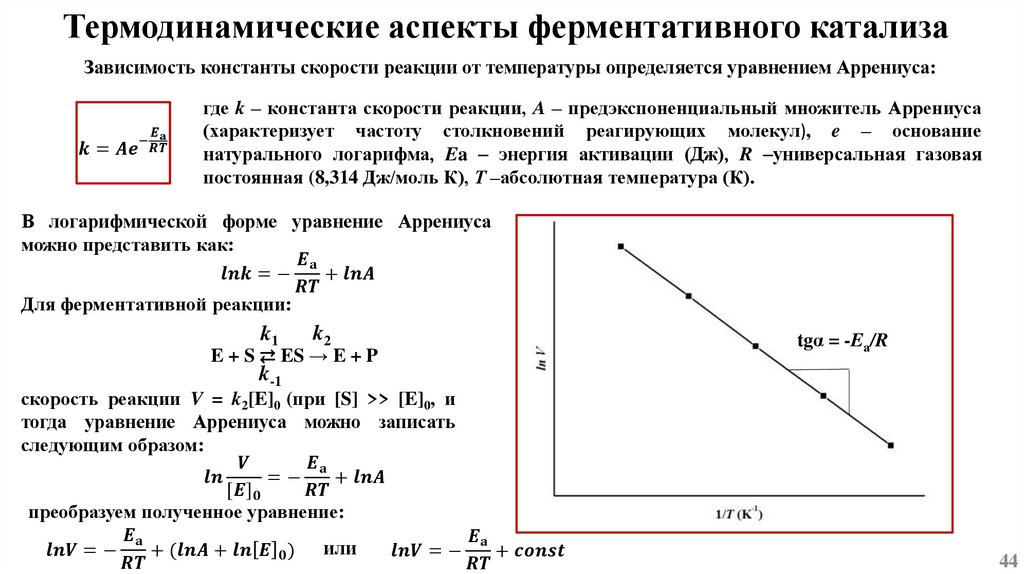
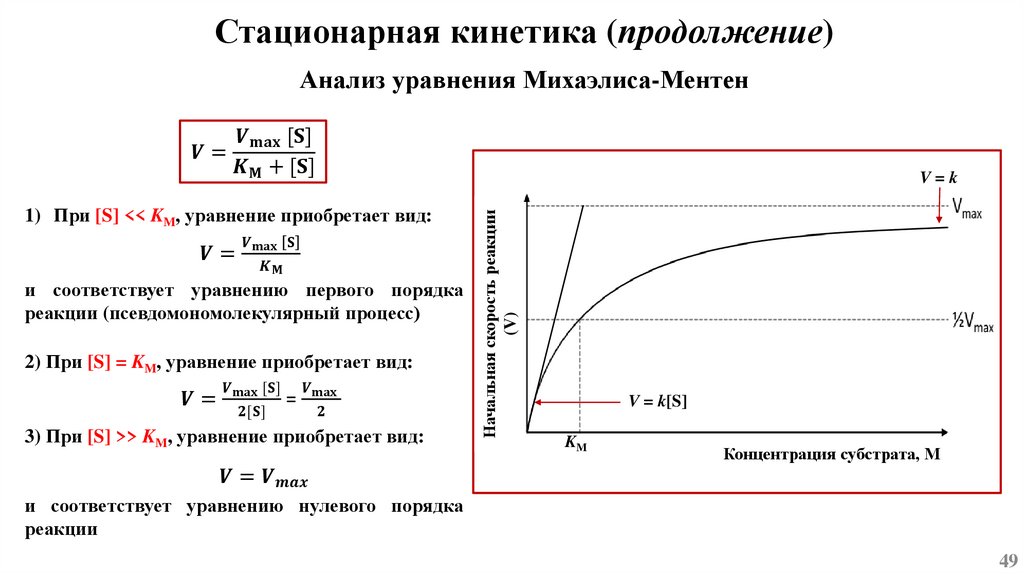
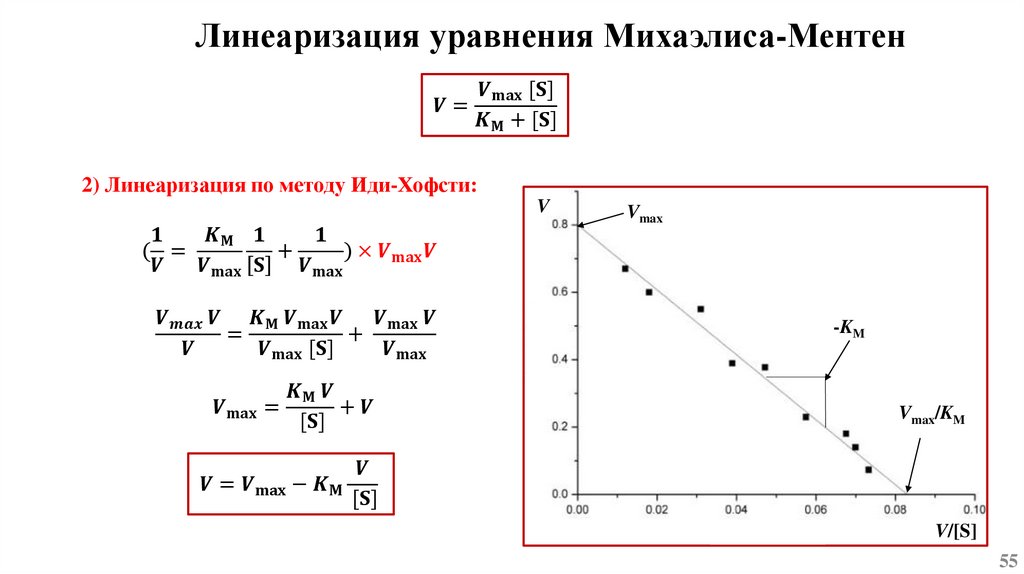
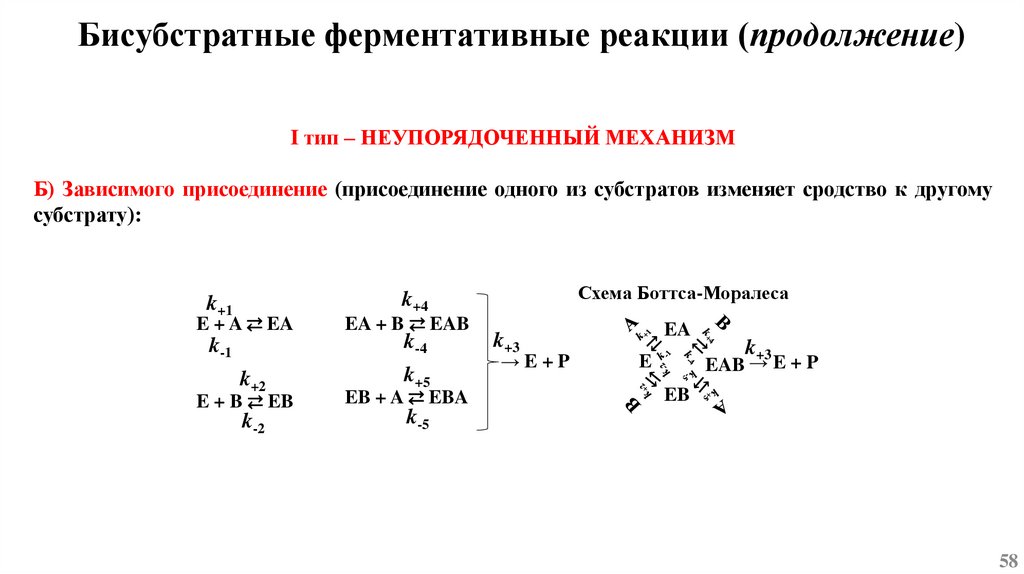
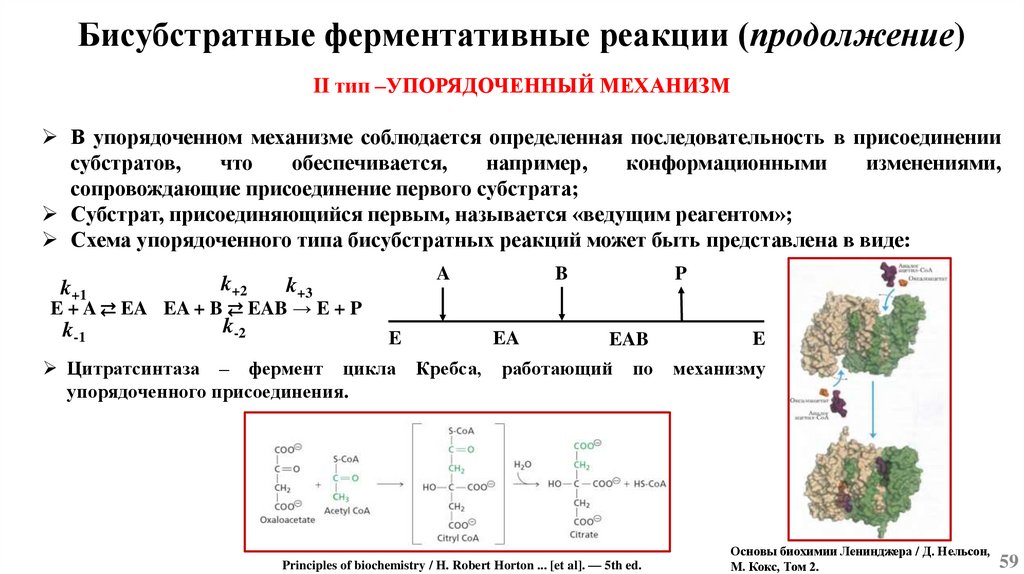
Основы химической кинетикиСогласно одному из основных положений химической кинетики – закону действующих масс, - скорость
химической реакции (при постоянной температуре) равна произведению константы скорости реакции
на концентрацию реагирующих веществ, взятых в степени их стехиометрических коэффициентов.
k1
mA + nB ⇄ pC + qD
k-1









































 Биология
Биология Химия
Химия








