Похожие презентации:
Ферменты
1.
Лекция «ФЕРМЕНТЫ»к.х.н., доцент кафедры Химии и технологии биомедицинских препаратов
Поливанова Анна Геннадьевна
2.
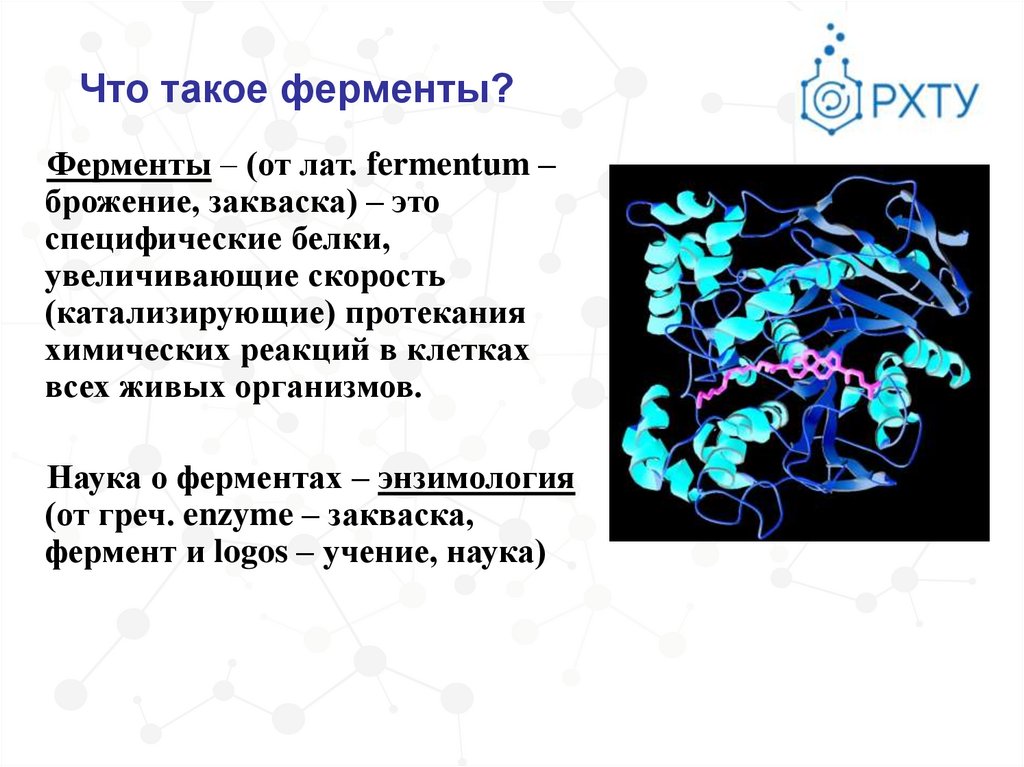
Что такое ферменты?Ферменты – (от лат. fermentum –
брожение, закваска) – это
специфические белки,
увеличивающие скорость
(катализирующие) протекания
химических реакций в клетках
всех живых организмов.
Наука о ферментах – энзимология
(от греч. enzyme – закваска,
фермент и logos – учение, наука)
3.
История изучения ферментовТермин «фермент» впервые был предложен в XVII
веке химиком ван Гельмонтом при обсуждении
механизмов пищеварения.
В 1833 французскими химиками
А.Пайеном и Ж. Персо впервые из
прорастающих зерен ячменя было
выделено активное вещество,
осуществляющее превращение
крахмала в сахар и получившее
название диастазы (амилазы).
В середине 19 в. разгорелась дискуссия о
природе брожения. Л. Пастер считал, что
брожение вызывается лишь живыми
микроорганизмами и что процесс брожения
неразрывно связан с их
жизнедеятельностью.
Ю. фон Либих и его сторонники, отстаивая
химическую природу брожения, считали,
что оно является следствием образования в
клетках микроорганизмов растворимых
ферментов.
4.
История изучения ферментовДискуссия Либиха и Пастера о природе брожения была
разрешена в 1897 г. Эрнстом Бухнером, который, растирая
дрожжи с инфузорной землёй, выделил из них бесклеточный
растворимый ферментный препарат (зимазу), вызывавший
спиртовое брожение. Открытие Бухнера утвердило
материалистическое понимание природы брожений.
5.
Общее строение ферментовФерменты
Простые
Однокомпонентные
состоят исключительно
из белка
Сложные
двух- и более
компонентные
Если фермент - сложный белок, то его небелковую часть называют
коферментом, а белковую - апоферментом.
Апофермент с коферментом образует активную форму катализатора
– холофермент.
6.
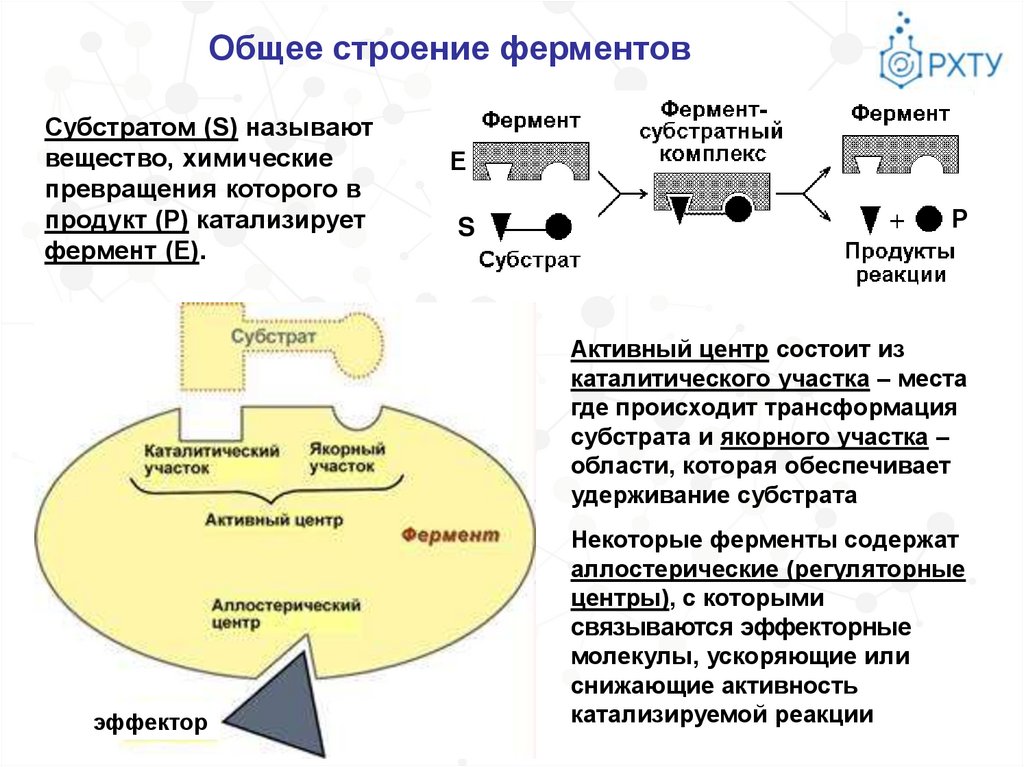
Общее строение ферментовСубстратом (S) называют
вещество, химические
превращения которого в
продукт (Р) катализирует
фермент (Е).
Е
S
Р
Активный центр состоит из
каталитического участка – места
где происходит трансформация
субстрата и якорного участка –
области, которая обеспечивает
удерживание субстрата
эффектор
Некоторые ферменты содержат
аллостерические (регуляторные
центры), с которыми
связываются эффекторные
молекулы, ускоряющие или
снижающие активность
катализируемой реакции
7.
Вспомогательные вещества в работе ферментовпродукт
продукт
Истинные коферменты постоянно не связаны с белком (ковалентными
связями), образуют связи в активном центре непосредственно в
момент катализа, выполняют функцию промежуточных переносчиков
атомов, функциональных групп и электронов
Простетическая группа – кофермент, постоянно (ковалентно)
связанный с ферментом в активном центре и после завершения
реакции его не покидает
Кофакторы – ионы металлов, присутствующие в активном центре и
участвующие в осуществлении ферментативной реакции
8.
Особенности ферментов как катализаторов• Высокая эффективность: ускоряют скорость реакции в
среднем в 108 – 1014 раз
• Высокая специфичность их действия (субстратная или
реакционная)
• Обеспечивают катализ при физиологических условиях.
Оптимальные условия протекания ферментативных реакций:
температура 37-38 °С, нормальное атмосферное давление, рН 6,9-7,7
(что характерно для большинства тканей)
• Активность и эффективность ферментов регулируется
специальными механизмами (вкл/выкл, высокое/низкое
сродство к субстрату)
• Высокая скоординированность с фругими ферментами в
рамках метаболонов
9.
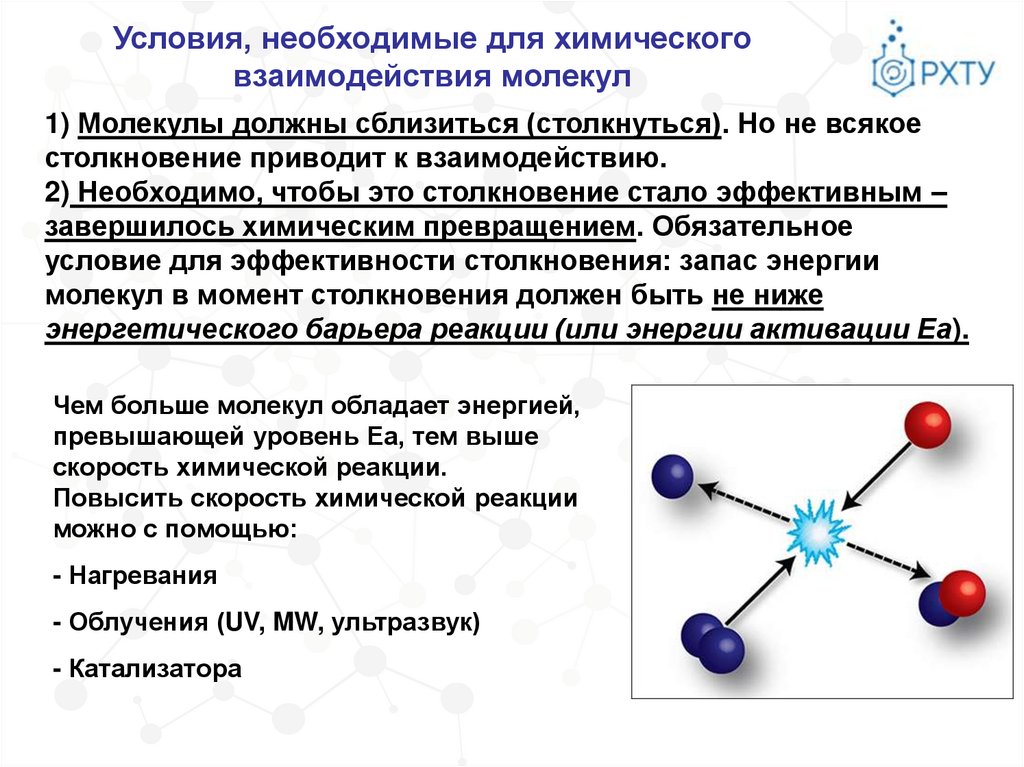
Условия, необходимые для химическоговзаимодействия молекул
1) Молекулы должны сблизиться (столкнуться). Но не всякое
столкновение приводит к взаимодействию.
2) Необходимо, чтобы это столкновение стало эффективным –
завершилось химическим превращением. Обязательное
условие для эффективности столкновения: запас энергии
молекул в момент столкновения должен быть не ниже
энергетического барьера реакции (или энергии активации Еа).
Чем больше молекул обладает энергией,
превышающей уровень Еа, тем выше
скорость химической реакции.
Повысить скорость химической реакции
можно с помощью:
- Нагревания
- Облучения (UV, MW, ультразвук)
- Катализатора
10.
Основные принципы ферментативного катализаСущность действия ферментов
заключается:
· в активации молекул
реагирующих веществ,
· в разбиении реакции на
несколько стадий, энергетический
барьер каждой из которых ниже
такового общей реакции.
В ферментативной реакции можно
выделить следующие этапы:
1. Присоединение субстрата (S) к
ферменту (E) с образованием
фермент-субстратного комплекса
(E-S).
2. Преобразование ферментсубстратного комплекса в один
или несколько переходных
комплексов (E-X) за одну или
несколько стадий.
3. Превращение переходного
комплекса в комплекс ферментпродукт (E-P).
4. Отделение конечных продуктов
от фермента.
11.
Факторы, снижающие энергию активацииферментативных процессов
• Снижение энтропии
реагирующей системы за счет
фиксации субстрата в
пространстве
Энтропия - мера беспорядка
молекул в растворе, уменьшает
возможность их взаимодействия
• Десольватация субстрата.
Сольватная оболочка из
связанных водородными связями
молекул воды окружает
большинство макромолекул в
водном растворе
• Комплементарность структуры активного центра и субстрата
• Эффект индуцированного соответствия
• Согласованность каталитических стадий ферментативной реакции
12.
Комплементарность структуры активного центра и субстратаАктивный центр ферментов - это определенный участок белковой молекулы,
способный комплементарно связываться с субстратом и обеспечивающий
его каталитическое превращение.
Структура активного центра сформирована радикалами аминокислот.
В активном центре фермента имеются аминокислотные остатки,
функциональные группы которых обеспечивают комплементарное
связывание субстрата (участок связывания), и аминокислотные остатки,
функциональные группы которых осуществляют химическое превращение
субстрата (каталитический участок), однако, не всегда эти участки имеют
чёткое пространственное разделение и могут "перекрываться".
Активный центр гексокиназы
13.
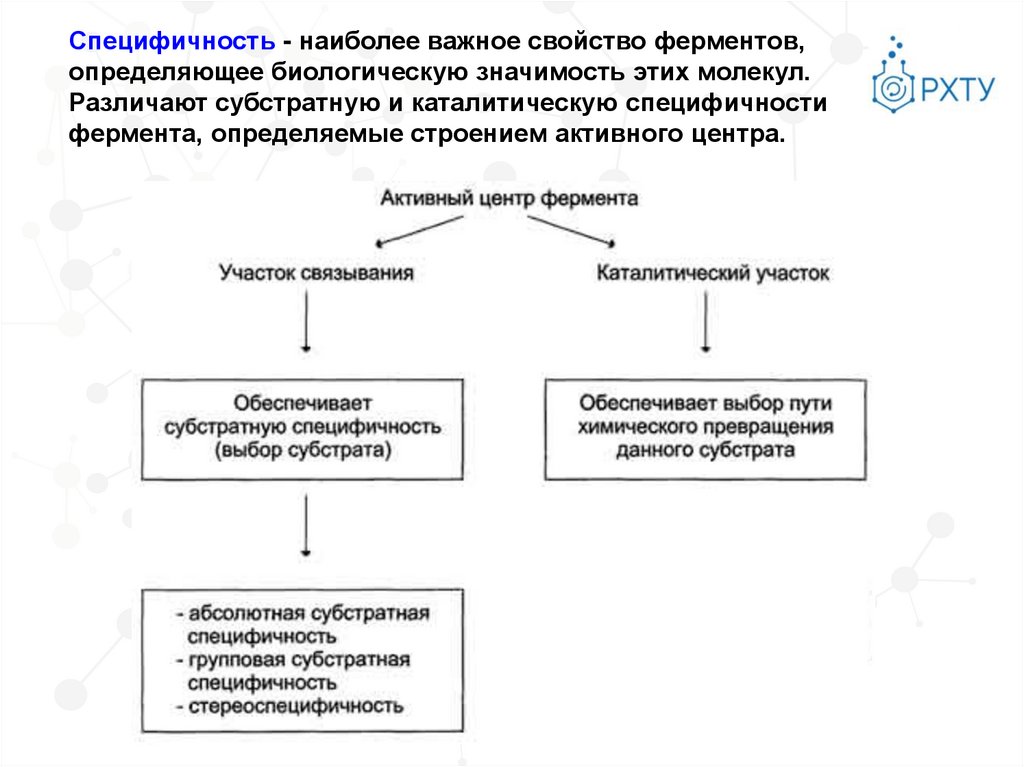
Специфичность - наиболее важное свойство ферментов,определяющее биологическую значимость этих молекул.
Различают субстратную и каталитическую специфичности
фермента, определяемые строением активного центра.
14.
Абсолютная субстратная специфичностьАктивный центр ферментов, обладающих абсолютной
субстратной специфичностью, комплементарен только одному
субстрату. Следует отметить, что таких ферментов в живых
организмах мало.
15.
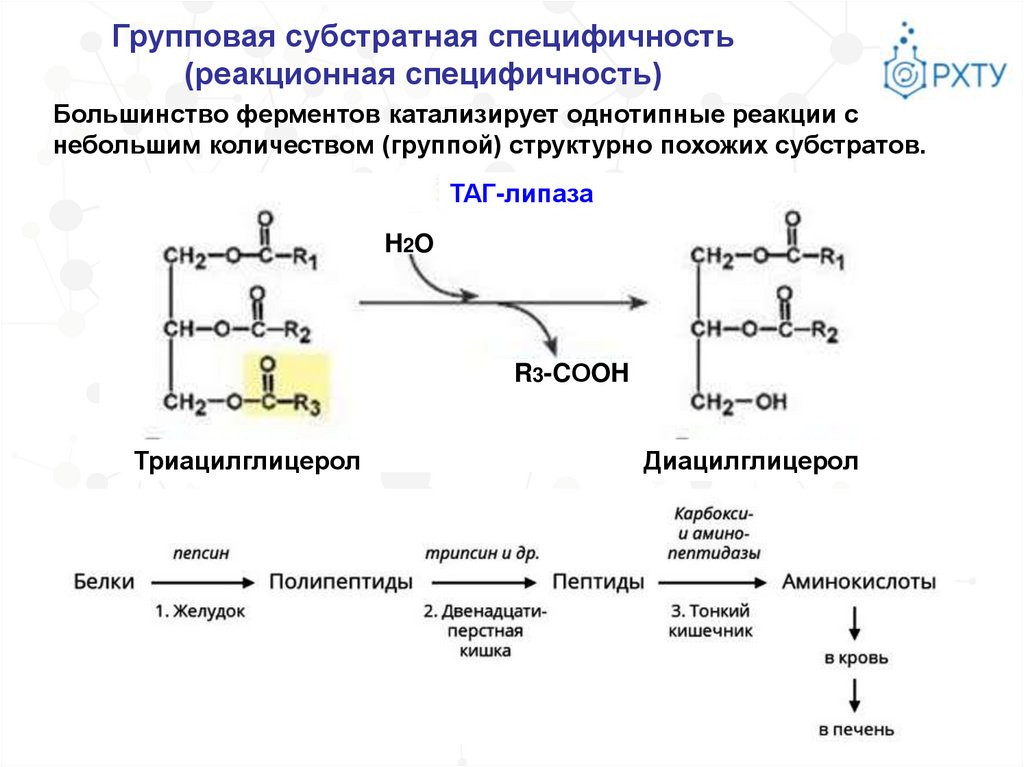
Групповая субстратная специфичность(реакционная специфичность)
Большинство ферментов катализирует однотипные реакции с
небольшим количеством (группой) структурно похожих субстратов.
ТАГ-липаза
H2O
R3-CОOH
Триацилглицерол
Диацилглицерол
16.
СтереоспецифичностьПри наличии у субстрата нескольких стереоизомеров фермент
проявляет абсолютную специфичность к одному из них.
Стереоспецифичность к D-сахарам. Большинство моносахаридов и
продуктов их обмена в организме человека и других млекопитающих
относят к D-стереоизомерам. Ферменты, осуществляющие их
метаболизм, имеют специфичность только к изомерам D-ряда
17.
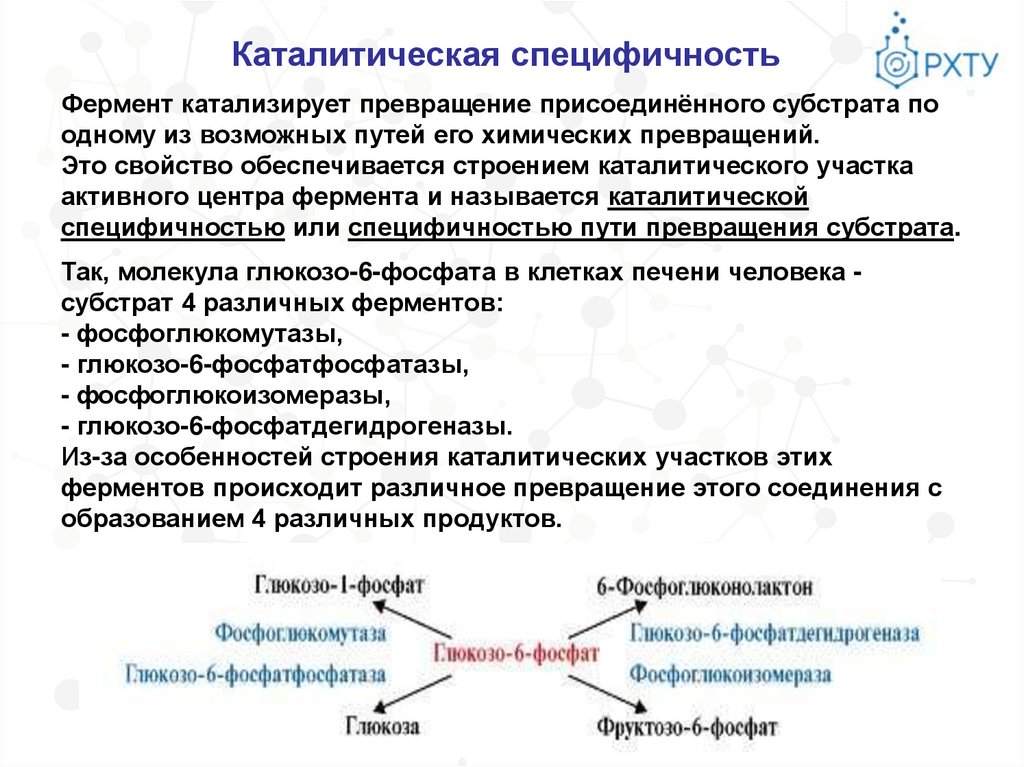
Каталитическая специфичностьФермент катализирует превращение присоединённого субстрата по
одному из возможных путей его химических превращений.
Это свойство обеспечивается строением каталитического участка
активного центра фермента и называется каталитической
специфичностью или специфичностью пути превращения субстрата.
Так, молекула глюкозо-6-фосфата в клетках печени человека субстрат 4 различных ферментов:
- фосфоглюкомутазы,
- глюкозо-6-фосфатфосфатазы,
- фосфоглюкоизомеразы,
- глюкозо-6-фосфатдегидрогеназы.
Из-за особенностей строения каталитических участков этих
ферментов происходит различное превращение этого соединения с
образованием 4 различных продуктов.
18.
Теории узнавания ферментом субстратаВ 1894 году Э.Фишер предложил определение: «Фермент подходит к
субстрату, как ключ к замку», т.е. существует строгое геометрическое
соответствие структуры субстрата и активного центра фермента.
Иногда эту теорию называют теорией «жесткой матрицы», жесткая
структура активного центра оказывается комплементарной
молекулярной структуре субстрата, обеспечивая тем самым
высокую специфичность фермента. После того, как образуется ESкомплекс, происходит реакция и продукты отделяются от фермента.
Образовавшиеся молекулы уже не подходят по форме к активному
центру молекулы фермента. Освободившийся фермент может
принимать новые молекулы.
19.
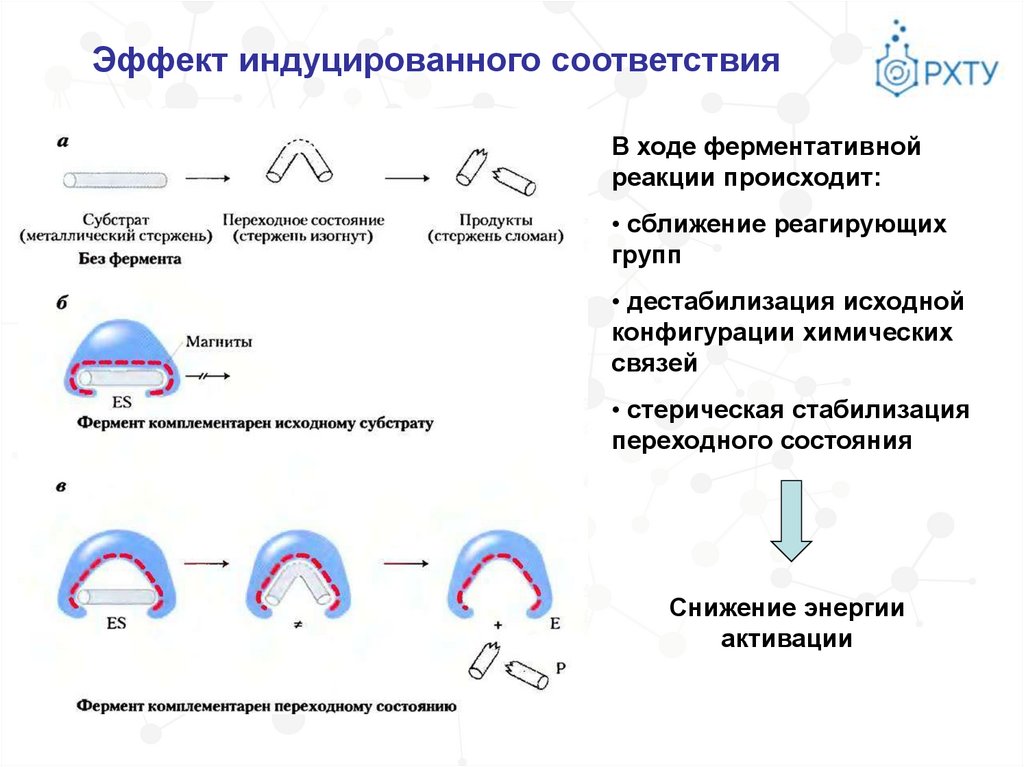
Эффект индуцированного соответствияВ противоположность модели Э. Фишера Д. Кошлендом в 50-е годы ХХ
века была разработана теория «индуцированного соответствия»,
допускающая высокую конформационную лабильность молекулы
белка-фермента, гибкость и подвижность активного центра.
В процессе реакции субстрат индуцирует конформационные
изменения молекулы фермента таким образом, что активный центр
принимает необходимую для связывания субстрата
пространственную ориентацию.
20.
Эффект индуцированного соответствияВ ходе ферментативной
реакции происходит:
• сближение реагирующих
групп
• дестабилизация исходной
конфигурации химических
связей
• стерическая стабилизация
переходного состояния
Снижение энергии
активации
21.
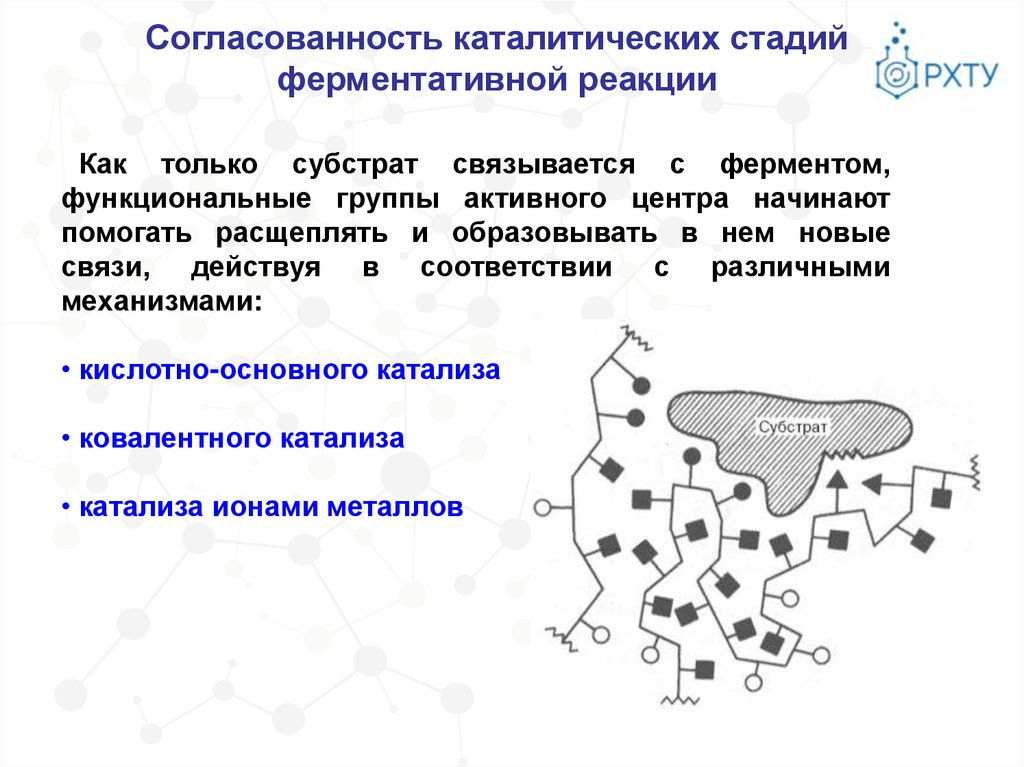
Согласованность каталитических стадийферментативной реакции
Как только субстрат связывается с ферментом,
функциональные группы активного центра начинают
помогать расщеплять и образовывать в нем новые
связи, действуя в соответствии с различными
механизмами:
• кислотно-основного катализа
• ковалентного катализа
• катализа ионами металлов
22.
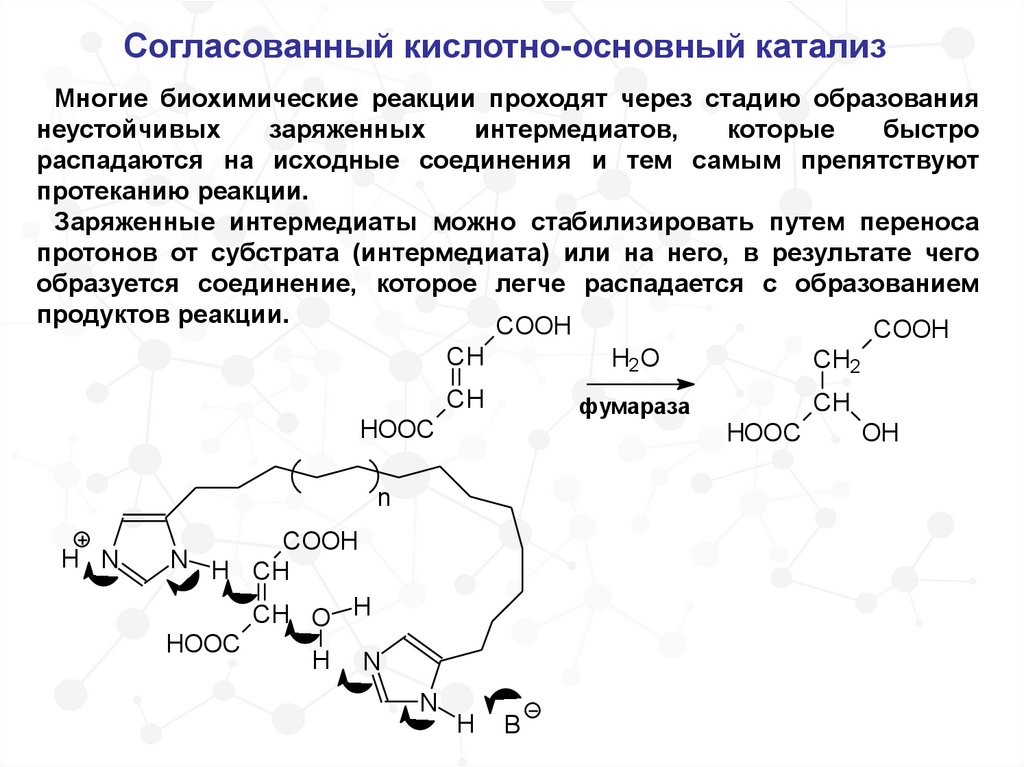
Согласованный кислотно-основный катализМногие биохимические реакции проходят через стадию образования
неустойчивых
заряженных
интермедиатов,
которые
быстро
распадаются на исходные соединения и тем самым препятствуют
протеканию реакции.
Заряженные интермедиаты можно стабилизировать путем переноса
протонов от субстрата (интермедиата) или на него, в результате чего
образуется соединение, которое легче распадается с образованием
продуктов реакции.
COOH
COOH
CH
H2O
CH2
CH
фумараза
HOOC
n
H N
COOH
N H CH
CH O H
HOOC
H N
N
H
B
CH
HOOC
OH
23.
Аминокислоты, участвующие в ферментативномкислотно-основном катализе
Многие органические реакции протекают при участии доноров
протонов (кислот) или акцепторов протонов (оснований). Активные
центры некоторых ферментов содержат функциональные группы
аминокислот, которые могут принимать участие в процессе катализа в
качестве доноров или акцепторов протонов:
24.
Ковалентный катализПри ковалентном катализе между ферментом и субстратом
временно образуется ковалентная связь.
например, при гидролизе связи между А и В:
А-В + Н2О А-OH + В-H
В присутствии фермента, имеющего нуклеофильную
группу Х:, реакция идет следующим образом:
А-В + Х: А-Х--В + Н2О А-OH + Х: + В-H
Если новый путь имеет меньшую энергию активации, чем
некаталитический, то новые стадии протекают быстрее,
чем реакция в отсутствие катализатора.
25.
Катализ ионами металловZn2+, Mg2+, Fe2+, Cu2+ и др.
Металлы, как прочно связанные с ферментом, так и захватываемые
из раствора вместе с субстратом, могут участвовать в катализе
несколькими способами:
• Ориентируют субстрат в активном центре определенным образом или
стабилизируют заряженную молекулу субстрата в переходном
состоянии.
• Являются частью активного центра фермента и участвуют в катализе.
Например,
способствуют протеканию
окислительно-восстановительных реакций, обратимо изменяя свою степень окисления.
Около трети известных на сегодняшний день ферментов для
проявления каталитической активности нуждаются в присутствии
одного или нескольких ионов металлов
26.
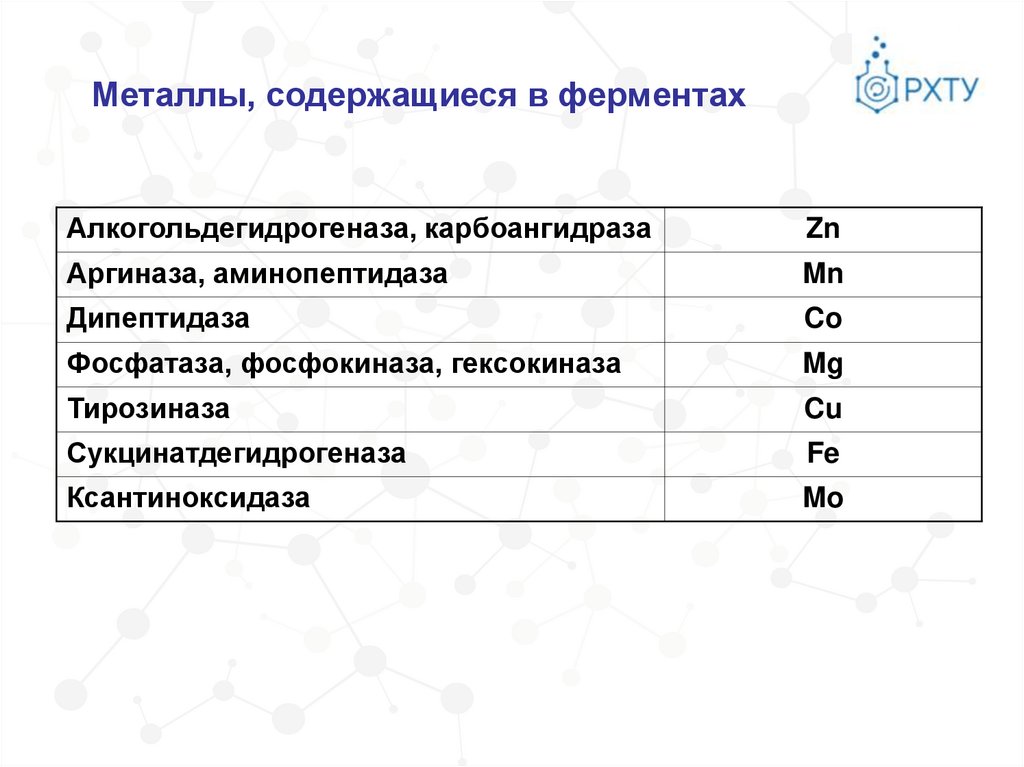
Металлы, содержащиеся в ферментахАлкогольдегидрогеназа, карбоангидраза
Zn
Аргиназа, аминопептидаза
Mn
Дипептидаза
Co
Фосфатаза, фосфокиназа, гексокиназа
Mg
Тирозиназа
Cu
Сукцинатдегидрогеназа
Fe
Ксантиноксидаза
Mo
27.
Ион Mg2+ не взаимодействуетнепосредственно с ферментом,
а участвует в стабилизации
молекулы АТФ и нейтрализации
отрицательного заряда
субстрата, что облегчает его
присоединение к активному
центру фермента и
"правильной" ориентации
молекулы АТФ в активном
центре фермента, ослабляя
фосфоэфирную связь и
облегчая перенос фосфата на
глюкозу.
В активном центре гексокиназы есть участки связывания для молекулы
глюкозы и комплекса Мg2+-АТФ. В результате ферментативной реакции
происходит перенос концевого γ-фосфатного остатка молекулы АТФ на
глюкозу с образованием глюкозо-6-фосфата.
28.
Номенклатура ферментовНа ранних стадиях исследований в области ферментов им присваивали
преимущественно тривиальные названия (пепсин, тромбин, трипсин)
Позже сложились различные подходы в присваивании имен ферментам.
На данный момент принято два типа названий ферментов:
• Рабочее или рекомендуемое название: складывается из названия
основного субстрата, типа катализируемой реакции и окончания «аза»
лактат + дегидрирование + аза = лактатдегидрогеназа
• Систематическая номенклатура:
Название фермента является сложным и состоит из 4 частей:
+ название субстрата
+ название типа катализируемой реакции
+ название одного из продуктов реакции
+ окончание –аза.
Глюкозо-6-фосфатфосфогидролаза:
• Субстрат: глюкозо-6-фосфат.
• Продукт реакции: фосфорная кислота.
• Тип реакции: гидролиз.
29.
Классификация ферментовНа сегодняшний день известно более 2000 различных ферментов.
Разработанная система классификации учитывает реакционную и
субстратную специфичность. Все ферменты включены в каталог под
своим классификационным номером, состоящим из четырех цифр
30.
Классификация ферментовКласс
1. Оксидоредуктазы
2. Трансферазы
Тип реакции
Важнейшие
подклассы
Дегидрогеназы,
Оскидазы,
Пероскидазы,
Редуктазы,
монооксигеназы,
Диокигеназы
С1-Трансфразы,
Гликозилтрансферазы,
Аминотрансферазы,
Фосфотрансферазы
3. Гидролазы
Эстеразы,
Гликозидазы,
Пептидазы,
Амидазы
4. Лиазы
(«синтазы»)
С-С-Лиазы,
С-О-Лиазы,
С-N-Лиазы,
C-S-Лиазы
5. Изомеразы
Эпимеразы,
Цис-транс-Изомеразы,
Внутримолекулярные
трансферазы
6. Лигазы
С-С-Лигазы,
С-О-Лигазы,
С-N-Лигазы,
C-S-Лигазы
31.
Коферменты и простетические группы оксидоредуктаз32.
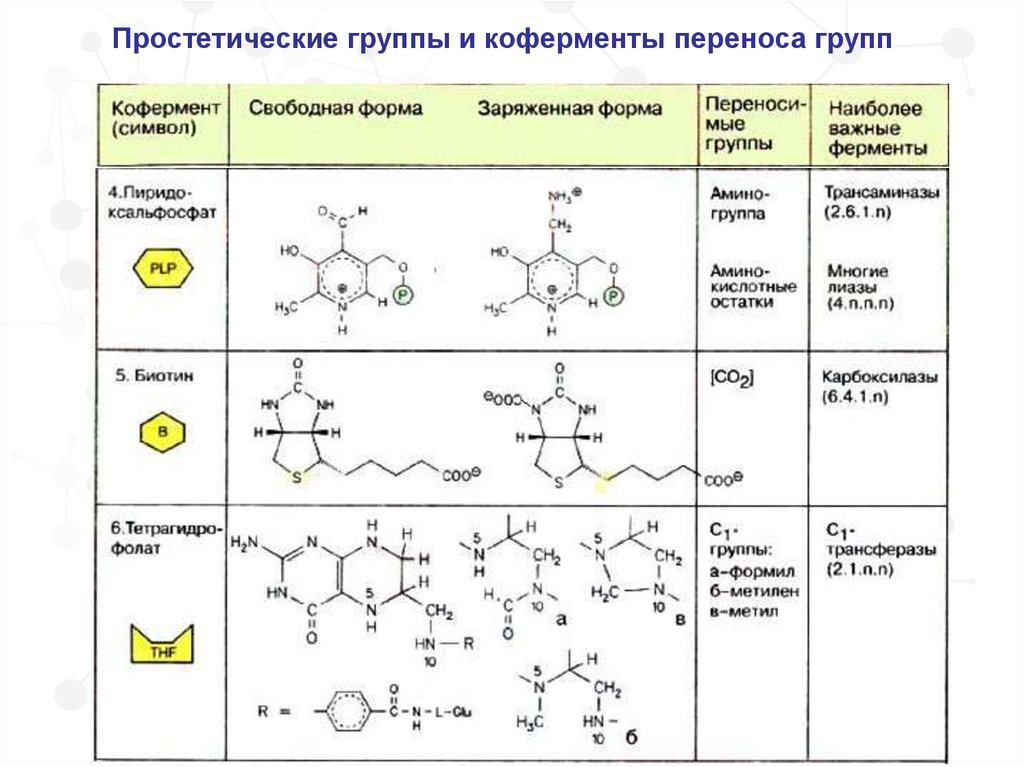
Простетические группы и коферменты переноса групп33.
Простетические группы и коферменты переноса групп34.
Кинетика ферментативных реакцийКинетика ферментативных реакций – это
раздел энзимологии, изучающий зависимость
скорости химических реакций, катализируемых
ферментами, от химической природы
реагирующих веществ и факторов окружающей
среды:
• Концентрация фермента;
• Концентрация субстрата;
• Температура;
• рН среды;
• Активаторы;
• Ингибиторы.
35.
В простейшем случае ферментативную реакцию можнопредставить как двухстадийный процесс:
Зависимость скорости реакции v от концентрации субстрата Сs
описывается уравнением Михаэлиса-Ментен, где
Км (константа Михаэлиса),
Vмакс (max) - максимальная скорость ферментативной реакции
при полном насыщении фермента субстратом:
Vmax Cs
v
Kм Cs
36.
При постоянной концентрациифермента скорость
ферментативной реакции во
многом определяется
количеством субстрата. По мере
увеличения концентрации
субстрата нарастает скорость
образования продукта, которая
постепенно достигает
максимальной величины (Vmax),
при которой весь фермент
насыщен субстратом и,
следовательно, находится в виде
фермент-субстратного комплекса
(ES). Дальнейшее повышение
концентрации субстрата не
приводит к увеличению
образования продукта, поэтому
скорость реакции не возрастает.
Vmax Cs
v
Kм Cs
Кm характеризует сродство
фермента к субстрату: чем ниже
значение Кm фермента, тем выше
его сродство к субстрату, и
наоборот.
Vmах и Km - кинетические
характеристики эффективности
фермента.
37.
Активность фермента – это изменение концентрации субстрата подвлиянием фермента в единицу времени.
Для выражения концентрации фермента и количественной оценки его
активности в условных единицах Комиссией по ферментам
Международного биохимического союза была рекомендована
стандартная международная единица (Е или U): за единицу активности
любого фермента принимается то количество его, которое в оптимальных
условиях катализирует превращение 1 микромоля субстрата или
образование 1 микромоля продукта в минуту (мкмоль/мин).
1Е = 1мкмоль превращенного субстрата / 1 мин
В 1972 г. Комиссия по ферментам Международного биохимического
союза предложила выражать активность ферментов в к а т а л а х.
Катал (символ - кат - это такое количество фермента, которое
способно превращать один моль субстрата за одну секунду (при
оптимальных условиях).
Международная единица ферментативной активности E связана с каталом
следующими равенствами:
1 кат = 1 моль S / c = 60 моль S / мин = 60х106 мкмоль / мин = 6х107 E,
1 E = 1 мкмоль / мин = 1 / 60 мкмоль/с = 1/60 мккат = 16,67 нкат.
38.
В медицине активность ферментов выражают чаще всего в единицахактивности на 1 л биологической жидкости либо на 1 мг (или 1 г) белка
или 1 мг (1 г) препарата фермента. Такая активность носит название
«удельная активность».
По удельной активности судят о качестве очистки фермента: чем меньше
посторонних белков, тем выше удельная активность. В процессе очистки
фермента удельная активность увеличивается, становится
максимальной и постоянной для очень хорошо очищенного (гомогенного)
фермента.
39.
Влияние температуры на скорость ферментативной реакцииСкорость ферментативных реакций, как и любых химических реакций,
зависит от температуры. При повышении температуры на 10 оС скорость
реакции увеличивается в 2-4 раза согласно правилу Вант-Гоффа. Однако,
при температурах выше 40 оС существенной становится денатурация
ферментов, что приводит к уменьшению суммарной активности.
Рост скорости
реакции с
повышением
температуры
Температура, оС
Утрата каталитической
активности
(денатурация фермента)
40.
Влияние pH на активность ферментовЗависимость скорости ферментативной реакции от рН имеет
колоколообразный вид. Значения рН, при которых наблюдается
наиболее высокая скорость ферментативной реакции, называют
оптимальными (рН-оптимум). Характер кривых и значение рН-оптимума
зависит от природы заряженных групп субстрата и заряженных групп
фермента (особенно тех, которые входят в активный центр). Оптимум рН
для большинства ферментов лежит в пределах от 6,0 до 8,0.
Отклонение рН среды от оптимального
вызывает изменение:
v
- ионизации функциональных групп
фермента, а иногда и субстрата;
- заряда фермента и его конформации;
- конформации активного центра
фермента;
- сродства фермента к субстрату.
5,0
6,0
7,0
8,0
То есть нарушается комплементарность
pH активного центра фермента к субстрату и
снижается скорость ферментативной
реакции.
41.
42.
Регуляция активности ферментов• Закон действующих масс
• Протеолитическая активация
• Активация вторичными мессенджерами
• Обратимая ковалентная модификация
• Аллостерическая регуляция
43.
Регуляция активности ферментов44.
Регуляция активности ферментов45.
Влияние эффекторов на активность ферментов• Эффекторы – вещества, которые, связываясь с
молекулой фермента, ингибируют (ингибиторы) или
усиливают (активаторы) активность фермента.
Эффекторы:
• метаболиты, вторичные мессенджеры,
образующиеся в организме, регулируют метаболизм,
направляя его в нужное русло.
• лекарственные препараты
• яды
46.
Ингибирование ферментовРазные химические агенты
(метаболиты, химические аналоги субстратов, токсины,
лекарственные средства, металлы)
могут ингибировать активность ферментов
Ферментативный ингибитор – вещество, замедляющее
протекание ферментативной реакции
Ингибитор связывается с ферментом, образуя комплекс IE
(ингибитор-фермент), что предупреждает формирование
комплекса ES (фермент-субстрат) или его расщепление
(высвобожение продукта реакции)
47.
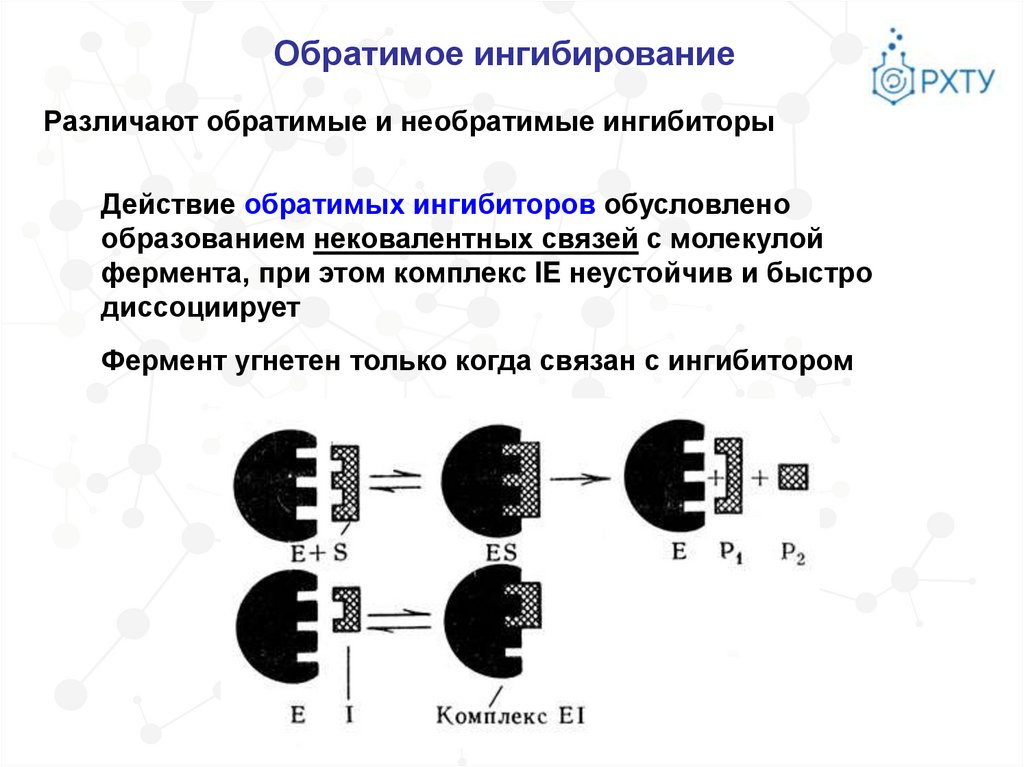
Обратимое ингибированиеРазличают обратимые и необратимые ингибиторы
Действие обратимых ингибиторов обусловлено
образованием нековалентных связей с молекулой
фермента, при этом комплекс IE неустойчив и быстро
диссоциирует
Фермент угнетен только когда связан с ингибитором
48.
В зависимости от места связыванияингибитора с ферментом различают
несколько типов ингибирования:
• Конкурентное
• Неконкурентное
• Бесконкурентное
• Аллостерическое ингибирование
49.
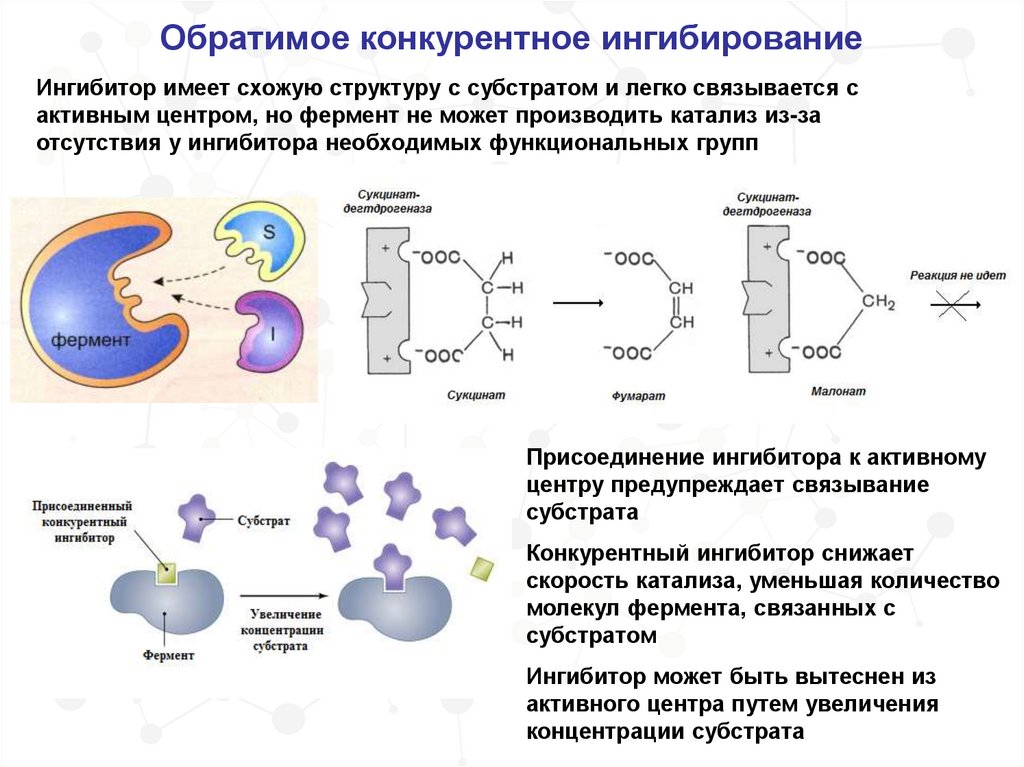
Обратимое конкурентное ингибированиеИнгибитор имеет схожую структуру с субстратом и легко связывается с
активным центром, но фермент не может производить катализ из-за
отсутствия у ингибитора необходимых функциональных групп
Присоединение ингибитора к активному
центру предупреждает связывание
субстрата
Конкурентный ингибитор снижает
скорость катализа, уменьшая количество
молекул фермента, связанных с
субстратом
Ингибитор может быть вытеснен из
активного центра путем увеличения
концентрации субстрата
50.
Витамин КАнтагонисты Витамина К (обратимые ингибиторы)
Антикоагулянты. В организме человека снижают свертываемость
крови, благодаря чему могут предупреждать образование тромбов в
сосудах. Тормозят биосинтез факторов свертывания.
51.
Неконкурентное ингибированиеИнгибитор присоединяется не к
активному центру, а к другому участку
фермента
неконкурентный
ингибитор
субстрат
Ингибитор и субстрат могут
одновременно связываться с ферментом
Ингибитор вызывает такие
конформационные изменения, которые не
позволяют ферменту превращать
субстрат в продукт, но не влияют на
сродство фермента к субстрату
Ингибитор не может быть вытеснен путем
увеличения концентрации субстрата
фермент
52.
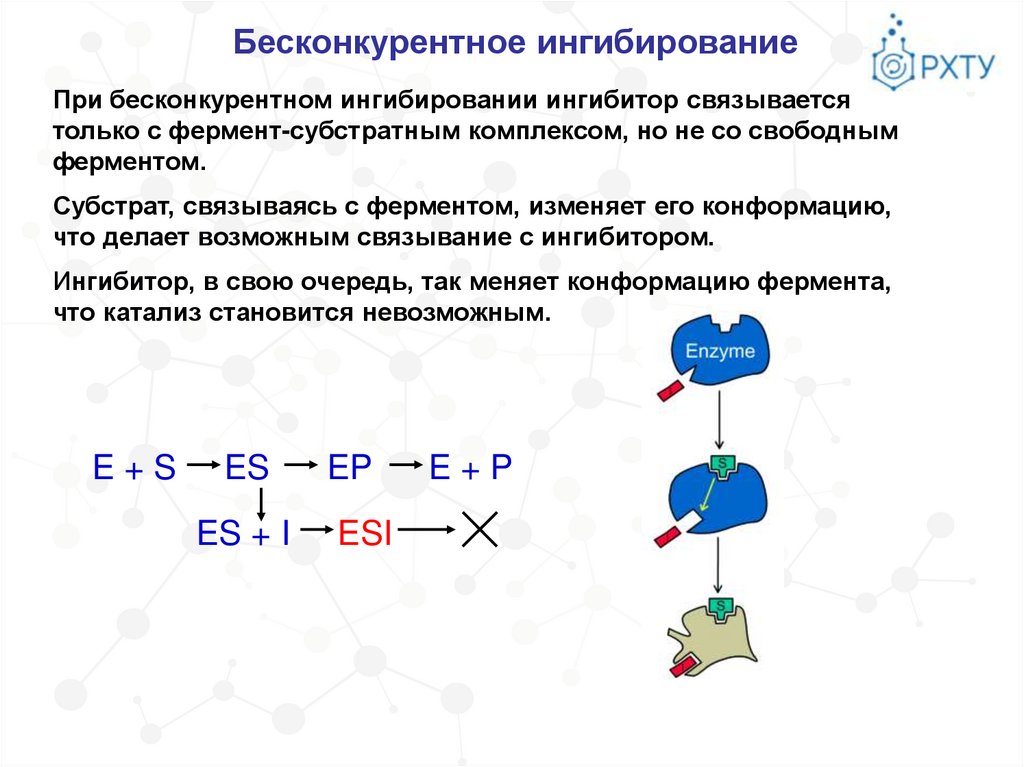
Бесконкурентное ингибированиеПри бесконкурентном ингибировании ингибитор связывается
только с фермент-субстратным комплексом, но не со свободным
ферментом.
Субстрат, связываясь с ферментом, изменяет его конформацию,
что делает возможным связывание с ингибитором.
Ингибитор, в свою очередь, так меняет конформацию фермента,
что катализ становится невозможным.
E+S
ES
ES + I
EP
ESI
E+P
53.
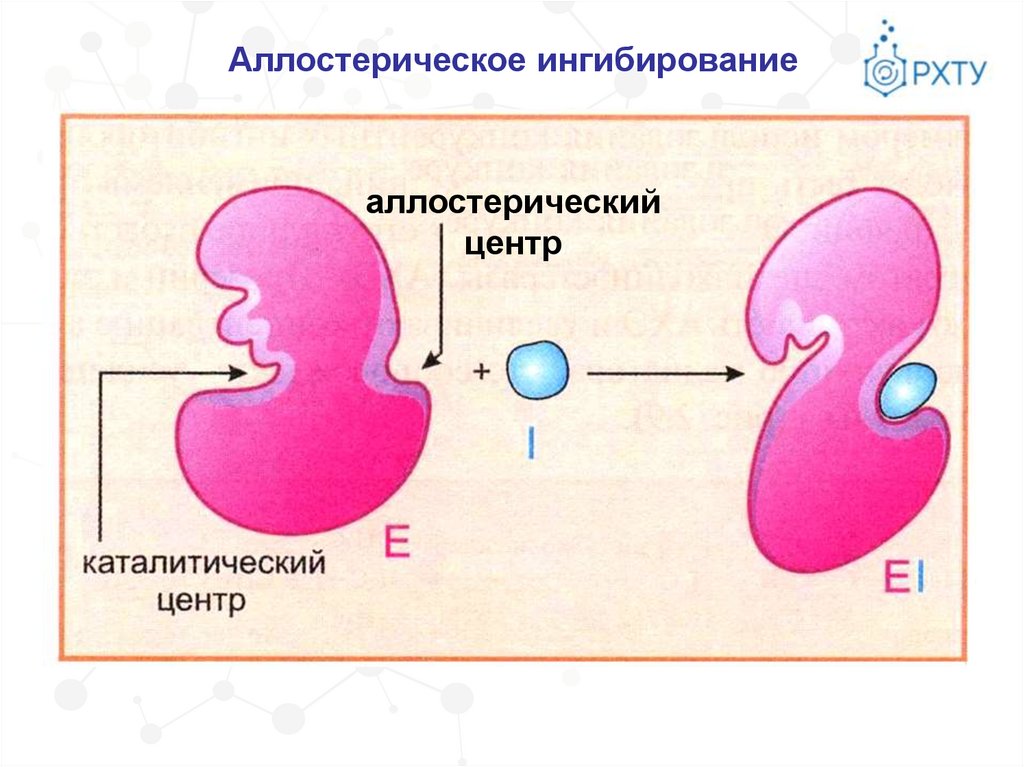
Аллостерическое ингибированиеаллостерический
центр
54.
Необратимое ингибированиеФормирование стабильного комплекса ингибитора с ферментом,
за счет образования ковалентных связей, ведущее к его
необратимой инактивации.
При необратимом ингибировании при разбавлении раствора не
происходит повышения удельной активности фермента
Необратимые ингибиторы: ионы тяжелых металлов, сильные
восстановители (арсин, фосфин), алкилаторы, ФОС
55.
Необратимое ингибированиеНеобратимое ингибирование циклооксигеназы
Необратимое ингибирование ацетилхолинэстеразы
56.
Механизм действия β-лактамных антибиотиков57.
Значение знаний о ферментах вмедицине
Индивидуальность клетки во многом определяется набором
ферментов, синтез которых генетически запрограммирован.
• Энзимопатии – патологии, обусловленные нарушением
синтеза или активности ферментов,
Возможные причины: генетически обусловленные –
врожденные; приобретенные.
• Энзимодиагностика. Диагностика, основанная на
определении активности в крови и моче ферментов
(органоспецифичные), которые являются маркерами
повреждения клеток, из которых они выходят в кровь при
повреждениях, вызванных воспалением или др. факторами.
• Энзимотерапия. Лечение больного с помощью
фармпрепаратов - ферментов










































 Биология
Биология








