Похожие презентации:
Карбоновые кислоты
1.
ПонятиеКлассификация
Номенклатура
Изомерия
Получение
Физические свойства
Химические свойства
Применение
2.
Карбоновыми кислотами называются производныеуглеводородов, в молекуле которых содержится
одна или несколько карбоксильных групп –COOH.
Общая формула карбоновых кислот:
Общая формула предельных одноосновных кислот:
СnH2n+1COOH (или СnH2nO2).
3.
Классификация карбоновых кислотКислоты
Одноосновные
Двухосновные
Трехосновные
4.
Классификация карбоновых кислотКислоты
Предельные
Непредельные
СН2=СН—СООН
пропеновая (акриловая)
кислота
Ароматические
5.
Номенклатура6.
Количество карбоксильных группуказывается в названии префиксами диили три-
7.
8.
ИзомерияДля алифатических кислот - изомеризация углеводородного
радикала.
Для ароматических - изомерия положения заместителя при
бензольном кольце.
Межклассовая изомерия со сложными эфирами
(например, CH3-COOH и HCOO-CH3).
9.
Получение1. Окисление альдегидов (кислородом на катализаторе; KMnO4;
K2Cr2O7):
2. Каталитическое окисление алканов:
2CH4 + 3O2 → 2H–COOH + 2H2O
10.
Получение3. Гидролиз сложных эфиров:
4. Гидролиз нитрилов:
5. Ароматические кислоты синтезируют окислением
гомологов бензола: в качестве окислителя можно
использовать растворы KMnO4 или K2Cr2O7 в кислой среде:
5C6H5CH3 + 6KMnO4 + 9H2SO4 → 5C6H5COOH + 3K2SO4
+
6MnSO4 + 14H2O
11.
Физическиесвойства
С - С жидкости с характерным резким запахом
1
3
С4- С9 вязкие маслянистые жидкости с неприятным запахом
С С10
твердые нерастворимые вещества
Карбоновые кислоты имеют аномально высокие температуры
кипения из-за наличия межмолекулярных водородных связей и
существуют в основном в виде димеров .
С ростом относительной молекулярной массы
температура кипения предельных одноосновных
кислот увеличивается
12.
1. Карбоновые кислоты- слабые электролиты, в водном растворе диссоциируют:Химические свойства
-
R–COOH = R–COO + H+
2. Взаимодействие с металлами:
2СH3COOH + Mg → (CH3COO)2Mg + H2
3. Взаимодействие с основными оксидами:
2СH3COOH + СaO → (CH3COO)2Ca + H2O
4. Взаимодействие с основаниями:
H–COOH + NaOH → H–COONa + H2O
13.
5. Взаимодействие с солями более слабых и летучих кислот:2СH3CH2COOH + Na2CO3
→ 2CH CH COONa + H O + CO
3
2
2
6. Взаимодействие со спиртами (этерификация):
CH3COOH+ C2H5OH =
CH3COOC2H5 + H2O
2
14.
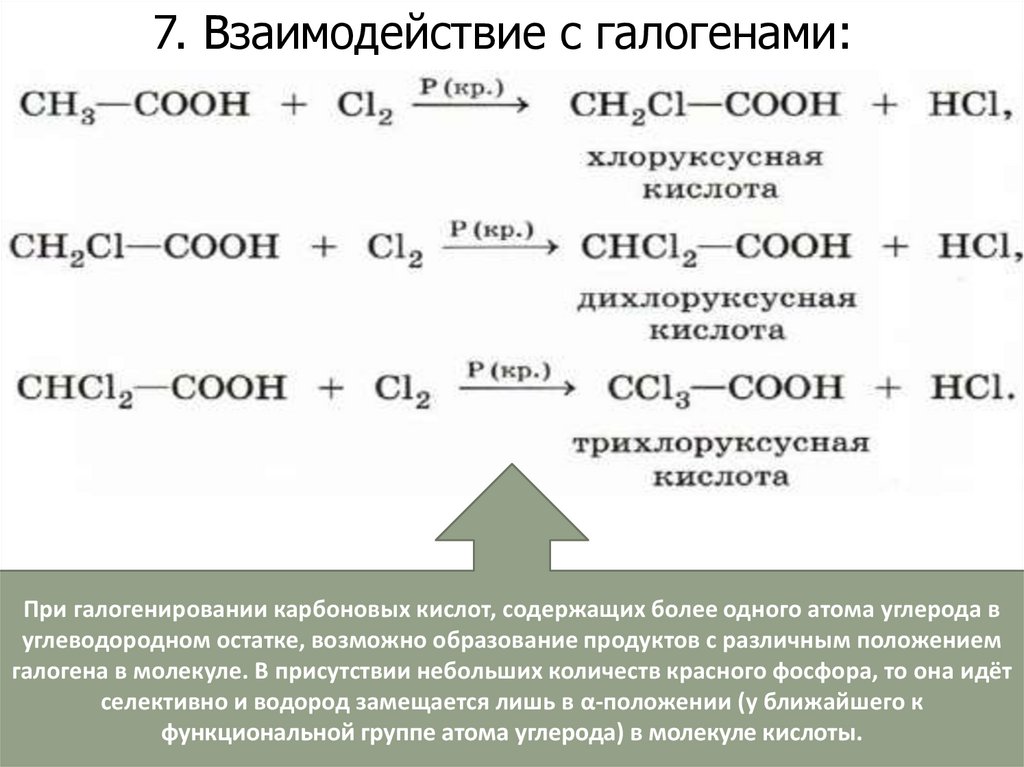
7. Взаимодействие с галогенами:При галогенировании карбоновых кислот, содержащих более одного атома углерода в
углеводородном остатке, возможно образование продуктов с различным положением
галогена в молекуле. В присутствии небольших количеств красного фосфора, то она идёт
селективно и водород замещается лишь в α-положении (у ближайшего к
функциональной группе атома углерода) в молекуле кислоты.
15.
8. Реакции присоединения по кратнойсвязи характерны для непредельных
карбоновых кислот
16.
9. Взаимодействие с галогенидаминеметаллов
17.
18.
19.
ПрименениеМасляная кислота – для получения ароматизирующих
добавок, пластификаторов и флотореагентов.
Щавелевая кислота – применяется при полировке
металлов, в деревообрабатывающей и кожевенной
промышленности.
Стеариновая C17H35COOH и пальмитиновая кислота
C15H31COOH – в качестве поверхностно-активных веществ,
смазочных материалов в металлообработке.
20.
Пятна ржавчины можно удалить раствором уксусной кислоты.Составьте молекулярные и ионные уравнения происходящих при
этом реакций, учитывая, что ржавчина содержит оксид и
гидроксид железа (III) — Fe2O3 и Fe(OH)3. Почему такие пятна не
удаляются водой? Почему они исчезают при обработке
раствором кислоты?
21.
Расположите следующие кислоты:уксусную, пропионовую, хлоруксусную,
дихлоруксусную и трихлоруксусную в
порядке усиления кислотных свойств.
Обоснуйте своё мнение.
22.
Образец предельной одноосновной органическойкислоты массой 3,7 г нейтрализовали водным
раствором гидрокарбоната натрия. При пропускании
выделившегося газа через известковую воду было
получено 5 г осадка. Какая кислота была взята?
Вычислите объём выделившегося газа.
Ответ: С2Н5СООН; 1,12 л СO2.
23.
Соли карбоновых кислот широко используются в пищевойпромышленности в качестве пищевых добавок. Они
выполняют роль консервантов, стабилизаторов,
регуляторов кислотности. Назовите соли, формулы и коды
которых представлены ниже.
По составу напитков и продуктов, представленному на
этикетках, определите, какие из них содержат
перечисленные пищевые добавки.






















 Химия
Химия








