Похожие презентации:
Самоспалахування. Фактори, що впливають на температуру самоспалахування. Лекція 5
1. Розділ II. ВИНИКНЕННЯ ПРОЦЕСУ ГОРІННЯ
Тема 4. САМОСПАЛАХУВАННЯГОРЮЧИХ СИСТЕМ.
Лекція 5
САМОСПАЛАХУВАННЯ.
ФАКТОРИ, ЩО ВПЛИВАЮТЬ НА
ТЕМПЕРАТУРУ САМОСПАЛАХУВАННЯ
2. План лекції
1. Теорії, що пояснюють процес самоспалахування2. Температура самоспалахування речовин.
Фактори, що впливають на температуру
самоспалахування
3. Визначення температури самоспалахування
горючих речовин.
4. Практичне значення температури самоспалахування.
3. 1. ТЕОРІЇ, ЩО ПОЯСНЮЮТЬ ПРОЦЕС САМОСПАЛАХУВАННЯ
Самоспалахування–
виникнення
горіння внаслідок різкого збільшення
швидкості екзотермічних реакцій під
впливом зовнішнього нагріву всієї горючої
системи до критичної температури у
відсутності джерела запалювання.
Горіння при самоспалахуванні
гомогенним, кінетичним.
є
4. 1.1. Теплова теорія самоспалахування
За тепловою теорією умовою виникненнягоріння є досягнення критичної температури в
системі, за якої інтенсивність виділення тепла в
ході
реакції
окислення
перебільшує
інтенсивність віддачі тепла від системи в
навколишнє середовище:
q(+) > q(–)
Виділення тепла обумовлено протіканням
хімічної реакції окислення:
q(+) = QнVгс хр
Віддача тепла виникає за рахунок конвекційної
теплопередачі від нагрітого тіла:
q(–) = S (Т – То).
5.
Температура самонагрівання - найменшатемпература горючої системи, при якій виникає
самовільне підвищення температури за рахунок
протікання внутрішніх екзотермічних реакцій.
6.
Інтенсивність тепловиділення:q( ) Vгс Q н хр
E
m n
q( ) Q н Vгс гр ок k о exp акт
RT
Графік зміни швидкості тепловиділення q(+) з
температурою відображається експоненційною
кривою.
Інтенсивність тепловіддачі:
q(-) = (Тсс - То) Sтв
Графік зміни швидкості тепловіддачі із зміною
температури Т відображається прямою, що проходить через точку (То, 0).
7.
Критичні умови виникнення горіння: q(+) = q(–);dq( )
dT T
cc
dq( )
;
dT T
cc
d 2 q( )
dT
0.
2
Tcc
8.
Період часу з початку перевищення температуригорючої системи над температурою навколишнього середовища до моменту виникнення горіння
називається періодом індукції або часом індукції.
9. 1.2. Ланцюгова теорія самоспалахування
За ланцюговою теорією виникнення горіння(тобто різке збільшення швидкості реакції
окислення) є наслідком накопичення в системі
каталізуючих продуктів реакції - активних
центрів (АЦ) - атоми, радикали або активні
молекули, які мають енергію більшу, ніж енергія
активації, що обумовлює їх високу реакційну
спроможність.
активація
ланцюг .реакція
ГР Ок
АЦ ПГ
Ланцюговими називають процеси, у яких
перетворення вихідних речовин у продукти
реакції
здійснюється
шляхом
регулярного
чергування декількох реакцій за участю АЦ.
10. ТИПИ ЛАНЦЮГОВИХ РЕАКЦІЙ
Зародження (ініціювання) ланцюгів - стадіяланцюгової реакції, в якій утворюються вільні
радикали з валентнонасичених молекул:
Н2 + О2 = Н* + НО2
Продовження ланцюга - стадія ланцюгової
реакції, що йде із збереженням вільної
валентності (один АЦП вступає в реакцію,
внаслідок якої один АЦП утворюється):
ОН* + Н2 = Н2О + Н*
11.
Розгалуження ланцюгів - стадія ланцюговогопроцесу, у якій перетворення активних
проміжних продуктів реакції призводить до
збільшення числа вільних радикалів (один АЦП
вступає в реакцію, внаслідок якої утворюється
два чи більше АЦП):
Н* + О2 = ОН* + *О*
Обрив ланцюга - стадія ланцюгового процесу,
що призводить до зникнення вільної валентності.
Н* + ОН* + М = Н2О + М
12. Схема нерозгалуженої та розгалуженої ланцюгової реакції
O2 + Е =2О*
*
Cl2 + h = 2Cl
*
*
*
*
H2 + Cl = HCl + H
Cl2 + H = HCl + Cl
*
*
*
*
*
*
H2 + O = OH + H
O2 + H = OH + H
13.
Швидкість ланцюгової реакції:dn
лр
o f g
d
де n – концентрація активних центрів,
о - швидкість початкового ініціювання (утворення) АЦ,
f - швидкість розгалуження ланцюга;
g - швидкість обриву ланцюга.
Умовою самоспалахування є перебільшення
швидкості реакції розгалуження над швидкістю
обриву ланцюга f >> g. При цьому загальна
швидкість процесу лр різко збільшується, реакція
окислення переходить у процес горіння.
Спалахування відбувається після періоду індукції часу, за який концентрація АЦ в системі досягне
критичного значення (внаслідок протікання реакцій
зародження й розгалуження).
14. 2. ТЕМПЕРАТУРА САМОСПАЛАХУВАННЯ (Тсс). ФАКТОРИ, ЩО ВПЛИВАЮТЬ НА Тсс.
Температура самоспалахування - найменшатемпература системи, при якій відбувається різке
збільшення швидкості екзотермічної реакції, що
призводить до появи полум'яного горіння.
Тсс = Tо + RTо2/Еакт
15.
На Tсс речовин впливають три групи факторів:1) вид горючої речовини
середня довжина вуглецевого ланцюга lсер;
теплотворна здатність горючої речовини Qн.
2) склад горючої суміші
концентрація горючої речовини в суміші гр;
вміст кисню в окислювальному середовищі О2;
наявність негорючих газів в суміші нг;
присутність каталізаторів або інгібіторів горіння.
3) умови, в яких знаходиться горюча суміш
площа тепловіддачі S;
об'єм Vгс і діаметр посудини d;
коефіцієнт тепловіддачі ;
тиск в системі Р;
початкова температура суміші Т0
16. 2.1. Хімічна будова горючої речовини
При збільшенні енергії розриву зв'язку реакціяокислення, а отже й процес самонагрівання йдуть
повільніше, Tсс підвищується.
гексан
бензол
C6H14 Tсс = 534К
C6H6 Tсс = 864К
Сполуки з ненасиченими зв'язками окислюються
легше, ніж насичені вуглеводні з таким самим
числом атомів карбону, отже і Tсс нижче.
бутан
бутилен
C4H10 Tсс = 704 К
C4H8 Tсс = 657 К
Для вуглеводнів ізомерної будови із збільшенням
розгалужень в молекулі Tсс підвищується.
бутан
ізобутан
C4H10 Tсс = 704 К
C4H10 Tсс = 749 К
17.
18. 2.2. Склад горючої суміші
Концентрація горючої речовиниq(+)=QнVгсwхр
Найбільша швидкість хімічної реакції, а отже і
тепловиділення в системі, спостерігаються за
стехіометричної концентрації горючої речовини.
Цій концентрації відповідає мінімальна Тсс.
1 моль ГР + (1 моль О2 + 3,76 моль N2) - 100 %
1 моль ГР
- стм %
в повітрі:
в кисні:
остм
100
,%
1 4,76
100
о
стм
,%
1
19.
Існують такі концентрації горючої речовини( гр< н або гр> в), за яких тепловиділення в
системі буде недостатнім для самонагрівання і
подальшого самоспалахування.
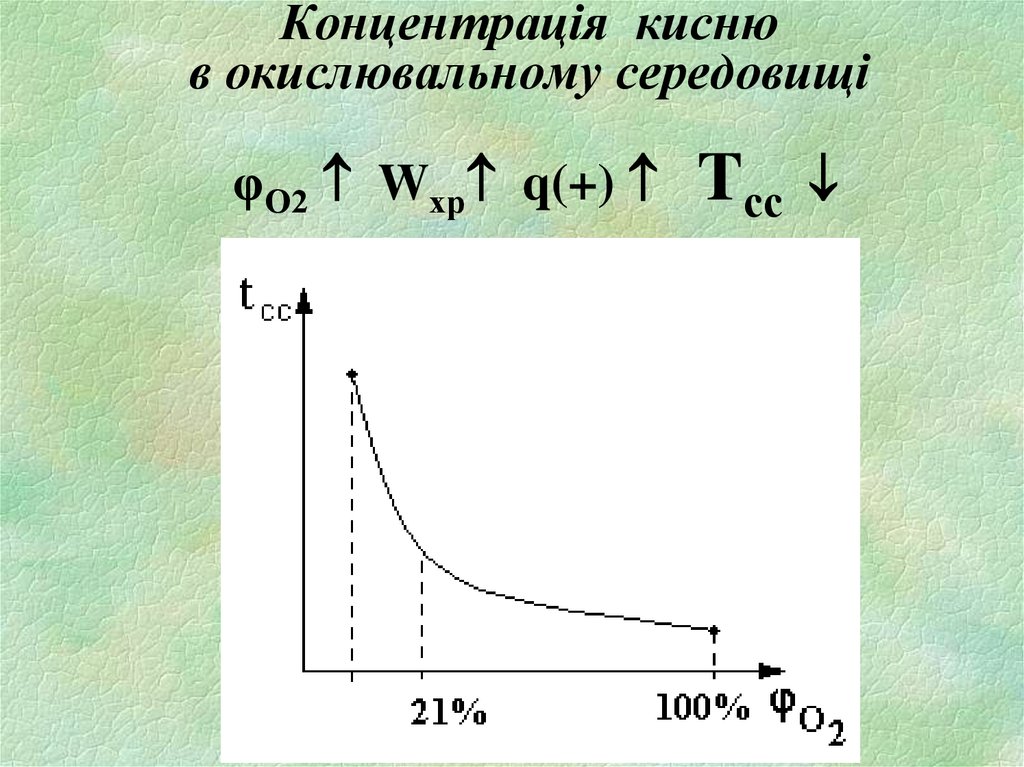
20. Концентрація кисню в окислювальному середовищі φО2 Wхр q(+) Tсс
Концентрація киснюв окислювальному середовищі
φО2 Wхр q(+)
Tсс
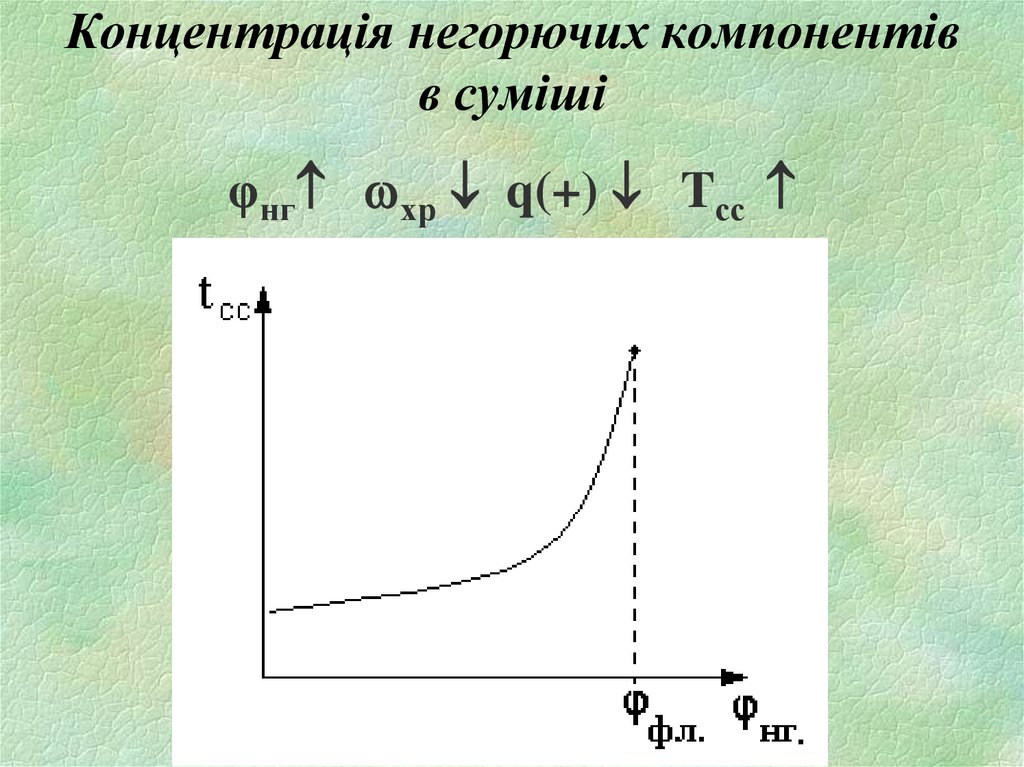
21. Концентрація негорючих компонентів в суміші
φнг хр q(+) Tсс22. 2.3. Умови, в яких знаходиться система
Об'єм і діаметр посудини.q(+) = QнVгсwхр
Vгс d3
q(-) = S(Тсс - То)
S d2
визначальний розмір
S/V d2/d3 1/d d
S/V
q(-)
Tсс
Вогнеперешкоджувач розбиває горючу систему на
маленькі об'єми і різко збільшує площу
тепловіддачі. При цьому Tсс горючої системи
різко збільшується і запалити таку суміш вже
практично неможливо.
23. 3. ВИЗНАЧЕННЯ Тсс
Експериментальні методи1) метод впускання заздалегідь готової
холодної суміші у вакуумовану нагріту
посудину;
2) метод адіабатичного стиснення заздалегідь
готової суміші;
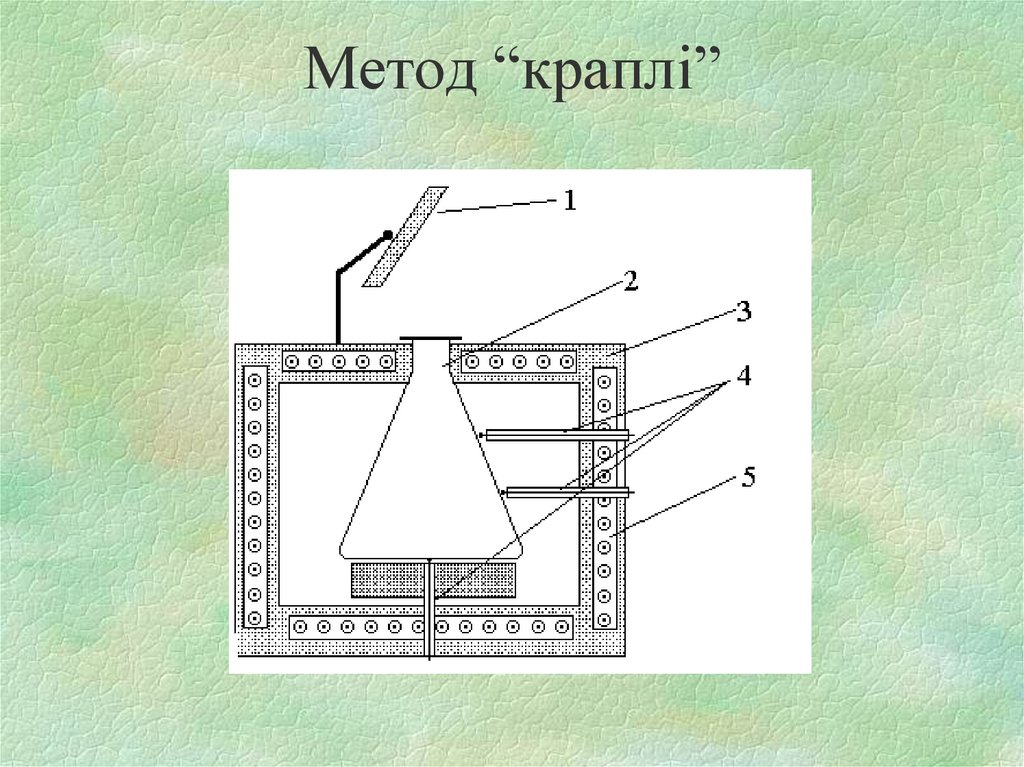
3) метод “краплі”, коли горюча суміш
утворюється в нагрітій посудині за рахунок
випаровування горючої речовини.
24. Метод “краплі”
25. Розрахункове визначення Tсс
при lcеp 5t cc 300 116 5 l cеp
при lcеp 5
t cc 300 38 l cеp 5
li
lсер
і
n ланц
Ланцюг - безперервна послідовність пов'язаних
атомів карбону, що починається і закінчується
кінцевими групами (m).
nланц = 0,5 m (m - 1 ).
26. Залежність tсс вуглеводнів від ефективної довжини вуглецевого ланцюга
lcp3,0
3,1
3,2
3,3
3,4
3,5
3,6
3,7
3,8
3,9
4,0
tcс
470
465
460
455
450
444
439
433
426
420
413
lcp
6,1
6,2
6,3
6,4
6,5
6,6
6,7
6,8
6,9
7,0
7,1
tcс
232
231
230
229
228
227
226
225
224
223
222
lcp
9,1
9,2
9,3
9,4
9,5
9,6
9,7
9,8
9,9
10,0
10,1
tcс
208
208
208
207
207
207
207
206
206
206
206
lcp
12,1
12,2
12,3
12,4
12,5
12,6
12,7
12,8
12,9
13,0
13,1
tcс
204
204
204
204
204
204
204
204
204
204
204
27.
Температуру самоспалахування інших класіворганічних сполук можна розрахувати за
формулою:
tсс = а tссалк + b
де a, b - константи гомологічного ряду
tссалк- температура самоспалахування алкана.
Сполуки
а
b
Спирти
0,6796
121,2
Ароматичні сполуки
0,6412
252,9
Форміати
0,7719
81,5
Ацетати
0,7909
52,0
Кислоти
0,7556
86,0
28. 4. Практичне значення температури самоспалахування
Тсс використовуютьдля оцінки пожежної небезпеки речовин
Чим нижче температура самоспалахування
речовини, тим легше виникне горіння, і, отже,
тим вище її пожежна небезпека
для
визначення
допустимої
(безпечної)
температури нагріву робочих поверхонь
технологічного обладнання
tбезп =0,8 tсс
29.
Для визначення групи вибухонебезпечнихсумішей газів з повітрям при виборі
вибухозахищеного енергоустаткування
Група вибухонебезпечних сумішей
Т1
Т2
Т3
Т4
Т5
Т6
Тсс, оС
більше за 450
300-450
200-300
135-200
100-135
85-100
30. Завдання на самопідготовку:
1. Вивчити матеріал1. Демидов, Шандыба, Щеглов:- Горение
и свойства горючих веществ, стор. 42-64.
2.Демидов, Саушев. Горение и свойства
горючих веществ, стор. 70-103.



























 Химия
Химия








