Похожие презентации:
Механизмы резистентности при хроническом миелоидном лейкозе
1.
Механизмырезистентности
при хроническом
миелоидном
лейкозе
Смирнова Анастасия, V курс
2020
2.
Хроническиймиелоидный
лейкоз
–
клональное
миелопролиферативное заболевание стволовой клетки, в основе
которого лежит хромосомная транслокация (9,22) с образованием
химерного белка BCR-ABL, кодирующего мутантную тирозинкиназу,
что приводит к постоянной и неконтролируемой пролиферации
клеток гранулоцитарного ряда, нарушению дифференцировки и
снижению апоптоза
( д.м.н., проф., Афанасьев Б.В.)
3.
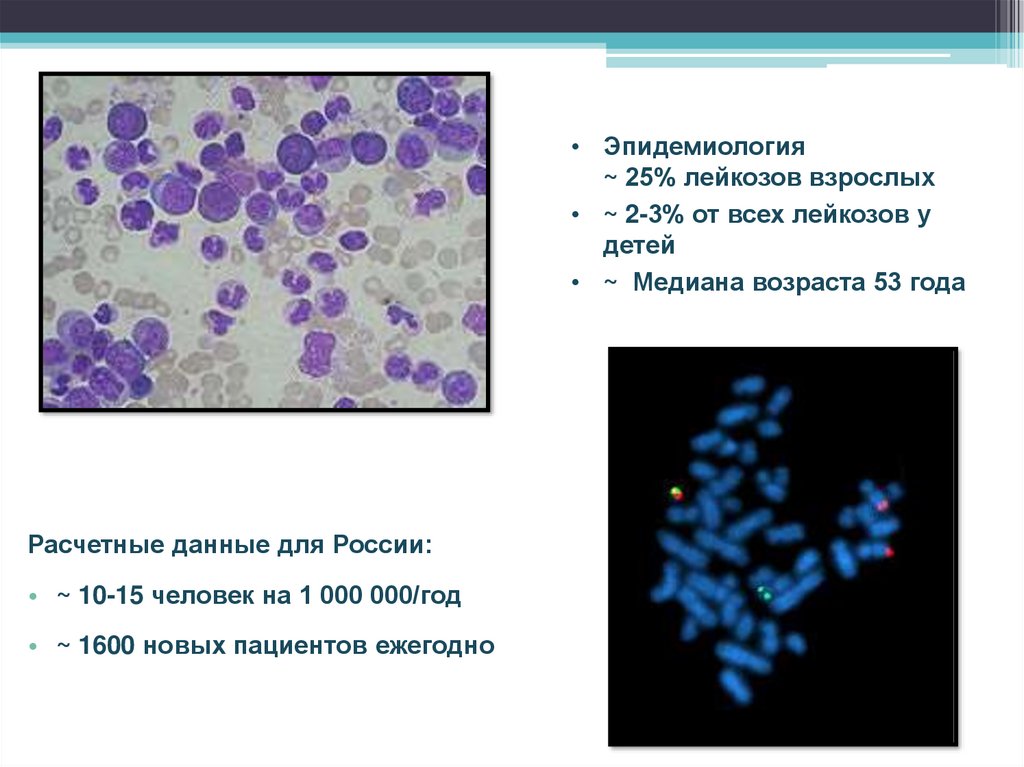
• Эпидемиология~ 25% лейкозов взрослых
• ~ 2-3% от всех лейкозов у
детей
• ~ Медиана возраста 53 года
Расчетные данные для России:
• ~ 10-15 человек на 1 000 000/год
• ~ 1600 новых пациентов ежегодно
4.
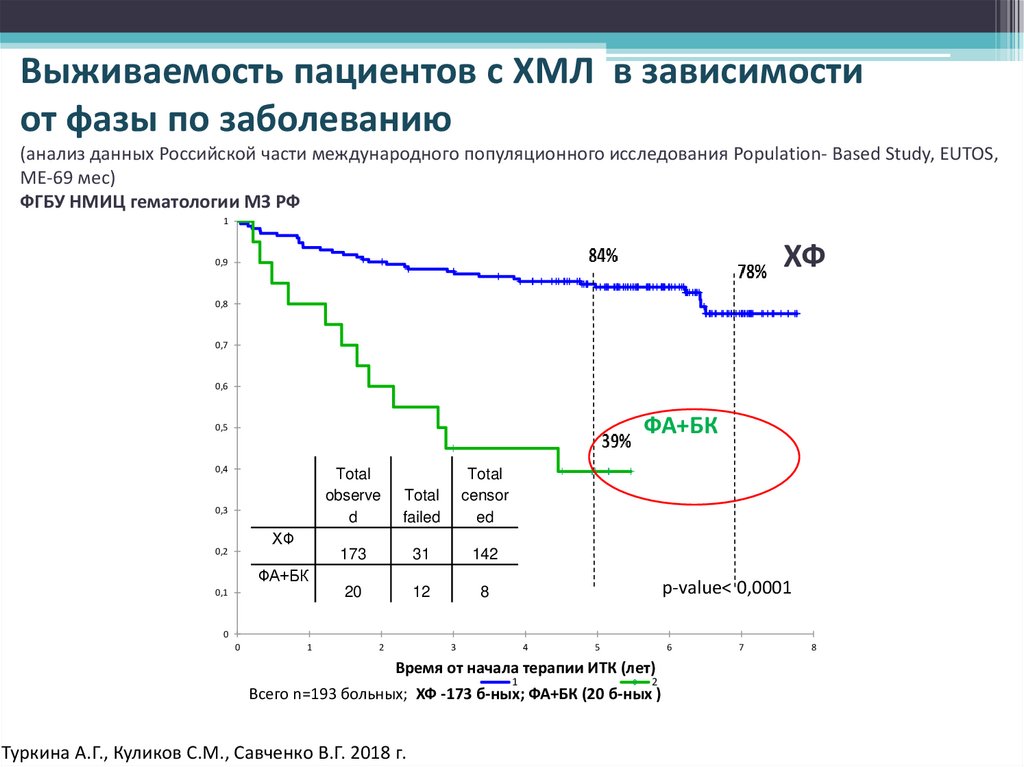
Выживаемость пациентов с ХМЛ в зависимостиот фазы по заболеванию
(анализ данных Российской части международного популяционного исследования Population- Based Study, EUTOS,
МЕ-69 мес)
ФГБУ НМИЦ гематологии МЗ РФ
1
ХФ
0,9
0,8
0,7
0,6
ФА+БК
0,5
0,4
0,3
Total
observe
d
Total
failed
Total
censor
ed
173
31
142
20
12
8
ХФ
0,2
ФА+БК
0,1
p-value< 0,0001
0
0
1
2
3
4
5
6
Время от начала терапии ИТК (лет)
1
2
Всего n=193 больных; ХФ -173 б-ных; ФА+БК (20 б-ных )
Туркина А.Г., Куликов С.М., Савченко В.Г. 2018 г.
7
8
5.
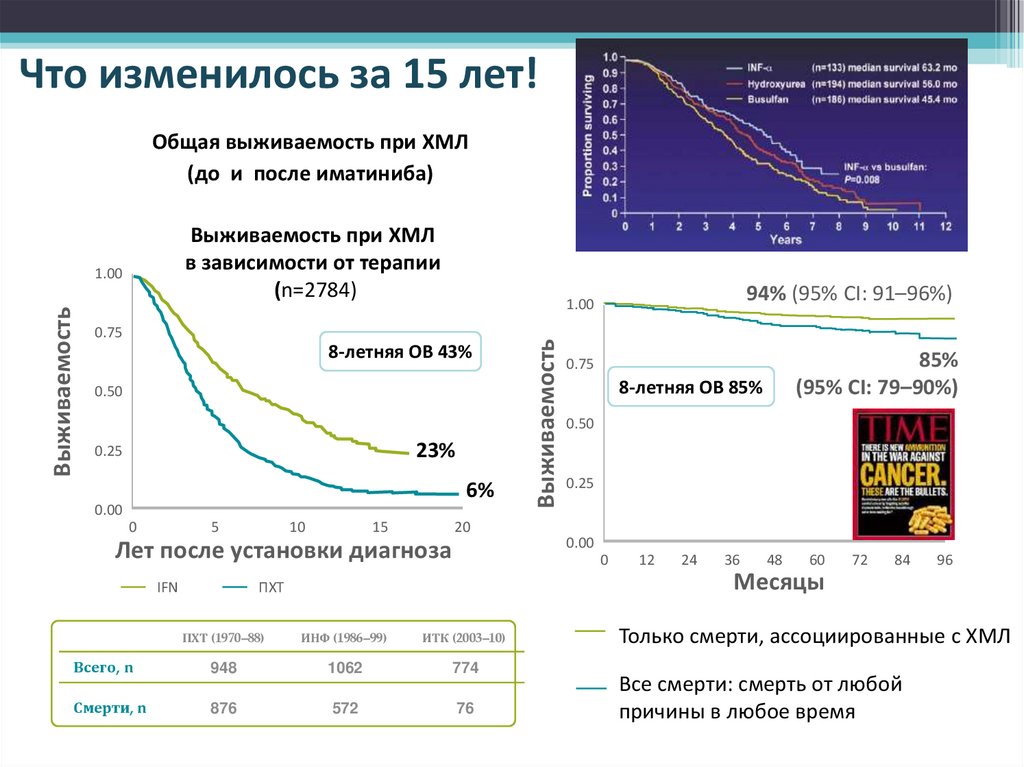
Что изменилось за 15 лет!Общая выживаемость при ХМЛ
(до и после иматиниба)
Выживаемость при ХМЛ
в зависимости от терапии
(n=2784)
0.75
8-летняя ОВ 43%
0.50
23%
0.25
6%
0.00
0
5
10
15
85%
(95% CI: 79–90%)
0.75
8-летняя ОВ 85%
0.50
0.25
20
0.00
Лет после установки диагноза
IFN
94% (95% CI: 91–96%)
1.00
Выживаемость
Выживаемость
1.00
0
12
24
36
48
60
72
84
96
Месяцы
ПХТ
ПХТ (1970–88)
ИНФ (1986–99)
ИТК (2003–10)
Всего, n
948
1062
774
Смерти, n
876
572
76
Только смерти, ассоциированные с ХМЛ
Все смерти: смерть от любой
причины в любое время
6.
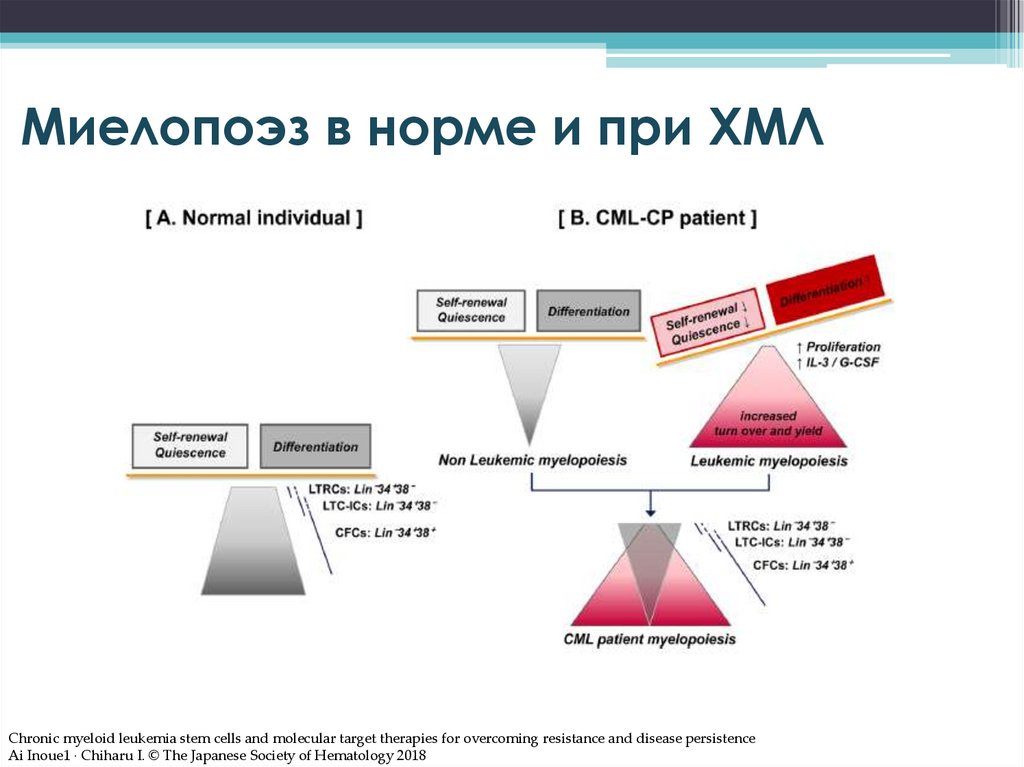
Миелопоэз в норме и при ХМЛChronic myeloid leukemia stem cells and molecular target therapies for overcoming resistance and disease persistence
Ai Inoue1 · Chiharu I. © The Japanese Society of Hematology 2018
7.
ELN 2020Последоват
е-льность
Заболевание
Возможности терапии
1я
линия
Все пациенты
Иматиниб 400мг x 1, Нилотиниб 300мг x 2, Дазатиниб
2я
линия
Непереносимость
иматиниба
Выбор ИТК в зависимости от сопутствующих заболеваний и
Неудача на
иматинибе
Переключение с Иматиниба на другие ИТК, с учетом
100мг x 1, Бозутиниб 500 мг 1 раз в день
побочных эффектов
мутаций, сопутствующих заболеваний и побочных
эффектов
Переключение с Нилотиниба на Дазатиниб, Бозутиниб или
Понатиниб
Переключение с Дазатиниба на Нилотиниб, Бозутиниб или
Понатиниб
Аллогенная ТСК
3я
линия
Переключение на другой ИТК (Понатиниб 45мг х 1,
радотиниб, PEG-IFNa + ИТК 2 поколения)
Аллогенная ТСК
Эксперементальное лечение (клинические исследования)
Любая
линия
T315I
Понатиниб, Аллогенная ТКМ
European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia A. Hochhaus M. Baccarani Blood
8.
9.
Основная проблема лечения ХМЛРЕЗИСТЕНТНОСТЬ ЛЕЙКОЗНЫХ
СТВОЛОВЫХ КЛЕТОК К ИМАТИНИБУ И
ДРУГИМ ИТК
10.
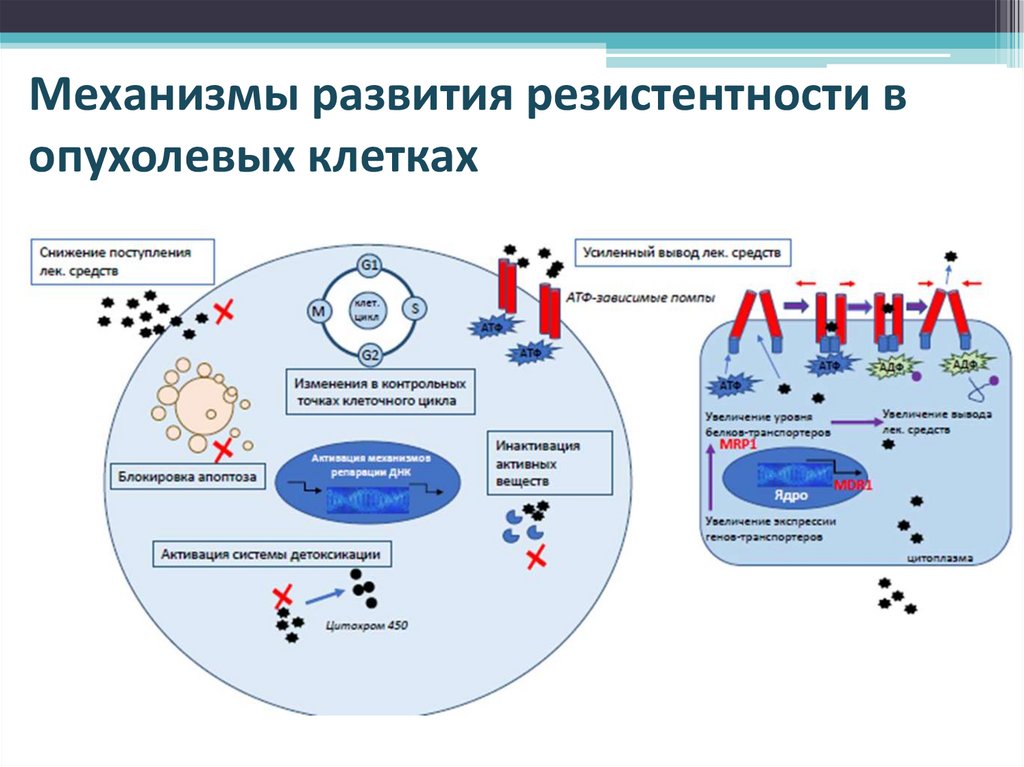
Механизмы развития резистентности вопухолевых клетках
11.
BCR-ABLзависимая
резистентность
Клеточные
автономные
факторы
Фармакокинетические
факторы
Неэффективность
ИТК
Комплаентность
Влияние
микроокружения
КМ на ЛСК
12.
Иматиниб: 8 лет наблюдения (IRIS)• 45% требуют смены терапии
Прекратили иматиниб
Большая часть отмены терапии – в первые три года
Главная причина неудачи терапии: Мутации в гене BCR-ABL
N Engl J Med 2017;376:917-27.
13.
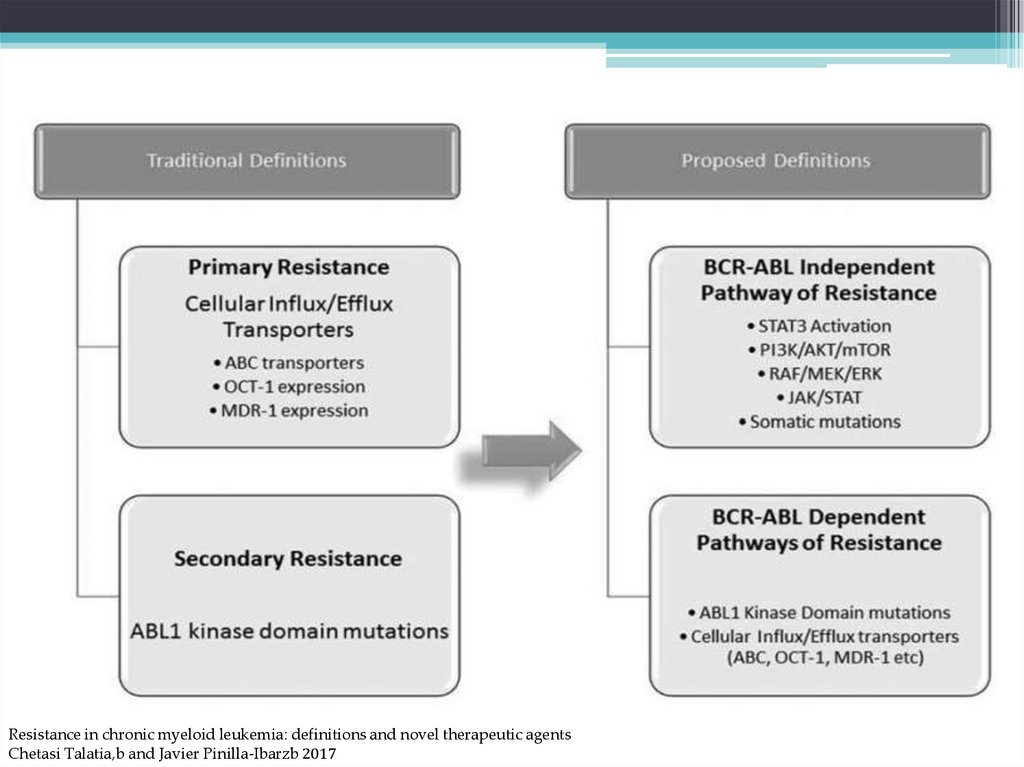
Resistance in chronic myeloid leukemia: definitions and novel therapeutic agentsChetasi Talatia,b and Javier Pinilla-Ibarzb 2017
14.
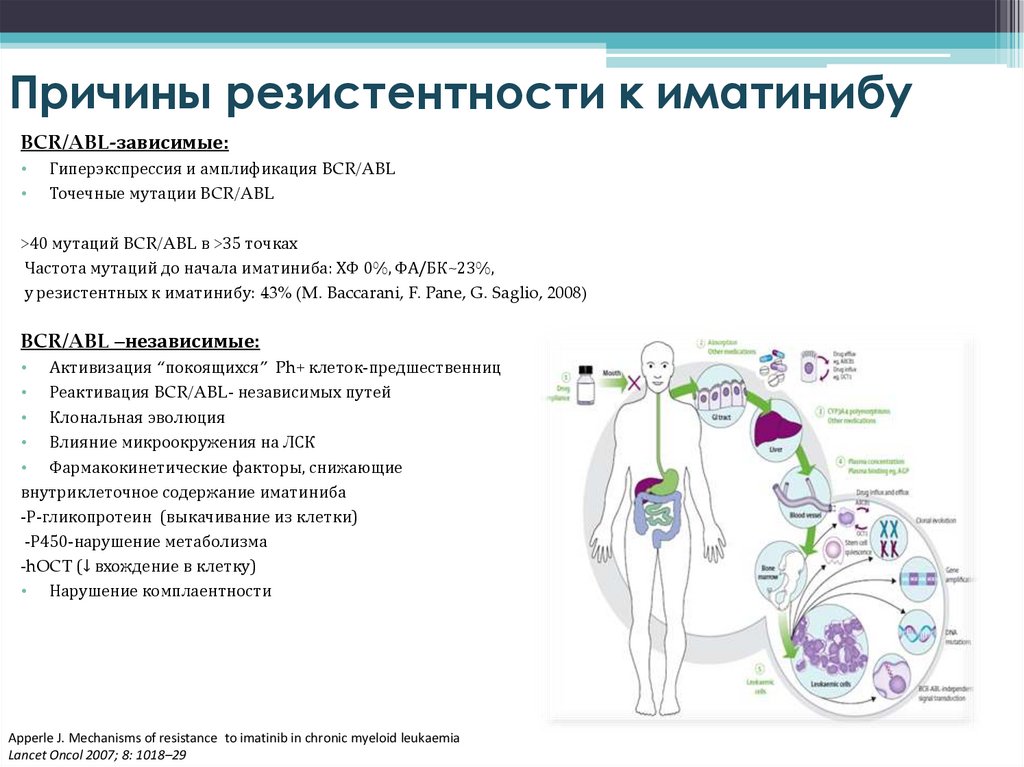
Причины резистентности к иматинибуBCR/ABL-зависимые:
Гиперэкспрессия и амплификация BCR/ABL
Точечные мутации BCR/ABL
>40 мутаций BCR/ABL в >35 точках
Частота мутаций до начала иматиниба: ХФ 0%, ФА/БК~23%,
у резистентных к иматинибу: 43% (M. Baccarani, F. Pane, G. Saglio, 2008)
BCR/ABL –независимые:
• Активизация “покоящихся” Ph+ клеток-предшественниц
• Реактивация BCR/ABL- независимых путей
• Клональная эволюция
• Влияние микроокружения на ЛСК
• Фармакокинетические факторы, снижающие
внутриклеточное содержание иматиниба
-Р-гликопротеин (выкачивание из клетки)
-Р450-нарушение метаболизма
-hOCT (↓ вхождение в клетку)
• Нарушение комплаентности
Apperle J. Mechanisms of resistance to imatinib in chronic myeloid leukaemia
Lancet Oncol 2007; 8: 1018–29
15.
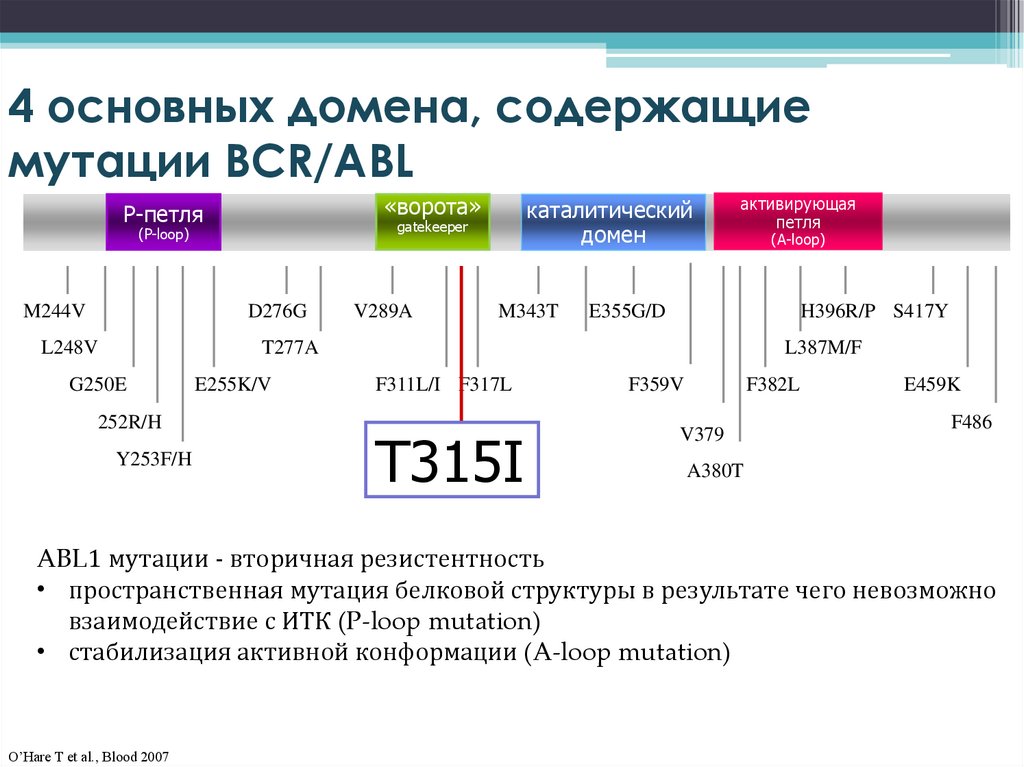
4 основных домена, содержащиемутации BCR/ABL
«ворота»
P-петля
(P-loop)
M244V
D276G
L248V
каталитический
домен
gatekeeper
V289A
M343T
T277A
G250E
Q252R/H
Y253F/H
E255K/V
активирующая
петля
E355G/D
H396R/P S417Y
M351T/V
F311L/I F317L
T315I
(A-loop)
L387M/F
F359V
F382L
V379I
E459K
F486S
A380T
ABL1 мутации - вторичная резистентность
• пространственная мутация белковой структуры в результате чего невозможно
взаимодействие с ИТК (P-loop mutation)
• стабилизация активной конформации (A-loop mutation)
O’Hare T et al., Blood 2007
16.
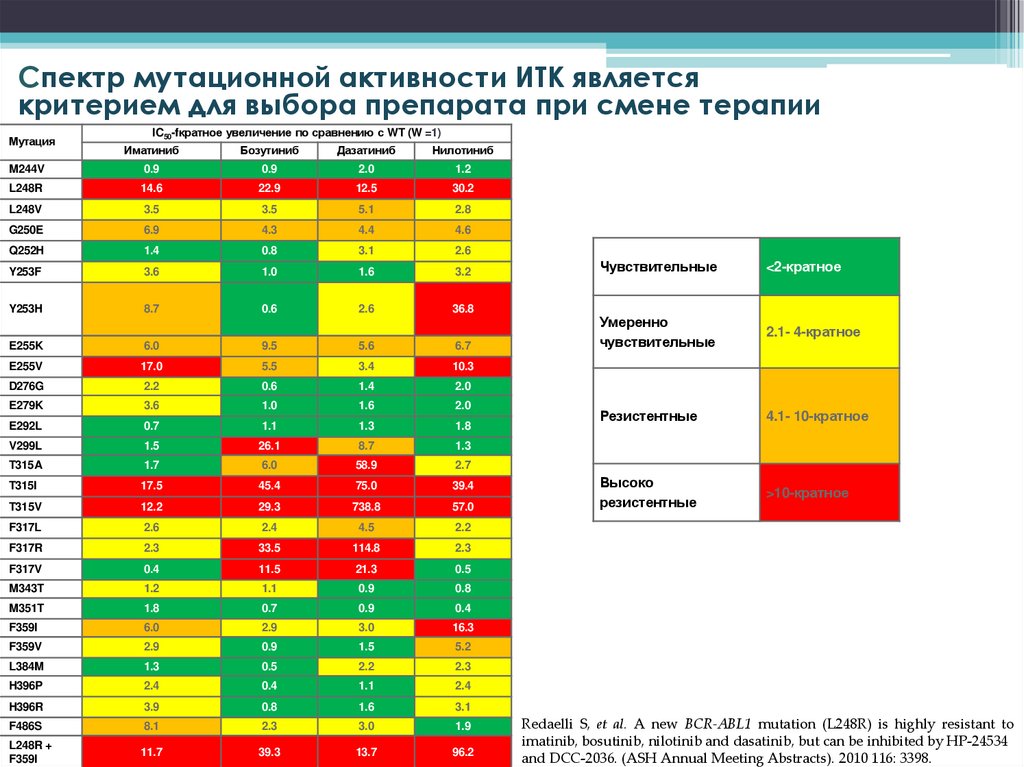
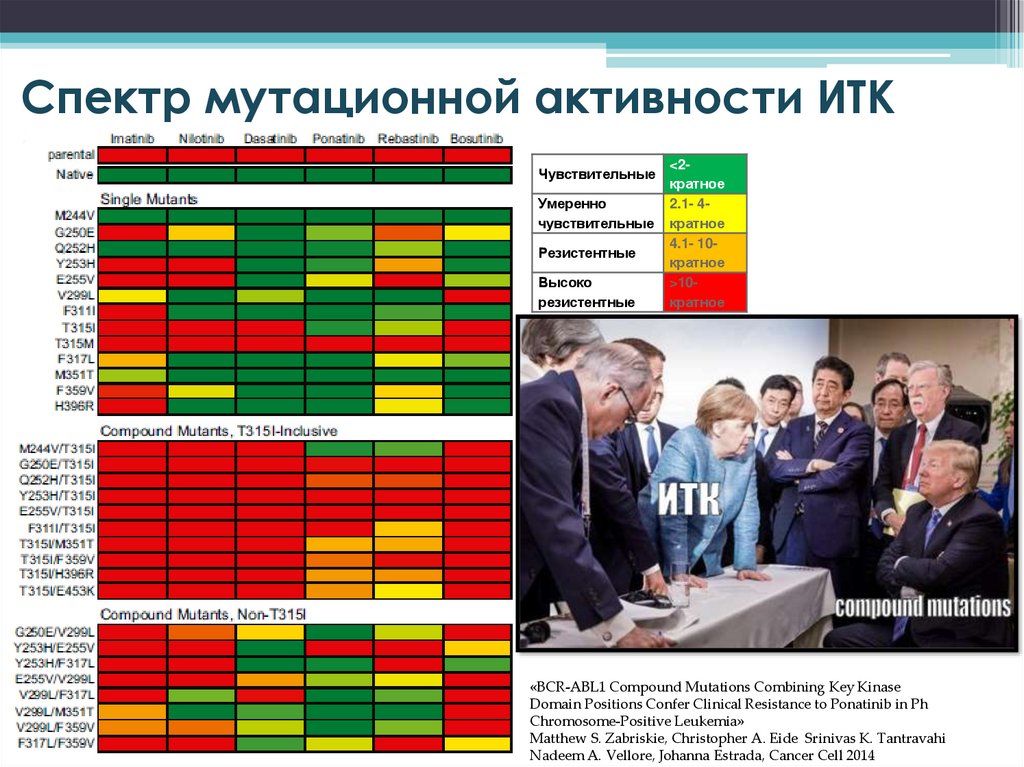
Спектр мутационной активности ИТК являетсякритерием для выбора препарата при смене терапии
Мутация
IC50-fкратное увеличение по сравнению с WT (W =1)
Иматиниб
Бозутиниб
Дазатиниб
M244V
0.9
0.9
2.0
Нилотиниб
1.2
L248R
14.6
22.9
12.5
30.2
L248V
3.5
3.5
5.1
2.8
G250E
6.9
4.3
4.4
4.6
Q252H
1.4
0.8
3.1
2.6
Y253F
3.6
1.0
1.6
3.2
Y253H
8.7
0.6
2.6
36.8
E255K
6.0
9.5
5.6
6.7
E255V
17.0
5.5
3.4
10.3
D276G
2.2
0.6
1.4
2.0
E279K
3.6
1.0
1.6
2.0
E292L
0.7
1.1
1.3
1.8
V299L
1.5
26.1
8.7
1.3
T315A
1.7
6.0
58.9
2.7
T315I
17.5
45.4
75.0
39.4
T315V
12.2
29.3
738.8
57.0
F317L
2.6
2.4
4.5
2.2
F317R
2.3
33.5
114.8
2.3
F317V
0.4
11.5
21.3
0.5
M343T
1.2
1.1
0.9
0.8
M351T
1.8
0.7
0.9
0.4
F359I
6.0
2.9
3.0
16.3
F359V
2.9
0.9
1.5
5.2
L384M
1.3
0.5
2.2
2.3
H396P
2.4
0.4
1.1
2.4
H396R
3.9
0.8
1.6
3.1
F486S
8.1
2.3
3.0
1.9
L248R +
F359I
11.7
39.3
13.7
96.2
Чувствительные
<2-кратное
Умеренно
чувствительные
2.1- 4-кратное
Резистентные
4.1- 10-кратное
Высоко
резистентные
>10-кратное
Redaelli S, et al. A new BCR-ABL1 mutation (L248R) is highly resistant to
imatinib, bosutinib, nilotinib and dasatinib, but can be inhibited by HP-24534
and DCC-2036. (ASH Annual Meeting Abstracts). 2010 116: 3398.
17.
Роль BCR-ABL в выживании ЛСК• Происхождение и поддержание Ph+ ЛСК
требует экспрессии BCR-ABL1, но не его
киназной активности.
• Другие существующие ранее или
необратимо индуцированные BCR-ABL1
генетические/эпигенетические изменения
способствуют выживанию ЛСК,
самообновлению и устойчивости к ИТК
• Экспрессия BCR-ABL приводит к
нестабильности генома СКК, ЛСК и
повреждению ДНК
«Cellular and Molecular Networks in Chronic Myeloid Leukemia: The Leukemic Stem, Progenitor and Stromal Cell Interplay»
Danilo Perrotti, Giovannino Silvestri Curr Drug Targets 2017
18.
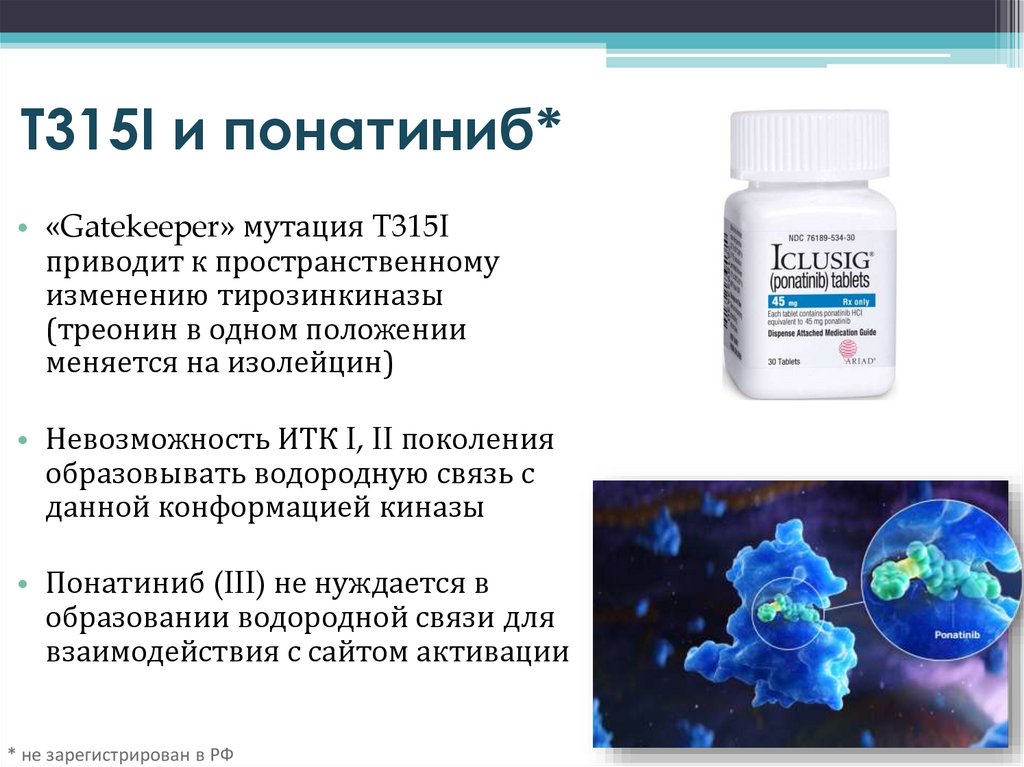
T315I и понатиниб*• «Gatekeeper» мутация T315I
приводит к пространственному
изменению тирозинкиназы
(треонин в одном положении
меняется на изолейцин)
• Невозможность ИТК I, II поколения
образовывать водородную связь с
данной конформацией киназы
• Понатиниб (III) не нуждается в
образовании водородной связи для
взаимодействия с сайтом активации
* не зарегистрирован в РФ
19.
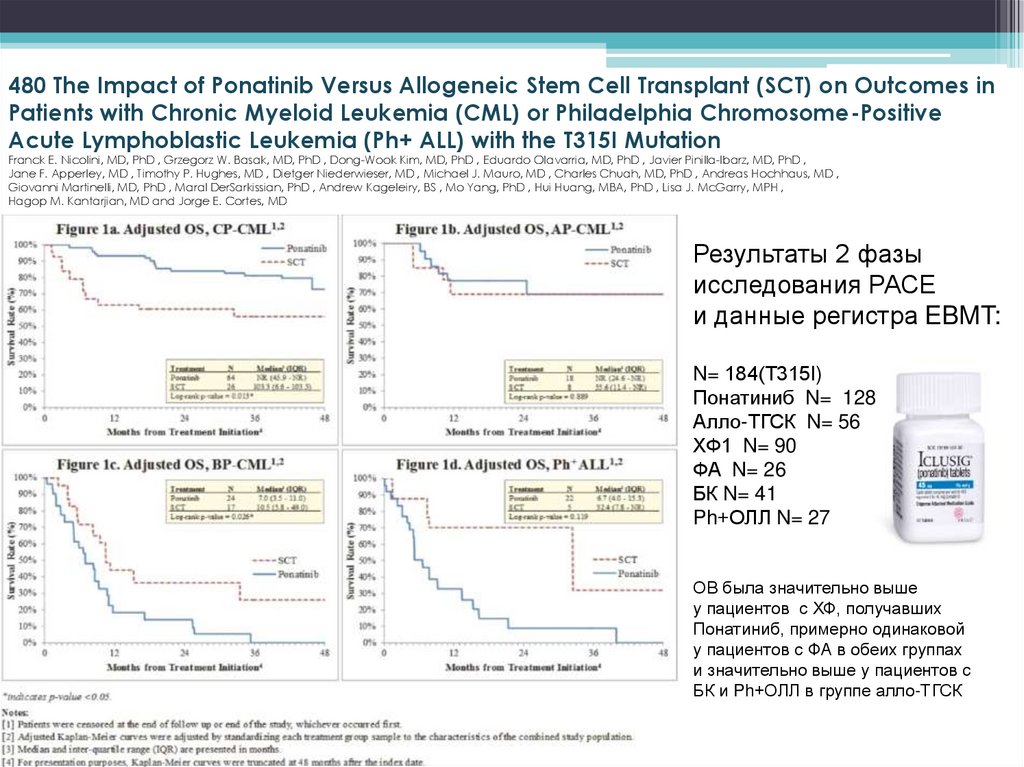
480 The Impact of Ponatinib Versus Allogeneic Stem Cell Transplant (SCT) on Outcomes inPatients with Chronic Myeloid Leukemia (CML) or Philadelphia Chromosome-Positive
Acute Lymphoblastic Leukemia (Ph+ ALL) with the T315I Mutation
Franck E. Nicolini, MD, PhD , Grzegorz W. Basak, MD, PhD , Dong-Wook Kim, MD, PhD , Eduardo Olavarria, MD, PhD , Javier Pinilla-Ibarz, MD, PhD ,
Jane F. Apperley, MD , Timothy P. Hughes, MD , Dietger Niederwieser, MD , Michael J. Mauro, MD , Charles Chuah, MD, PhD , Andreas Hochhaus, MD ,
Giovanni Martinelli, MD, PhD , Maral DerSarkissian, PhD , Andrew Kageleiry, BS , Mo Yang, PhD , Hui Huang, MBA, PhD , Lisa J. McGarry, MPH ,
Hagop M. Kantarjian, MD and Jorge E. Cortes, MD
Результаты 2 фазы
исследования РАСЕ
и данные регистра EBMT:
N= 184(Т315I)
Понатиниб N= 128
Алло-ТГСК N= 56
ХФ1 N= 90
ФА N= 26
БК N= 41
Ph+ОЛЛ N= 27
ОВ была значительно выше
у пациентов с ХФ, получавших
Понатиниб, примерно одинаковой
у пациентов с ФА в обеих группах
и значительно выше у пациентов с
БК и Ph+ОЛЛ в группе алло-ТГСК
20.
Проблема резистентности кпонатинибу
По результатам 2 фазы клинического исследования PACE
(Ponatinib Ph+ ALL and CML Evaluation)
• в ХФ у 70 % пациентов с мутацией T315I был достигнут
ПЦГО
• в ФА у 52 % , в БК у 31 %
«Resistant mutations in CML and Ph+ALL – role of ponatinib» Geoffrey D Miller,Benjamin J Bruno,Carol S Lim Department of Pharmaceutics and
Pharmaceutical Chemistry, College of Pharmacy, University of Utah, Salt Lake City, Utah, USA, Biologics Targets and Therapy, 20 October 2014
Причины
• Сочетанные мутации (compound mutations) в BCR-ABL
• Активация альтернативных путей (клеточные автономные факторы),
которые ведут к блокировке апоптоза у клеток, несмотря на
ингибирование BCR-ABL
«Mechanisms of resistance to ponatinib therapy in chronic myeloid leukemia»
O'Hare, Thomas J. Deininger, Michael W. University of Utah, Salt Lake City, UT, United States 2017
21.
Спектр мутационной активности ИТКЧувствительные
Умеренно
чувствительные
Резистентные
Высоко
резистентные
<2кратное
2.1- 4кратное
4.1- 10кратное
>10кратное
«BCR-ABL1 Compound Mutations Combining Key Kinase
Domain Positions Confer Clinical Resistance to Ponatinib in Ph
Chromosome-Positive Leukemia»
Matthew S. Zabriskie, Christopher A. Eide Srinivas K. Tantravahi
Nadeem A. Vellore, Johanna Estrada, Cancer Cell 2014
22.
Микроокружение и ЛСК• Стволовые клетки/ клетки-предшественники
ХМЛ реконструируют нишу костного мозга,
это приводит к сдвигу нормального гемопоэза
в сторону лейкемического.
• Достигается за счет аберрантного
перепрограммирования мезенхимальных
стромальных клеток.
• Обусловлено продукцией цитокинов и
хемокинов (например, MIP1α, MIP1β, IL-1β, IL4, IL-6, TNFα, CXCL12, LIF, BMP2 / 4)
«Cellular and Molecular Networks in Chronic Myeloid Leukemia: The Leukemic Stem, Progenitor and Stromal Cell Interplay»
Danilo Perrotti, Giovannino Silvestri Curr Drug Targets 2017
23.
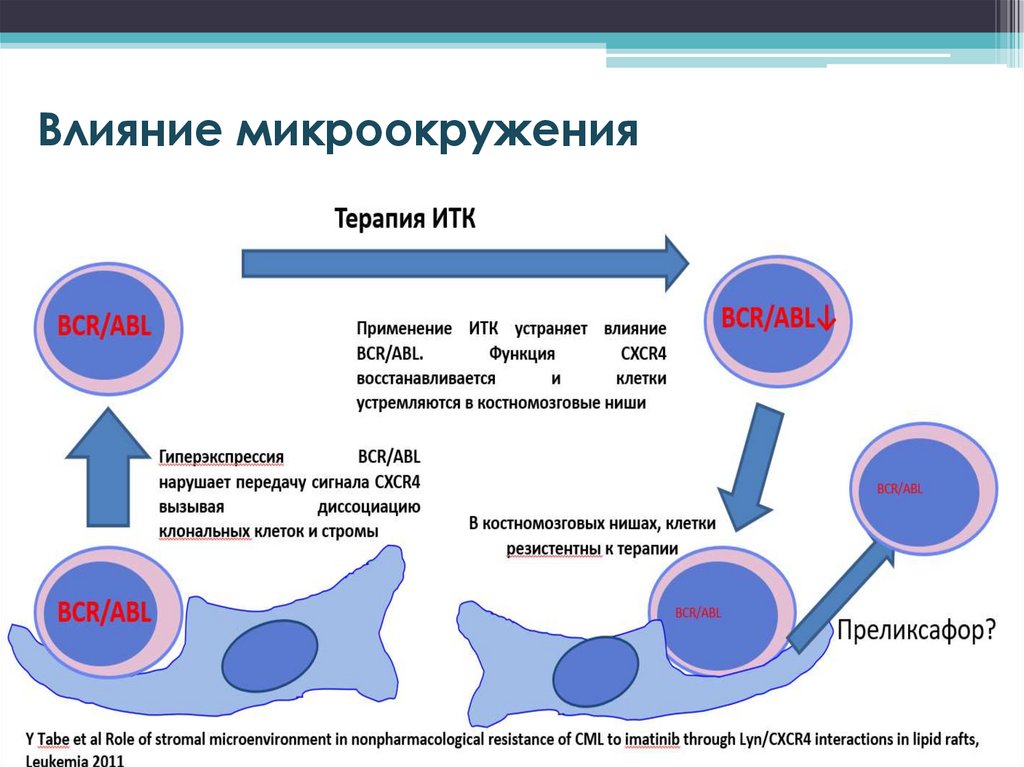
Влияние микроокружения• Сигналы, опосредованные микроокружением,
увеличивают ROS-зависимую генетическую
нестабильность
• N-кадгерин-опосредованная адгезия ЛСК и
клеток-предшественников к мезенхимальным
стромальным клеткам усиливает самообновление
и выживание ЛСК и защищает стволовые клетки /
клетки-предшественники ХМЛ от ИТКиндуцированного апоптоза посредством
стабилизации / активации передачи сигналов
через WNT путь
«Cellular and Molecular Networks in Chronic Myeloid Leukemia: The Leukemic Stem, Progenitor and Stromal Cell Interplay»
Danilo Perrotti, Giovannino Silvestri Curr Drug Targets 2017
24.
Клеточные сигналы и ЛСК• Путь Wnt имеет решающее значение для
самообновления ЛСК и взаимодействия с
нишей КМ, особенно при переходе от
хронической фазы к бластному кризу, его
активация была связана с наличием BCR-ABL1
• BCR-ABL1 может активировать несколько
путей регуляции, включая Raf / MEK / ERK, SRC
и JAK / STAT пути
«Concise Review: Chronic Myeloid Leukemia: Stem Cell
Niche and Response to Pharmacologic Treatment»
ELENA ARRIGONI , MARZIA DEL RE Stem Cells Translational Medicine
25.
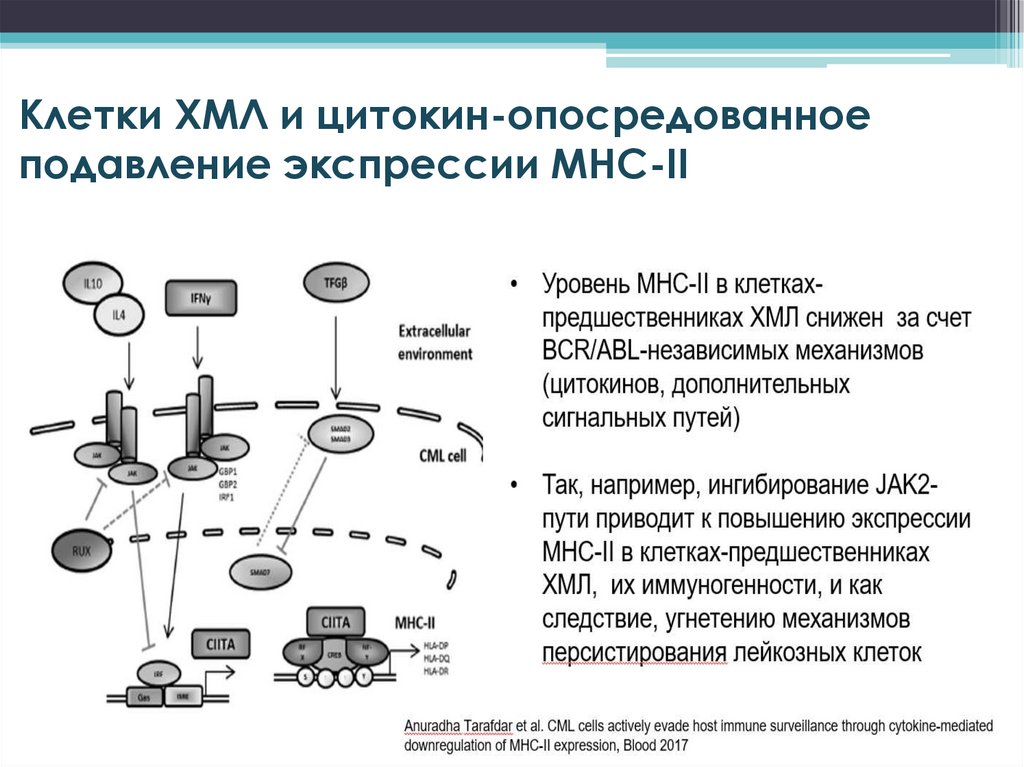
Клетки ХМЛ и цитокин-опосредованноеподавление экспрессии MHC-II
26.
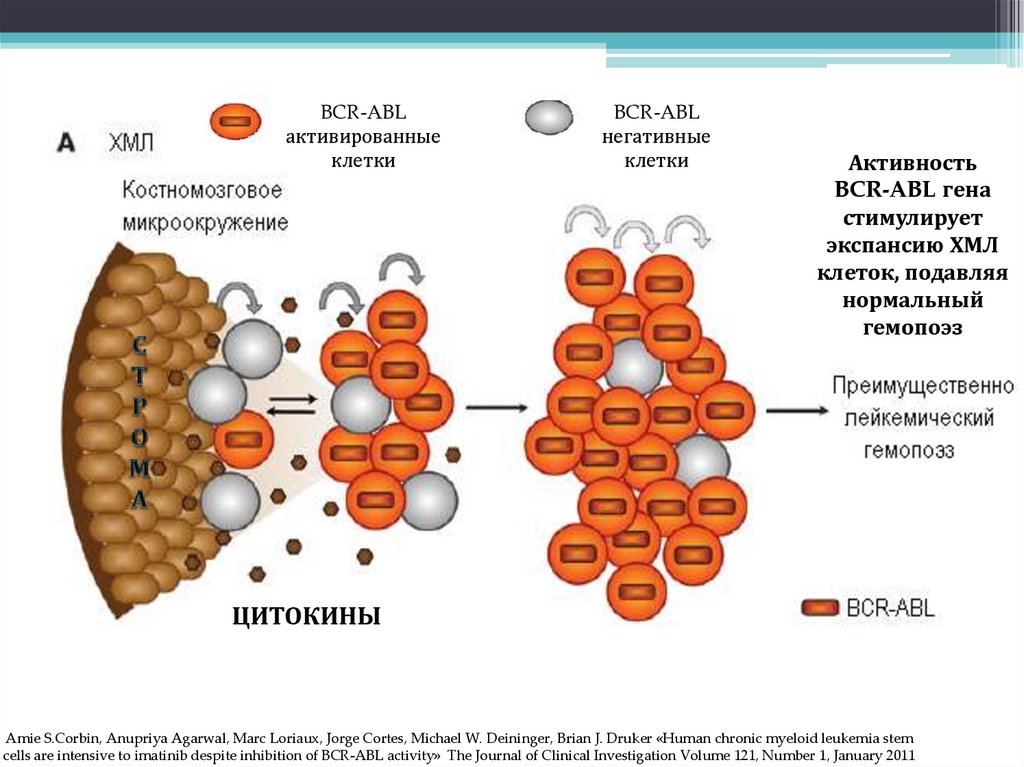
BCR-ABLактивированные
клетки
BCR-ABL
негативные
клетки
Активность
BCR-ABL гена
стимулирует
экспансию ХМЛ
клеток, подавляя
нормальный
гемопоэз
ЦИТОКИНЫ
Amie S.Corbin, Anupriya Agarwal, Marc Loriaux, Jorge Cortes, Michael W. Deininger, Brian J. Druker «Human chronic myeloid leukemia stem
cells are intensive to imatinib despite inhibition of BCR-ABL activity» The Journal of Clinical Investigation Volume 121, Number 1, January 2011
27.
Brian S.Druker 2006-2011• Серия работ по изучению ХМЛ-ЛСК (покоящихся и активных)
• Объект исследования-различные субпопуляции ХМЛ-ЛСК:
CD34+CD38+Lin+CD133+; Lin± CD34+CD38-; Ki-67-PCNA-; Ki-67+PCNA+
• Методы исследования:
• Суррогатные методы определяющие общего внутриклеточного уровня
фосфотирозина- FACS, CBKL, LTC-IC и другие культуры
• Murine-long-term engraftment assays
• Иммуноблотинг
• 5мкг Imatinib
• Цель: Изучить способность ХМЛ-ЛСК к выживанию в зависимости от BCL-ABL
Выводы: Выживаемость покоящихся примитивных ХМЛ-ЛСК
не зависит от BCR-ABL. Для их элиминации требуется
разработка принципиально новых методов воздействия на
ХМЛ-ЛСК.
28.
Клеточные сигналы и выживаниеЛСК
ЛСК
«Mechanisms of Disease Progression and Resistance to Tyrosine Kinase Inhibitor Therapy in Chronic Myeloid Leukemia: An Update»
Luana Bavaro, Margherita Martelli, Molecular sciences 2019
29.
Влияние микроокружения30.
Фармакокинетические факторы• Ингибиторы тирозинкиназы метаболизируются
преимущественно в печени с помощью CYP450
• Выводятся кишечником, до 90% с калом
• P-гликопротеин (увеличение экспрессии MDR1)
приводит к повышенному выведению ЛС
• hOCT (снижение активности) приводит к
уменьшению поступления ЛС в клетку
31.
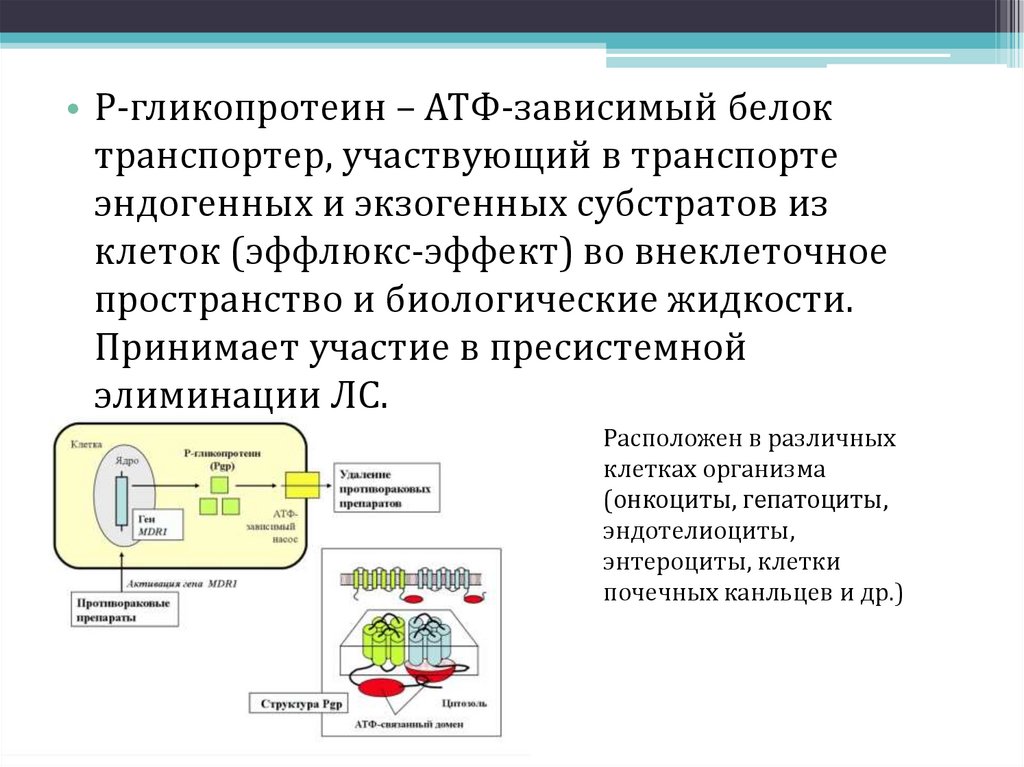
• Р-гликопротеин – АТФ-зависимый белоктранспортер, участвующий в транспорте
эндогенных и экзогенных субстратов из
клеток (эффлюкс-эффект) во внеклеточное
пространство и биологические жидкости.
Принимает участие в пресистемной
элиминации ЛС.
Расположен в различных
клетках организма
(онкоциты, гепатоциты,
эндотелиоциты,
энтероциты, клетки
почечных канльцев и др.)
32.
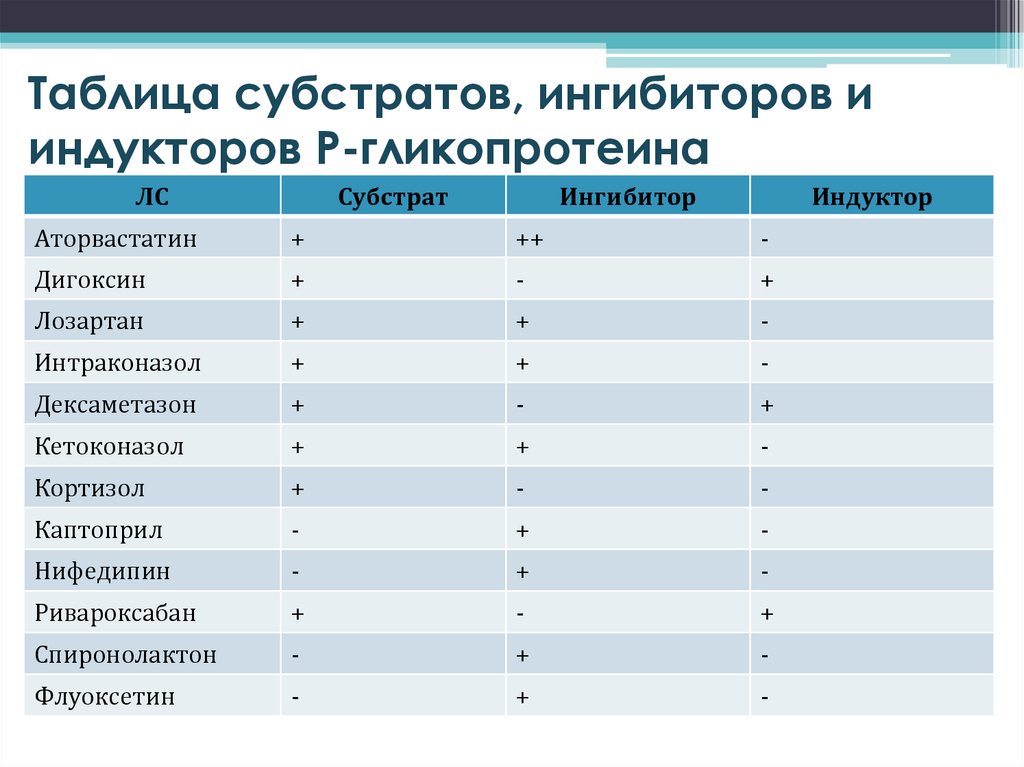
Таблица субстратов, ингибиторов ииндукторов Р-гликопротеина
ЛС
Субстрат
Ингибитор
Индуктор
Аторвастатин
+
++
-
Дигоксин
+
-
+
Лозартан
+
+
-
Интраконазол
+
+
-
Дексаметазон
+
-
+
Кетоконазол
+
+
-
Кортизол
+
-
-
Каптоприл
-
+
-
Нифедипин
-
+
-
Ривароксабан
+
-
+
Спиронолактон
-
+
-
Флуоксетин
-
+
-
33.
hOCT1 (human organic cation transporter)hOCT1- это белок транспортер,
расположенный на
цитоплазматической мембране
клетки и отвечающий за
транспортировку экзогенных и
эндогенных субстратов во внутрь
клетки (инфлюкс-эффект). При
снижении его активности
уменьшается биодоступность
препарата.
34.
Проблема приверженностипациентов лечению
• Образовательные беседы с пациентом
о важности приверженности для достижения
результатов терапии
• Регулярный мониторинг приверженности наряду
с мониторингом ответа (в 3, 6, 12 мес. от начала
терапии)
• Упрощение режима приема терапии,мониторинг и
управление побочными эффектами
• Использование устройств с мониторингом приема
препарата
• Вовлечение членов семьи пациента в решение
проблемы приверженности
35.
Преодоление резистентностиЛСК -ХМЛ
• Терапия высокими дозами ИТК + / • Новые поколения ИТК
++/Дазатиниб, нилотиниб, бозутиниб, понатиниб
• Комбинации различных ИТК? ?
+/• Ингибирование других сигнальных путей – в процессе
исследования
Перспективные результаты - JAK2, Wnt/катенин,
Hedgehog, BCL, PML, гистон-деацетилаза, ALOX5,
FOXO, ингибиторы трансляции и др.
• Иммунотерапия + + + / - (алло-ТГСК)
36.
ELN 2020Последоват
е-льность
Заболевание
Возможности терапии
1я
линия
Все пациенты
Иматиниб 400мг x 1, Нилотиниб 300мг x 2, Дазатиниб
2я
линия
Непереносимость
иматиниба
Выбор ИТК в зависимости от сопутствующих заболеваний и
Неудача на
иматинибе
Переключение с Иматиниба на другие ИТК, с учетом
100мг x 1, Бозутиниб 500 мг 1 раз в день
побочных эффектов
мутаций, сопутствующих заболеваний и побочных
эффектов
Переключение с Нилотиниба на Дазатиниб, Бозутиниб или
Понатиниб
Переключение с Дазатиниба на Нилотиниб, Бозутиниб или
Понатиниб
Аллогенная ТСК
3я
линия
Переключение на другой ИТК (Понатиниб 45мг х 1,
радотиниб, PEG-IFNa + ИТК 2 поколения)
Аллогенная ТСК
Эксперементальное лечение (клинические исследования)
Любая
линия
T315I
Понатиниб, Аллогенная ТКМ
European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia A. Hochhaus M. Baccarani Blood
37.
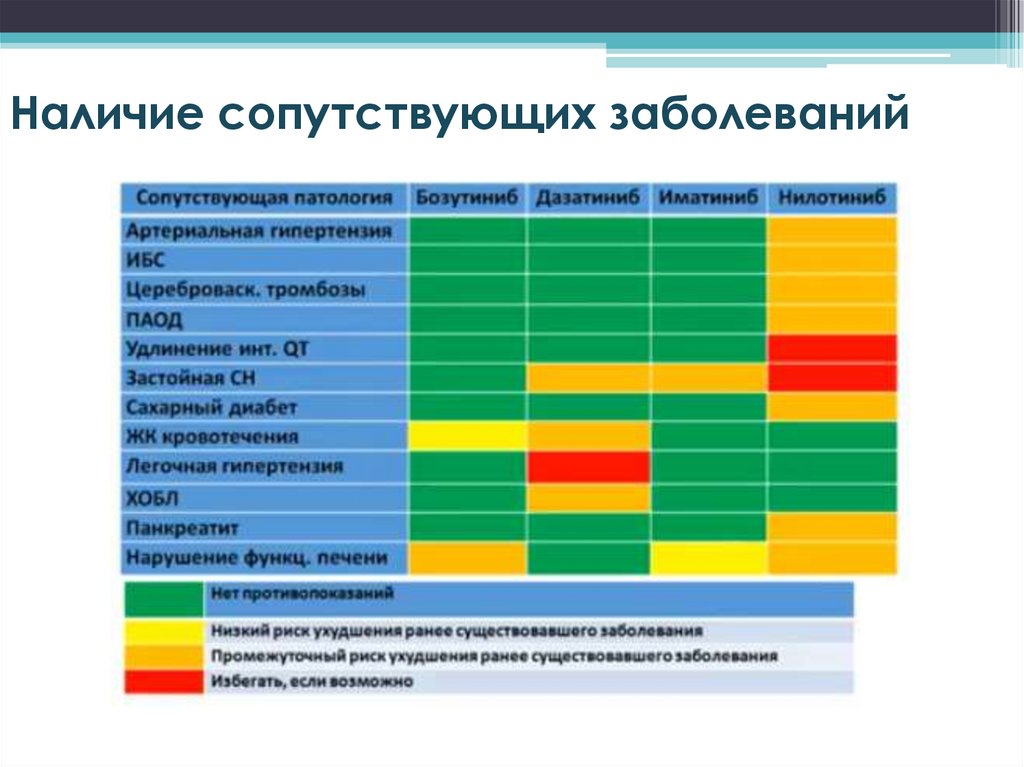
Наличие сопутствующих заболеваний38.
Эффективность и безопасность препарата PF114*у пациентов хроническим миелолейкозом
с резистентностью к предшествующей терапии ИТК
В исследование включено 18 пациентов (медиана возраста 50,5 лет) в ХФ или ФА,
резистентных по крайней мере к одному из новых ИТК или резистентных к ИМА при
наличии мутации T315I.
Эскалация дозы от 50мг/д до 500мг/д.
Терапию продолжали 11/18 пациентов на дозах 200-500мг/д
БЦГО достигнут у 4/11 пациентов, получивших не менее 3-х циклов, включая 2-х
пациентов с мутацией T315I
1 ДЛТ на дозе 400мг – эритематозная сыпь
Наиболее частые осложнения 2-3ст на дозе 400мг/д
– дерматологическая токсичность 4/11 пациентов
PF-114, a potent and selective inhibitor of native and mutated BCR/ABL is active against Philadelphia chromosome-positive
(Ph+) leukemias harboring the T315I mutation
Mian А.А. et al. Leukemia, 2015, 29: 1104–1114
Turkina A.G. et al., Blood, 2017, 130:895
* не зарегистрирован в РФ
39.
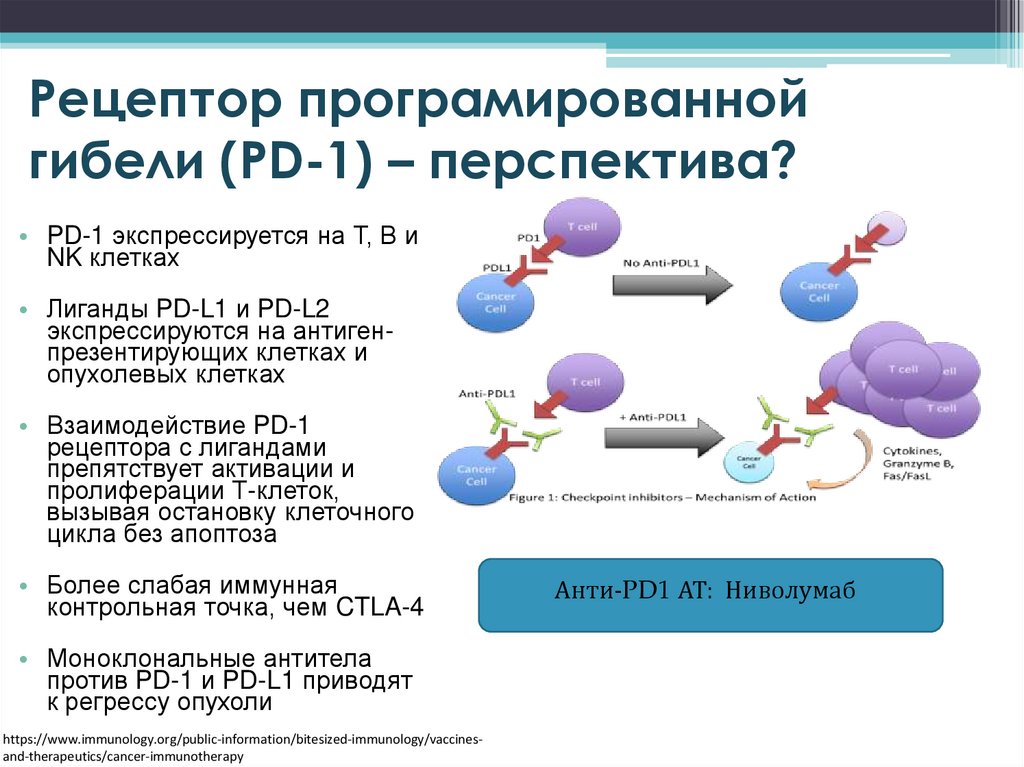
Рецептор програмированнойгибели (PD-1) – перспектива?
• PD-1 экспрессируется на Т, В и
NK клетках
• Лиганды PD-L1 и PD-L2
экспрессируются на антигенпрезентирующих клетках и
опухолевых клетках
• Взаимодействие PD-1
рецептора с лигандами
препятствует активации и
пролиферации Т-клеток,
вызывая остановку клеточного
цикла без апоптоза
• Более слабая иммунная
контрольная точка, чем CTLA-4
• Моноклональные антитела
против PD-1 и PD-L1 приводят
к регрессу опухоли
https://www.immunology.org/public-information/bitesized-immunology/vaccinesand-therapeutics/cancer-immunotherapy
Анти-PD1 АТ: Ниволумаб
40.
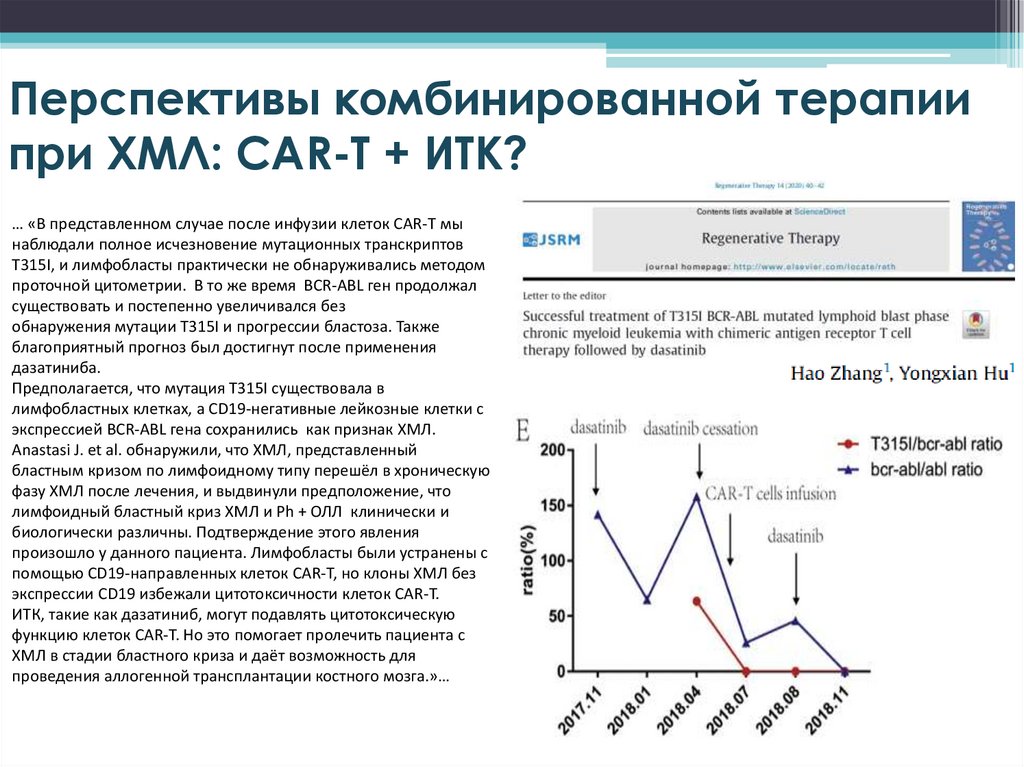
Перспективы комбинированной терапиипри ХМЛ: CAR-T + ИТК?
… «В представленном случае после инфузии клеток CAR-T мы
наблюдали полное исчезновение мутационных транскриптов
T315I, и лимфобласты практически не обнаруживались методом
проточной цитометрии. В то же время BCR-ABL ген продолжал
существовать и постепенно увеличивался без
обнаружения мутации T315I и прогрессии бластоза. Также
благоприятный прогноз был достигнут после применения
дазатиниба.
Предполагается, что мутация T315I существовала в
лимфобластных клетках, а CD19-негативные лейкозные клетки с
экспрессией BCR-ABL гена сохранились как признак ХМЛ.
Anastasi J. et al. обнаружили, что ХМЛ, представленный
бластным кризом по лимфоидному типу перешёл в хроническую
фазу ХМЛ после лечения, и выдвинули предположение, что
лимфоидный бластный криз ХМЛ и Ph + ОЛЛ клинически и
биологически различны. Подтверждение этого явления
произошло у данного пациента. Лимфобласты были устранены с
помощью CD19-направленных клеток CAR-T, но клоны ХМЛ без
экспрессии CD19 избежали цитотоксичности клеток CAR-T.
ИТК, такие как дазатиниб, могут подавлять цитотоксическую
функцию клеток CAR-T. Но это помогает пролечить пациента с
ХМЛ в стадии бластного криза и даёт возможность для
проведения аллогенной трансплантации костного мозга.»…
41.
Выводы• Появление ИТК радикально изменило
результаты
терапии пациентов с ХМЛ. Длительность и качество
жизни пациентов с ХМЛ сравнимо с аналогичными
показателями здоровой популяции
• При
ХМЛ
главной
проблемой
является
резистентность лейкемических стволовых клеток
• Алло-ТГСК
на
данный
момент
является
единственным радикальным методом лечения ХМЛ
• Механизмы резистентности до конца не изучены,
но продолжаются исследования в данной области




















 Медицина
Медицина








