Похожие презентации:
Основные понятия и законы химии
1.
Основные понятия и законыхимии.
План:
1. Атомно-молекулярное учение в химии
2. Химические элементы
3. Классификация веществ. Аллотропия
4. Относительная атомная масса
5. Относительная молекулярная масса
6. Моль. Молярная масса
7. Химические знаки, формулы и уравнения
8. Химические реакции. Классификация реакций.
9. Закон сохранения массы вещества
10. Закон постоянства состава
11. Газовые законы. Закон Авогадро. Молярный объем газа
2.
Химия – это наука, изучающая состав, свойства и превращения веществ, а также явления,которые сопровождают эти превращения.
Одно из первых определений химии как науки дал великий русский ученый М.В. Ломоносов:
«Химическая наука рассматривает свойства и изменения тел… состав тел…объясняет причину
того, что с веществами при химических превращениях
происходит».
Д.И.Менделеев в книге «Основы химии» дал
следующее определение химии: «Химия – это учение
об элементах и их соединениях».
Общая химия рассматривает основные
химические понятия, а также важнейшие
закономерности, связанные с химическими
превращениями. Здесь включены основы из различных разделов современной науки:
физической химии, химической кинетики, структурной химии и др.
3.
1.Атомно-молекулярное учение в химииОсновные положения этого учения были изложены в работе «Элементы
математической химии» М.В. Ломоносова. Основные положения этого
учения:
- Все вещества состоят из «корпускул» (молекул)
- Молекулы состоят из элементов (атомов)
Частицы молекулы и атомы – находятся в непрерывном движении.
Тепловое состояние тел есть результат движения их частиц.
- Молекулы простых веществ состоят из одинаковых
атомов, молекулы сложных веществ - из различных.
Атомно-молекулярное учение в химии окончательно
утвердилось лишь в середине XIXв. на международном
съезде химиков в г.Карлсруэ в 1860 г , где были
приняты определения понятий молекулы и атома.
-
4.
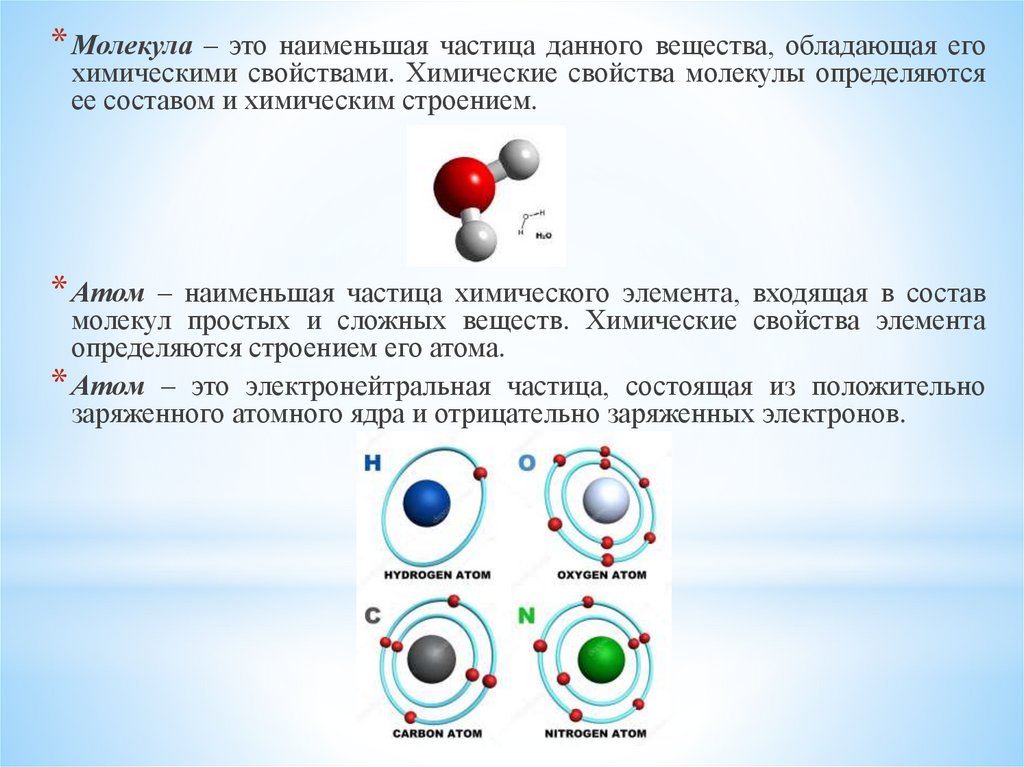
* Молекула – это наименьшая частица данного вещества, обладающая егохимическими свойствами. Химические свойства молекулы определяются
ее составом и химическим строением.
* Атом – наименьшая частица химического элемента, входящая в состав
молекул простых и сложных веществ. Химические свойства элемента
определяются строением его атома.
* Атом – это электронейтральная частица, состоящая из положительно
заряженного атомного ядра и отрицательно заряженных электронов.
5.
2. Химические элементыАтомно-молекулярное учение позволило объяснить основные понятия
и законы химии. Химический элемент – каждый отдельный вид атомов.
Важнейшей характеристикой атома является положительный заряд его
ядра, численно равный порядковому номеру элемента.
Химический элемент - определенный вид атомов с одинаковым
положительным зарядом ядра.
Известно 118 элементов. Все они
объединены по характерным
признакам, повторяющимся с
определенной периодичностью в
таблицу, имеющую название
периодического закона Д.И. Менделеева.
Все элементы делят на металлы и неметаллы.
Важной характеристикой элементов является их распространенность в
земной коре.
6.
7.
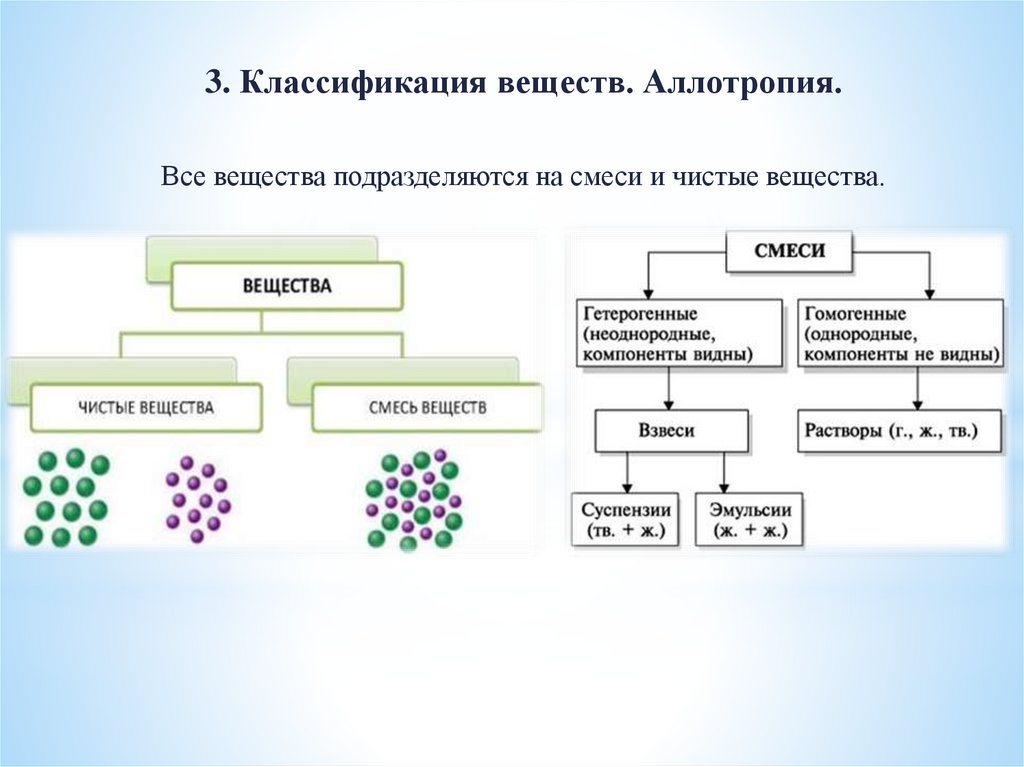
3. Классификация веществ. Аллотропия.Все вещества подразделяются на смеси и чистые вещества.
8.
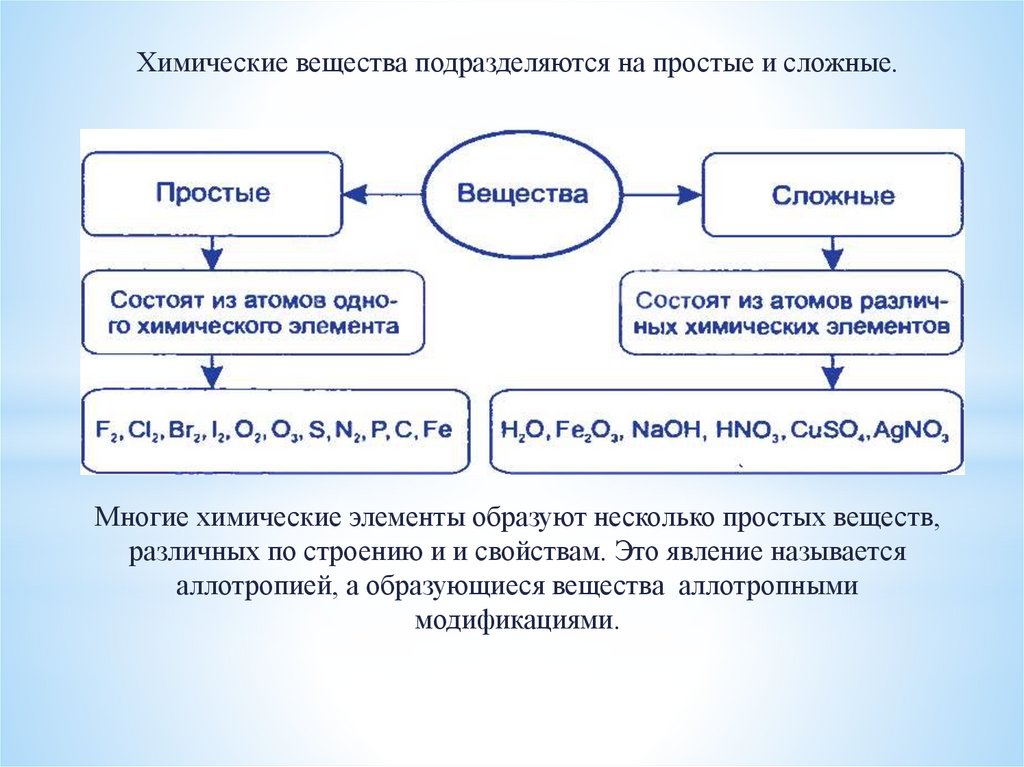
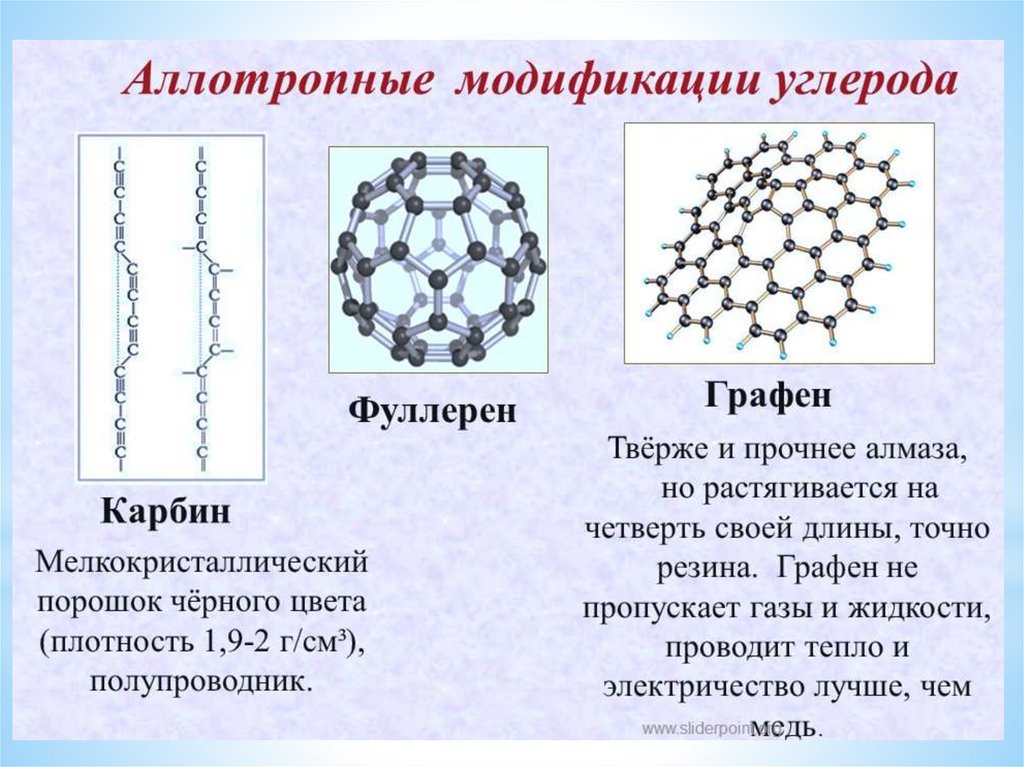
Химические вещества подразделяются на простые и сложные.Многие химические элементы образуют несколько простых веществ,
различных по строению и и свойствам. Это явление называется
аллотропией, а образующиеся вещества аллотропными
модификациями.
9.
10.
11.
4. Относительная атомная массаВ химии используются не абсолютные значения атомных масс, а
относительные. В 1961г. За единицу атомной массы принята атомная
единица массы (а.е.м.), которая представляет собой 1/12 часть массы
изотопа углерода 12С.
Относительной атомной массой Ar химического элемента называется
величина, равная отношению средней массы атома естественного
изотопического состава элемента к 1/12 массы атома углерода 12С.
Относительные атомные массы элементов обозначают Ar.
Ar(Н) – относительная атомная масса водорода,
Ar(О) - относительная атомная масса кислорода,
Ar(С) - относительная атомная масса
Ar(Н) =
1,6 х10-27 кг
1/ х 1,993х10-26кг
12
= 1,0079
12.
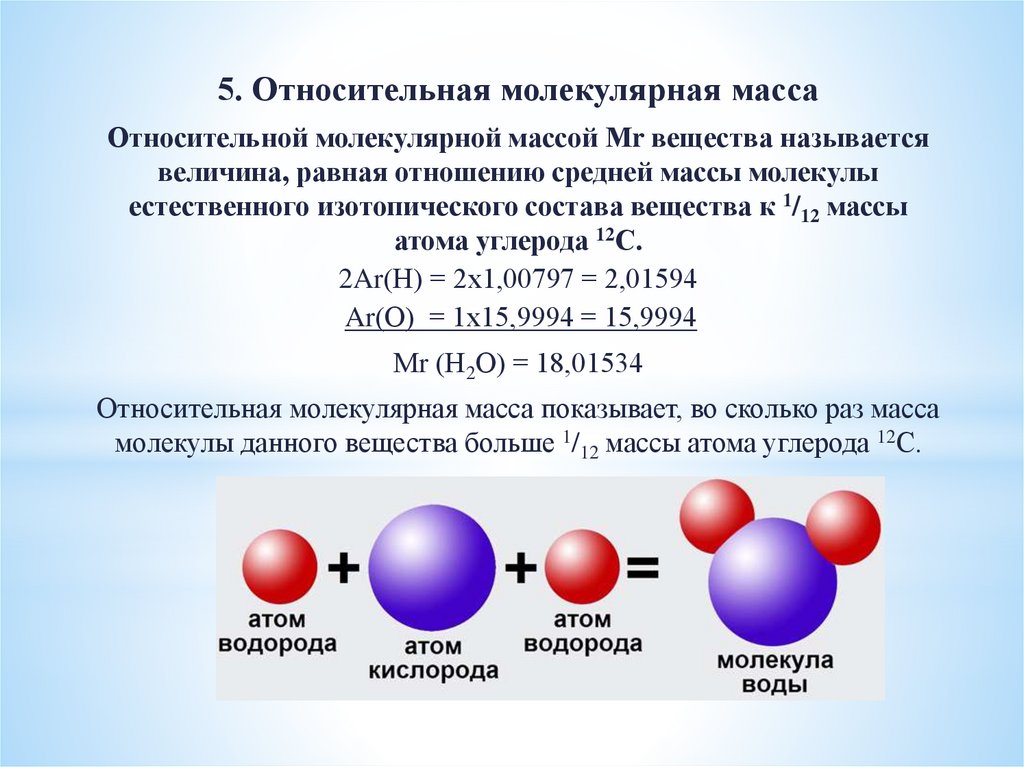
5. Относительная молекулярная массаОтносительной молекулярной массой Мr вещества называется
величина, равная отношению средней массы молекулы
естественного изотопического состава вещества к 1/12 массы
атома углерода 12С.
2Ar(Н) = 2х1,00797 = 2,01594
Ar(О) = 1х15,9994 = 15,9994
Мr (Н2О) = 18,01534
Относительная молекулярная масса показывает, во сколько раз масса
молекулы данного вещества больше 1/12 массы атома углерода 12С.
13.
6. Моль. Молярная массаВ международной системе единиц (СИ) за единицу количества вещества
принят моль.
Моль – это количество вещества, содержащее столько структурных
единиц (молекул, атомов, ионов, электронов и др.), сколько атомов
содержится в 0,012 кг изотопа углерода 12С.
Зная массу одного атома углерода (1,993х10-26кг), можно вычислить
число атомов NA в 0,012 кг углерода:
NA =
0,012 кг/моль
1,993х10-26кг
= 6,02х1023 1/моль
Это число называется постоянной Авогадро и показывает число
структурных единиц в 1 моль любого вещества.
Молярная масса – величина, равная отношению массы вещества к
количеству вещества.
В общем случае молярная масса вещества, выраженная в г/моль,
численно равна относительной атомной или молекулярной массе этого
вещества.
14.
Масса и количество вещества – понятия разные. Масса веществавыражается в килограммах (граммах), а количество вещества в молях.
Между массой вещества (m,г), количеством вещества (n, моль) и
молекулярной массой (М,г/моль) существуют соотношения:
m = nМ,
n = m/М,
М = m/n.
15.
7. Химические знаки, формулы и уравненияЭлементы принято обозначать химическими знаками (символами).
16.
Состав сложных веществ изображается при помощи химическихформул.
17.
Химические уравнения записываются с помощью химических формул изнаков.
Они служат для изображения химических реакций и отражают закон
сохранения массы веществ. Состоят из двух частей, соединенных знаком
равенства. В левой части записываются формулы веществ, вступающих в
реакцию, в правой – формулы веществ, образующихся в результате реакции.
Число атомов каждого элемента в левой части равно числу тех же атомов в
правой. Это означает, что это уравнение удовлетворяет закону сохранения
массы веществ. Коэффициенты перед формулами веществ в уравнениях
химических реакций называются стехиометрическими коэффициентами.
Стехиометрические количества – это количества веществ, которые
соответствуют уравнению реакции или формуле. Стехиометрические
расчеты – это расчеты по химическим формулам и уравнениям.
18.
8. Химические реакции. Классификация реакций.Явления, при которых одни вещества превращаются в другие.
Отличающихся от исходных составом и свойствами, и при этом не
происходит изменения состава ядер атомов, называются химическими.
Иначе их называют химическими превращениями, химическими
реакциями или химическими взаимодействиями.
Химические реакции классифицируются по следующим признакам:
1) выделения или поглощения теплоты(экзотермические и
эндотермические);
2) изменения числа исходных и конечных веществ (соединения,
разложения, замещения);
3)обратимости (обратимые и необратимые);
4) изменения степени окисления атомов, входящих в состав реагирующих
веществ (окислительно-восстановительные).
19.
1) Реакции по признаку выделения или поглощения теплотыразделяют на экзотермические и эндотермические.
Реакции, протекающие с выделением теплоты, называют
экзотермическими.
Реакции, протекающие с поглощением теплоты из окружающей
среды, называются эндотермическими.
Количество выделенной или поглощенной в результате реакции
теплоты называют тепловым эффектом процесса.
Раздел химии, изучающий тепловые эффекты различных процессов,
называется термохимией. Химические уравнения, в которых
приводятся тепловые эффекты реакций, называются
термохимическими.
20.
Тепловой эффект реакции зависит от температуры и давления,поэтому его приводят к стандартным условиям:
Температура 25оС (298 К) и давление р = 101,3 кПа.
В термодинамических уравнениях указывается также указывается
состояние веществ: кристаллическое (к), жидкое (ж),
газообразное (г), растворимое (р) и др.
Тепловой эффект принято обозначать ΔН, выражать в кДж и
относить к тому количеству вещества, которое определено
уравнением реакции. У эндотермических процессов ΔН>0, а
экзотермических ΔН<0.
Каждое вещество обладает определенной энтальпией
(теплосодержанием). Энтальпия (Н) является мерой энергии,
накапливаемой веществом при его образовании.
Тепловой эффект реакции при постоянном давлении ΔН
представляет собой разность энтальпий конечных продуктов
реакции (обозначается Нкон) и исходных реагирующих веществ
(Нисх)
21.
Если все конечные продукты реакции и исходные вещества находятсяв стандартных условиях, то ΔН называют стандартной энтальпией
процесса и обозначают ΔНо298
22.
23.
24.
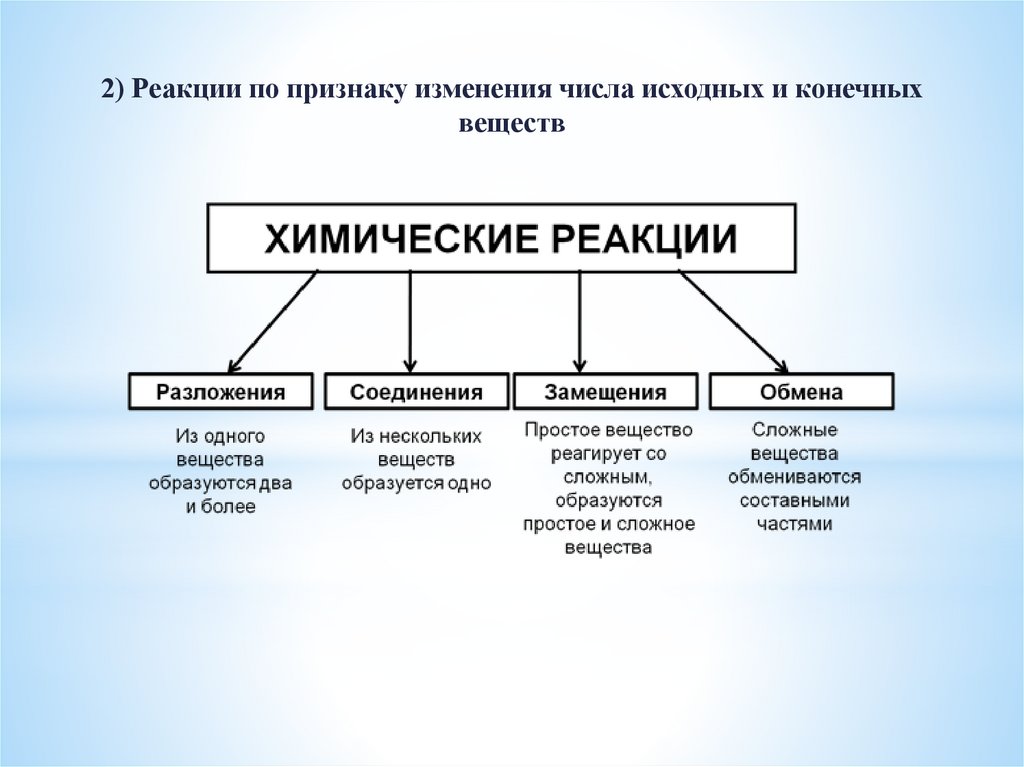
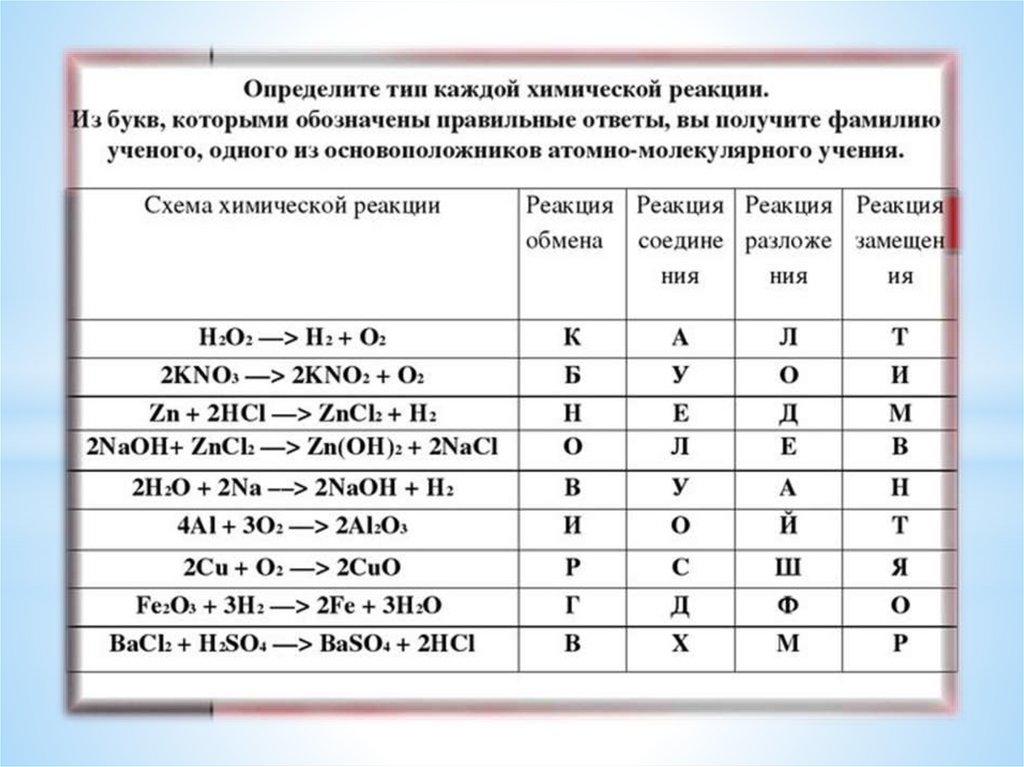
2) Реакции по признаку изменения числа исходных и конечныхвеществ
25.
26.
27.
3) Реакции по признаку обратимости. Выделяют реакцииобратимые и необратимые
Необратимые реакции — реакции, при которых взятые вещества
нацело превращаются в продукты реакции, не реагирующие между
собой при данных условиях. Гомогенные реакции являются
необратимыми в случаях образования: а) газа; б) осадка; в) воды.
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2
BaCl2 + H2SO4 = BaSO4 + 2HCl
2NaOH + H2SO4 = Na2SO4 + 2H2О
Обратимые реакции — химические реакции, протекающие
одновременно в двух противоположных направлениях (прямом и
обратном). Состояние, когда скорость прямой реакции равна
скорости обратной реакции, называют химическим равновесием.
На химическое равновесие влияют: а)концентрации исходных
веществ и продуктов; б)температура; в) давление.
28.
4) Реакции по признаку изменения степени окисления атомов,входящих в состав реагирующих веществ
29.
9. Закон сохранения массы вещества30.
Масса веществ, вступивших в химическую реакцию,равна массе веществ, образующихся в результате
реакции.
31.
32.
10. Закон постоянства составаСформулировал Жозеф Луи Пруст
(1754 – 1826) – французский химик –
аналитик. Исследование состава
различных веществ, выполненное им
в 1799-1803 годах, послужило основой
открытия закона постоянства состава
для веществ молекулярного строения.
Каждое химически чистое
вещество независимо от
местонахождения и способа
получения имеет постоянный
качественный и количественный
состав и свойства.
33.
34.
11. Газовые законы. Закон Авогадро. Молярный объем газаГей-Люссак, Жозеф Луи – французский химик и физик, член Французской
Академии наук, иностранный почетный член
Петербургской Академии наук. Установил
закон объемных отношений:
Объемы вступающих в реакцию газов
при одинаковых условиях (температуре и
давлении) относятся друг к другу как
простые целые числа.
35.
Этот закон позволил итальянскому ученому Амедео Авогадро (1811г)предположить, что молекулы простых газов (водорода, кислорода,
азота и т.д.) состоят из одинаковых атомов.
Изучение свойств газов позволило Авогадро высказать гипотезу,
которая была подтверждена опытными данными и стала называться
законом Авогадро:
В равных объемах различных газов при одинаковых условиях
(температура и давление) содержится одинаковое число молекул.
36.
Молярный объем газа – это отношение объема вещества к количествуэтого вещества.
37.
На основании закона Авогадро определяются молярные массыгазообразных веществ. Чем больше масса молекул газа, тем больше
масса одного и того же объема газа. В равных объемах газов при
одинаковых условиях содержится одинаковое число молекул, а
следовательно, и молей газов. Отношение масс равных объемов газов
равно отношению их молярных масс:
m1:m2=M1:M2
где m1 – масса определенного объема первого газа; m2 - масса такого
же объема второго газа; M1и M2 – молярные массы первого и второго
газов.
Отнощение массы определенного объема одного газа к массе такого
же объема другого газа (взятого при тех же условиях) называется
плотностью первого газа по второму (обозначается буквой D):
38.
Обычно плотность газа определяется по отношению к самомулегкому газу – водороду (DH2). Молярная масса водорода равна
2г/моль, следовательно
М = 2DH2.
Молекулярная масса вещества в газообразном состоянии равна
его удвоенной плотности по водороду.
Часто плотность газа определяется по отношению к воздуху (Dв),
тогда молекулярная масса определяется выражением
М = 29Dв.
39.
40.
Для решения расчетных химических задач, связанных с газообразнымивеществами, используются газовые законы.
Закон Бойля-Мариотта:
При постоянной температуре объем данного количества газа обратно
пропорционален давлению, под которым он находится.
pV = const,
где p – давление, V- объем газа
Закон Гей-Люссака:
V/Т = const,
где Т – температура в К(кельвинах)
Закон Бойля-Мариотта и Гей-Люссака:
pV/Т = const
Эта формула употребляется для вычисления объема газа, если известен его
объем при других условиях
41.
Если известны масса или количество газа, а необходимо вычислить егообъем, используют уравнение Менделеева-Клапейрона:
Где n – количество вещества газа, моль; m – масса, г; М – молярная масса
газа, г/моль; R – универсальная газовая постоянная.
R = 8,31 Дж/(моль*К)
42.
Решение типовых задачОпределите количество вещества атомного железа в оксиде железа (III) массой
56 г.
2. Вычислите какое количество вещества карбоната кальция заключается в 40г.
СаСО3.
3. Определите массу 15 моль нитрата калия.
4. Относительная атомная масса серебра равна 108. определите массу одного
атома серебра в граммах.
5. Сколько молекул содержится в 6,8 г сероводорода? Вычислите массу одной
молекулы Н2S.
6. Какая масса фосфора потребуется для получения фосфорной кислоты Н3РО4
массой 29,4 г ?
7. Определите массовую долю кристаллизационной воды в кристаллической
соде Na2CO3*10H2O?
8. Какую массу будет иметь азот объемом 30 л при нормальных условиях?
9. Какой объем займет при нормальных условиях хлороводород массой 14,6г?
10. Какой объем займет при температуре 20оС и давлении 250 кПа аммиак массой
51г?
11. Давление водяного пара при 25оС составляет 3173 Па, сколько молекул
содержится в 1 мл этого пара?
1.



































 Химия
Химия








