Похожие презентации:
Буферная система
1.
Буферная система2.
Протолитический баллансБуферные системы
Белки, жиры, углеводы
всасывание, метаболизм
продукты обмена
переваривание,
СО2, Н2О , конечные
СО2 + Н2О Н2СО3 Н+ + НСО3–
13 моль/сутки углекислоты
30 – 80 ммоль других кислот
За сутки организм человека вырабатывает ~ 30 л 1 М
НСl, а изменение рН на 0.6 единиц приводит к
летальному исходу!
рH крови 7,36 – 7,42, рН эритр 7,25
3.
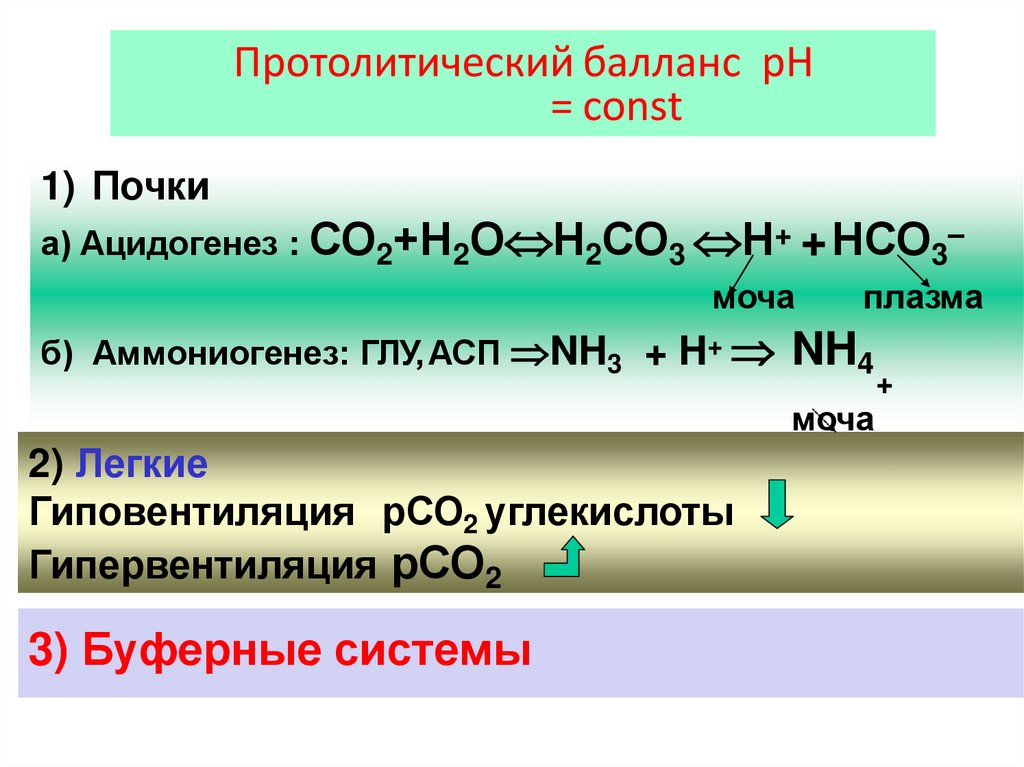
Протолитический балланс рН= const
1) Почки
а) Ацидогенез : СО2+Н2О Н2СО3 Н+ +НСО3–
моча
плазма
б) Аммониогенез: ГЛУ,АСП NH3 + H+ NH4
моча
2) Легкие
Гиповентиляция рСО2 углекислоты
Гипервентиляция рСО2
3) Буферные системы
+
4.
Добавим 1 каплю (0,05 мл) 1М НСl к 1л воды(безбуферный раствор, рН=7)
и рассчитаем изменение рН:
1000 мл –
0,05 мл –
1 капля
V 0.05 мл
1 моль H+
х
х = 0,05/1000 = 5·10-5 моль
рН = - lg 5·10-5 = 4,6
Изменение рН составит 7- 4,6 = 2.4 единицы
За сутки организм человека
вырабатывает ~ 30 л 1 н НСl
(600000 капель!), а изменение рН на 0.6
единиц приводит к летальному исходу!
Вывод!
Буферные системы крови обладают колоссальной буферной
емкостью!
108
5.
Протолитический баллансБуферные системы
Буферная система – протолитическая
(кислотно-основная) система, способная
поддерживать постоянство рН при
разбавлении или при добавлении
небольших количеств кислот или
щелочей
Кислотные буферные системы:
Слабая кислота – донор протонов
Соль этой кислоты (сопряженное основание) –
акцептор протонов
СН3СООН/ СН3СОО–
6.
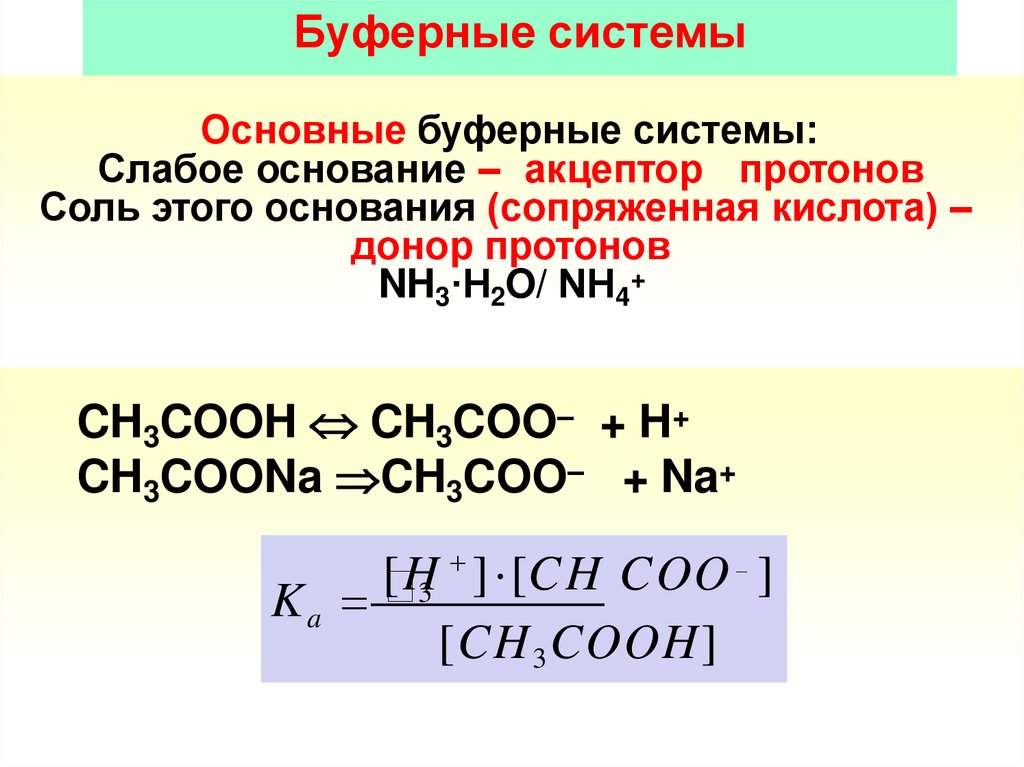
Буферные системыОсновные буферные системы:
Слабое основание – акцептор протонов
Соль этого основания (сопряженная кислота) –
донор протонов
NH3·H2O/ NН4+
CH3COOH CH3COO– + H+
CH3COONa CH3COO– + Na+
[H
]
[CH
COO
]
3
Ka
[CH 3 COOH]
7.
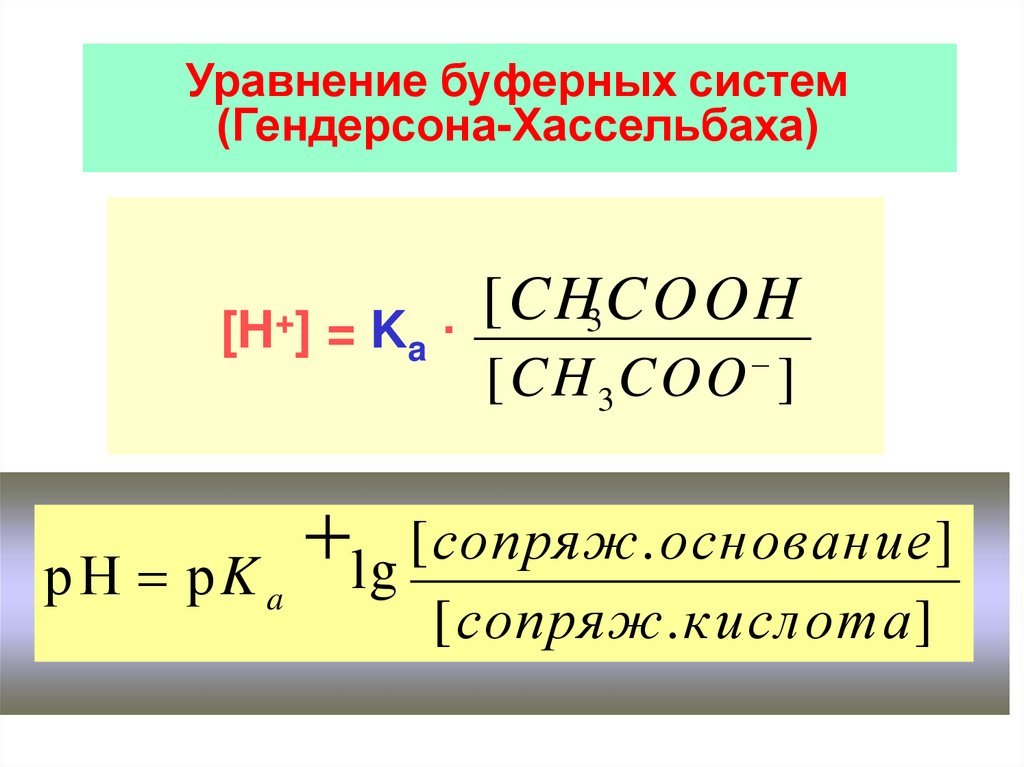
Уравнение буферных систем(Гендерсона-Хассельбаха)
[H+] = K
a
[CHCOOH
3
·
[CH 3 COO ]
[сопряж.основание]
lg
р Н рK
a
[сопряж.кислота]
8.
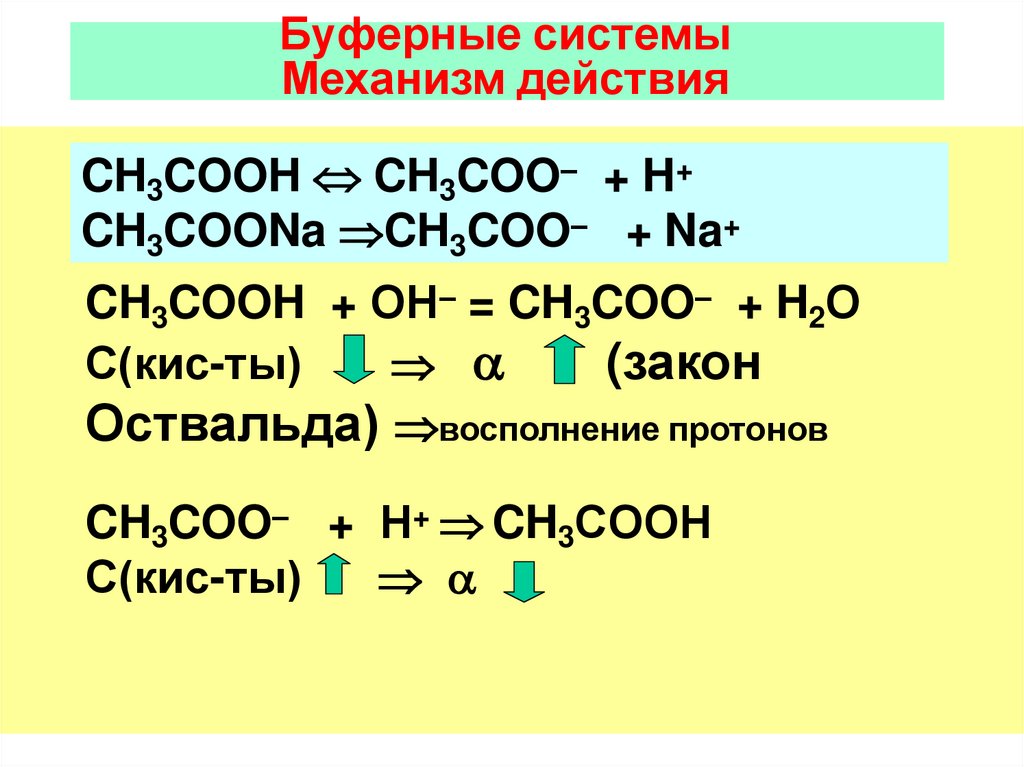
Буферные системыМеханизм действия
CH3COOH CH3COO– + H+
CH3COONa CH3COO– + Na+
CH3COOH + ОН– = CH3COO– + H2О
(закон
С(кис-ты)
Оствальда) восполнение протонов
CH3COO– + Н+ CH3COOН
С(кис-ты)
9.
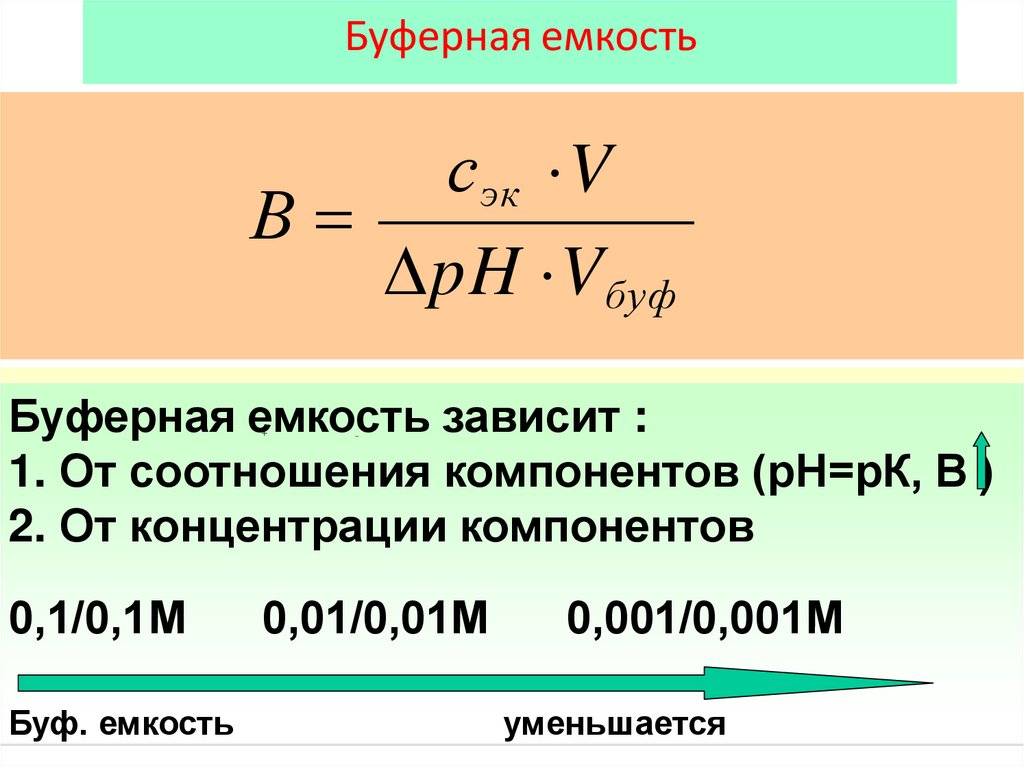
Буферная емкостьсэк V
В
pH V буф
Буферная емкость зависит :
1. От соотношения компонентов (рН=рК, В )
2. От концентрации компонентов
Ka
0,1/0,1М
Буф. емкость
[H ] [CH3COO ]
[CH3COOH]
0,01/0,01М
0,001/0,001М
уменьшается
10.
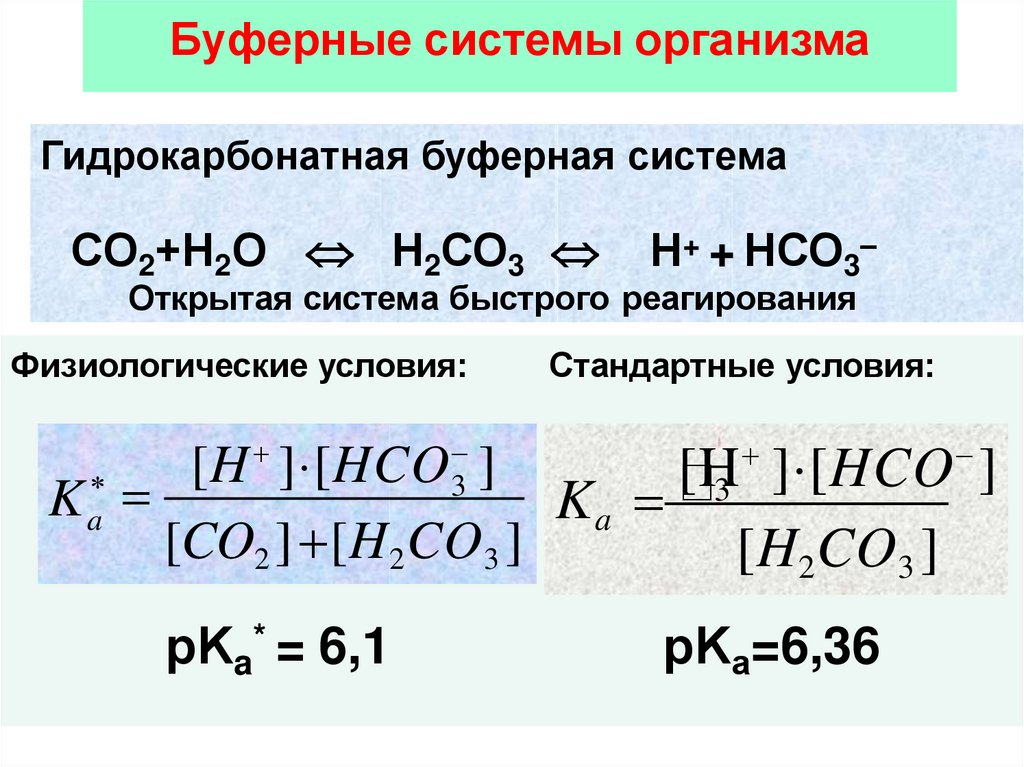
Буферные системы организмаГидрокарбонатная буферная система
СО2+Н2О Н2СО3
Н+ + НСО3–
Открытая система быстрого реагирования
Физиологические условия:
Стандартные условия:
[H
] [HCO
]
[H
] [HCO
]
3
3
Ka
Ka
[CO2 ] [H2 CO3 ]
[H2CO3 ]
рKa* = 6,1
рKа=6,36
11.
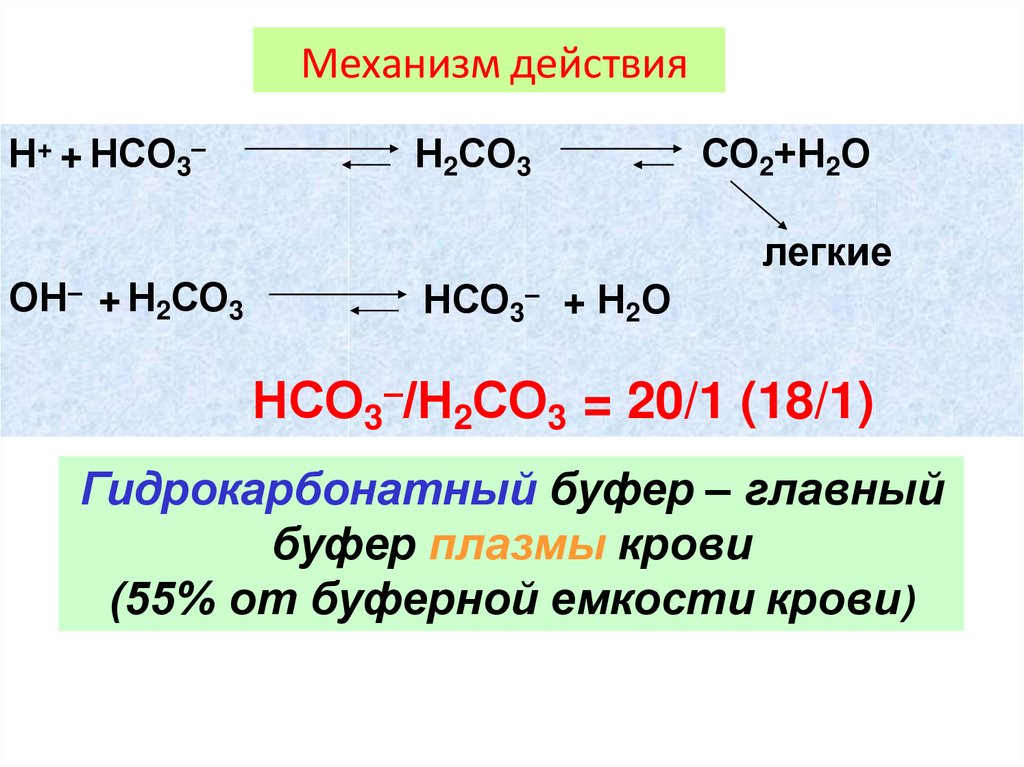
Механизм действияН+ + НСО3–
Н2СО3
СО2+Н2О
легкие
ОН– + Н2СО3
НСО3– + Н2О
НСО3–/Н2СО3 = 20/1 (18/1)
Гидрокарбонатный буфер – главный
буфер плазмы крови
(55% от буферной емкости крови)
12.
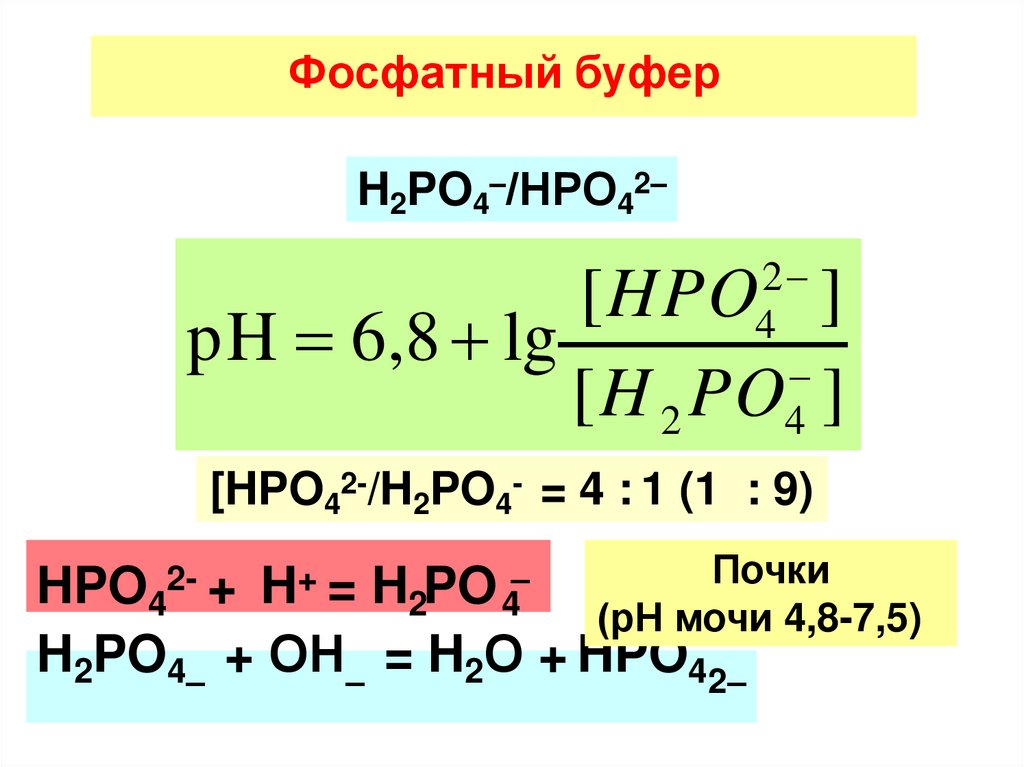
Фосфатный буферH2PO4–/НРО42–
2
4
4
[HPO ]
pH 6,8 lg
[H 2 PO ]
[HPO42-/H2PO4- = 4 : 1 (1 : 9)
Почки
HPO42- + H+ = H2PO 4–
(рН мочи 4,8-7,5)
H2PO4– + ОН– = H2О + HPO42–
13.
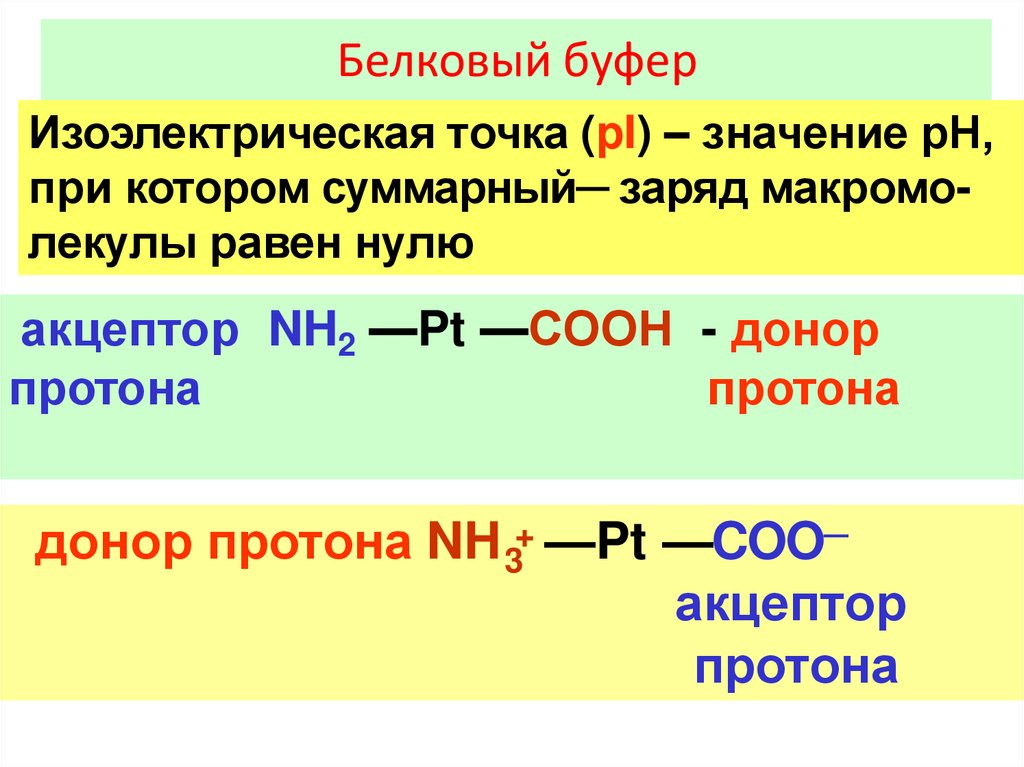
Белковый буферИзоэлектрическая точка (pI) – значение рН,
при котором суммарный─ заряд макромолекулы равен нулю
акцептор NH2 —Pt —COOН - донор
протона
протона
донор протона NH 3+ —Pt —COO─
акцептор
протона
14.
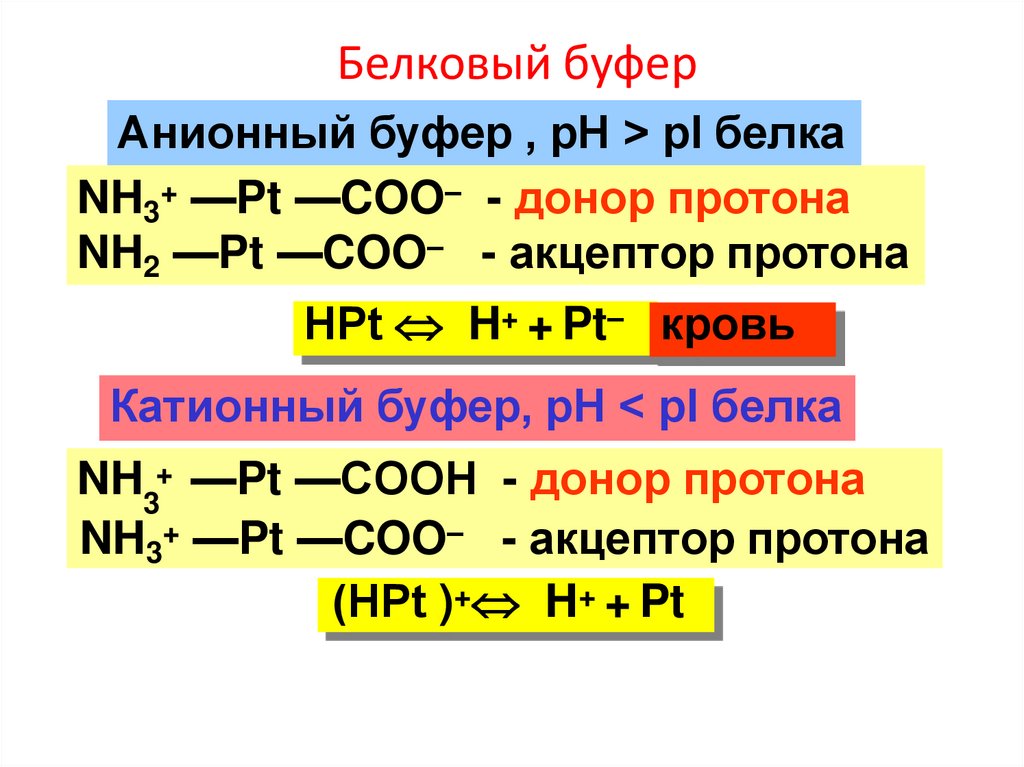
Белковый буферАнионный буфер , рН > pI белка
NH3+ —Pt —COO– - донор протона
NH2 —Pt —COO– - акцептор протона
НPt H+ + Pt– кровь
Катионный буфер, рН < pI белка
NH3+ —Pt —COOН - донор протона
NH3+ —Pt —COO– - акцептор протона
(НPt )+ H+ + Pt
15.
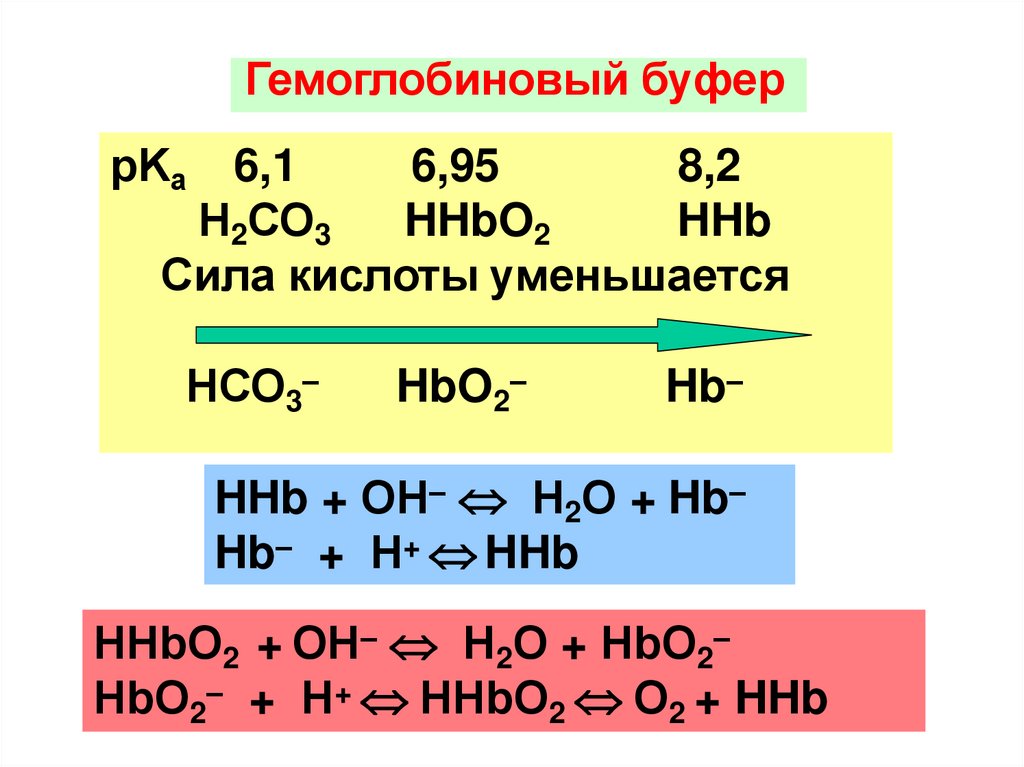
Гемоглобиновый буферрKа
6,1
6,95
8,2
Н2СО3
HHbO2
HHb
Сила кислоты уменьшается
НСО3–
HbO2–
Hb–
HHb + ОН– Н2О + Hb–
Hb– + Н+ HHb
HHbО2 + ОН– Н2О + HbО2–
HbО2– + Н+ HHbО2 О2 + HHb
16.
На сродство гемоглобина к кислородувлияет рН. Это явление носит название
эффекта Бора. При подкислении среды
(снижение рН)
сродство гемоглобина к
кислороду снижается, при увеличении рН
(подщелачивание) – повышается.
HHb + О2 HHbО2 Н+ + HbО2–
Действие гемоглобиновой буферной
системы сопряжено с процессами
газообмена в капиллярах легких и тканей
17.
Гемоглобиновая буферная система:Гемоглобиновая
H-Hb
K-Hb
венозная кровь
рН = 7.36
Оксигемоглобиновая
HHbО2
К-HbО2
артериальная кровь
рН = 7.42
~ 35 % общего буферного
действия крови
~ 63-75 % общего
буферного действия
в эритроцитах
121
18.
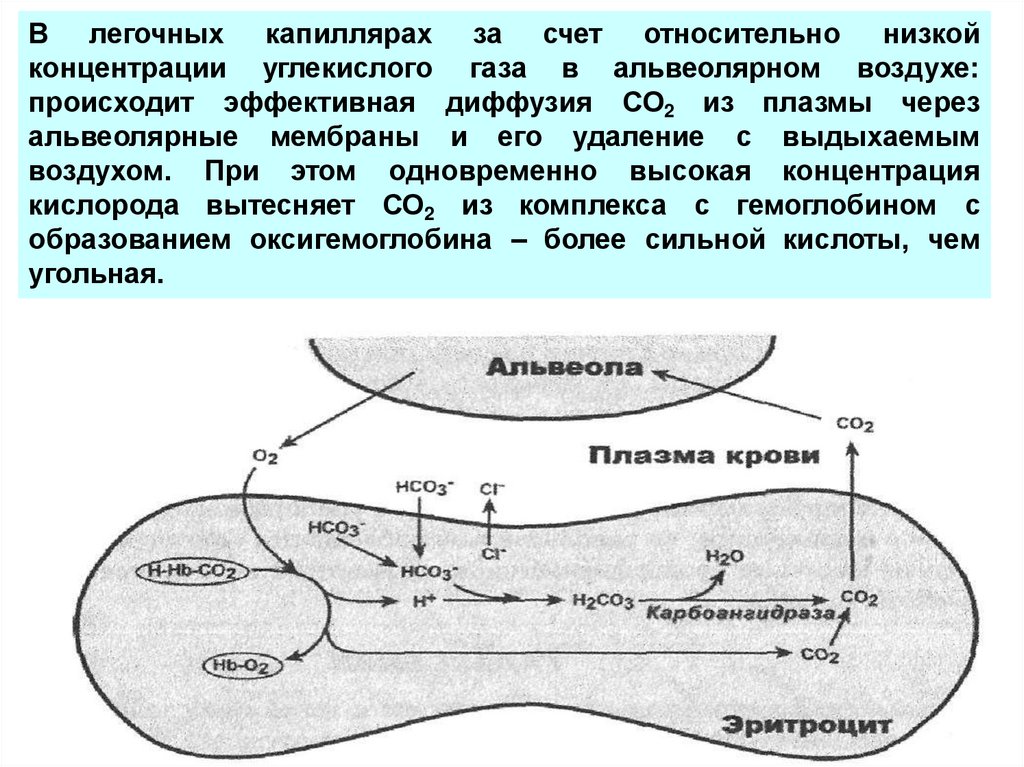
В легочных капиллярах за счет относительно низкойконцентрации углекислого газа в альвеолярном воздухе:
происходит эффективная диффузия СО2 из плазмы через
альвеолярные мембраны и его удаление с выдыхаемым
воздухом. При этом одновременно высокая концентрация
кислорода вытесняет СО2 из комплекса с гемоглобином с
образованием оксигемоглобина – более сильной кислоты, чем
угольная.
19.
Оксигемоглобин более сильная кислота, чем гемоглобин!HHb H Hb
pK 8,2
HHbO2 H HbO2
pK 6,95
В легких идет процесс оксигенации:
H Hb О2 H НbО2
pK 8,2
pK 6,95
Среда должна стать более кислой, но бикарбонатион взаимодействует с оксигемоглобином и
кислотность среды восстанавливается:
HCO3- + H-HbO2 → HbO2- + H2O +CO2↑
123
20.
В тканях диффундирующий в кровь из клеток СО2 большейчастью (около 90%) попадает в эритроциты, что стимулируется
быстрой, постоянно идущей реакцией превращения СО2 в
угольную кислоту при участии фермента карбоангидразы.
Угольная кислота диссоциирует и подкисляет содержимое
эритроцита, что улучшает отдачу оксигемоглобином кислорода в
ткани.
21.
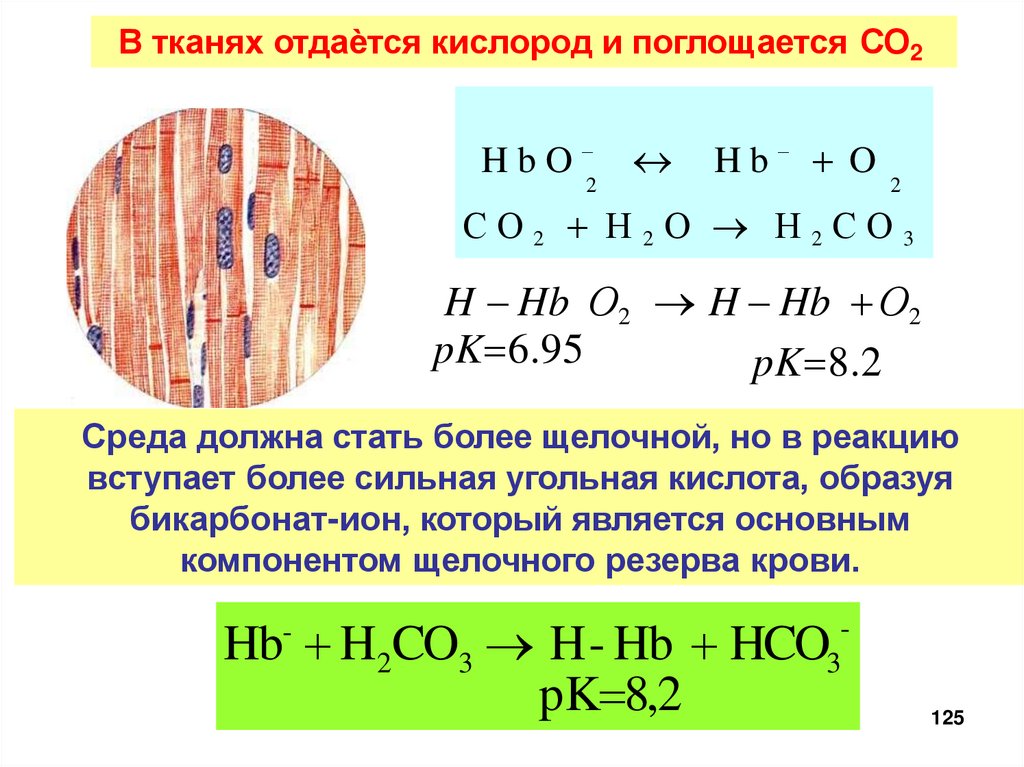
В тканях отдаѐтся кислород и поглощается СО2HbO
2
Hb O
2
СО2 Н2О Н2СО3
H Hb О2 H Hb О2
pK 6.95
pK 8.2
Среда должна стать более щелочной, но в реакцию
вступает более сильная угольная кислота, образуя
бикарбонат-ион, который является основным
компонентом щелочного резерва крови.
Hb H2CO3 H- Hb HCO
pK 8,2
-
3
125
22.
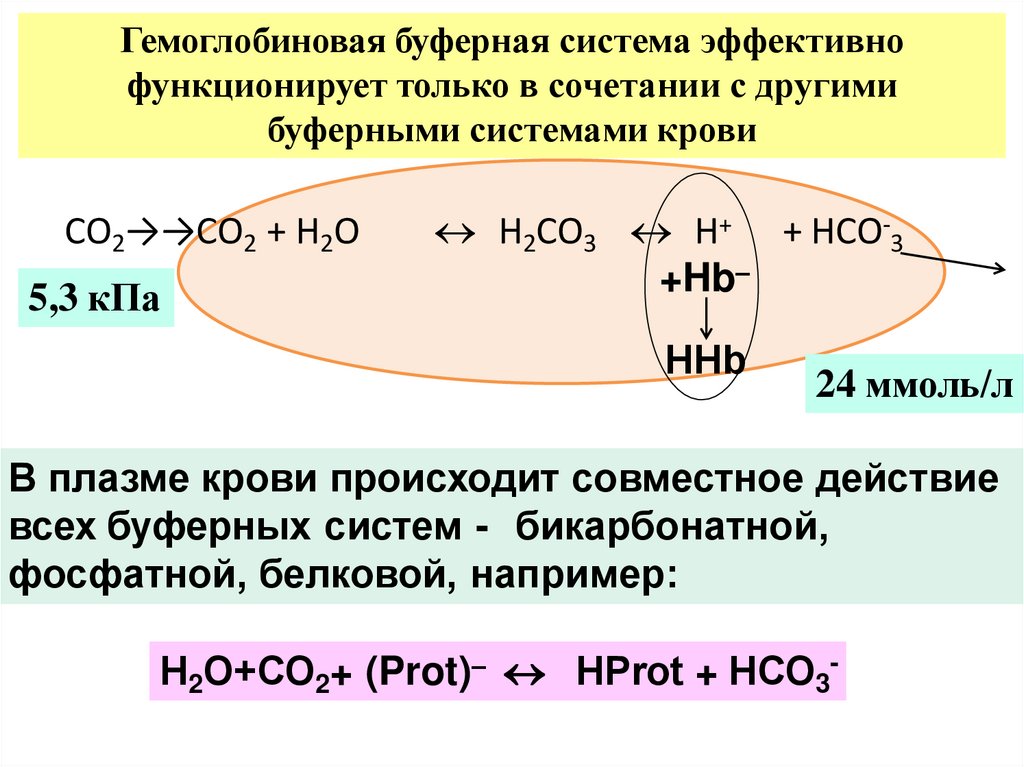
Гемоглобиновая буферная система эффективнофункционирует только в сочетании с другими
буферными системами крови
СО2→→СО2 + Н2О
5,3 кПа
Н2СО3 Н+ + НСО-3
+Hb–
НHb
24 ммоль/л
В плазме крови происходит совместное действие
всех буферных систем - бикарбонатной,
фосфатной, белковой, например:
Н2О+СО2+ (Prot)– HРrot + НСО3-
23.
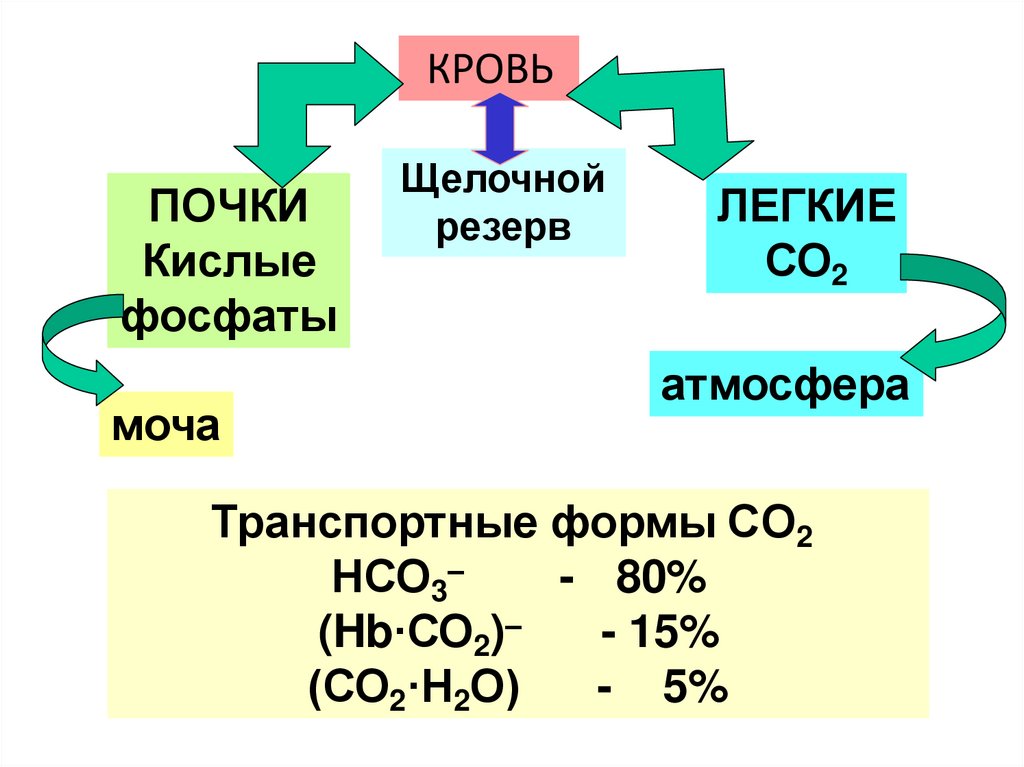
КРОВЬПОЧКИ
Кислые
фосфаты
моча
Щелочной
резерв
ЛЕГКИЕ
СО2
атмосфера
Транспортные формы CО2
НСО3–
- 80%
(Hb·СО2)–
- 15%
(СО2·Н2О)
- 5%
24.
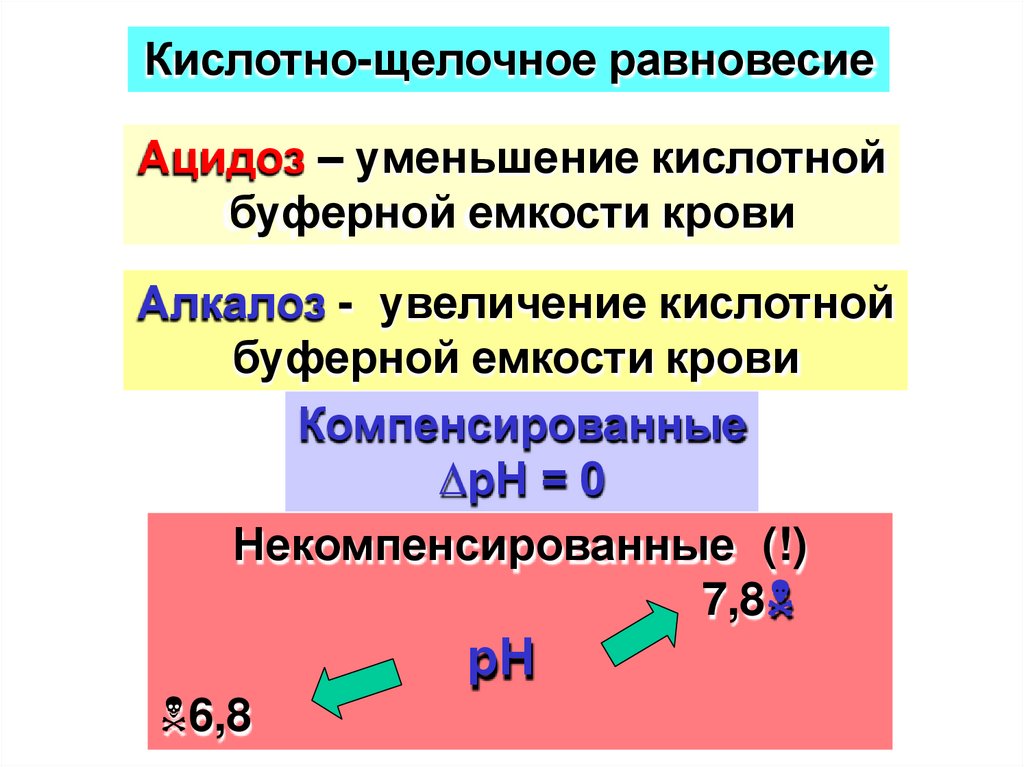
Кислотно-щелочное равновесиеАцидоз – уменьшение кислотной
буферной емкости крови
Алкалоз - увеличение кислотной
буферной емкости крови
Компенсированные
∆рН = 0
Некомпенсированные (!)
7,8
рН
6,8
25.
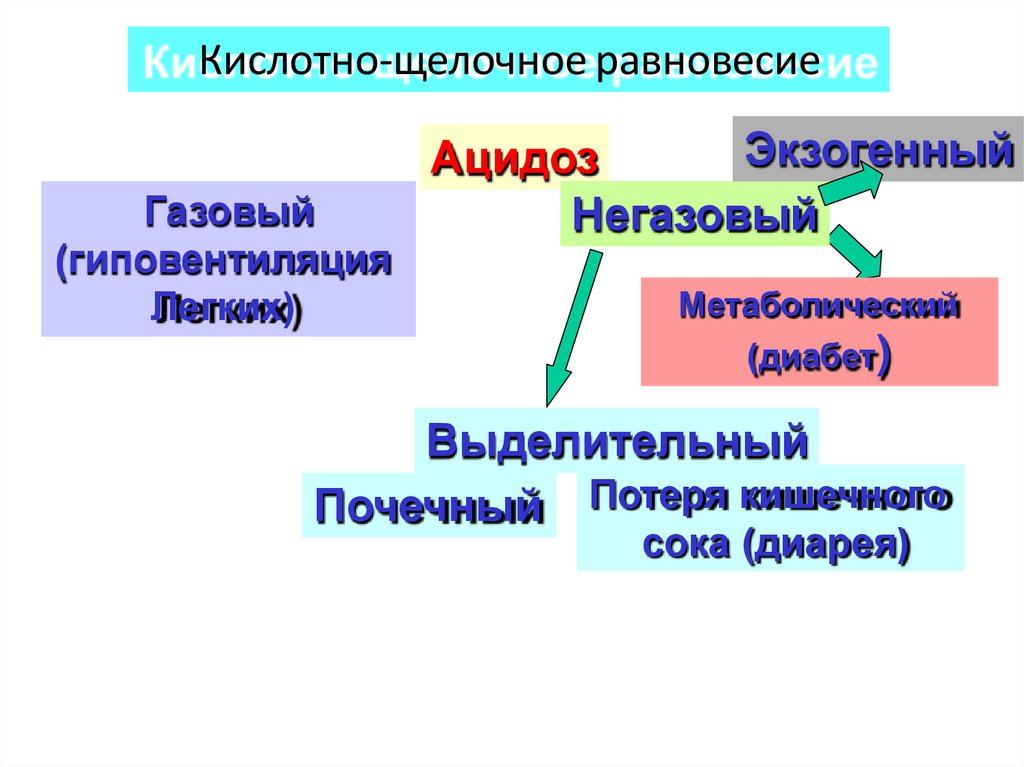
Кислотно-щелочное равновесиеГазовый
(гиповентиляция
Легких)
Экзогенный
Ацидоз
Негазовый
Метаболический
(диабет)
Выделительный
Почечный Потеря кишечного
сока (диарея)
26.
Кислотно-щелочное равновесиеЭкзогенный
АЛКАЛОЗ
Газовый
Негазовый
(гипервентиляция
Метаболилегких)
ческий
Выделительный
Потеря желудочного
Почечный
сока
27.
Кислотно-щелочное равновесиерН = 7,35 – 7,45
6,8 - 7,8
рСО2 = 40 5 мм рт ст (5,3 кПа)
10 – 130 мм рт ст
с(НСО3–) = 24,4 ± 3 ммоль/л
ВВ = 42 ± 3 ммоль/л










 Химия
Химия








