Похожие презентации:
Протолитические равновесия. Буферные растворы. Лекция 1
1.
Ставропольский государственный медицинский университетКафедра общей и биологической химии
Лекция 1
«Протолитические равновесия. Буферные
растворы»
1
2.
Цель лекции:формирование знаний о составе и механизме
действия буферных систем, необходимых для
обоснования протекающих в условиях живых
системах
процессов
протолитического
гомеостаза.
2
3. План лекции:
1. Основные положения протолитическойтеории Бренстеда- Лоури.
2. Буферные растворы и их
количественные характеристики.
3. Буферные системы крови.
4. Кислотно- основное состояние
организма. Ацидоз. Алкалоз.
4.
ТеорияАррениуса
БренстедаЛоури
Льюиса
Кислота
Основание
Диссоциирует с
Диссоциирует с
образованием ионов H+ образованием ионов
(HNO3 и др.)
OH- (NaOH и др.)
Донор протонов
(NH4+, HCl,
[Cu(H2O)6]2+ )
Акцептор протонов
(NH3, OH-, PO43- )
Акцептор электронной Донор электронной
пары (BF3, Ag+ )
пары (NH3, F- )
4
5.
Протонная (протолитическая)теория кислот и оснований- теория
Бренстеда-Лоури (1923 г.)
Йоханнес Николаус Бренстед
(1879—1947) — датский
физикохимик
Томас Мартин Лоури
(1875 — 1936) — английский
химик
5
6.
Кислота –acid - молекулярная частица или иондонор протонов (НА, ВН+ )НА
⇄
кислота
Н+ + А–
сопряженное
основание
Основание -base- молекулярная частица или
ион акцептор протонов ( В, А–)
В + Н+ ⇄ ВН+
основание
сопряженная
кислота
Амфолит- молекулярная частица или ион,способная
быть как донором, так и акцептором протонов
6
7.
Кислота и сопряженное основание - сопряжённаякислотно- основная (протолитическая) пара
НА
А–
В ВН+
к-та
сопр.
осн-е
осн-е
сопр.
к-та
СН3СООН Н+ + СН3СОО–
К-та
Протолитическая пара:
сопр. осн-е
СН3СООН / СН3СОО–
К-та
Сопр. осн-е
!! Чем слабее кислота, тем сильнее сопряженное
основание
7
8. Количественные характеристики кислот и оснований Бренстеда
Количественно кислотность и основность оценивают, какправило, по отношению к воде как основанию НА Н+ + А–
Н+ + H2O H3O+
Мерой кислотности является константа равновесия,
называемая константой кислотности (Ka)
Ka=[A-] [H3O+]/[AH]
Показатель кислотности pKа = -lg Kа
!!! Чем больше Ка, тем меньше рКа и тем сильнее кислота и слабее
сопряженное основание
Условно кислоты делят на "сильные" pKa < 0 и "слабые" pKa 2-15.7
8
9. Мерой основности является константа равновесия, называемая константой основности Кb
В + H2O В‧ H2O ВН+ + OHKb =[ВН+] [OH- ] / [В‧ H2O]Показатель основности рKb = -lg Kb
!!! Чем больше Кв, тем меньше рКв и тем сильнее
основание и слабее сопряженная кислота
9
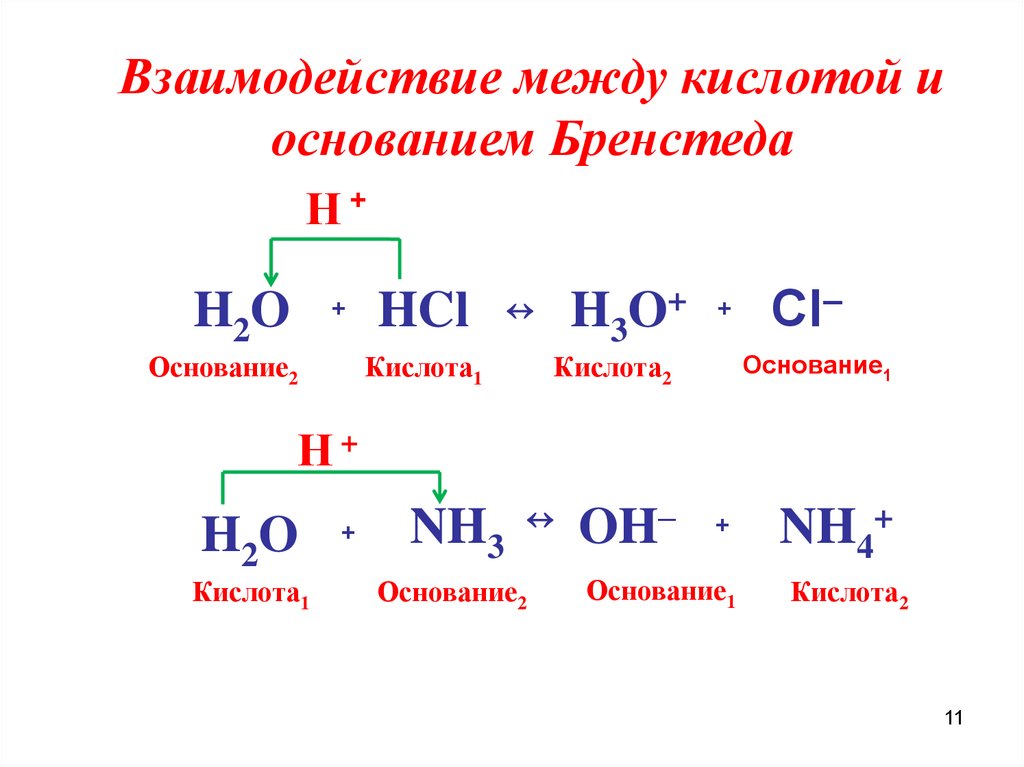
10. Взаимодействие между кислотой и основанием Бренстеда- протолитическая реакция
сопряженная кислотно- основная пара (1)Кислота1 Основание2 ↔ Основание1 Кислота2
сопряженная кислотно- основная пара (2)
В результате конкуренции за протон между основаниями
взаимодействующих кислотно-основных пар
устанавливается кислотно- основное (протолитическое )
равновесие. Смещено в сторону образования более слабых
кислот и оснований
11.
Взаимодействие между кислотой иоснованием Бренстеда
Η+
H2O
+
Основание2
HCl
Кислота1
H3O+ + Cl–
Основание1
Кислота2
Η+
Кислота1
+
H2O
NH3 OH–
Основание2
+
NH4+
Основание1
Кислота2
11
12. Кислотно-основное (протолитическое) равновесие
Побеждает пара, которая содержит более сильныйакцептор протона (основание).
! ! Протолитическое равновесие смещается в
сторону образования более слабой кислоты
12
13. КОС (кислотно-основное состояние)-
КОС (кислотно-основное состояние)относительное постоянство реакции внутреннейсреды организма, количественно
характеризующееся концентрацией H+
Концентрацию H+ выражают с помощью
величины рН
13
14. Протолитический гомеостаз
выражается в достаточно постоянных значениях рНбиологических сред и в способности восстанавливать
рН при поступлении в эти среды кислот и оснований
14
15. Водородный показатель – рН -
Водородный показатель – рН это мера активной кислотности (в случае разбавленныхрастворов отражает концентрацию) ионов водорода в растворе
pН = – lg[H+]
Показатель основности раствора
рОН = – lg[OH–]
Кw = [H+] · [OH–] = 10-7моль/л · 10-7моль/л =10–14 [моль2/л2]
Кw -ионное произведение воды (при 25°C)
– lg[H+]+(– lg[OH–])=– -lg10–14
рН + рОН = 14
[H+] > [OH–],среда кислая рН< 7
[OH–] > [H+],среда щелочная, рН > 7
[H+] =[OH–],среда нейтральная, рН=7
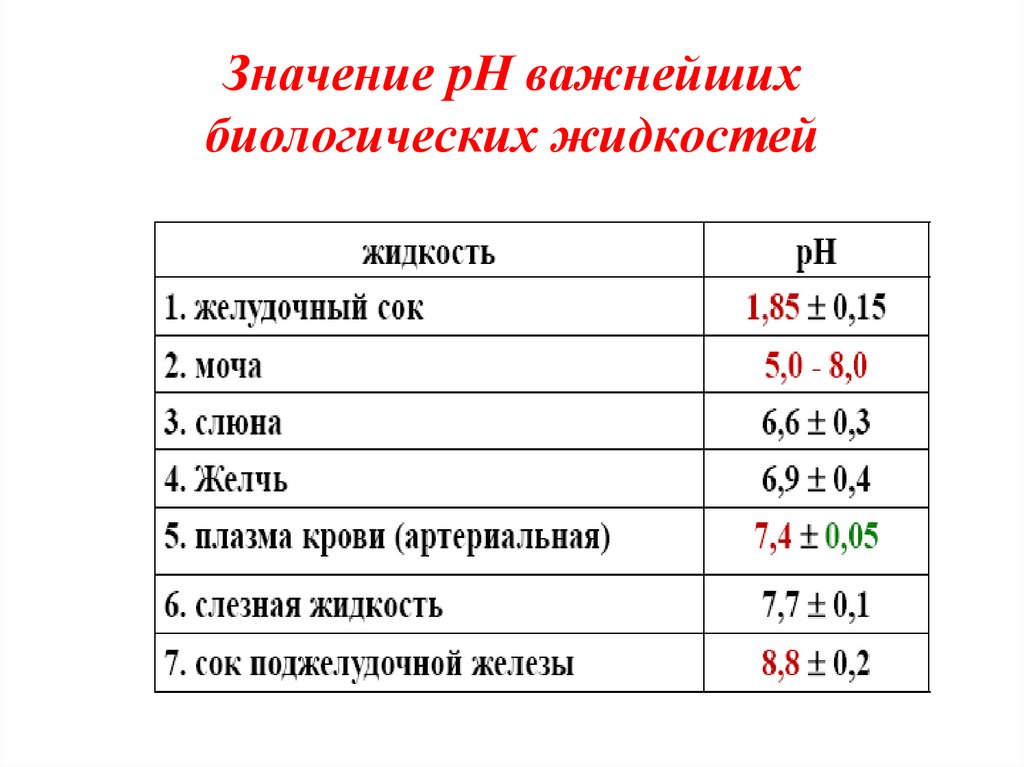
16. Значение рН важнейших биологических жидкостей
17. Биологическое значение регуляции КОС
1. H+, соединяясь с органическими молекулами, меняют ихстроение и свойства:
Белков (главное ферментов)
Нуклеиновых кислот
Углеводов
Липидов (амфифильных) и т.д.
В организме происходит накопление кислот и оснований,
при этом кислоты обычно накапливаются быстрее , чем
основания.
17
18. Источники кислот и оснований в организме
Эндогенное происхождение (метаболизм)Кислоты
Н2СО3 = 20 моль/сут.
HCl, Н2SO4, H3PO4,
окси-, кето-, амино-,
нуклеиновые,
жирные и т.д. = 80 ммоль/сут
Основания
• Аммиак,
аминокислоты аргинин,
лизин,
• биогенные амины:
катехоламины,
гистамин, серотонин) и т.д
Экзогенное происхождение (пища)
Кислоты
Уксус, лимонная к-та, яблочная
кислота и т.д.
Основания
Сода NaHCO3
18
19. Механизмы регуляции кислотно-основного состояния в организме
• Физиологические ( органы и ткани: легкие, почки,костная ткань, печень, кожа, ЖКТ)
• Физико-химические
В основе физико-химических механизмов регуляции лежит
поддержание постоянства рН внутренней среды буферными
системами организма, которые представлены буферными
системами крови, клеток и внеклеточных пространств тканей
19
20. Буферные системы (БС) -
Буферные системы (БС) равновесные протолитические системы, способныесохранять практически постоянное значение рН при
добавлении небольших количеств кислот и щелочей, а
также при разбавлении .
Раствор, содержащий буферные системы- буферный раствор.
! В результате метаболизма в организме человека ежесуточно образуется
количество кислоты ≈ 25л НCI (конц.).
ΔрН на 0,6 единиц- летальный исход !!!
21. Классификация буферных систем
1. Кислотные: слабая кислота + соль этой кислотыА– НА
Гидрокарбонатная
, в растворе:
Фосфатная
, в растворе:
21
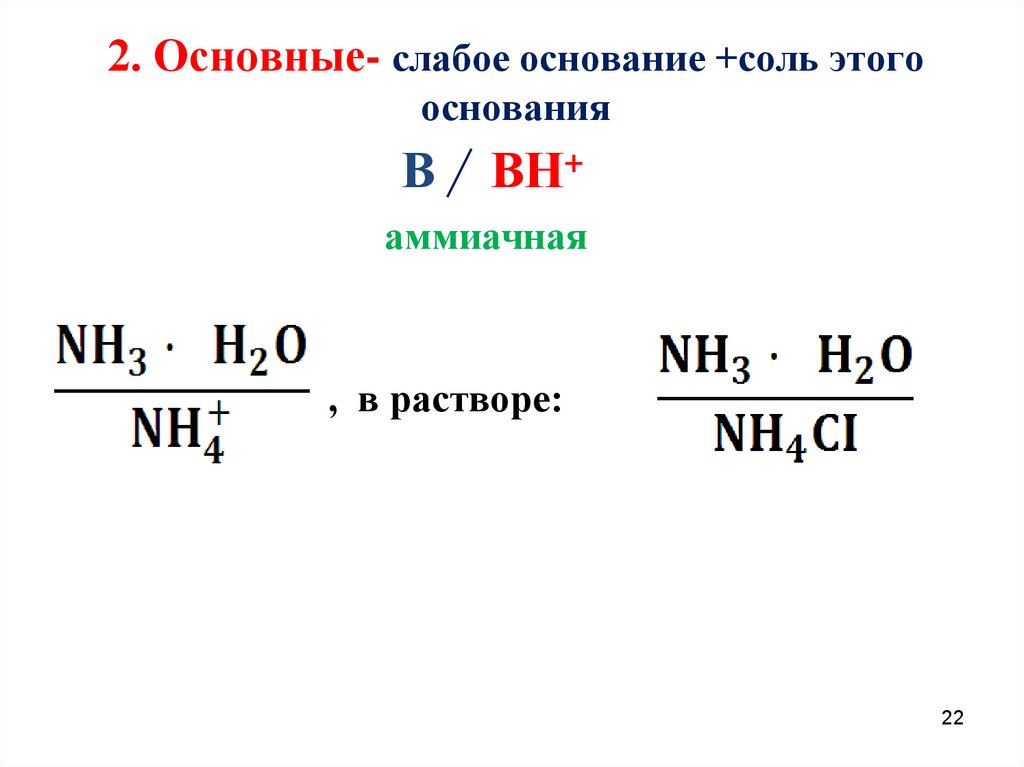
22. 2. Основные- слабое основание +соль этого основания
ВВН+
аммиачная
, в растворе:
22
23.
3. Ионы и молекулы амфолитовБелковая и аминокислотная буферная
система
в водных растворах:
NH2–Рt–СООН (R) NH3+–Pt–COO– (R±)
акцептор
протона
донор
протона
донор
протона
акцептор
протона
(биполярный ион)
рI (ИЭТ)
– изоэлектрическая точка белка – значение рН, при
котором молекула белка, в целом,
электронейтральна
23
24.
При добавлении сильной кислоты:NH 3 Pt COO H NH 3 Pt COOH
катион белкаR+
При добавлении щелочи:
NH 3 Рt COO OH NH 2 Pt COO H 2O
Η+
анион белка R–
24
25. Белковая буферная система
+NH -Pt-COO акцептор протона
Катионная
+
Анионная
NH -Pt-COO
3
NH3-Prot-COOН донор протона
2
+ NH - Pt-COO3
акцептор протона
-
донор протона
Pt - остаток макромолекулы белка
25
26. Буферное действие- способность буферных систем сохранять постоянство pH Механизм буферного действия:
Буферное действиеспособность буферных систем сохранятьпостоянство pH
Механизм буферного действия:
HCO3- / H2CO3 к данной протолитической
системе
а)добавим сильную кислоту: HCl → H+ + ClHCO3- + H+ ↔ H2CO3 ↔ CO2 + H2O
б)добавим сильное основание: NaOH → Na+ + OH-
H2CO3 + OH- ↔ HCO3- + H2O
H+
27. Эквивалентная замена: сильная кислота HCl → H2CO3 слабая кислота сильное основание NaOH → HCO3- слабое снование Вывод: в БС
кислотный компонент нейтрализуетсильное основание, основный- сильную кислоту,
поэтому рН БС практически не изменяется
в основных БС анион (основание Бренстеда)
работает против кислоты, а кислотапротив щелочи
28. КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ БУФЕРНЫХ СИСТЕМ: рН Буферная емкость Зона буферного действия
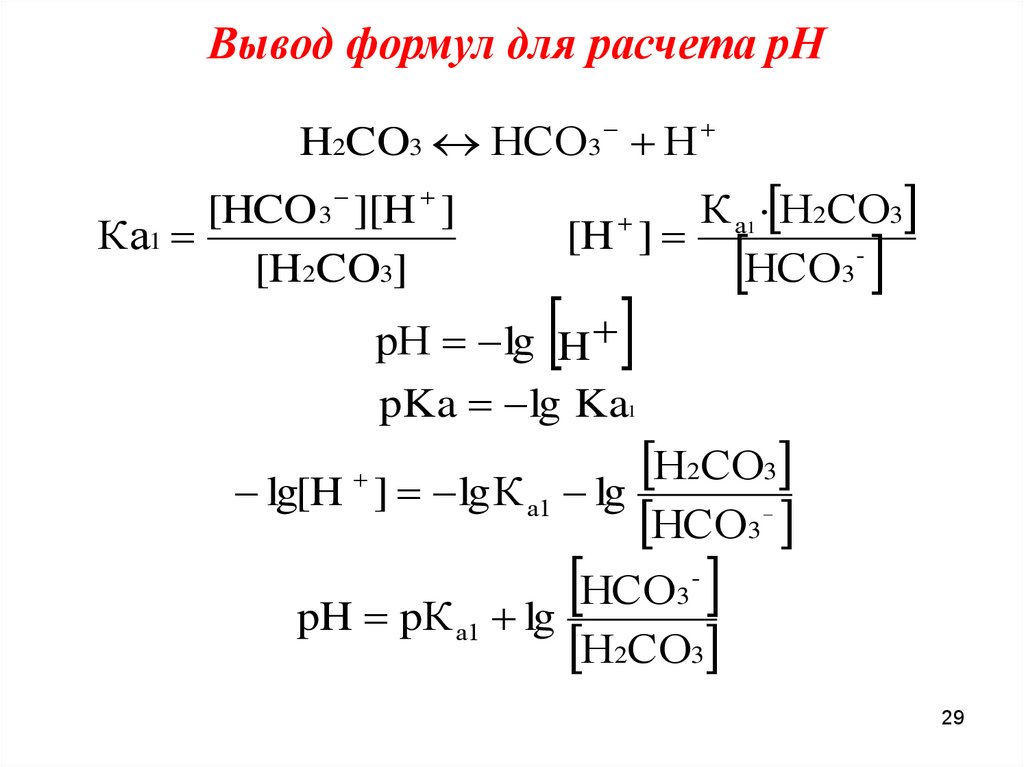
29.
Вывод формул для расчета рНH2CO3 НCO3 Н
К а1 · Н2СО3
[H ]
НСО3 рН lg H
[HCO 3 ][H ]
Ка1
[H2CO3]
pKa lg Ka1
Н2СО3
lg[H ] lgК а1 lg
НСО3
НСО
pH pК lg
3
а1
-
Н2СО3
29
30.
Уравнение Гендерсона-ГассельбахаВ общем случае:
pH рКа lg
С
сопр.основание
С
кислота
акцепторН
рН рКа lg
донорН
30
31.
рН буферного раствора зависит от:Природы компонентов (рК слабой кислоты или
основания)
Соотношения концентраций компонентов (кислоты и
соли)
Температуры
!!! рН не зависит от разбавления, т.к. концентрация
компонентов уменьшается, но соотношение остаётся
постоянным
31
32.
Для основного буферного раствора:pH 14 pKв lg
Cосн
Ссопр. к-та
32
33.
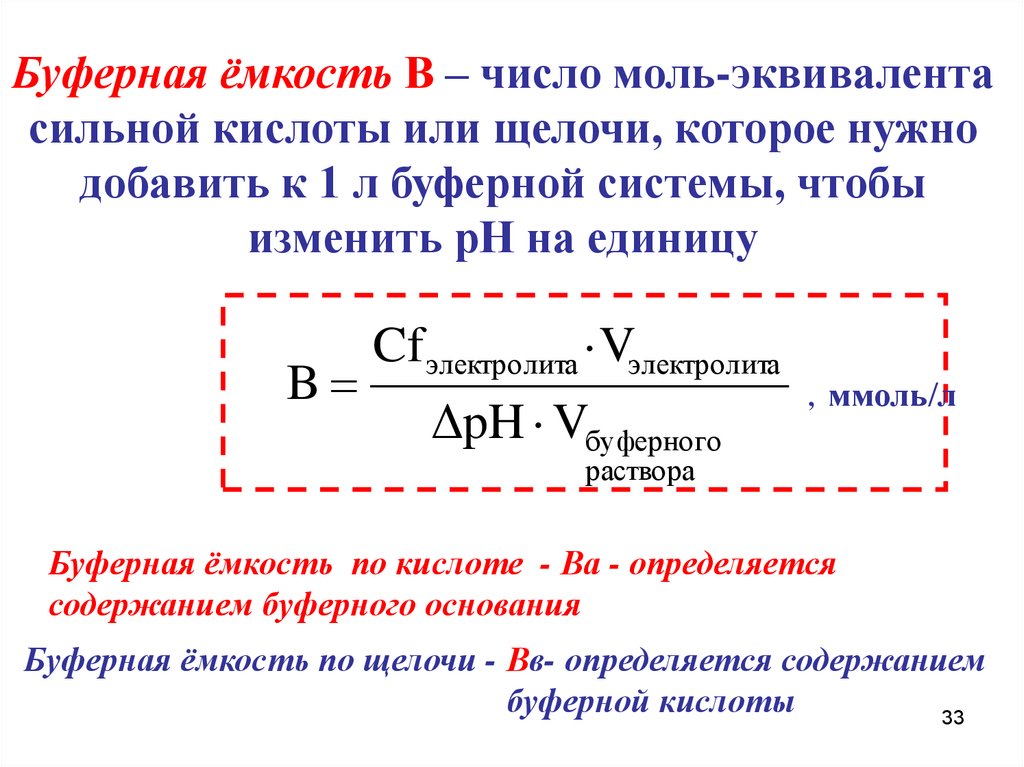
Буферная ёмкость В – число моль-эквивалентасильной кислоты или щелочи, которое нужно
добавить к 1 л буферной системы, чтобы
изменить рН на единицу
B
Cf электролита ·Vэлектролита
ΔpH · Vбуферного
, ммоль/л
раствора
Буферная ёмкость по кислоте - Ва - определяется
содержанием буферного основания
Буферная ёмкость по щелочи - Вв- определяется содержанием
буферной кислоты
33
34.
Буферная ёмкость зависит от:Абсолютных концентраций компонентов
От соотношения компонентов
и максимальна при соотношении 1 : 1,
когда рН = рКa, при этом Вa = В b
От рН буферного раствора
!!! БЕ уменьшается при разбавлении, т.к.
уменьшаются концентрации компонентов
34
35.
Зона буферного действия1.Буферное действие зависит от соотношения
компонентов буферной системы
2. Зона буферного действия - определённый
интервал значений рН, в пределах которого
сохраняется буферное действие
pH pKа 1
35
36.
Буферные системы организмаГлавный источник ионов водорода в организме - углекислый
газ, образующийся в результате метаболизма
(15000 моль/сутки):
СО2 + Н2О ⇄ СО2∙Н2О ⇄Н2СО3⇄ HCO3 + Н+
В меньшей степени - (30–80 ммоль/сутки) кислоты:
-серная (в результате обмена серусодержащих аминокислот),
-фосфорная (при метаболизме фосфорсодержащих
соединений),
-органические кислоты, образующиеся при неполном
окислении липидов и углеводов
36
37.
Защитные функции по поддержанию рНвыполняют :
Гидрокарбонатная БС
Фосфатная БС
Гемоглобиновая БС
Белковая БС
37
38. Распределение буферных систем плазмы крови, цельной крови по буферной ёмкости
Плазма кровиГидрокарбонатная→белки → фосфатная →
→аминокислоты
Цельная кровь (эритроциты)
Гемоглобиновая → гидрокарбонатная →
→фосфатная → белковая
39.
I. Гидрокарбонатная буферная система55%буферной емкости крови
Зона буферного действия pH=5,4-7,4
Содержится в эритроцитах, межклеточной
жидкости, в почечной ткани, cлюне
HCO 3
20
18
или
H 2 CO3
1
1
Ва>Вв
В физиологических условиях с учётом
растворенного СО2 (37oС)
3
HCO
Ка
CO2 H 2CO3
Kа 7,76·10 7
pKа 6,11
39
40.
Уравнение Гендерсона-Гассельбаха(для расчета рН крови)
3
[HCO ]
pH 6,11 lg
s pСO 2
рСО2 – альвеолярное давление (парциальное
давление СО2 воздуха, находящегося в равновесии с
кровью)
S – коэффициент, учитывающий растворимость
газов в жидкости (S= 0,033)
40
41.
Расчёт рН крови[ HCO3 ] 23,9 ммоль / л
S ·pCO2 0,033·40 мм рт.столба 1,2
23,9
pH крови 6,11 lg
7,4
1,2
20
pH крови 6,11 lg
7,4
1
41
42.
Механизм действия гидрокарбонатнойбуферной системы
1. При увеличении в крови концентрации ионов Н+ :
H+ + HCO3– H2CO3 CO2 + H2O
выводится через легкие за 10-15 мин
2. При поступлении в кровь оснований:
OH– + H2CO3 HCO3– + H2O
H+
избыток удаляется через почки
Система быстрого реагирования. Восстанавливается счет
легочной вентиляции в течение 10-18 часов.
42
43.
II. Фосфатная буферная система:Зона буферного действия
рН=6,2-8,2
КН2РО4 и К2НРО4 -в клетках (ткани почек,
пищеварительных желёз)
NaH2PO4 и Na2HPO4- в плазме крови, межклеточной
жидкости, cлюне .
В норме:
НРO 4
2
H 2 PO 4
4
1
Ва>Вв
Уравнение буферного действия:
2
НРO 4
рН 6,8 lg
H 2 PO 4
43
44.
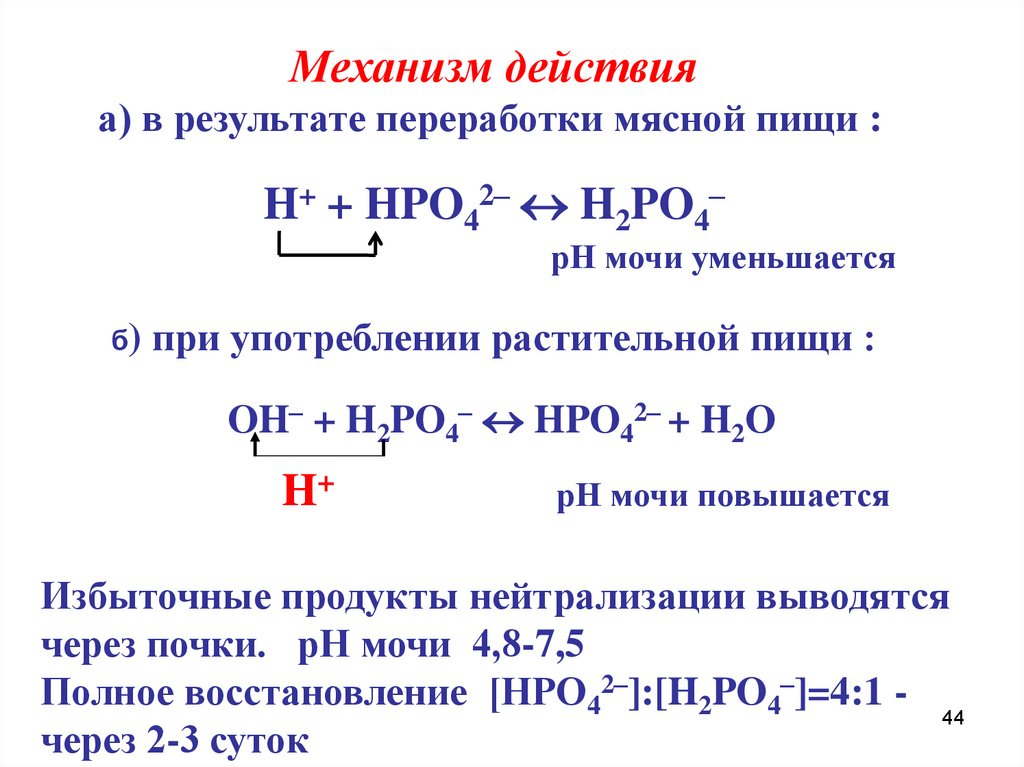
Механизм действияа) в результате переработки мясной пищи :
H+ + HPO42– H2PO4–
рН мочи уменьшается
б) при употреблении растительной пищи :
OH– + H2PO4– HPO42– + H2O
H+
рН мочи повышается
Избыточные продукты нейтрализации выводятся
через почки. рН мочи 4,8-7,5
Полное восстановление [НРО42–]:[H2PO4–]=4:1 44
через 2-3 суток
45.
III. Белковая буферная системаподдерживает постоянство рН в клетках и
тканях, причем:
катионная (R+ ) в средах с рН<6,
анионная (R- ) в средах с рН>6.
В крови работает анионный белковый буфер
Попадающие на кожу человека небольшие
количества кислоты или щелочи довольно быстро
нейтрализуются белковой буферной системой
45
46.
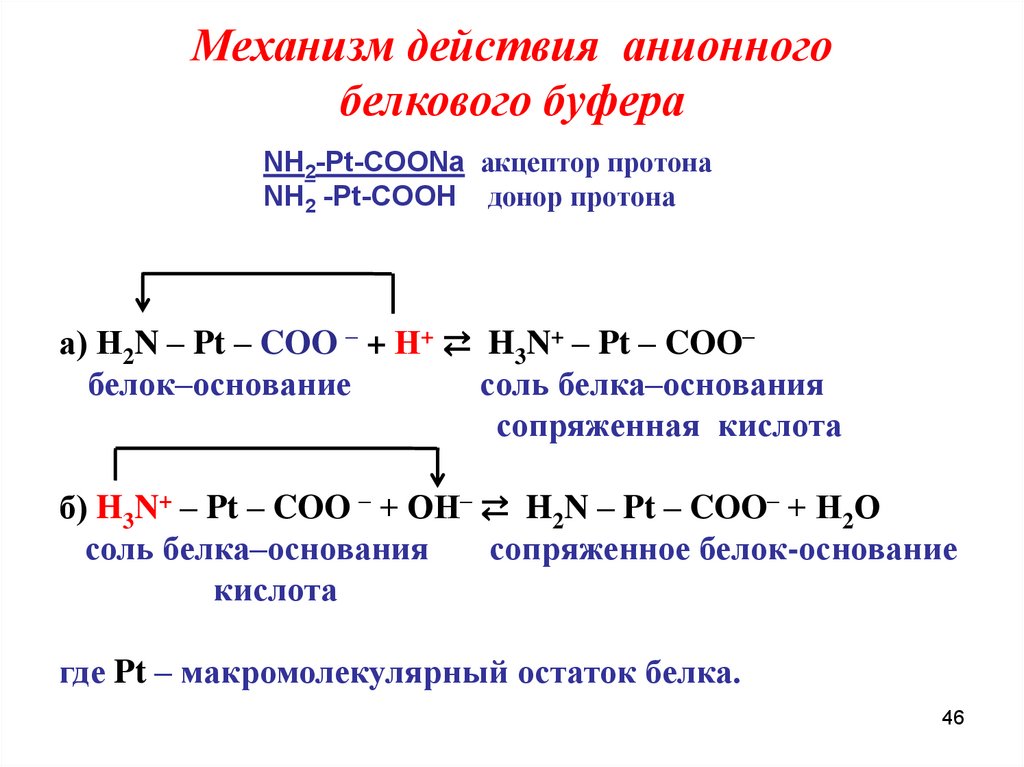
Механизм действия анионногобелкового буфера
NH2-Pt-COONa акцептор протона
NH2 -Pt-COOН донор протона
а) H2N – Pt – COO – + Н+ ⇄ H3N+ – Pt – COO–
белок–основание
соль белка–основания
сопряженная кислота
б) H3N+ – Pt – COO – + ОН– ⇄ H2N – Pt – COO– + Н2О
соль белка–основания
сопряженное белок-основание
кислота
где Pt – макромолекулярный остаток белка.
46
47.
IV. Гемоглобиновая буферная система:Гемоглобиновая
H-Hb
K-Hb
венозная кровь
рН = 7.32 – 7.36
~ 35 % общего
буферного
действия крови
Вв > Ва
Оксигемоглобиновая
HHbО2
К-HbО2
артериальная кровь
рН = 7.42 – 7.46
~ 63-75 % общего
буферного
действия
в эритроцитах
Ва > Вв
47
48.
Оксигемоглобин более сильная кислота, чемгемоглобин!
Механизм действия связан с присоединением и
отдачей кислорода
+
НвО
ННв + О2 ⇄ ННвО2⇄ Н +
2
ННв ⇄ Н+ + Нв–
48
49.
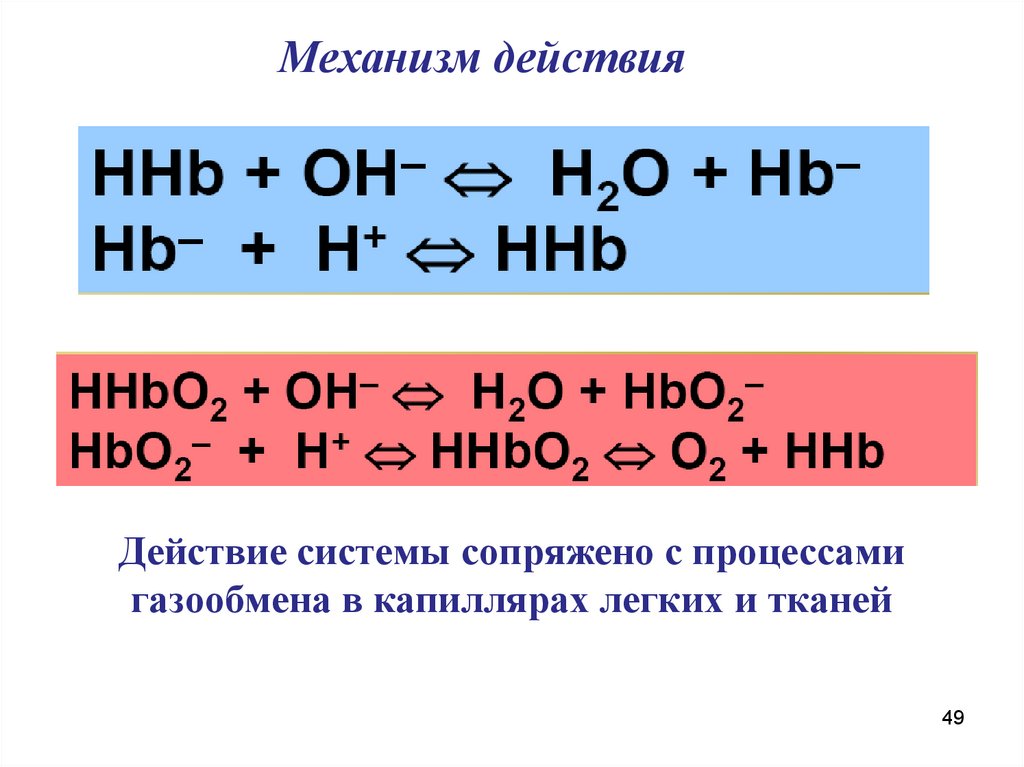
Механизм действияДействие системы сопряжено с процессами
газообмена в капиллярах легких и тканей
49
50.
Взаимосвязь гидрокарбонатной и гемоглобиновойбуферных систем
В легких идет процесс оксигенации:
H Hb О2 H НbО2
pKа 8.2
pKа 6.95
среда должна стать более кислой, но гидрокарбонатион взаимодействует с оксигемоглобином и
кислотность среды восстанавливается:
HCO3- + H-HbO2 → HbO2- + H2O + CO2↑
Η+
удаляется
через легкие
50
51.
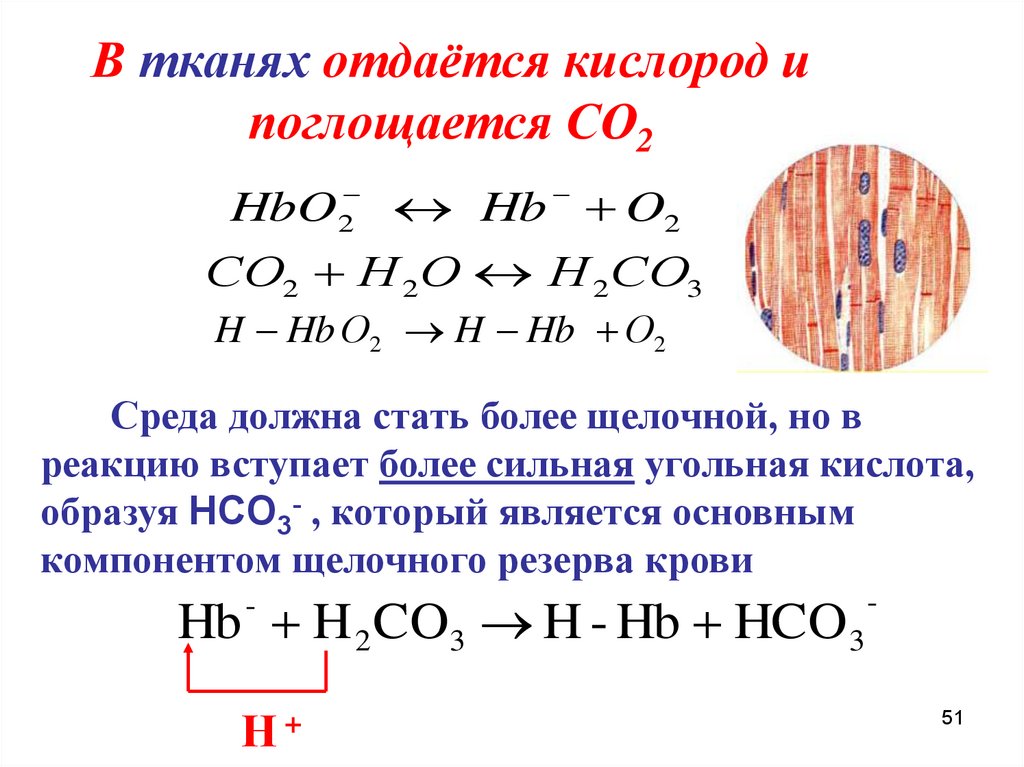
В тканях отдаётся кислород ипоглощается СО2
HbO
2
Hb O2
СО2 Н 2О Н 2СО3
H Hb О2 H Hb О2
Среда должна стать более щелочной, но в
реакцию вступает более сильная угольная кислота,
образуя HCO3- , который является основным
компонентом щелочного резерва крови
Hb H 2 CO3 H - Hb HCO 3
-
Η+
-
51
52.
Щелочной резерв кровиЧисло мл СО2, содержащееся в 100 мл крови
(главным образом в виде гидрокарбонатов НСО3-)
Норма:
50-70 % (по объему)
или 25-30 ммоль/л
52
53.
Кислотно- основное состояние организма.Ацидоз. Алкалоз.
53
54.
Все буферные системы организма обладают большейбуферной емкостью по кислоте, чем по основанию,
( поскольку характеризуются соотношением):
1 : 4 < [акцептор протона] : [донор протона] < 1 : 20
Это соотношение находится в соответствии с особенностями
метаболизма человеческого организма, образующего больше кислотных
продуктов, чем основных.
Именно поэтому очень важным показателем для физиологических сред
является буферная емкость Ва по кислоте.
При заболеваниях органов дыхания, кровообращения, печени,
желудка, почек, при отравлениях, голодании, диабете, ожоговой болезни
может наблюдаться уменьшение или увеличение Ва по сравнению с
нормой.
Возникают патологические явления: ацидоз и алкалоз.
54
55.
Ацидоз– накопление в организме кислых продуктов
уменьшение рН крови в сравнении с нормой (ацидемия)
(уменьшение Ва и щелочного резерва в сравнении с
нормой)
Алкалоз
– накопление в организме щелочных продуктов
увеличение рН крови в сравнении с нормой (алкалемия)
(увеличение Ва в сравнении с нормой , щелочной резерв
увеличивается)
55
56.
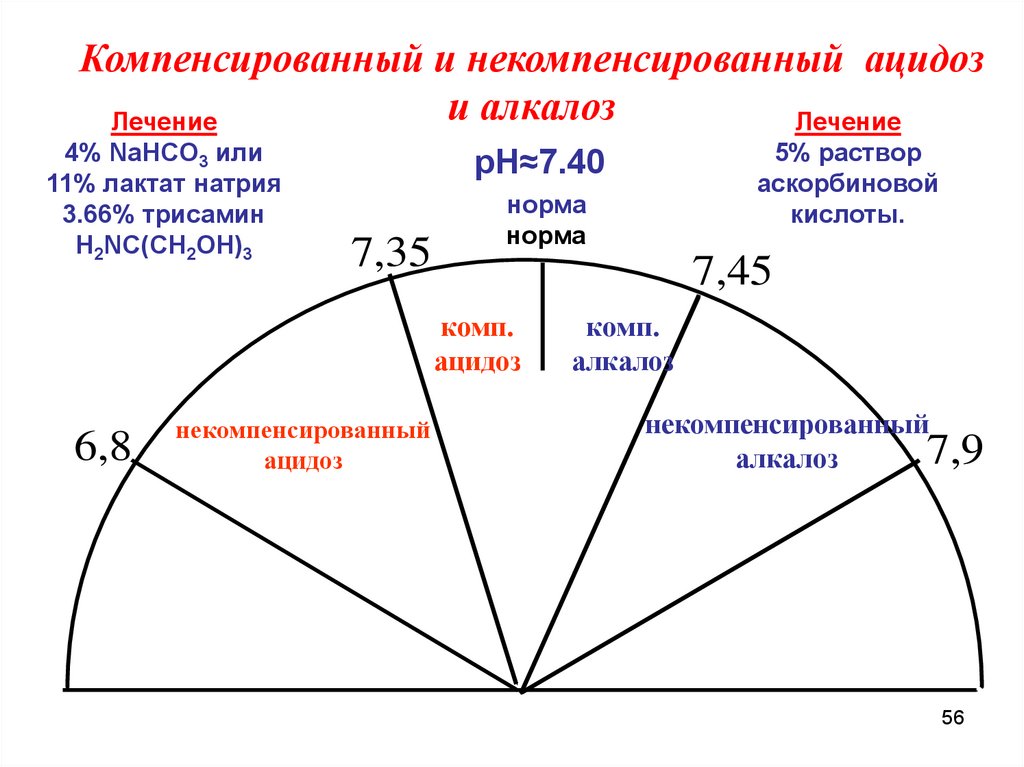
Компенсированный и некомпенсированный ацидози алкалоз
Лечение
Лечение
4% NaHCO3 или
11% лактат натрия
3.66% трисамин
Н2NС(СН2ОН)3
7,35
норма
норма
7,45
комп.
ацидоз
6,8
5% раствор
аскорбиновой
кислоты.
рН≈7.40
некомпенсированный
ацидоз
комп.
алкалоз
некомпенсированный
7,9
алкалоз
56
57.
МЕТАБОЛИЧЕСКИЙ АЦИДОЗНедостаток НСО3- или избыток нелетучих кислот
в межклеточной жидкости
Причины:
введение или образование стойких кислот
(молочная кислота при шоке, кетокислоты при
голодании и диабете);
неполное удаление кислот при почечной
недостаточности;
потеря НСО3- при заболеваниях ЖКТ;
кислородное голодание тканей.
57
58.
ДЫХАТЕЛЬНЫЙ АЦИДОЗИзбыток СО2 (вследствие понижения легочной
вентиляции –гиповентиляции по сравнению с
нормой)
Причины:
нарушение регуляции дыхания при травмах и опухолях
мозга, кровоизлияниях в мозг
введение транквилизаторов (барбитуратов)
отравление морфином, алкоголем
пневмония, отек легких, попадание инородных предметов в
дыхательный тракт
58
59.
ДЫХАТЕЛЬНЫЙ АЛКАЛОЗНедостаток СО2 (в связи с повышением легочной
вентиляции-гипервентиляции ,
в сравнении с нормой) .
Причины:
вдыхание разреженного воздуха;
тепловая отдышка;
лихорадочное состояние, истерия.
59
60.
МЕТАБОЛИЧЕСКИЙ АЛКАЛОЗУдаление кислот из организма или накопление
НСО3Причины:
потеря
Н+
при
рвоте
и
кишечной
непроходимости;
увеличение НСО3- при введении солей
органических кислот (лимонной, молочной,
уксусной, яблочной);
длительный приём
минеральной воды.
щелочной
пищи
или
60




















































 Химия
Химия








