Похожие презентации:
Виды химической связи
1.
ВИДЫ ХИМИЧЕСКОЙ СВЯЗИ
• ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЕТОК.
2.
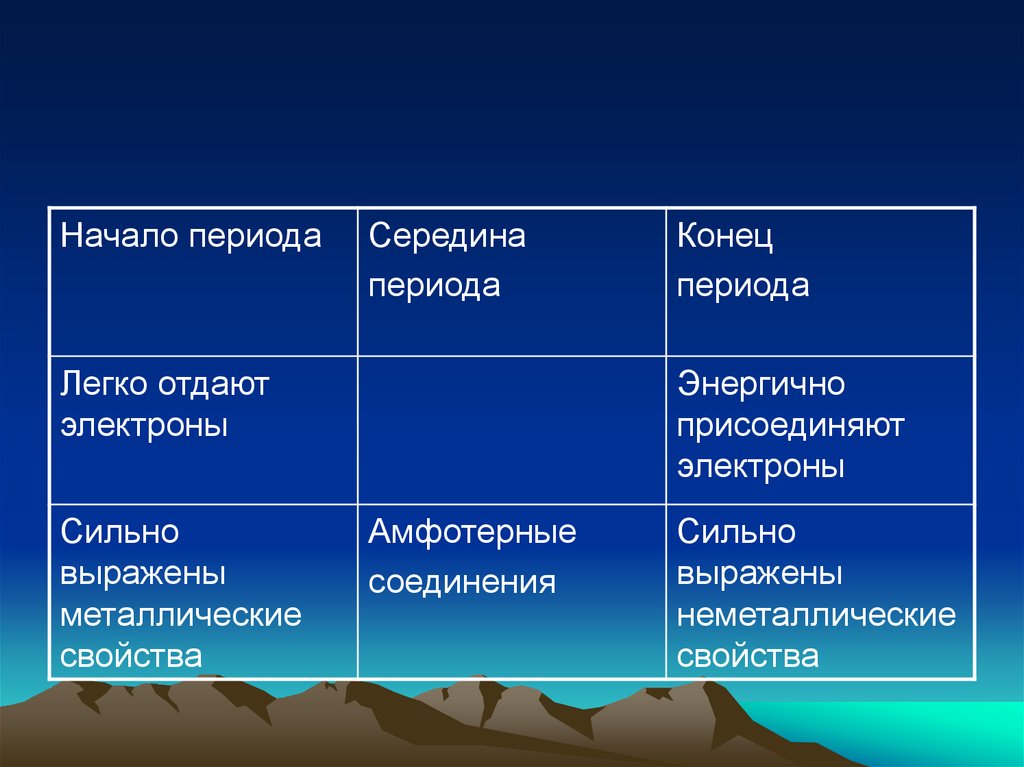
Начало периодаСередина
периода
Легко отдают
электроны
Сильно
выражены
металлические
свойства
Конец
периода
Энергично
присоединяют
электроны
Амфотерные
соединения
Сильно
выражены
неметаллические
свойства
3.
Электроотрицательность (ЭО)это свойство атома оттягивать насебя электроны от других атомов.
• Условно принята за единицу
электроотрицательность лития.
Соответственно вычисляют ЭО других
элементов. Получаем примерную шкалу
ЭО.
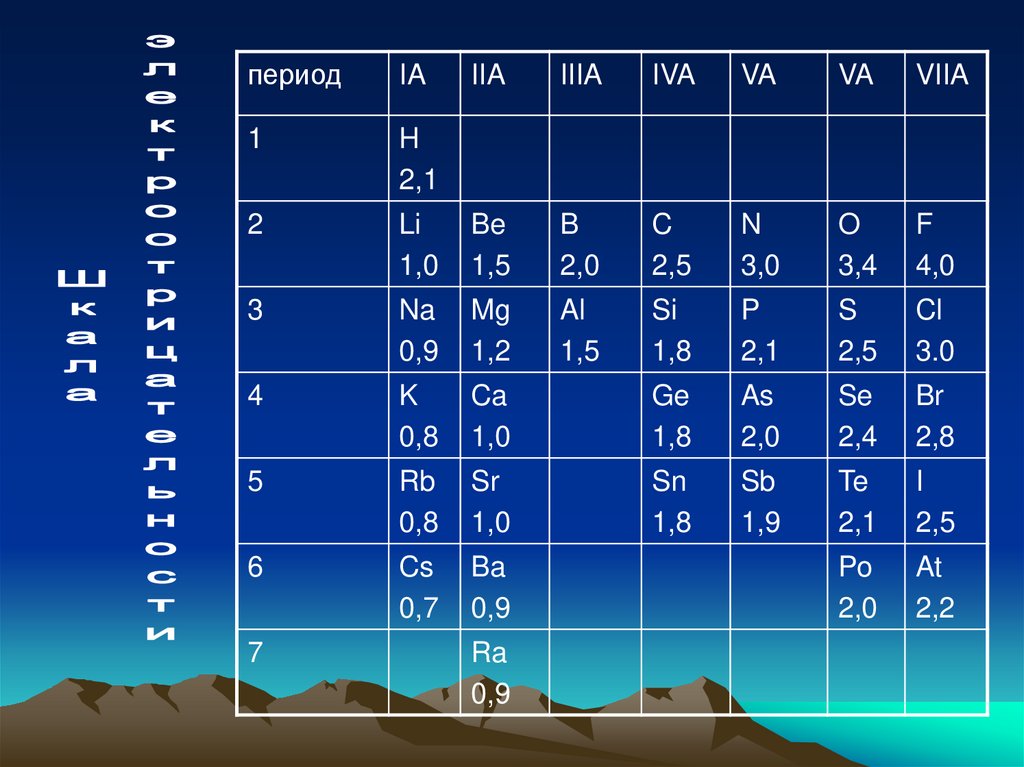
4. Шкала электроотрицательности
периодIA
1
H
2,1
2
IIA
IIIA
IVA
VA
VA
VIIA
Li
1,0
Be
1,5
B
2,0
C
2,5
N
3,0
O
3,4
F
4,0
3
Na
0,9
Mg
1,2
Al
1,5
Si
1,8
P
2,1
S
2,5
Cl
3.0
4
K
0,8
Ca
1,0
Ge
1,8
As
2,0
Se
2,4
Br
2,8
5
Rb
0,8
Sr
1,0
Sn
1,8
Sb
1,9
Te
2,1
I
2,5
6
Cs
0,7
Ba
0,9
Po
2,0
At
2,2
7
Ra
0,9
5.
• ЭО (с увеличением порядковогономера)
• в периоде –возрастает
• в группе уменьшается
6. Химическая связь-
Химическая связьэто взаимодействие, которое связываетотдельные атомы в молекулы.
Основным условием образования
химической связи является понижение
полной энергии многоатомной системы
по сравнению с энергией
изолированных атомов.
7.
• Согласно современнымпредставлениям, природа химической
связи объясняется взаимодействием
полей, образуемых электронами и
ядрами атомов, участвующих в
образовании химического соединения.
8.
• Химическая связь – это взаимодействиеатомов, обусловленное перекрываем их
электронных облаков, которое
сопровождается уменьшением полной
энергии системы.
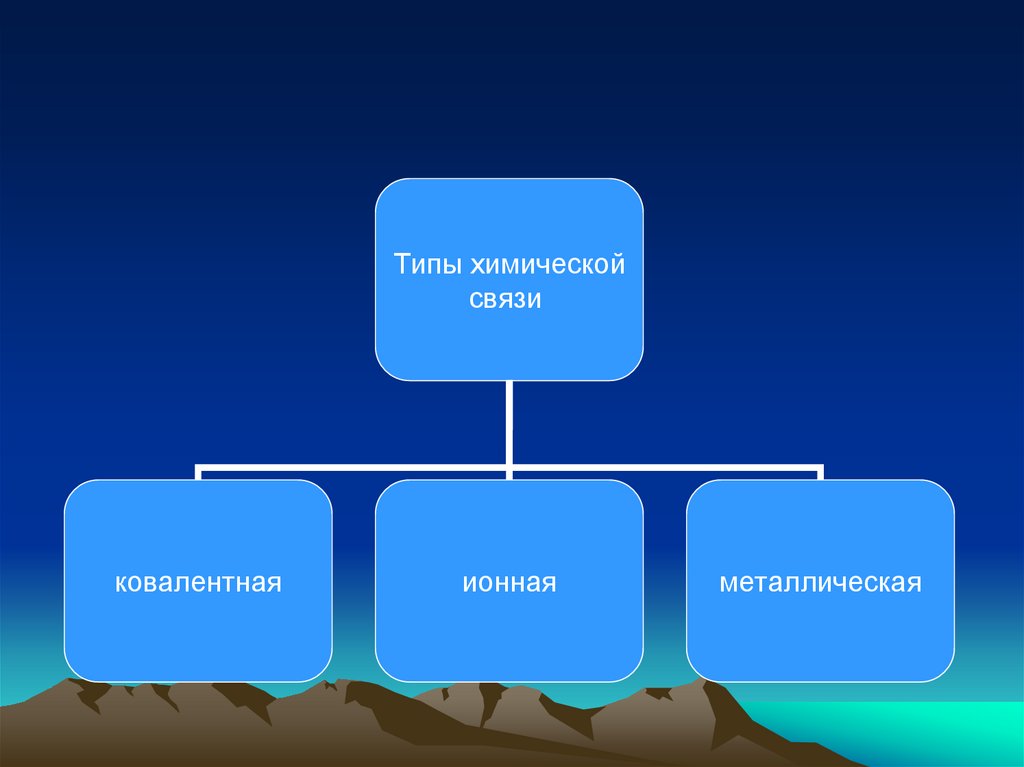
• В зависимости от характера распределения
электронной плотности различают три вида
химической связи:
9.
Типы химическойсвязи
ковалентная
ионная
металлическая
10. Ковалентная связь
Ковалентной называют связь,
которая возникает в неметаллах в
результате образования общих
электронных пар.
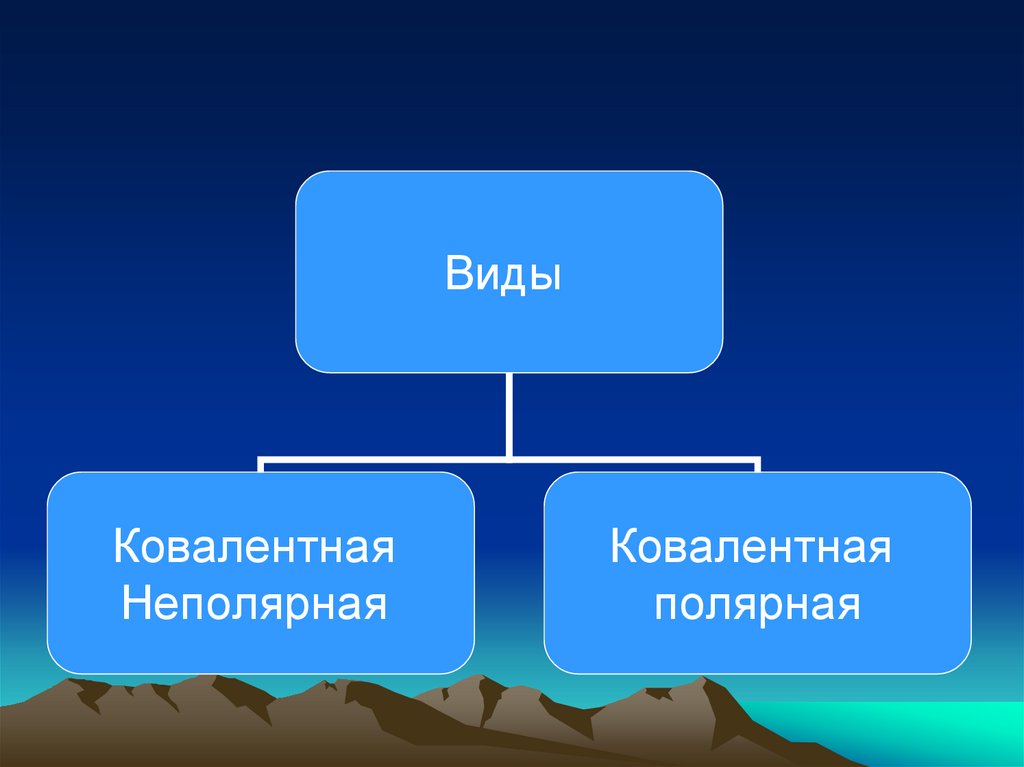
• Различают два вида ковалентной связи:
11.
ВидыКовалентная
Неполярная
Ковалентная
полярная
12.
• Ковалентная неполярная образуетсямежду неметаллами одинаковой ЭО.
• Например: N2; H2; O2;
• Общее электронное облако
расположено симметрично в
пространстве между ядрами
• Н(:)Н
13.
• Ковалентная полярная образуется внеметаллах разной ЭО. Общее
электронное облако смещено в сторону
более электроотрицательного
элемента.
• Пример: H(:Cl
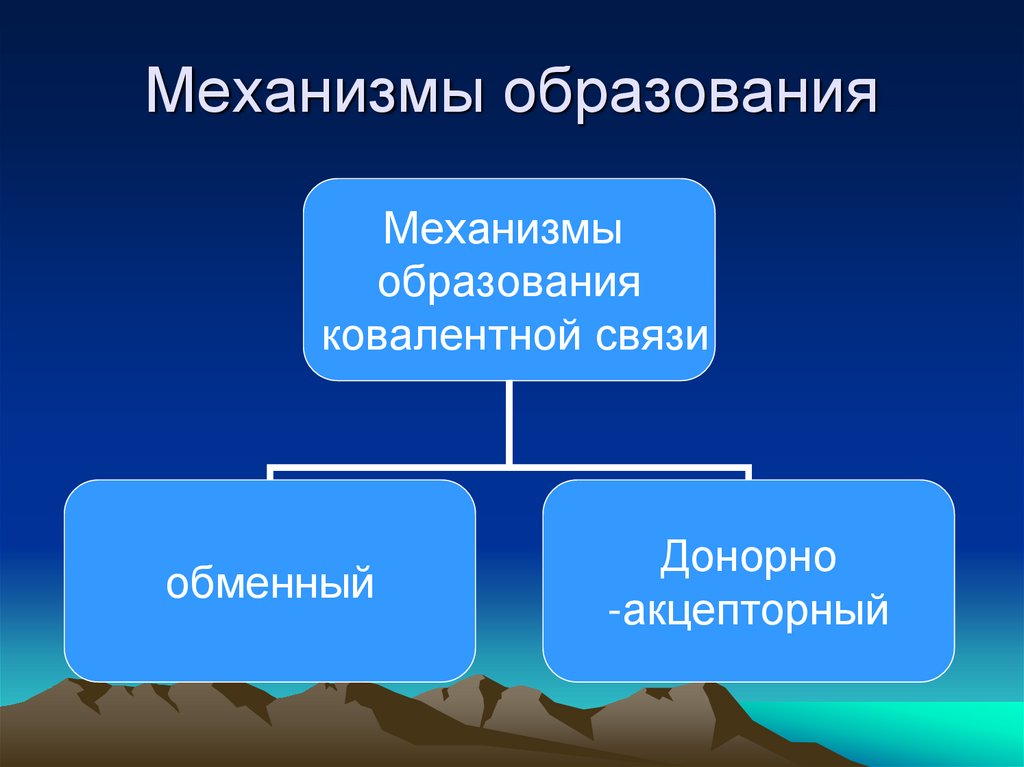
14. Механизмы образования
Механизмыобразования
ковалентной связи
обменный
Донорно
-акцепторный
15. Обменный механизм
• Общая электронная пара возникает привзаимодействии двух электронов
• Сl : Cl
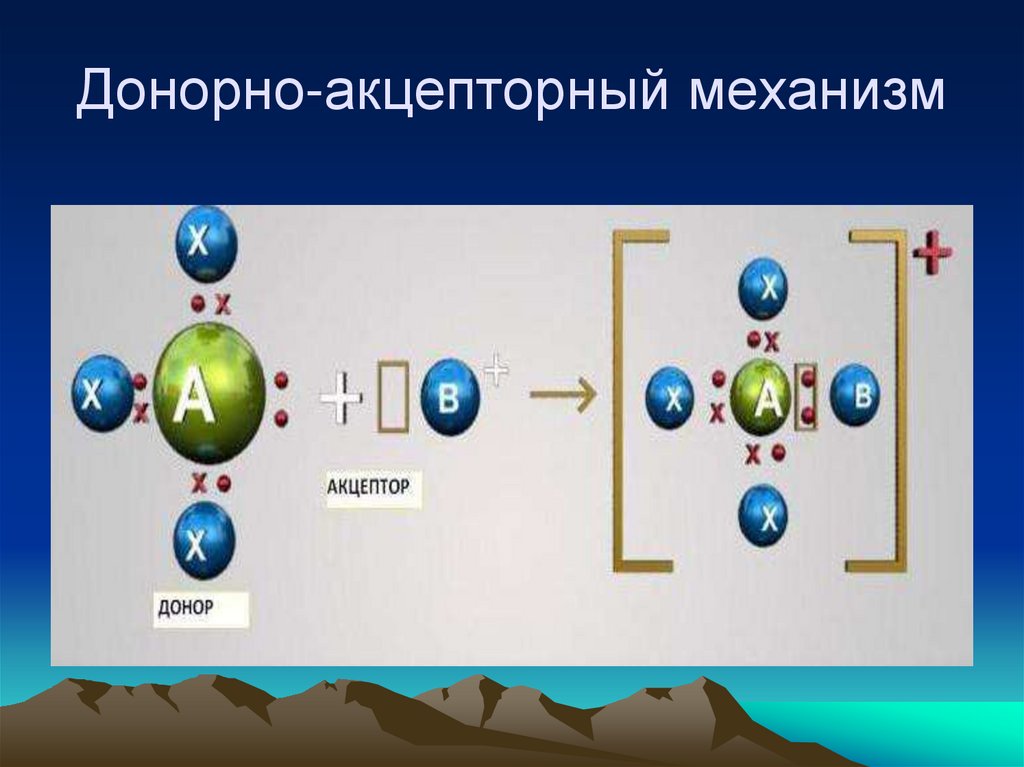
Донорно-акцепторный
• Переход существующей пары электронов
донора (поставщик электронов) на пустую
орбиталь акцептора.
• Э: + А
16. Ионная связь
• Это вид связи, возникает под действиемэлектростатических сил притяжения
противоположно заряженных ионов.
• Происходит почти полное смещение
электронов от менее электроотрицательного
элемента к более ЭО. Атом, который
полностью отдал электроны, превращается в
положительно заряженный ион, а атом
принимающий электроны в отрицательно
заряженную частицу.
17. Донорно-акцепторный механизм
18.
• Na -1e Na+• Cl+ e Cl• Примеры: соли, оксиды металлов
19. КРИСТАЛЛИЧЕСКИЕ РЕШЕТКИ
• Существует три агрегатных состояния:любое вещество может быть газом,
жидкостью и твердым веществом.
Например, всем известная жидкость – вода
может быть паром или льдом. Газ кислород
при низких температурах сначала
превращается в жидкость, а еще при более
низких – затвердевает в синие кристаллы.
20. Агрегатное состояние
Агрегатноесостояние
газ
жидкость
твердое
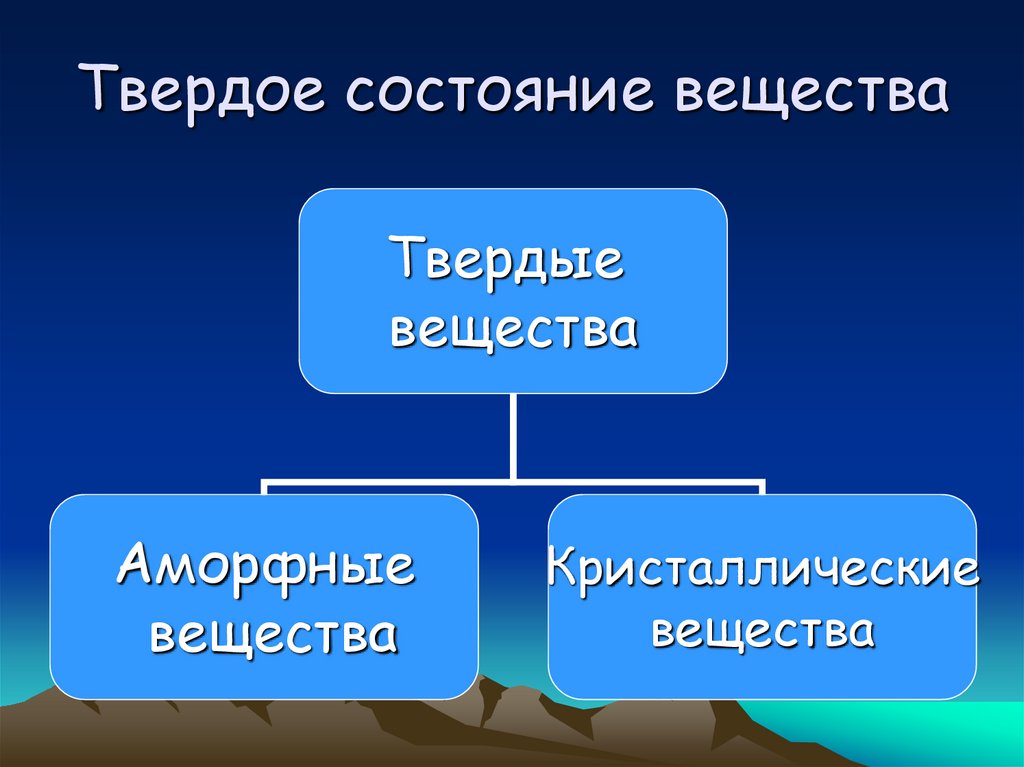
21. Твердое состояние вещества
Твердыевещества
Аморфные
вещества
Кристаллические
вещества
22. Аморфные вещества
Аморфные вещества не имеютопределенной температуры плавления
– при нагревании они постепенно
размягчаются и переходят в текучее
состояние.
23.
К аморфным веществам относится:большинство пластмасс
• Стекло, канифоль, воск, пластилин
• Шоколад, различные смолы
• жевательные резинки
24. Пластмассы
25.
26. Воск
27.
28. пластилин
29. Шоколад
30. Жевательная резинка
31. Кристаллические вещества
- Имеют строго определенную температуруплавления.
- Характеризуются правильным
расположением частиц, из которых они
построены: атомов, молекул или ионов. Эти
частицы расположены в строго
определенных точках пространства – узлах.
32.
• Узел – точка пересечения линий,соединяющих центры молекул
• Если соединить эти узлы прямыми
линиями, то образуется
пространственный каркас –
кристаллическая решетка.
• В узлах воображаемой
кристаллической решетки могут
находиться ионы, атомы и молекулы.
33.
• В зависимости от типа частиц,расположенных в узлах
кристаллической решетки, и характера
связи между ними различают четыре
типа кристаллических решеток:
• ионные,
• атомные,
• молекулярные
• металлические.
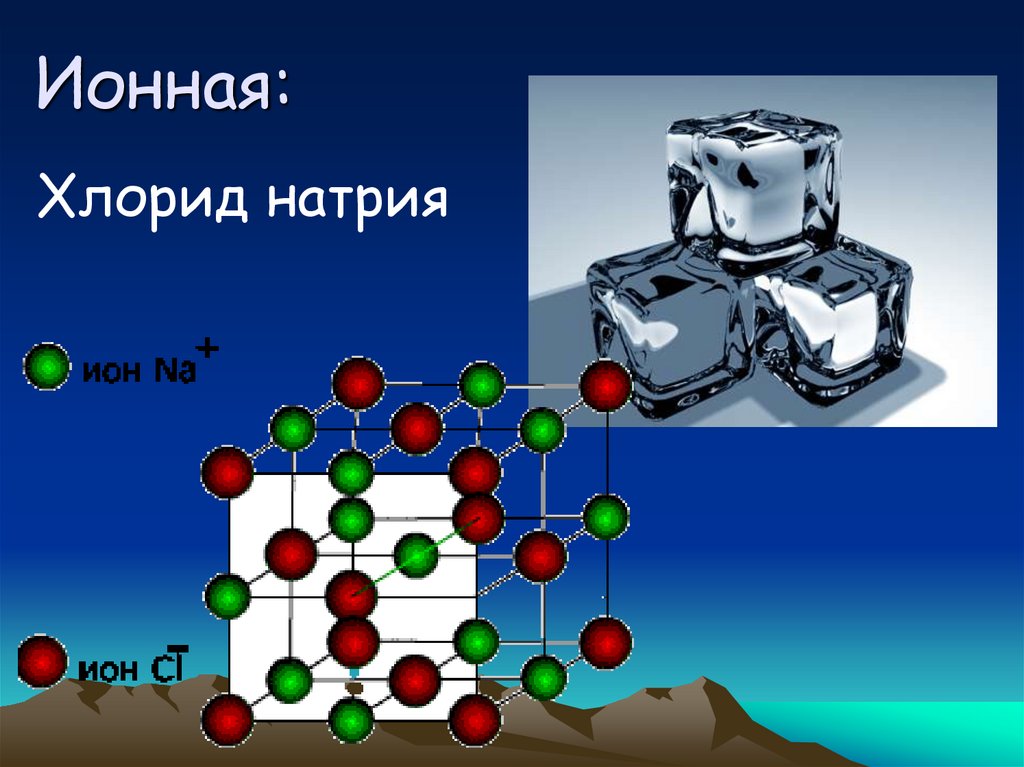
34. Ионная:
Хлорид натрия35.
36. Ионая кристаллическая решетка
В узлах ионы
Связи прочные
Т пл. высокие
Твердые
непластичные
37. Атомная:
Алмази графит
38. Атомная кристаллическая решетка
Связи прочные
Т пл. высокие
Прочные
Твердые
Не пластичные
Не растворимы в воде
39. Молекулярная
Йод40. Молекулярная решетка
Связи непрочные
Т пл. низкие
Непрочные
Непластичные
Мало растворимые
41. Металлическая
Железо42. Механизм образования металлической связи
Na+Na+
Na+
Na+
Na
Na
Na+
Na
+
Na
Na+
Металлическая связь
– это особый тип
связи в металлах и
сплавах
между
атомами и ионами
металлов за счет
обобществленных
электронов.
Na
Вещества с металлической связью имеют
металлические кристаллические решетки
43. Основные физические свойства
Металлический блеск44. Основные физические свойства
Температураплавления
Плотность
металлов
3370
21,45
19,3
1755
1539
11,34
8,9
961
660
7,87
328
2,7
98
1,74
-39
W
Pt
Fe Ag
Al
Pb Na Hg
0,5
Pt
Au
Pb
Cu
Fe
Al
Mg
Li
45. Основные физические свойства
Пластичность иковкость металлов
связана со смещением
слоев кристаллической
решетки относительно
друг друга
46. Основные физические свойства
Теплопроводностьобусловлена
большой подвижностью электронов,
которые сталкиваясь
с колеблющимися
атомами и ионами
обмениваются с ними
энергией.
Происходит
выравнивание температуры по всему
куску металла
47. Основные физические свойства
→+
е
→
е
-
Электропроводность
связана с направленным движением электронов при помещении металла в электрическое поле
48.
Типрешетки
Молеку
лярная
Виды
частиц в
узлах
решетки
молекулы
металличе Атомская
ионы
Вид связи между
частицами
Примеры в-в
Физ. св-ва в-в
м/у молекулами –
слабые силы
межмолекулярного
протяжения, а внутри
молекул – прочная
ковалентная связь.
Лед, твердые
хлороводо
род и
сероводород,
гелий, неон,
водород,
кислород,
сера, сахар,
нафталин
Непрочные,
летучие,
легкоплавкие,
имеют малую
твердость,
низкие t
плавления,
летучи
металлическая
Металлы и
сплавы
Ковкие,
пластичные,
тягучие,
металлический
блеск
49.
Тип решеткиВиды
частиц в
узлах
решетки
Вид связи
между
частицами
Примеры в-в
Ионная
Ионы
Ионная
Соли, оксиды
и гидроксиды
типичных
металлов
Атомная
Атомы
Ковалент
ная
Алмаз, кварц
Физ. св-ва в-в
Связи
прочные
Твердые,
прочные,
нелетучие,
тугоплавкие
Тпл. высокие
Связи
непрочные,
Тпл. высокие
очень твердые,
очень плавкие









































 Химия
Химия








