Похожие презентации:
Теория электролитической диссоциации
1.
Теорияэлектролитической
диссоциации
2.
План работы1. Определение.
2. Электролиты, неэлектролиты.
3. Теория диссоциации.
4. Механизм диссоциации.
5. Диссоциация кислот, оснований, солей.
3.
ДиссоциацияЭлектролитами называются вещества, растворы или
расплавы которых проводят электрический ток.
Электролиты:
соли;
кислоты;
основания.
Тип связи: ионные или ковалентные
полярные.
4.
ДиссоциацияНеэлектролитами называются вещества, растворы
или расплавы которых не проводят электрический ток.
Неэлектролиты:
кислород;
водород;
многие органические вещества (сахар,
эфир, бензол).
Тип связи: ковалентные неполярные или
малополярные.
5.
Сильные электролитыСильные электролиты –это такие электролиты, которые в
водных растворах полностью диссоциируют на ионы.
Соли.
NaCl, KNO3, AlCl3
Сильные
кислоты.
HClO4, HClO3, HNO3, H2SO4, HCl,
HI, HBr
Щелочи.
NaOH, KOH, CsOH, RbOH,
Sr(OH)2, LiOH, Ba(OH)2, Ca(OH)2.
6.
Слабые электролитыСлабые электролиты –это такие электролиты, которые в
водных растворах не полностью диссоциируют на ионы.
Слабые кислоты:
HClO2, HClO, HNO2, H2SO3,H2CO3, H2SiO3,
H3PO4, H3PO3, H3BO3, CH3COOH, H2S, HCN, HF
Слабые нерастворимые в воде основания:
Fe(OH)2, Cu(OH)2, Pb(OH)2
Гидроксид аммония:
NH4OH.
7.
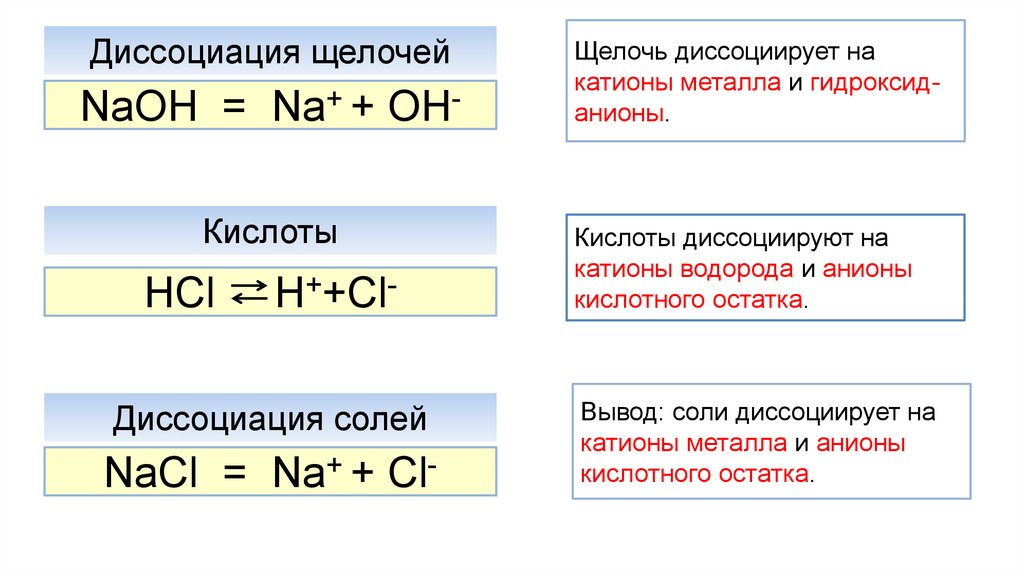
Диссоциация щелочейNaOH = Na+ + OHКислоты
HCl
H++Cl-
Диссоциация солей
NaСl = Na+ + Cl-
Щелочь диссоциирует на
катионы металла и гидроксиданионы.
Кислоты диссоциируют на
катионы водорода и анионы
кислотного остатка.
Вывод: соли диссоциирует на
катионы металла и анионы
кислотного остатка.
8.
Реакции ионного обменаМолекулярное уравнение
Fe Cl3+ 3 Na OH =Fe(OH)3 + 3 Na Cl
Полное ионное уравнение
Fe3++3Cl-+3Na++3OH-=Fe(OH)3 +3Na++3ClСокращенное ионное уравнение
Fe3++3Cl-+3Na++3OH-=Fe(OH)3 +3Na++3ClFe3++3OH-=Fe(OH)3







 Химия
Химия








