Похожие презентации:
Электролитическая диссоциация
1.
Электролитическаядиссоциация
записать тему в тетрадь
2.
Электролитическая диссоциация– процесс распада электролита на
ионы при растворении его в воде
или расплавлении.
записать определение в тетрадь
3.
Диссоциация(записать в тетрадь информацию со слайда)
Электролитами называются вещества, растворы или
расплавы которых проводят электрический ток.
Электролиты:
соли;
кислоты;
основания.
Тип связи: ионные или ковалентные
полярные.
4.
Диссоциация(записать в тетрадь информацию со слайда)
Неэлектролитами называются вещества, растворы
или расплавы которых не проводят электрический ток.
Неэлектролиты:
кислород;
водород;
многие органические вещества (сахар,
эфир, бензол).
Тип связи: ковалентные неполярные или
малополярные.
5.
Степень диссоциация(записать в тетрадь информацию со слайда)
Число, показывающее, какая часть молекул
распалась на ионы, называется степенью
электролитической диссоциации.
Степень диссоциации равна отношению числа
молекул, которые распались на ионы, к общему числу
молекул в растворе.
ά=
n
N
* 100%
n - число молекул, распавшихся на ионы; N - общее
число растворенных молекул.
6.
Сильные электролиты(записать в тетрадь информацию со слайда)
Сильные электролиты – это такие электролиты, которые
в водных растворах полностью диссоциируют на ионы,
степень диссоциации равна 1 (100 %).
Соли.
NaCl, KNO3, AlCl3
Сильные
кислоты.
HClO4, HClO3, HNO3, H2SO4, HCl,
HI, HBr
Щелочи.
NaOH, KOH, CsOH, RbOH,
Sr(OH)2, LiOH, Ba(OH)2, Ca(OH)2.
7.
Слабые электролиты(записать в тетрадь информацию со слайда)
Слабые электролиты – это такие электролиты, которые в
водных растворах не полностью диссоциируют на ионы,
степень диссоциации меньше 1 (100 %).
Слабые кислоты:
HClO2, HClO, HNO2, H2SO3,H2CO3, H2SiO3,
H3PO4, H3PO3, H3BO3, CH3COOH, H2S, HCN, HF
Слабые нерастворимые в воде основания:
Fe(OH)2, Cu(OH)2, Pb(OH)2
Гидроксид аммония:
NH4OH.
8.
Механизм диссоциацииCl-
Na+
-
+
Na+
Cl-
+
-
Cl-
Na+
-
+
Схема диссоциации.
9.
++
-
-
+
-
-
+
-
+
+
Гидратированные ионы.
+
Cl-
-
Na+
-
+
10.
Диссоциация щелочейNaOH = Na+ + OHKOH = K + + OH-
Ca(OH)2 = Ca2+ + 2OHВывод: щелочь диссоциирует на катионы металла и
гидроксид-анионы.
11.
Диссоциация солейNaСl = Na+ + ClKNO3 = K+ + NO3-
CaCl2 = Ca2+ + 2ClВывод: соли диссоциирует на катионы металла и
анионы кислотного остатка.
12.
КислотыТрехосновная кислота
Пример:
Одноосновная
кислота
Кислоты-электролиты, при диссоциации
которых образуются катионы водорода.
HCl
H++Cl-
H3PO4
H++H2PO4- (1 ступень)
H2PO4-
H++HPO42- (2 ступень)
HPO42-
H++PO43- (3 ступень)
13.
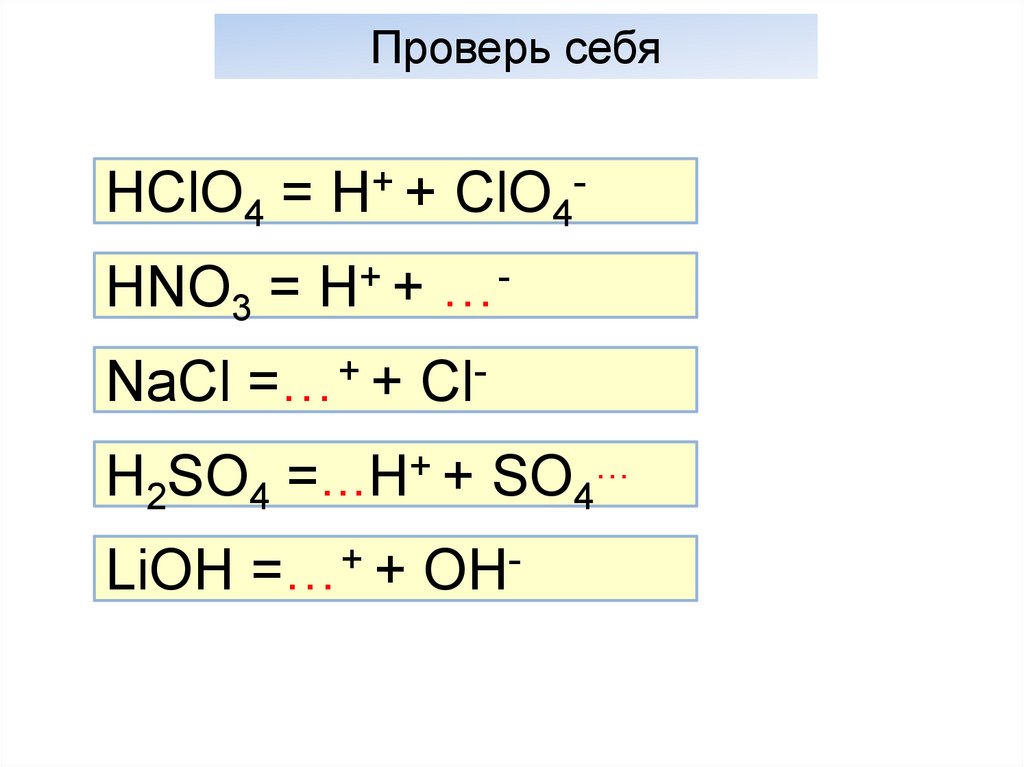
Проверь себяHClO4 = H+ + ClO4HNO3 = H+ + …NaCl =…+ + ClH2SO4 =...H+ + SO4…
LiOH =…+ + OH-
14.
Реакции ионного обменаМолекулярное уравнение
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
Полное ионное уравнение
Fe3++3Cl-+3Na++3OH-=Fe(OH)3 +3Na++3ClСокращенное ионное уравнение
Fe3++3Cl-+3Na++3OH-=Fe(OH)3 +3Na++3ClFe3++3OH-=Fe(OH)3
15.
Записать в тетрадьинформацию со слайда 14
Конспект изучить.
Высылать конспект не нужно














 Химия
Химия








