Похожие презентации:
Алюминий. Алюминотермия. Амфотерность оксида и гидроксида. Применение алюминия и его оксида
1.
Общественный смотр знанийпо теме: «Алюминий.
Алюминотермия.
Амфотерность оксида и
гидроксида. Применение
алюминия и его оксида».
2.
3.
«Этому металлу сужденовеликое будущее».
Чернышевский Н. Г.
4.
5.
6. 3NaF AlF3 - криолит
7.
8.
9.
10.
11.
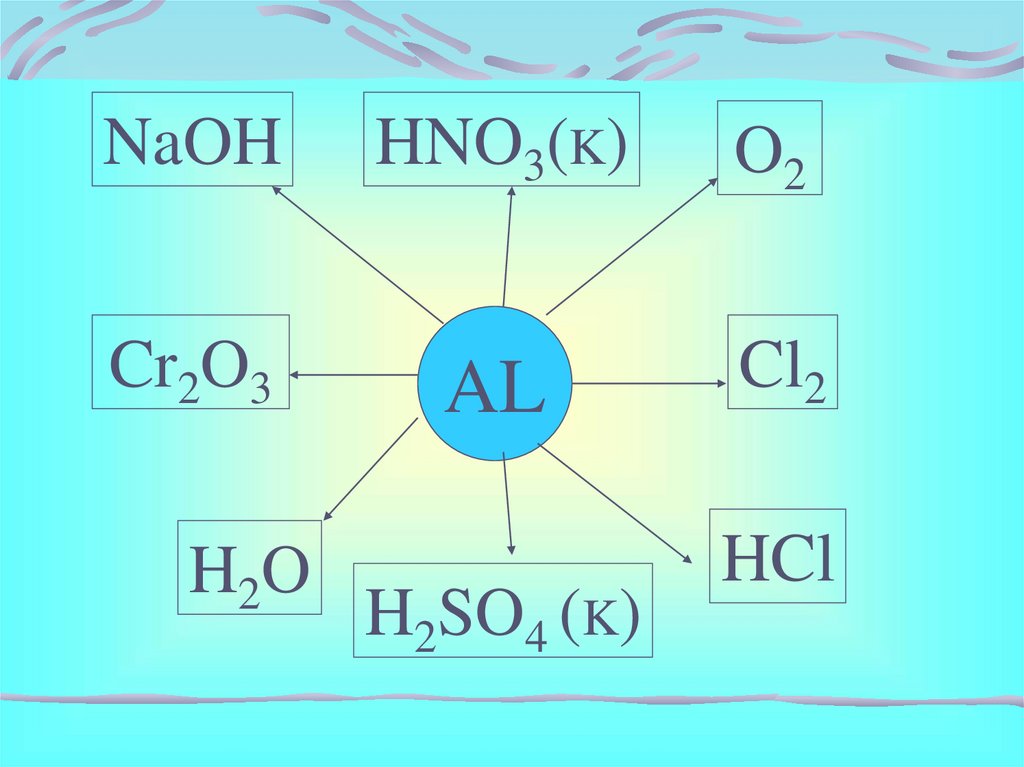
NaOHCr2O3
H2 O
HNO3(K)
O2
AL
Cl2
H2SO4 (K)
HCl
12.
13.
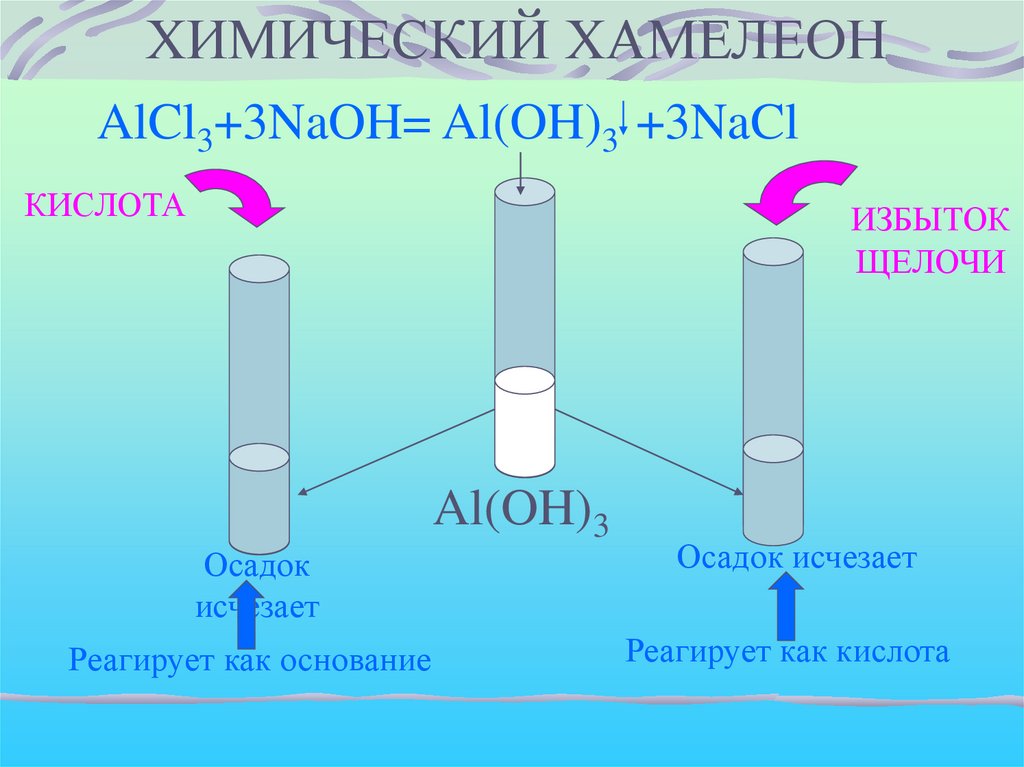
ХИМИЧЕСКИЙ ХАМЕЛЕОНAlCl3+3NaOH= Al(OH)3 +3NaCl
КИСЛОТА
ИЗБЫТОК
ЩЕЛОЧИ
Al(OH)3
Осадок
исчезает
Осадок исчезает
Реагирует как основание
Реагирует как кислота
14.
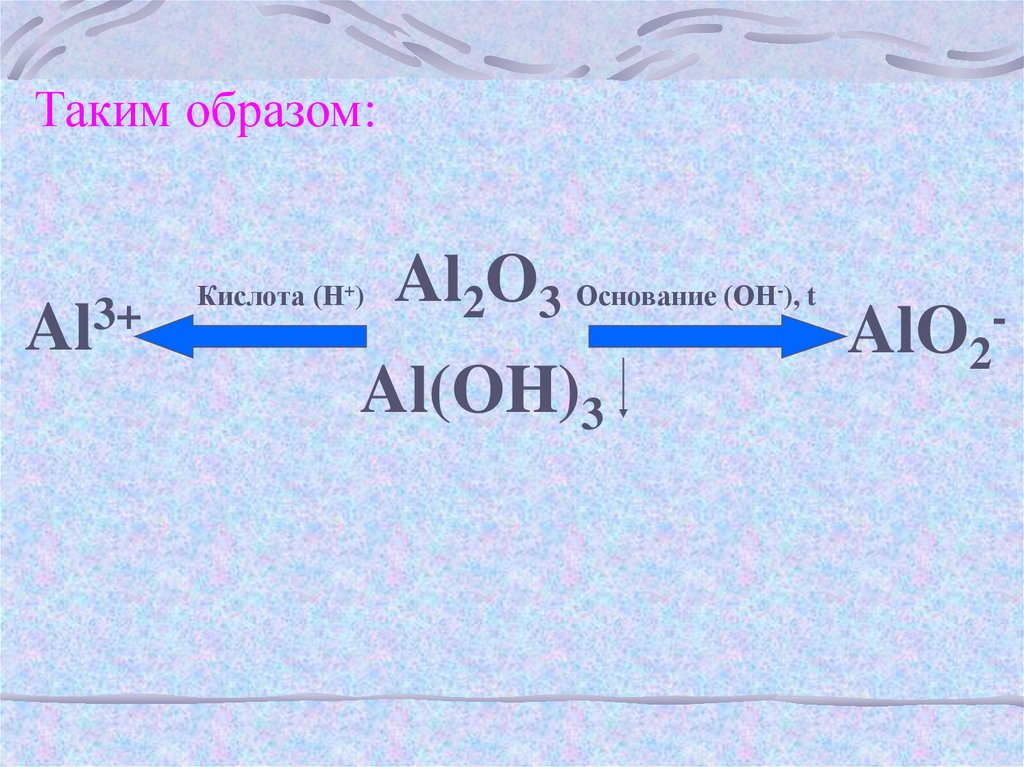
Таким образом:3+
Al
Кислота (Н+)
Al2O3 Основание (ОН ), t
Al(OH)3
-
AlO2-
15.
Домашнее задание:1).п. 46, упражнения № 3,
№ 4, № 5 стр. 189-190,
дописать уравнения реакции
2)Составить задачу с участием AL или его
соединений, предложить её решение.
16.
Домашнее задание:3) Написать сочинение:
«Социальный образ алюминия и его роль в
обществе».
4)Из слова «алюмосиликаты»/ь, ъ, й
составить слова – химические термины и пояснить
их.
17.
Мне все понравилосьМне ничего не понятно
Мне было интересно
Мне было скучно
Мне было легко
Мне было трудно
Я узнал много нового
Я не узнал ничего нового














 Химия
Химия








