Похожие презентации:
Азот. Урок химии в 9 классе
1.
Урок химии в 9 классе по тме:„Азот“
Цель урока: сформировать понятие
об
азоте
как
о
химическом
элементе и простом веществе.
2.
Характеристика азота на основании его положения в Периодической системе Д.И.Менделеева
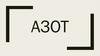
АЗОТ (лат. Nitrogenium — рождающий селитры), N
(читается «эн»), химический элемент второго ), химический элемент второго
периода VA группы периодической системы,
атомный номер 7, атомная масса 14,0067.
3.
Азот как химический элемент. Степениокисления азота.
Задание 1. Заполните
таблицу «Характеристика азота на основании его
положения в Периодической системе Д.И.Менделеева».
Символ
элемента
Состав
ядра
атома
p
n
ē
Строение
электронной
оболочки
Характерные
степени
окисления
Формула и характер
Высшего Высшего
оксида
гидроксида
Формула
водородного
соединения
4.
Азот как простое веществоАЗОТ в свободном виде — газ без цвета, запаха и
вкуса, плохо растворим в воде. Состоит из
двухатомных молекул N2, обладающих высокой
прочностью. Относится к неметаллам.
5.
Получение азотаВ лаборатории чистый («химический»), химический элемент второго ) азот
получают
добавляя
при
нагревании
насыщенный раствор хлорида аммония NH4Cl
к твердому нитриту натрия NaNO2:
NaNO2 + NH4Cl = NaCl + N2 + 2H2O.
Можно также нагревать
аммония:
NH4NO2 = N2 + 2H2O.
твердый
нитрит
6.
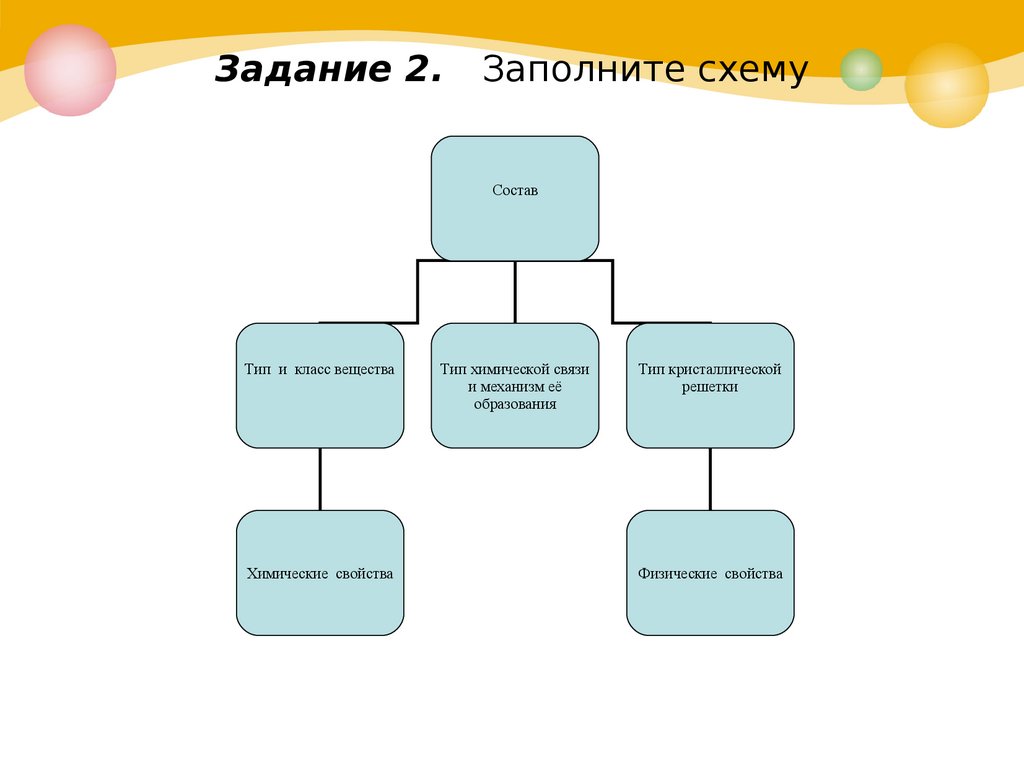
Задание 2.Заполните схему
Состав
Тип и класс вещества
Химические свойства
Тип химической связи
и механизм её
образования
Тип кристаллической
решетки
Физические свойства
7.
Проверим заполнение схемыСостав
N2
Тип и класс вещества
Тип химической связи и
механизм её образования
Ковалентная неполярная
N≡N
Простое
Неметалл
Химические свойства
Химически инертен
Взаимодействие
металлами, водородом
кислородом.
с
и
Тип кристаллической
решетки
Молекулярная
Физические свойства
Бесцветный газ, без запаха и
вкуса, плохо растворим в воде
8.
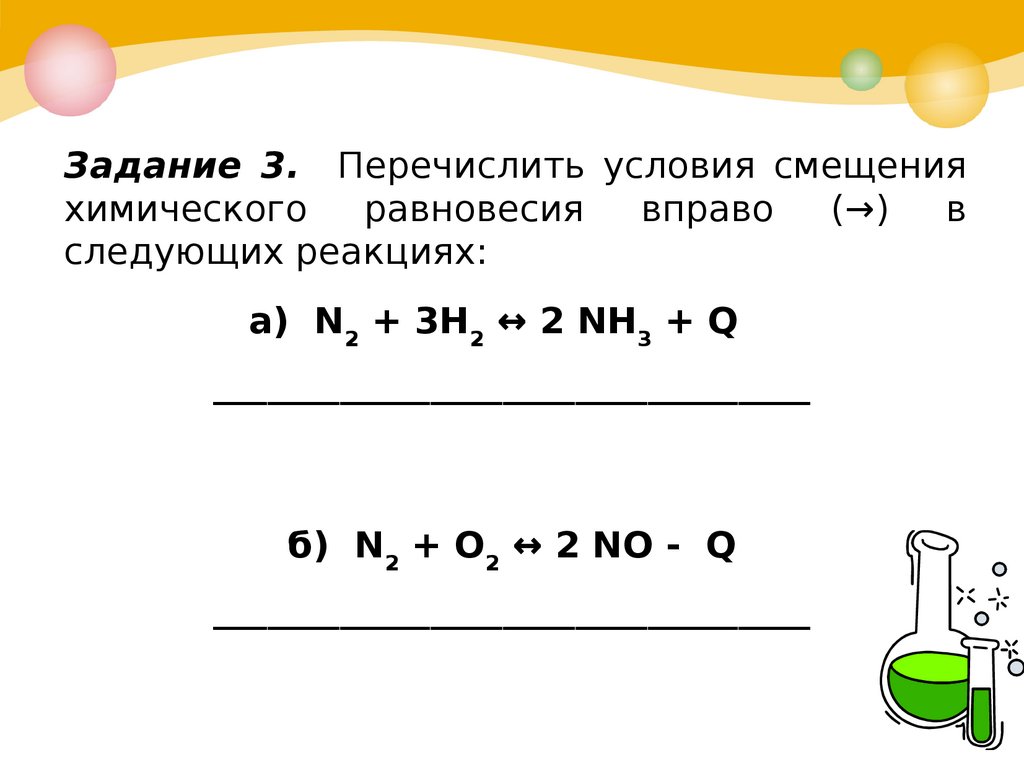
Задание 3. Перечислить условия смещенияхимического
равновесия
вправо
(→)
в
следующих реакциях:
а) N2 + 3НН2 ↔ 2 NН3Н + Q
_________________________________
б) N2 + О2 ↔ 2 NО - Q
_________________________________
9.
Круговорот азота с природе10.
Применение азотав промышленности газ азот используют
главным образом для получения аммиака;
как химически инертный газ азот
применяют для обеспечения инертной
среды в различных химических и
металлургических процессах, при
перекачке горючих жидкостей;
11.
Применение азотажидкий азот
широко используют
как хладагент;
его применяют в
медицине, особенно
в косметологии;
важное значение в
поддержании
плодородия почв
имеют азотные
минеральные
удобрения.
12.
Решение задачЗадача 1.
Сколько грамм кальция
потребуется для взаимодействия с 28
граммами азота?
Задача
2.
Сколько
литров
воздуха,
содержащего 78 % азота, потребуется для
получения 100 литров аммиака?
Задача 3. Сколько грамм нитрида алюминия
можно получить из 54 грамм алюминия и
66,2 литров азота?











 Химия
Химия