Похожие презентации:
Степень окисления. Вещества молекулярного и немолекулярного строения (11 урок)
1.
Степень окисления. Веществамолекулярного и
немолекулярного строения
2.
Степень окисления — условный заряд наатоме в молекуле или в кристалле, который
вычислен из предположения, что все
ковалентные связи имеют ионный характер.
3.
Степень окисления свободных атомов и простых веществ равна 0Степень окисления водорода в соединениях с неметаллами
равна +1, а с металлами равна -1
Степень окисления фтора в соединениях всегда равна -1
Степень окисления кислорода в соединениях равна -2
(исключения: O +2F2 и пероксиды: Н202-1)
Степень окисления металлов в
соединениях всегда положительная
Суммарная степень окисления всех атомов в молекуле равна 0.
Высшая степень окисления элемента равна номеру группы
Низшая степень окисления: для металлов равна 0, для
неметаллов равна номер группы -8
Элементы в высшей степени окисления могут только принимать
электроны
Элементы в низшей степени окисления могут только отдавать
электроны
Элементы в промежуточной степени окисления могут и
принимать, и отдавать электроны
4.
5.
№1 Из перечисленных формул выпишитеформулы: оксидов, кислот, оснований и солей.
Дайте названия веществам.
К2О, FеСl2, НСl, РbO2, Мn2O7, К2O, Fе(ОН)3,
НNO3 , СаSO3, AgСl, КОН.
№2 Составьте формулы бинарных соединений
между элементами:
AI+3S-2; C+4CI-1; Na+1N-3; P+3O-2; Mg+2O-2;
6.
№3 Определите степень окисления элементов ввеществах:
Na 2О, Fе2О3, KСl, SO2, Cl2O7, Ag2O, H2, Al2О3.
Дайте названия веществам
№4 Составить формулы веществ по названиям,
указать степень окисления каждого элемента:
a) хлорид кальция
b) оксид железа (III)
c) оксид азота (V)
d) хлорид серы (IV)
e) сульфид хрома (VI)
f) гидрид магния
g) карбид алюминия
7.
№5 Обе частицы содержат атом азота водинаковой степени окисления:
а) HNO3, NOF
б) NO-3, NO-2
в) HNO2, NCl3
г) NO+2, NO2
№6 Схеме превращения S-2 → S+4 соответствует
химическое уравнение:
а) 2H2S + O2 = 2S + 2H2O
б) 2H2S +3O2 = 2SO2 +2H2O
в) H2SO3 + H2O2 = H2SO4 + H2O
г) 4H2O2 + PbS = PbSO4 + 4H2O
8.
Молекулярные веществаМолекулярные вещества — это вещества,
мельчайшими структурными частицами которых
являются молекулы
Молекулы — наименьшая частица молекулярного вещества,
способная существовать самостоятельно и сохраняющая его
химические свойства.
Молекулярные вещества имеют низкие температуры
плавления и кипения и находятся в стандартных
условиях в твердом, жидком или газообразном
состоянии.
Например:
Вода H2O — жидкость, tпл=0°С; tкип=100°С;
Кислород O2 — газ, tпл=-219°С; tкип=-183°С;
9.
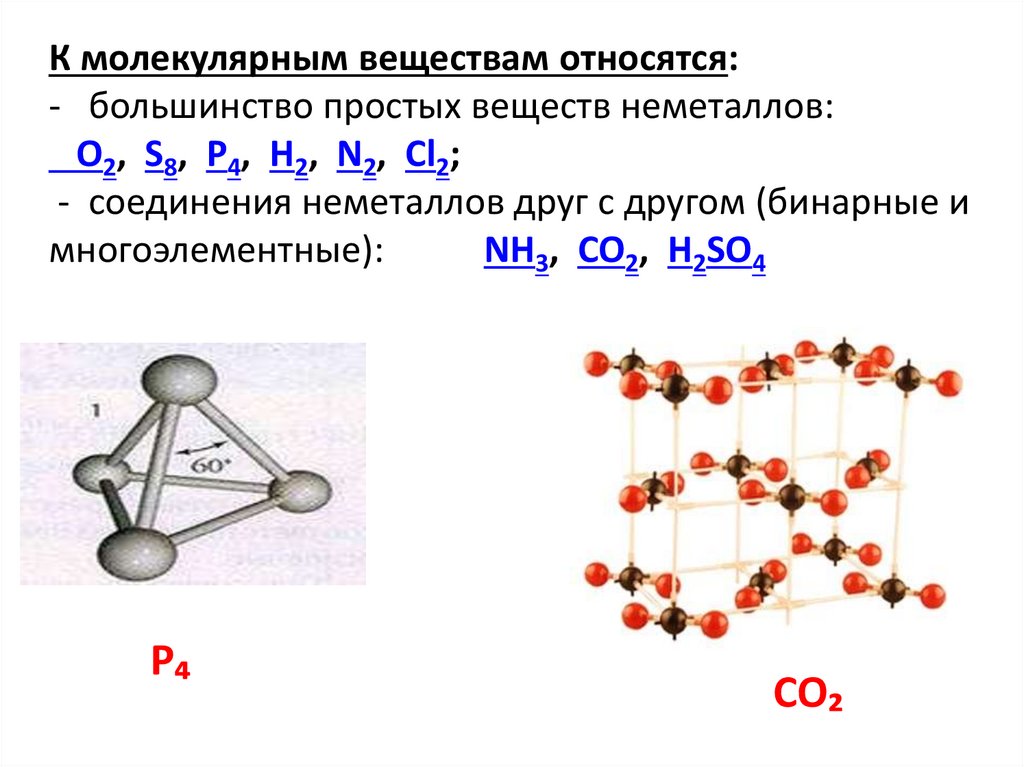
К молекулярным веществам относятся:- большинство простых веществ неметаллов:
O2, S8, P4, H2, N2, Cl2;
- соединения неметаллов друг с другом (бинарные и
многоэлементные):
NH3, CO2, H2SO4
P₄
CO₂
10.
Немолекулярные веществаНемолекулярные вещества — это вещества,
мельчайшими структурными частицами которых
являются атомы или ионы.
Ион — это атом или группа атомов, обладающих
положительным или отрицательным зарядом.
Например: Na+, Cl−.
Немолекулярные вещества находятся в стандартных
условиях в твердом агрегатном состоянии и имеют
высокие температуры плавления и кипения.
Например: натрий хлорид NaCl — твердое вещество,
tпл=801°С; tкип=1465°С; медь Cu — твердое вещество,
tпл=1083°С; tкип=2573°С; кремний Si — твердое
вещество, tпл=1420°С; tкип=3250°С;
11.
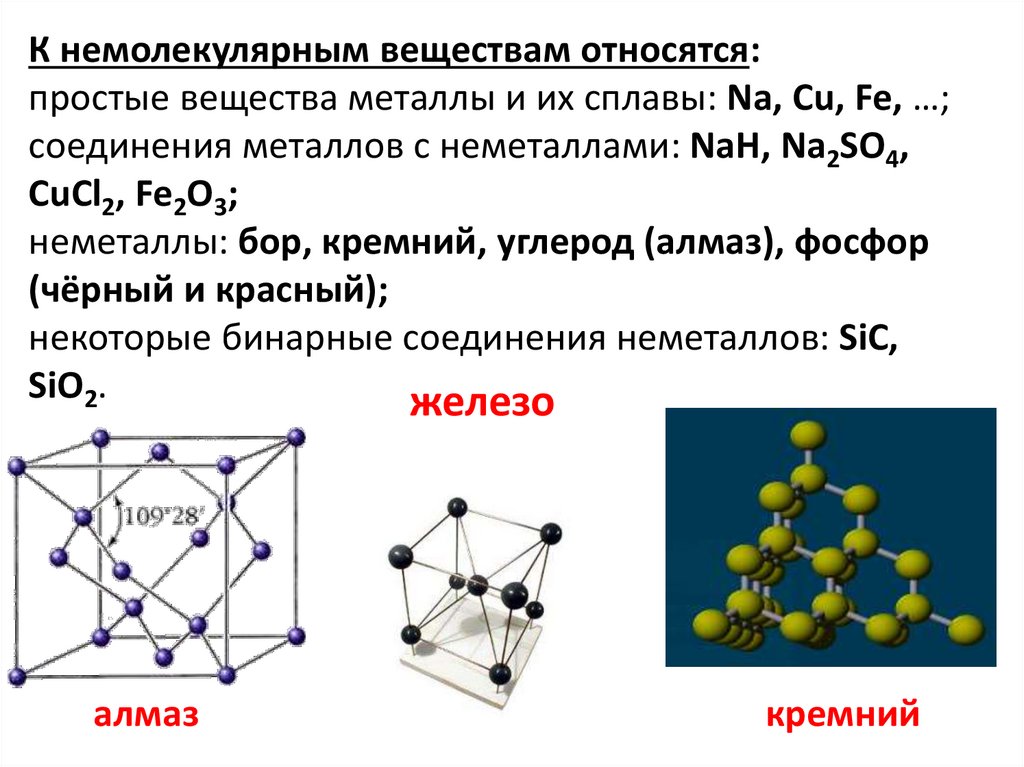
К немолекулярным веществам относятся:простые вещества металлы и их сплавы: Na, Cu, Fe, …;
соединения металлов с неметаллами: NaH, Na2SO4,
CuCl2, Fe2O3;
неметаллы: бор, кремний, углерод (алмаз), фосфор
(чёрный и красный);
некоторые бинарные соединения неметаллов: SiC,
SiO2.
железо
алмаз
кремний
12.
Кристаллическое строениеКристаллическая
структура — такая
совокупность атомов, в
которой с каждой точкой
кристаллической
решетки связана
определенная группа
атомов.
Упорядоченное
расположение частиц в
кристалле вещества
13.
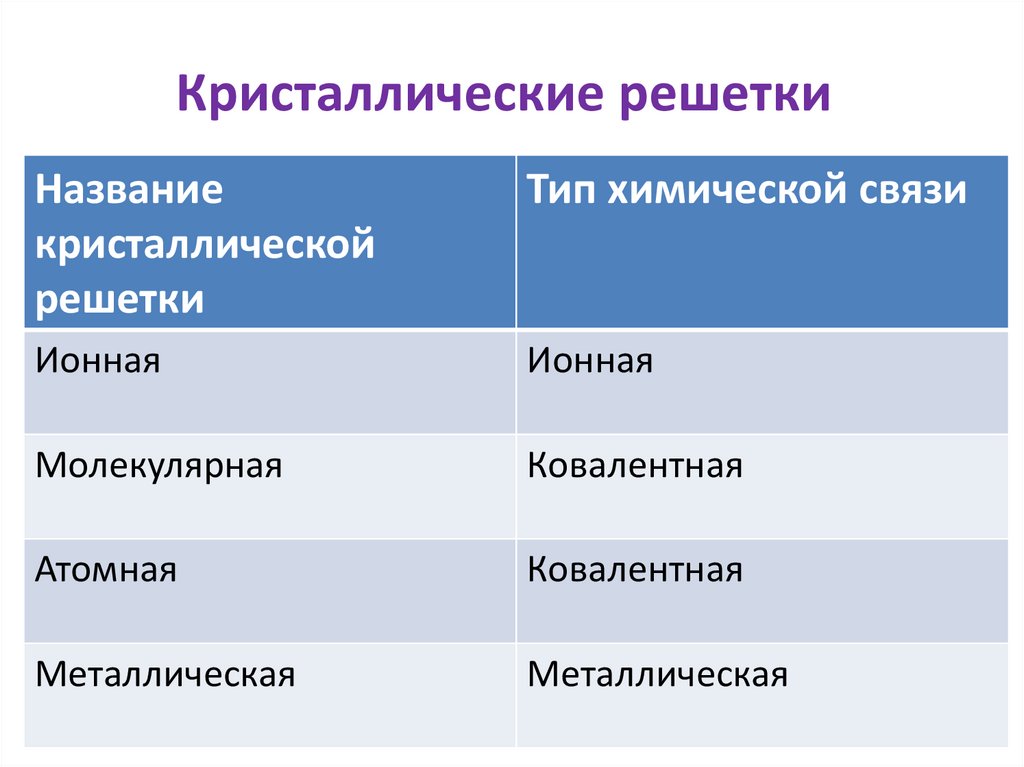
Кристаллические решеткиНазвание
кристаллической
решетки
Тип химической связи
Ионная
Ионная
Молекулярная
Ковалентная
Атомная
Ковалентная
Металлическая
Металлическая
14.
Кристаллические решеткиЗаполните таблицу:
Название типа
Виды
кристаллическо частиц в
й решетки
узлах КР
Атомная КР
Молекулярная
КР
Ионная КР
Металлическая
КР
Вид
химической
связи между
частицами
Характерны Примеры
е
веществ
физические
свойства
15.
Определить степень окисленияэлементов в реакциях
1) 2MnO2 + O2 + 4KOH = 2K2MnO4 + 2H2O
2) MnO2 + 4HCI = MnCI2 + CI2 + 2H2O
3) KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4
+ K2SO4 + H2O
4) KMnO4 + Na2SO3 + H2O → MnO2↓ + Na2SO4
+ KOH
5) KMnO4 + Na2SO3 + КOH → Na2SO4 + K2MnO4
+ H2O












 Химия
Химия








