Похожие презентации:
Вещества молекулярного и немолекулярного строения (11 класс)
1. Тема. Вещества молекулярного и немолекулярного строения
Цели урока: Обобщить и углубить знания учащихсяо зависимости свойств веществ от природы
химической связи и типа кристаллической решетки.
Развивать умение предсказывать свойства веществ
по их строению и определять строение веществ по
их свойствам.
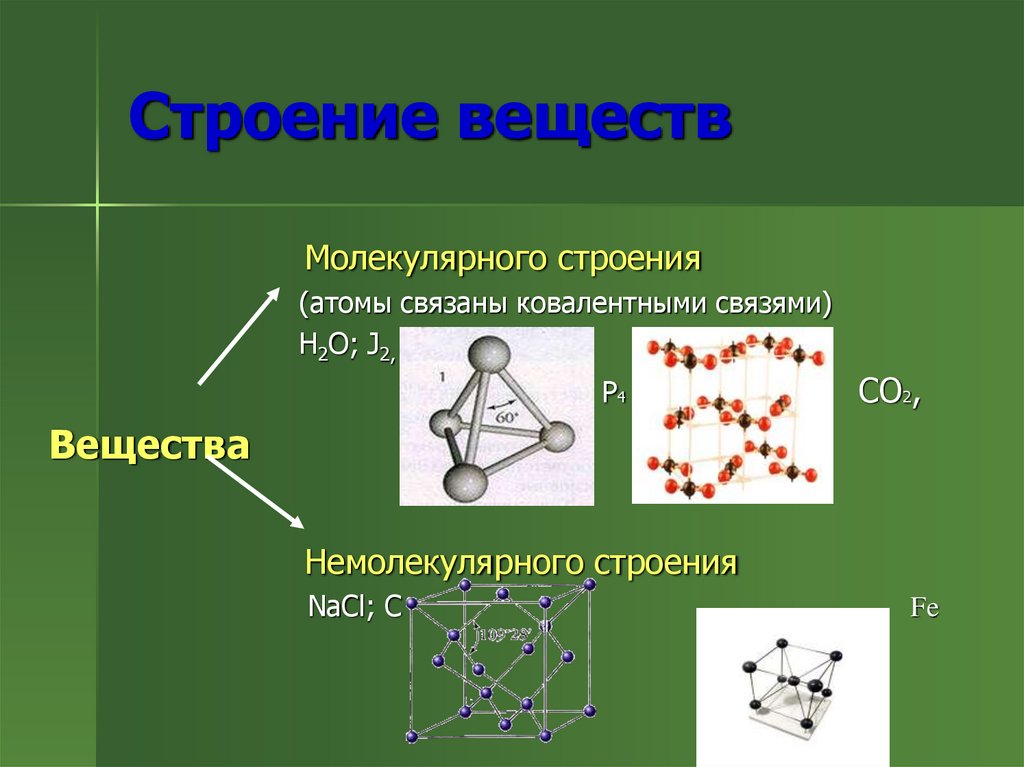
2. Строение веществ
Молекулярного строения(атомы связаны ковалентными связями)
H2O; J2,
Р4
СО2,
Вещества
Немолекулярного строения
NaCl; C
Fe
3.
Молекулярные веществаМолекулярные вещества — это вещества,
мельчайшими структурными частицами которых
являются молекулы
Молекулы — наименьшая частица молекулярного вещества,
способная существовать самостоятельно и сохраняющая его
химические свойства.
Молекулярные вещества имеют низкие
температуры плавления и кипения и находятся в
стандартных условиях в твердом, жидком или
газообразном состоянии.
Например:
Вода H2O — жидкость, tпл=0°С; tкип=100°С;
Кислород O2 — газ, tпл=-219°С; tкип=-183°С;
4.
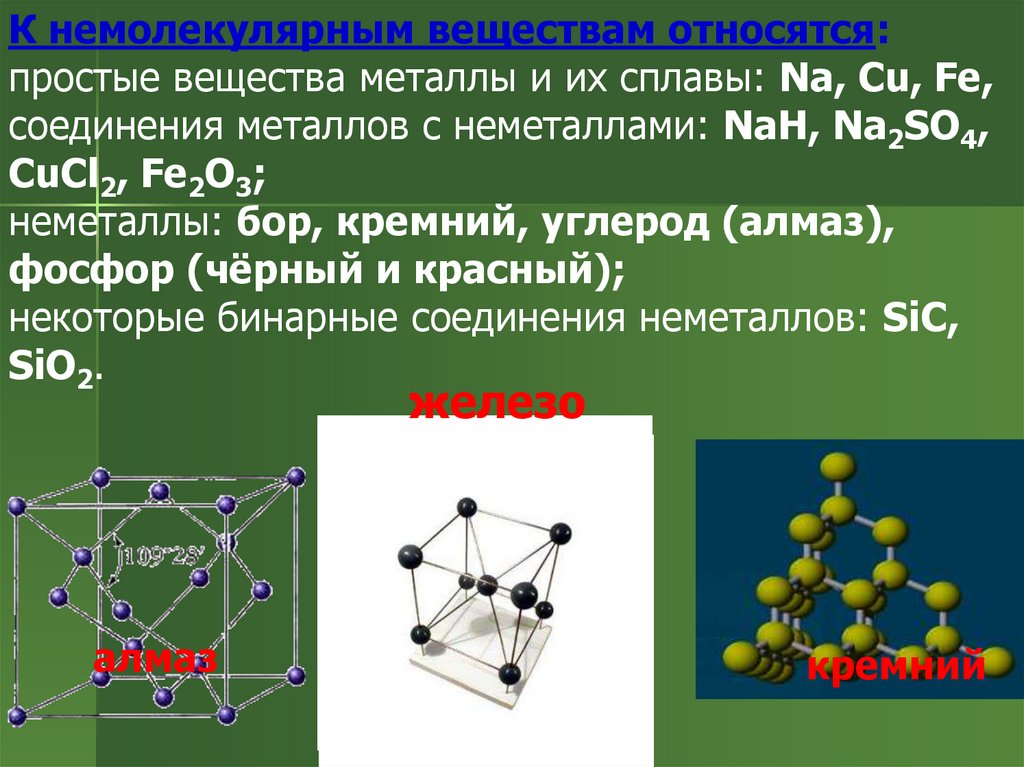
К немолекулярным веществам относятся:простые вещества металлы и их сплавы: Na, Cu, Fe,
соединения металлов с неметаллами: NaH, Na2SO4,
CuCl2, Fe2O3;
неметаллы: бор, кремний, углерод (алмаз),
фосфор (чёрный и красный);
некоторые бинарные соединения неметаллов: SiC,
SiO2.
железо
алмаз
кремний
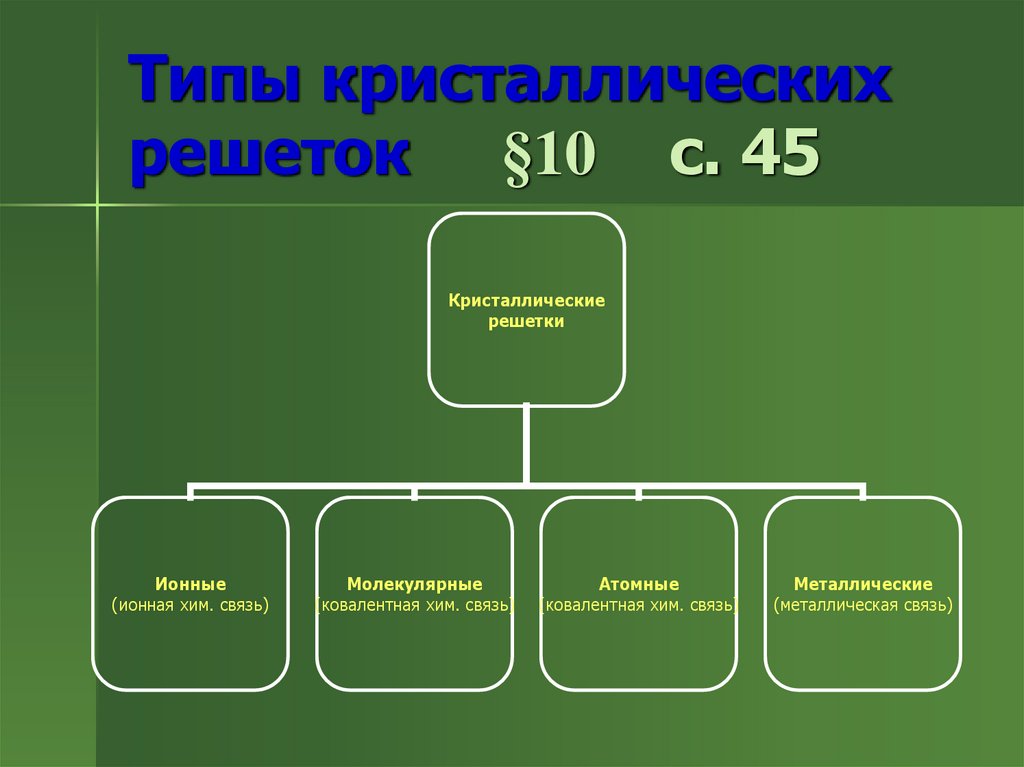
5. Типы кристаллических решеток §10 с. 45
Кристаллическиерешетки
Ионные
(ионная хим. связь)
Молекулярные
(ковалентная хим. связь)
Атомные
(ковалентная хим. связь)
Металлические
(металлическая связь)
6. 1. Ионная кристаллическая решетка
++
Вещества:
твердые;
+ хрупкие;
Ионы
+ +
термостойкие;
тугоплавкие;
+ малолетучие;
не проводят ток и тепло в твердом виде;
их растворы и расплавы – электролиты;
диссоциируют в полярных растворителях.
Примеры: K2SO4, Ca(NO3)2, NaCl, MgO, щелочи
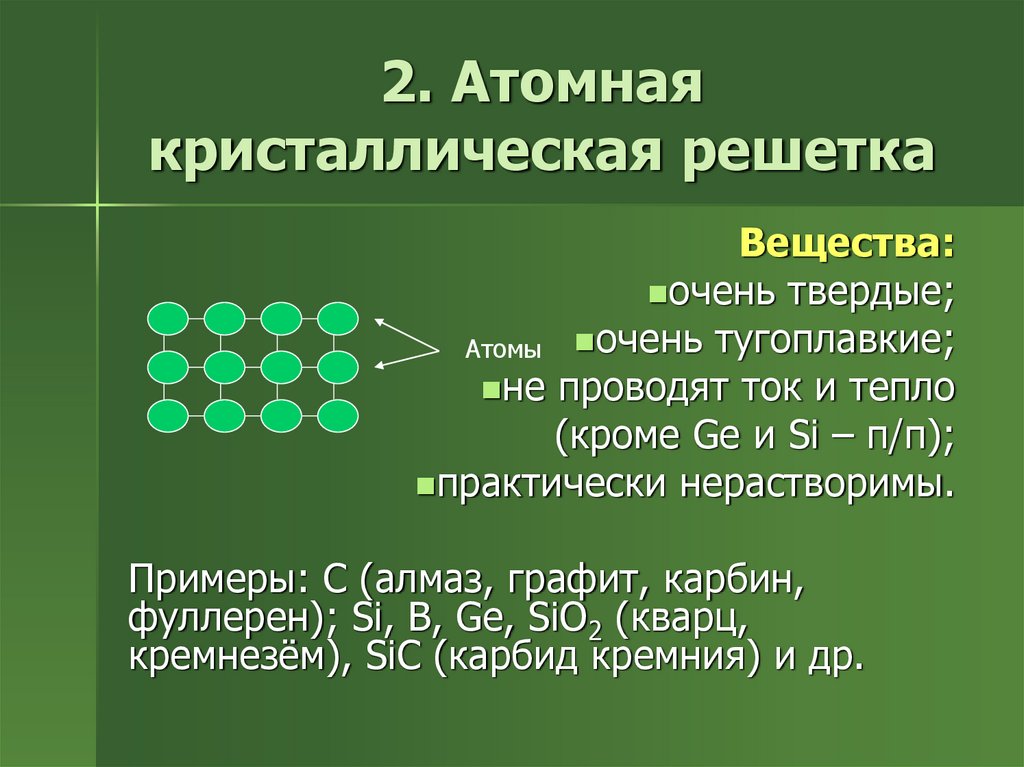
7. 2. Атомная кристаллическая решетка
Вещества:очень твердые;
Атомы очень тугоплавкие;
не проводят ток и тепло
(кроме Ge и Si – п/п);
практически нерастворимы.
Примеры: C (алмаз, графит, карбин,
фуллерен); Si, B, Ge, SiO2 (кварц,
кремнезём), SiC (карбид кремния) и др.
8. 4. Металлическая кристаллическая решетка
++
+
+
+
+
Вещества:
С металлическим блеском;
непрозрачные;
Атомы металлов
Хорошо проводят тепло
Ионы металлов
и электрический ток;
Ковкие и пластичные.
Свободные
электроны
Примеры: Na, Mg, Zn, Fe.
Металлическая – это связь между ионами и атомами
металлов и относительно свободными электронами (не
направлена, не насыщаема). Для металлов в твердом и
жидком состоянии.
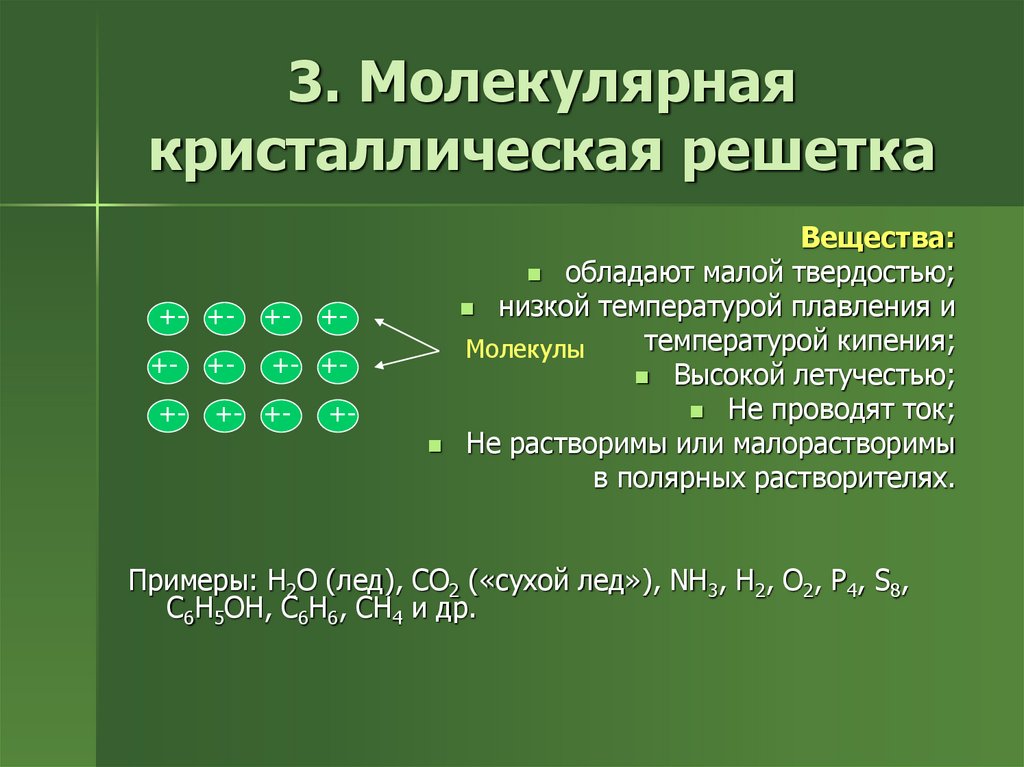
9. 3. Молекулярная кристаллическая решетка
+- +-+-
+-
+-
+-
+- +-
+-
+- +-
+-
Вещества:
обладают малой твердостью;
низкой температурой плавления и
температурой кипения;
Молекулы
Высокой летучестью;
Не проводят ток;
Не растворимы или малорастворимы
в полярных растворителях.
Примеры: H2O (лед), CO2 («сухой лед»), NH3, H2, O2, P4, S8,
C6H5OH, C6H6, CH4 и др.
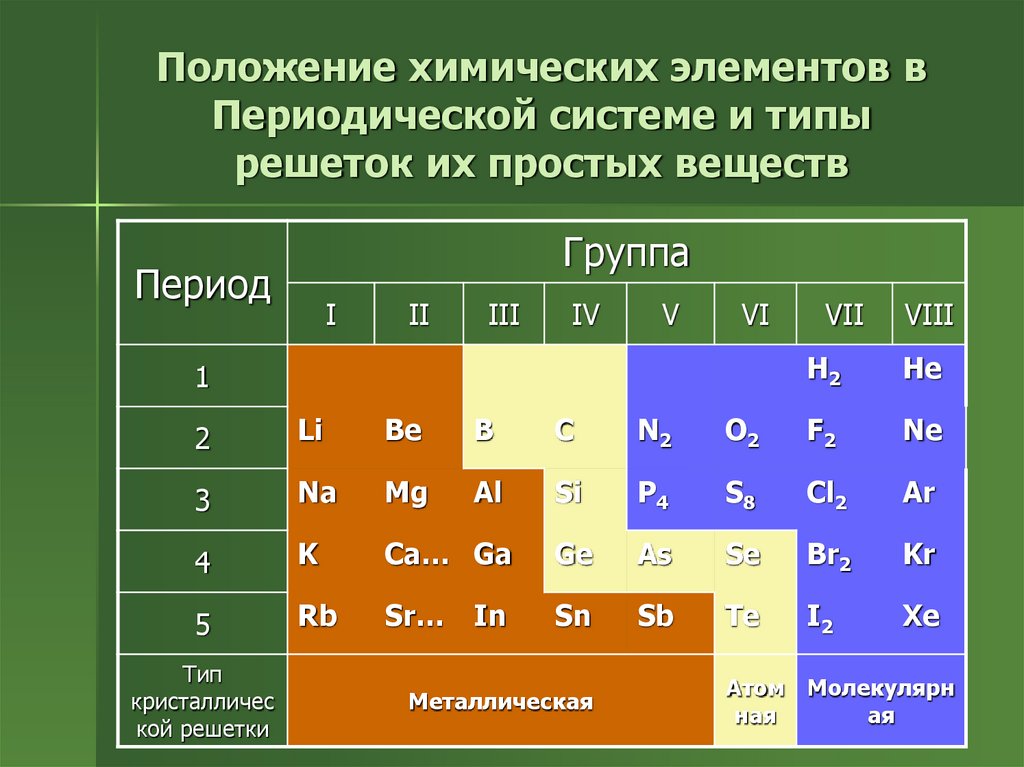
10. Положение химических элементов в Периодической системе и типы решеток их простых веществ
ГруппаПериод
I
II
III
IV
V
VI
1
VII
VIII
H2
He
2
Li
Be
B
C
N2
O2
F2
Ne
3
Na
Mg
Al
Si
P4
S8
Cl2
Ar
4
K
Ca… Ga
Ge
As
Se
Br2
Kr
5
Rb
Sr…
Sn
Sb
Te
I2
Xe
Тип
кристалличес
кой решетки
In
Металлическая
Атом Молекулярн
ная
ая
11. Закрепление
Вам предлагается пройти тест.1.
Молекулярной структуры не имеет
1) йод (тв)
3) углекислый газ
2) графит
4) метан
2. Молекулярное строение имеет:
1) вода
3) оксид натрия
2) оксид кремния ( IV) 4) алмаз
12. Закрепление
3. Атом является структурной единицей:1) метана
3) кислорода
2) водорода
4) кремния
4. Кристаллическую структуру как у алмаза
имеет:
1) кремнезём
2) оксид натрия
2) оксид углерода ( II) 4) белый фосфор
13. Закрепление
5. У веществ с атомной решёткой:1) высокая твёрдость 3) летучесть
2) низкая t плав.
4) низкая t кип.
6. В узлах решёток молекулярного строения
1) атомы
3) молекулы
2) атомы и молекулы 4) молекулы и ионы
14. Закрепление
7. Хлорид натрия, алмаз и лёд имеюткристаллическую решётку:
1) ионную, молекулярную, атомную
2) молекулярную, атомную, ионную
3) атомную, ионную, молекулярную
4) ионную, атомную, молекулярную
15. Закрепление
8. Нафталин – лёгкоплавкое кристаллическое вещество потому, что имеет кристаллическую решётку:1) молекулярную
2) ионную
3) металлическую
4) атомную
16.
Хлорид кальцияТпл= 772 °C
Бесцветные кристаллы
Хорошо растворяется в
воде
Сильный электролит
Пищевая добавка Е 509
в производстве сыра,
творога, сухого молока;
джема, желе,
мармелада;
консервированных
овощей и фруктов










 Химия
Химия








