Похожие презентации:
Алкены. Ненасыщенные углеводороды, непредельные углеводороды, этиленовые углеводороды. Олефины (10 класс)
1.
АлкЕНыНенасыщенные углеводороды
Непредельные углеводороды
Этиленовые углеводороды
Олефины
2.
АлкЕНы –ациклические углеводороды,
содержащие в молекуле
помимо одинарных Ϭ-связей,
одну двойную связь
(Ϭ- и π-связи) между атомами
углерода (С=С)
3.
Общая формулаCnH2n
n=1 нет
n=2 С2Н4 этен (этилен)
n= 3 С3Н6 пропен (пропилен)
n=4 С4Н8 бутен
n=5 С5Н10 пентен
n=6 С6Н12 гексен
n=7 С7Н14 гептен
n=8 С8Н16 октен
n=9 С9Н18 нонен
n=10 С10Н20 децен
название —
олефины — алкены
получили по
аналогии с жирными
непредельными
кислотами
(олеиновая,
линолевая), остатки
которых входят в
состав жидких жиров
— масел
4.
Строение молекулы этилена• sp2-гибридизациия атомов углерода
• Ϭ-связи находятся в одной плоскости, валентный угол 120°
• перекрывание гибридных орбиталей приводит к образованию
σ-связи, а за счет негибридизованных р-орбиталей соседних
атомов углерода образуется вторая, π-связь
• наличие подвижной, легко поляризуемой π -связи приводит к
тому, что алкены химически более активны, чем алканы
5.
Изомерия и номенклатураИзомерия
Этилен не имеет изомеров!!!
1. Структурная изомерия
А) углеродной цепи (углеродного скелета)
СН2 = СН – СН2 – СН2 – СН3
пентен-1
СН3 – С = СН – СН3
СН3
2-метилбутен-2
Б) положения двойной связи
СН2 = СН – СН2 – СН3
бутен-1
СН3 – СН = СН – СН3
бутен-2
6.
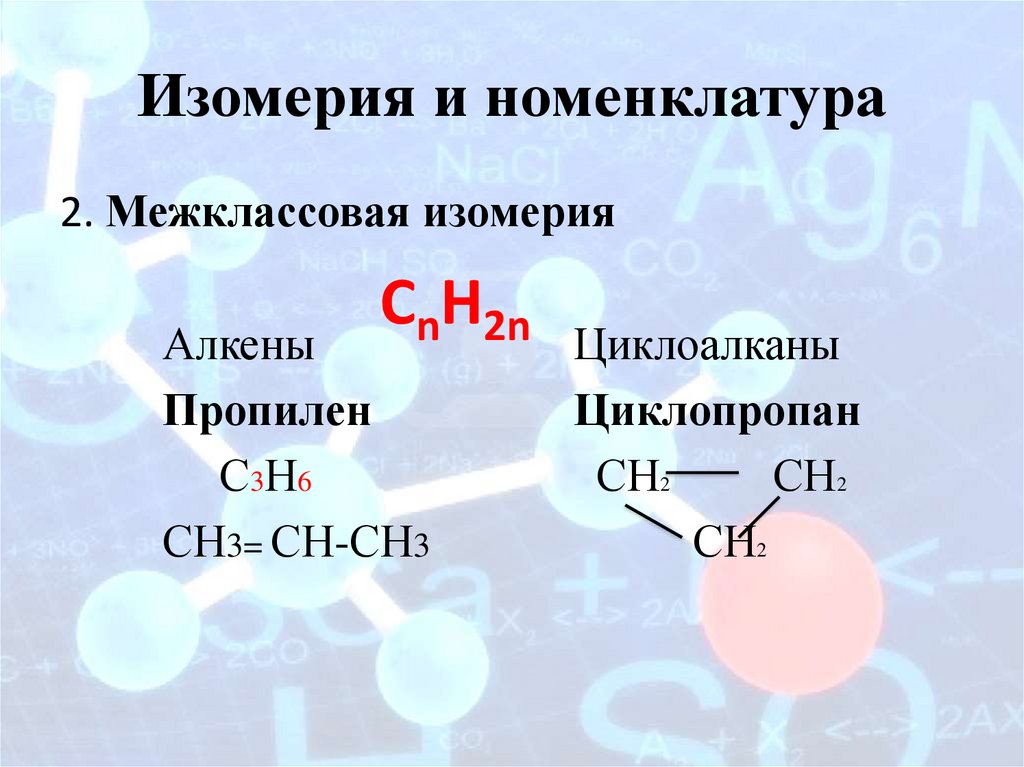
Изомерия и номенклатура2. Межклассовая изомерия
CnH2n
Алкены
Пропилен
С3Н6
СН3= СН-СН3
Циклоалканы
Циклопропан
СН2
СН2
СН2
7.
Изомерия и номенклатура3. Геометрическая изомерия
(цис-транс-изомерия)
Н3С
Н3С
С=С
Н
Н
Цис-бутен-2
Н
Н3С
СН3 – СН = СН– СН3
бутен-2
С=С
Н
Н3С
Транс-бутен-2
8.
Изомерия и номенклатураНоменклатура
• 1.Выбор главной цепи. В случае алкенов главная цепь
должна содержать двойную связь.
• 2.Нумерация атомов главной цепи начинается с того
конца, к которому ближе находится двойная связь.
• 3.Формирование названия. В конце названия указывают
номер атома углерода, у которого начинается двойная
связь, и суффикс -ен.
9.
Физические свойства алкеновC2H4 до C4H8
C5H10 до C16H32
C17H34 и далее
Газы
Жидкости
Твёрдые вещества
T кипения и Т плавления увеличиваются
Плохо растворимы в воде
10.
Получение алкеновВ промышленности алкены получают крекингом
или дегидрированием алканов нефти.
1. Термический крекинг алканов (t = 600̊ C)
CH3-CH2-CH2-CH3 → CH2=CH2 + CH3-CH3
бутан
этилен
этан
2. Дегидрирование алканов (t=400̊C, Cr2O3 или Ni)
CH3-CH3 → CH2=CH2 + Н2
этан
этилен
11.
Получение алкеновЛабораторные способы получения
алкенов основаны на реакциях отщепления
(элиминирование) двух заместителей от
соседних атомов углерода
H H
H H
C C →
C=C
+ X Y,
X Y
где Х-Y: H2, Cl2, Br2, I2, HOH, HCl, HBr...
12.
Получение алкенов3. Внутримолекулярная дегидратация спиртов
А) первичных
H SO
t>140 C
СН2-СН2
CH2=CH2 + Н2O
Н
OH
этанол
этилен
Б) вторичных (по правилу Зайцева)
2
CH3-CH-CH-CH3
4(конц)
0
H2SO4(конц) t>1400C
CH3-CH=CH-CH3 + Н2O
Н OH
бутанол – 2
бутен-2
13.
Получение алкенов4. Дегидрогалогенирование (NaOH или KOH
спиртовой раствор)
А) первичные галогеналканы
t
CH3-CH2-Cl +KOH(спирт.р-р) → CH2=CH2 + KCl +H2O
хлорэтан
этилен
Б) вторичные галогеналканы (по правилу Зайцева)
t
СH3-CH2-CH-CH3 +KOH(спирт.р-р) → СH3-CH=CH-CH3 + KCl+H2O
Сl
2-хлорбутан
бутен-2
14.
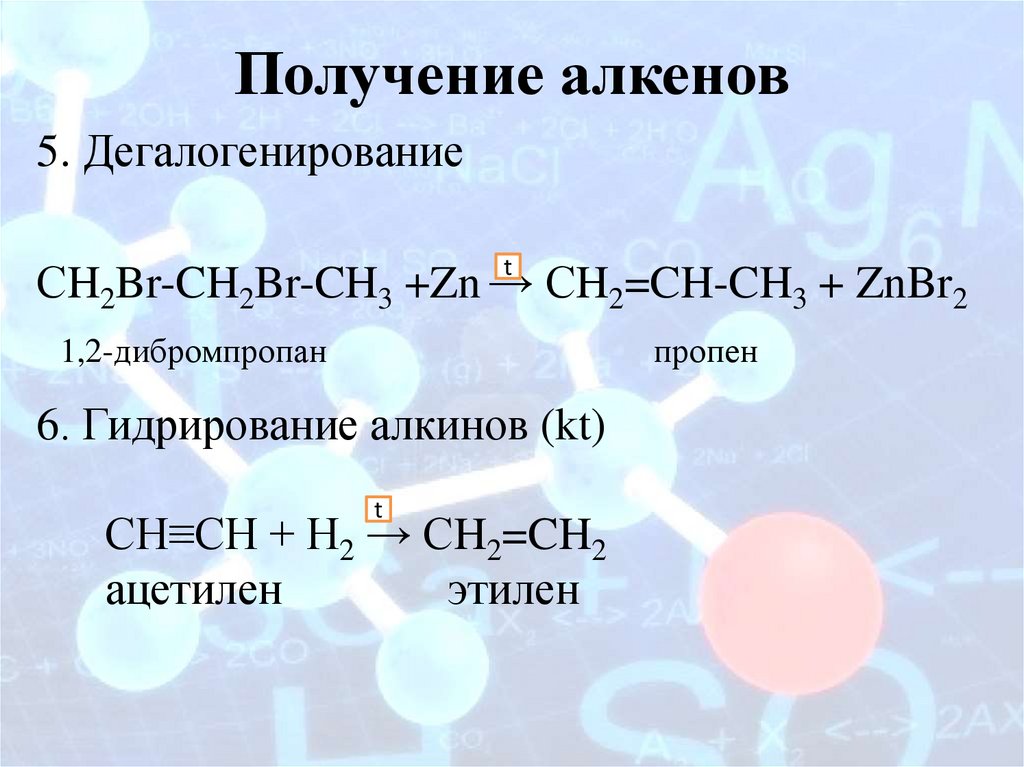
Получение алкенов5. Дегалогенирование
t
СH2Br-CH2Br-CH3 +Zn → СH2=CH-CH3 + ZnBr2
пропен
1,2-дибромпропан
6. Гидрирование алкинов (kt)
t
СH≡CH + H2 → СH2=CH2
ацетилен
этилен
15.
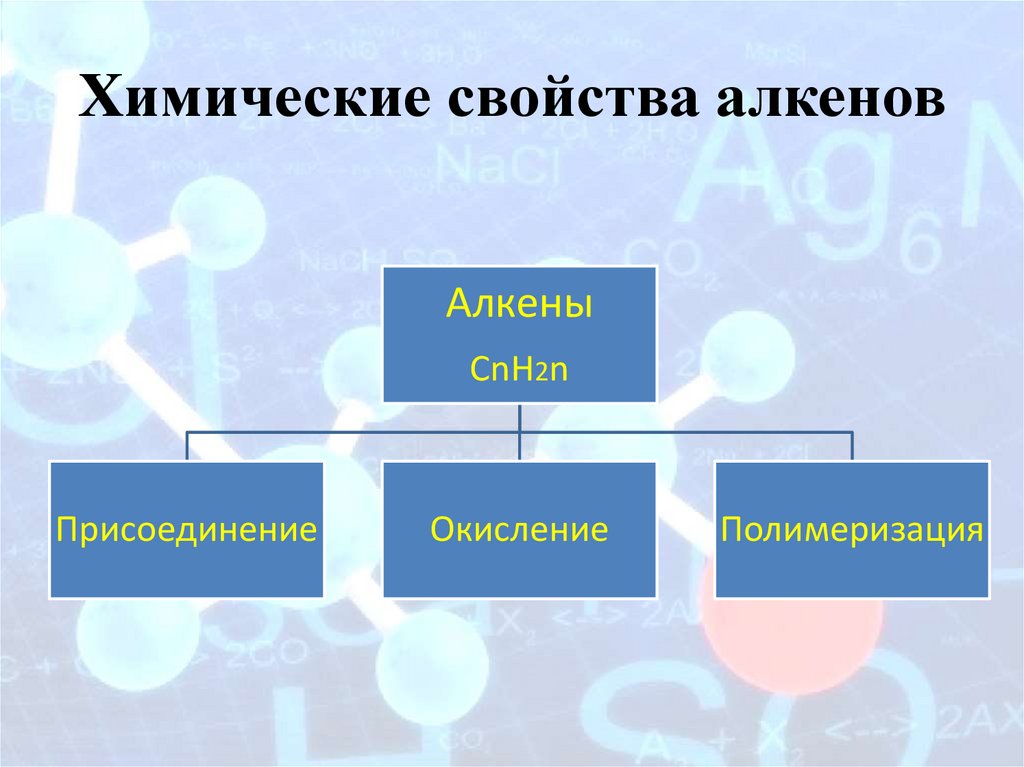
Химические свойства алкеновАлкены
CnH2n
Присоединение
Окисление
Полимеризация
16.
Реакции присоединения1. Гидрогалогенирование
CH2=CH2 + HBr → CH3–CH2Br
этилен
бромэтан
CH3– CH=CH2 + HBr → CH3 – CHBr –CH3
пропен
2-бромпропан
Присоединение происходит по правилу
Марковникова: атом водорода присоединяется к
наиболее гидрированному атому углерода
17.
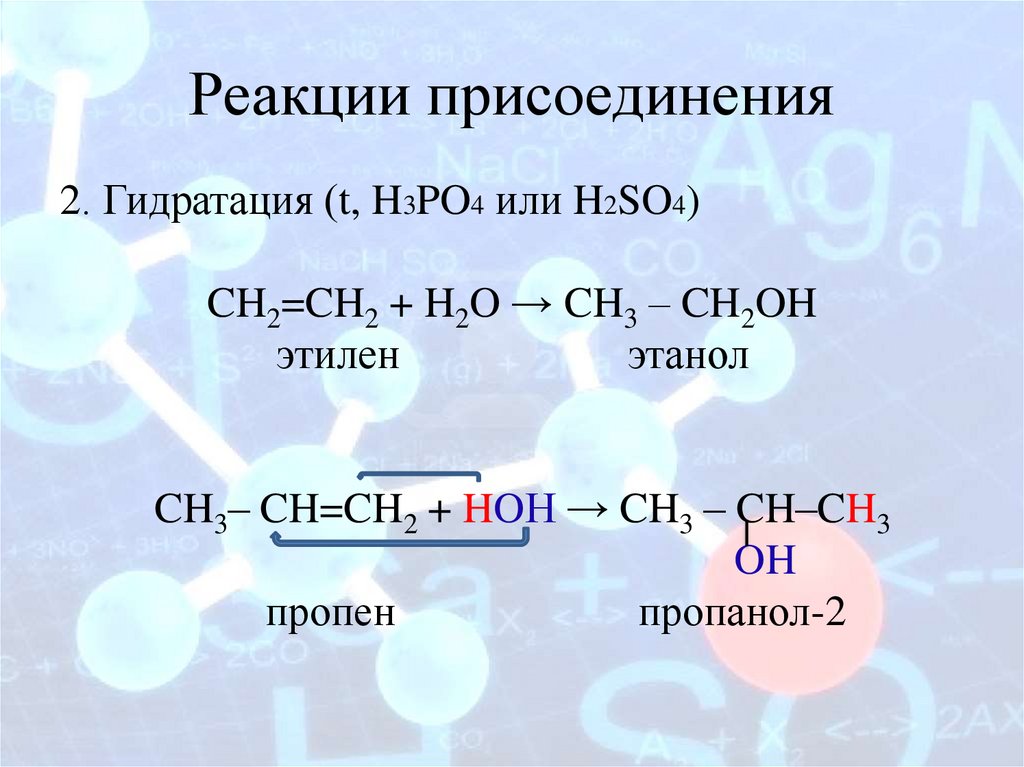
Реакции присоединения2. Гидратация (t, H3PO4 или H2SO4)
CH2=CH2 + H2O → CH3 – CH2OH
этилен
этанол
CH3– CH=CH2 + HOН → CH3 – CH–CH3
OH
пропен
пропанол-2
18.
Реакции присоединенияпротив правила Марковникова
1. Присутствие пероксидов H2O2
H2O2
CH2=CH–СН3 + HOН → CH2ОН – CH2–СН3
пропен
пропанол-1
H2O2
CH2=CH–СН3 + HСl → CH2Сl – CH2–СН3
пропен
1-хлорпропан
19.
Реакции присоединенияпротив правила Марковникова
2.Двойная связь сопряжена с
электроноакцепторными заместителями
(-F, -Cl, -NO2, -COOH и т.д.)
20.
Реакции присоединения3. Галогенирование
Бромирование (качественная реакция)
CH2=CH2 + Br2 → CH2 Br –CH2 Br
этен
1,2-дибромэтан
Хлорирование (газовая фаза при сильном нагревании)реакция замещения по α-углероду!!!
CH2=CH–CH3 + Cl2 → CH2=CH–CH2 Cl + HCl
пропен
3-хлорпропен-1
21.
Реакции присоединения4.Гидрирование (Ni, t, p )
CH2=CH2 + H2 → CH3 –CH3
этен
этан
Дегидрирование (при высокой температуре)
CH2=CH2 → CH ≡CH + H2
этен
ацетилен
22.
Реакции полимеризации5.Полимеризация – процесс соединения одинаковых
молекул (мономеров), протекающий за счёт разрыва кратных
связей, с образованием высокомолекулярного соединения
(полимера).
этилен
kt, t, p
nCH2=CH2 →
мономер
полиэтилен
( – CH2 – CH2 – )n
полимер
n – степень полимеризации
23.
Реакции полимеризацииnCH3–CH=CH2 → ( – CH – CH2 – )n
CH3
пропилен
полипропилен
nCH2=CHCl → ( – CH2 – CH – )n
Cl
винилхлорид
поливинилхлорид
(хлорэтен)
24.
Реакции окисления6.Мягкое окисление перманганатом калия
(реакция Вагнера) (на холоду или t=0 ̊С)
3CH2=CH2+2KMnO4+4H2O →3CH2– CH2+2MnO2 +2KOH
этилен
OH
OH
этандиол-1,2(этиленгликоль)
3CH3–CH=CH2+2KMnO4+4H2O→3CH3–CH2–CH2+2MnO2+2KOH
пропилен
OH OH
пропандиол-1,2
25.
Реакции окисленияOH
+MnO2 +KOH
OH
+KMnO4 + H2O→
CH=CH2
+KMnO4 + H2O→
Стирол
(винилбензол)
CH–CH2
+MnO2 +KOH
OH OH
1-фенилэтандиол-1,2
26.
Реакции окисления7.Жесткое окисление перманганатом калия в
присутствии концентрированной серной
кислоты при нагревании (кач.реакция)
t
5СH3–CH=CH–CH3 +8KMnO4 +12H2SO4 →
бутен-2
10CH3–COOH +8MnSO4 +4K2SO4 +12H2O
t
СH3–CH=CH
2 +2KMnO4 + 3H2SO4 →
пропен
CH3–COOH+ СО2↑+K2SO4+2MnSO4+4H2O
27.
Реакции окисленияt
5CH2=CH2 +12KMnO4 + 18H2SO4 →
этилен
10СО2↑+6K2SO4+12MnSO4+28H2O
28.
Реакции окисления8. Неполное каталитическое окисление
200с, Ag
2CH2=CH 2+ О2
2CH2–CH 2
O
окись этилена
9. Горение
CH2=CH 2+ 3O2 → 2CO2 + 2H2O
29.
СПИСОК ЛИТЕРАТУРЫ• http://himege.ru/alkeny-nomenklatura-polucheniexarakternye-ximicheskie-svojstva/
• https://ru.wikipedia.org/wiki
• https://studarium.ru/article/183
1. Габриелян О.С. Химия. 10 класс. Базовый уровень:
учебник/ О.С.Габриелян.-2-е изд., стереотип. М.:Дрофа, 2017.
2. Егоров А.С. Химия: экспресс-репититор для
подготовки к ЕГЭ. – Ростов н/Д:Феникс,2017.
2. Крышилович Е.В. Химия.- Москва:Эксмо,2018.
3. Химия. Большой справочник для подготовки к ЕГЭ:
справочное издание/ под ред. Дронькина В.Н. – Ростов
н/Д: Легион,2017.

























 Химия
Химия








