Похожие презентации:
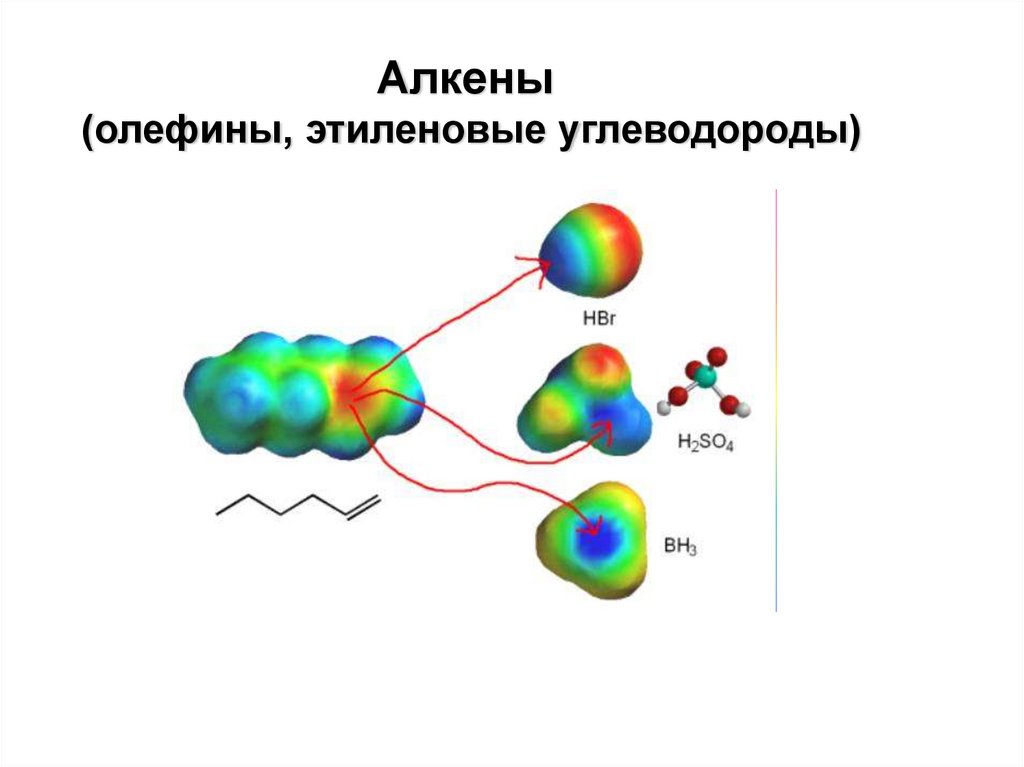
Алкены (олефины, этиленовые углеводороды)
1.
Алкены(олефины, этиленовые углеводороды)
2.
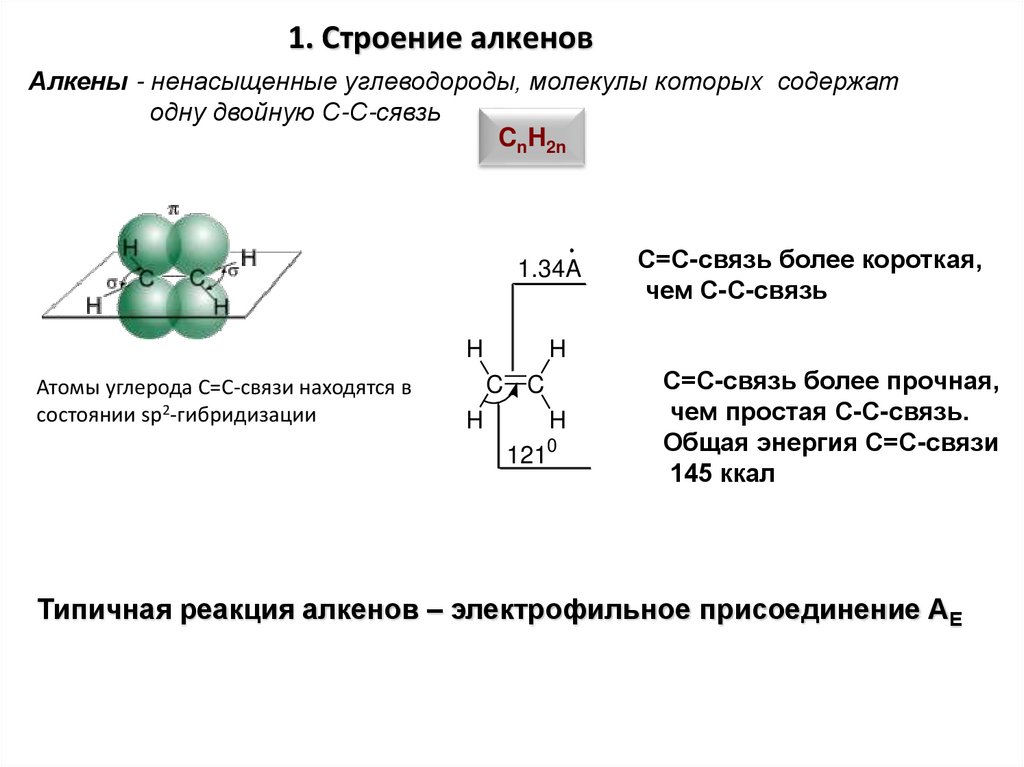
1. Строение алкеновАлкены - ненасыщенные углеводороды, молекулы которых содержат
одну двойную С-С-сявзь
CnH2n
1.34A
H
Атомы углерода С=С-связи находятся в
состоянии sp2-гибридизации
H
C C
H
С=С-связь более короткая,
чем С-С-связь
H
1210
С=С-связь более прочная,
чем простая С-С-связь.
Общая энергия С=С-связи
145 ккал
Типичная реакция алкенов – электрофильное присоединение АЕ
3.
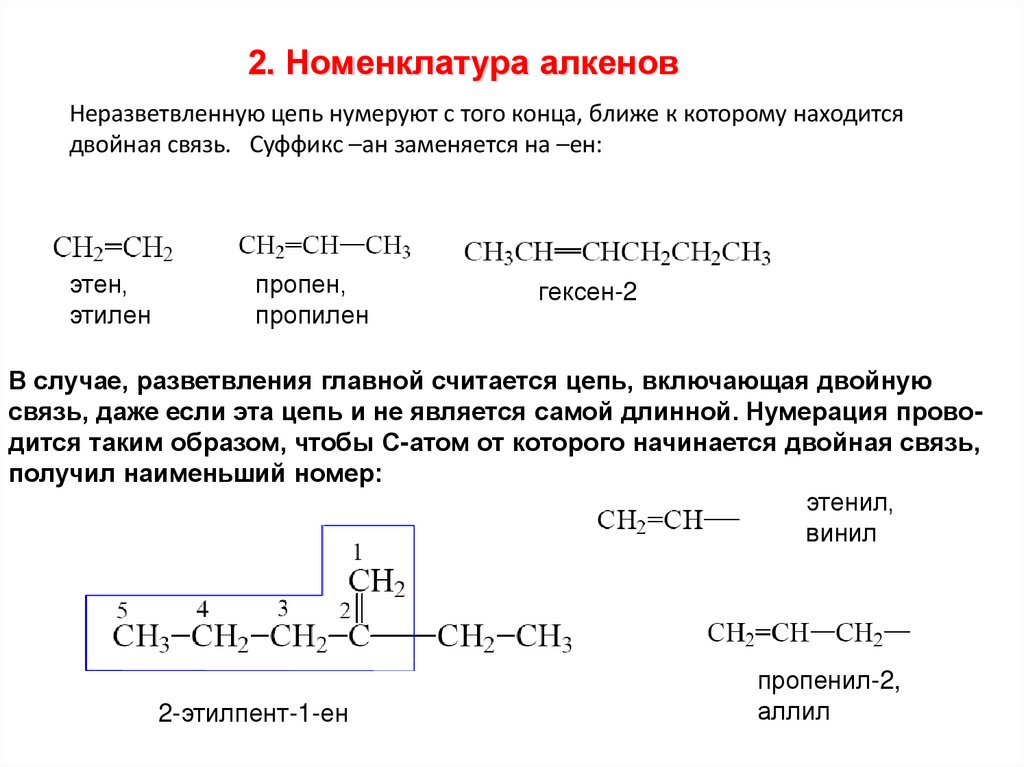
2. Номенклатура алкеновНеразветвленную цепь нумеруют с того конца, ближе к которому находится
двойная связь. Суффикс –ан заменяется на –ен:
этен,
этилен
пропен,
пропилен
гексен-2
В случае, разветвления главной считается цепь, включающая двойную
связь, даже если эта цепь и не является самой длинной. Нумерация проводится таким образом, чтобы С-атом от которого начинается двойная связь,
получил наименьший номер:
этенил,
винил
2-этилпент-1-ен
пропенил-2,
аллил
4.
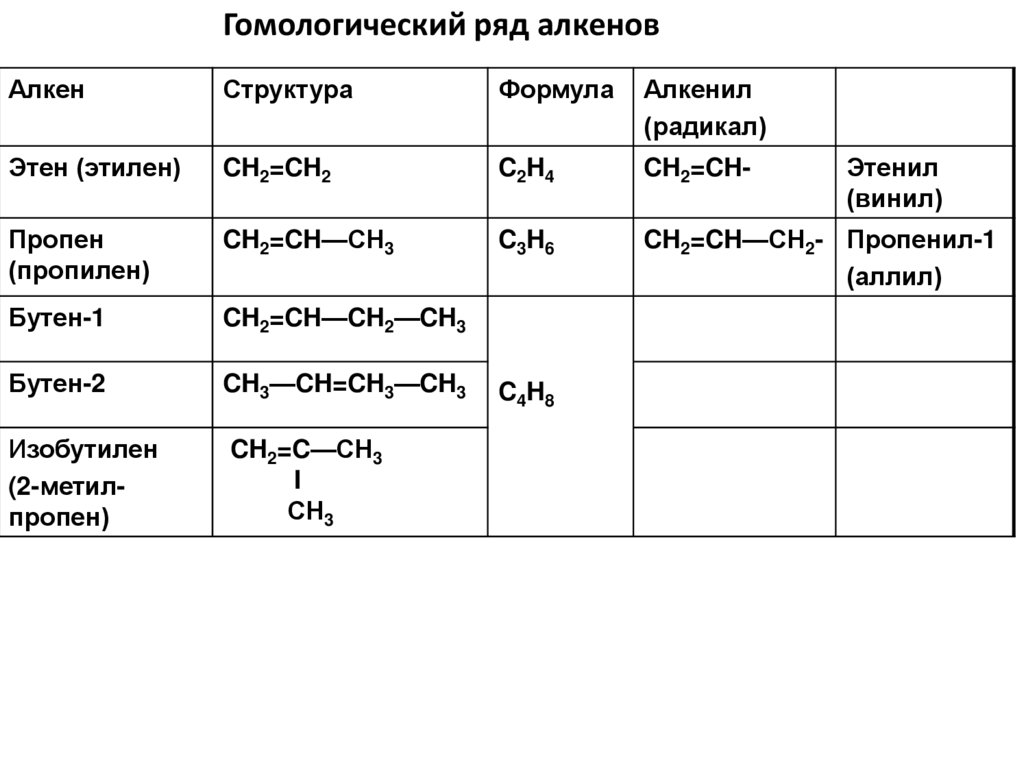
Гомологический ряд алкеновАлкен
Структура
Формула
Алкенил
(радикал)
Этен (этилен)
CH2=CH2
C2H4
CH2=CH-
Пропен
(пропилен)
CH2=CH—СН3
C3H6
CH2=CH—СН2- Пропенил-1
(аллил)
Бутен-1
CH2=CH—CH2—CH3
Бутен-2
CH3—CH=CH3—CH3
Изобутилен
(2-метилпропен)
CH2=C—СН3
I
СН3
C4H8
Этенил
(винил)
5.
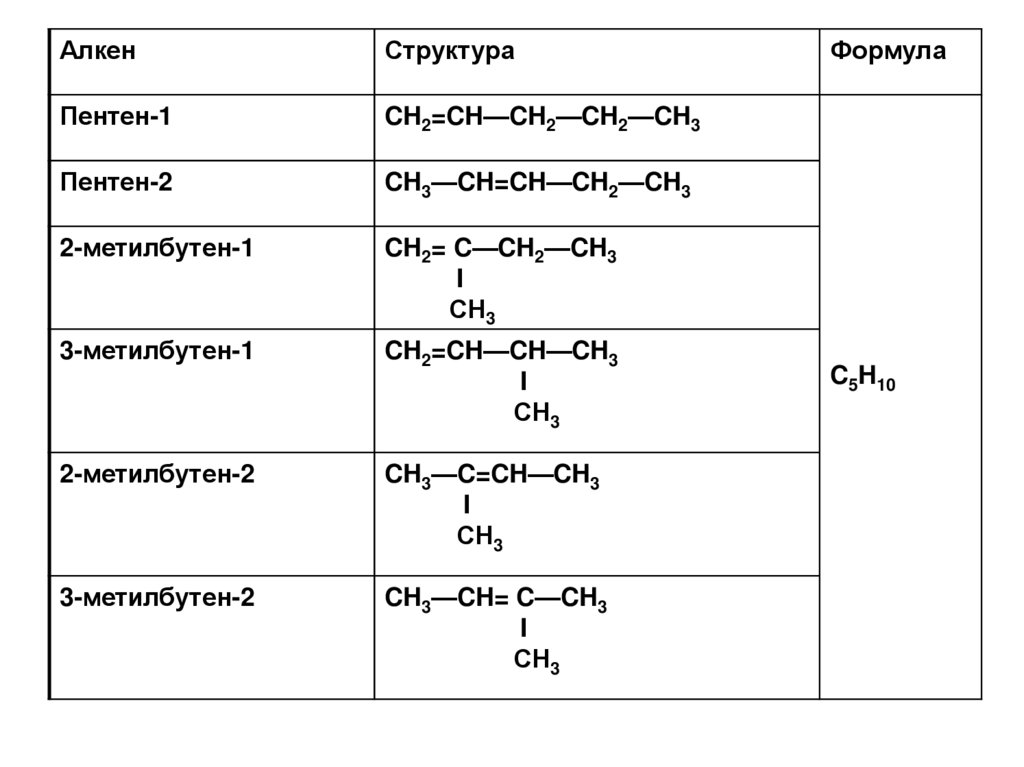
АлкенСтруктура
Пентен-1
CH2=CH—CH2—CH2—CH3
Пентен-2
CH3—CH=CH—CH2—CH3
2-метилбутен-1
CH2= C—CH2—CH3
I
СН3
3-метилбутен-1
CH2=CH—CH—CH3
I
СН3
2-метилбутен-2
CH3—C=CH—CH3
I
СН3
3-метилбутен-2
CH3—CH= C—CH3
I
СН3
Формула
C5H10
6.
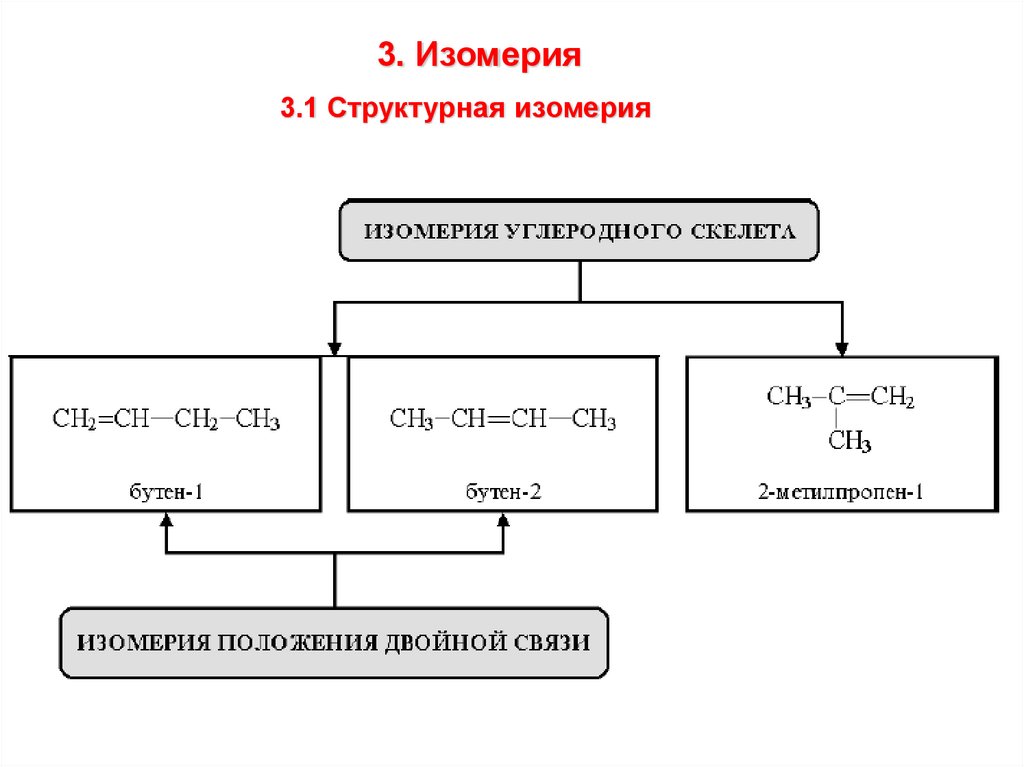
3. Изомерия3.1 Структурная изомерия
7.
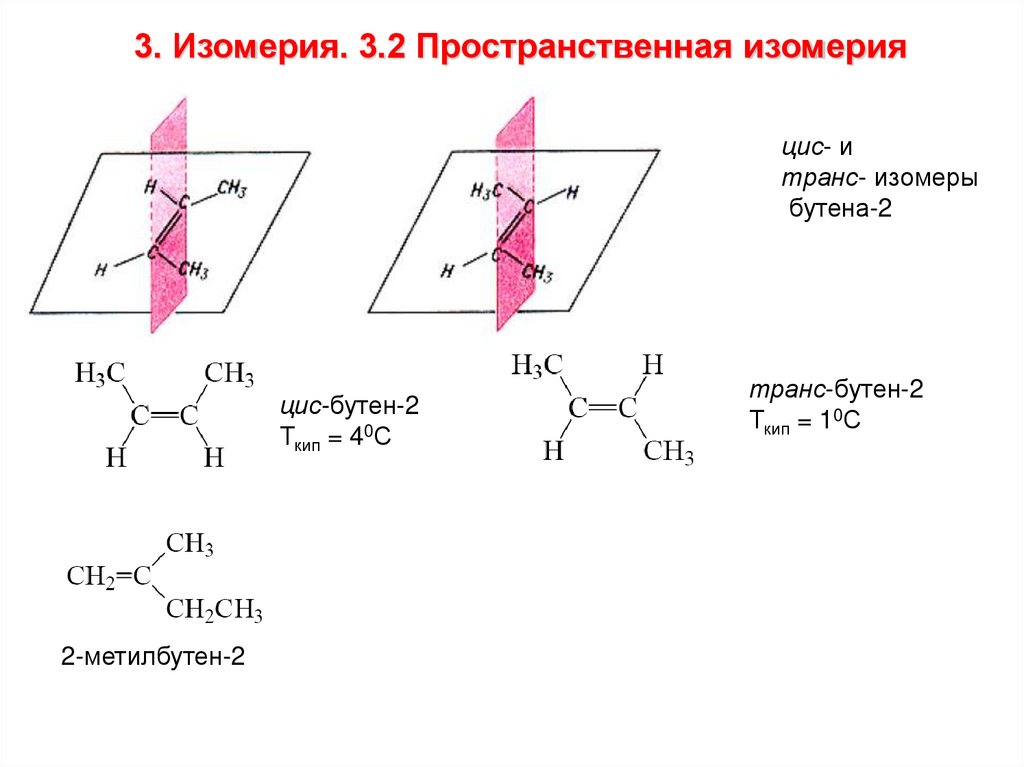
3. Изомерия. 3.2 Пространственная изомерияцис- и
транс- изомеры
бутена-2
цис-бутен-2
Ткип = 40С
2-метилбутен-2
транс-бутен-2
Ткип = 10С
8.
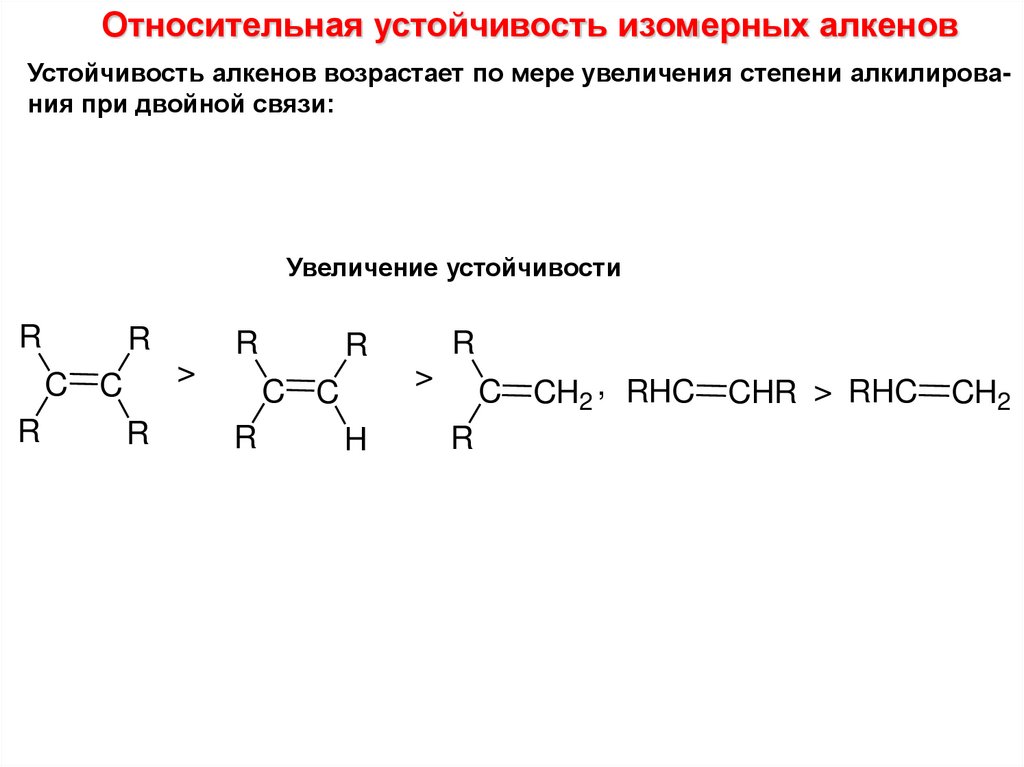
Относительная устойчивость изомерных алкеновУстойчивость алкенов возрастает по мере увеличения степени алкилирования при двойной связи:
Увеличение устойчивости
R
R
>
C C
R
R
R
>
C C
R
R
R
H
C CH2 , RHC
R
CHR > RHC
CH2
9.
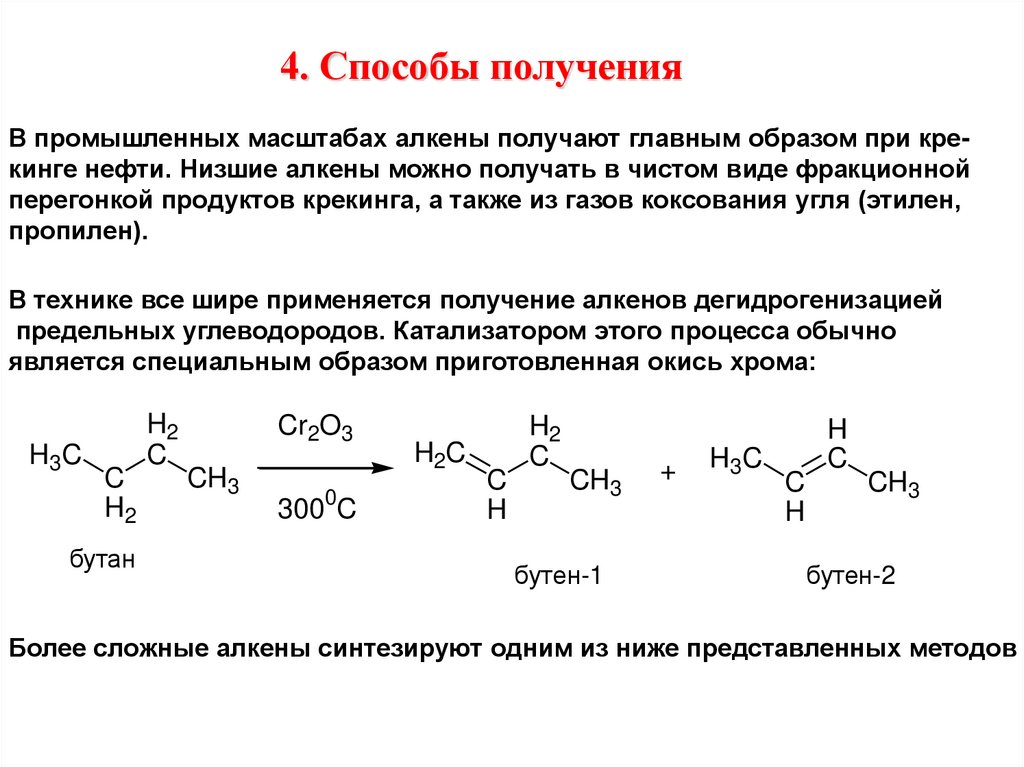
4. Способы полученияВ промышленных масштабах алкены получают главным образом при крекинге нефти. Низшие алкены можно получать в чистом виде фракционной
перегонкой продуктов крекинга, а также из газов коксования угля (этилен,
пропилен).
В технике все шире применяется получение алкенов дегидрогенизацией
предельных углеводородов. Катализатором этого процесса обычно
является специальным образом приготовленная окись хрома:
H3C
C
H2
бутан
H2
C
Cr2O3
CH3
0
300 C
H2C
C
H
H2
C
CH3
бутен-1
+
H3C
C
H
H
C
CH3
бутен-2
Более сложные алкены синтезируют одним из ниже представленных методов
10.
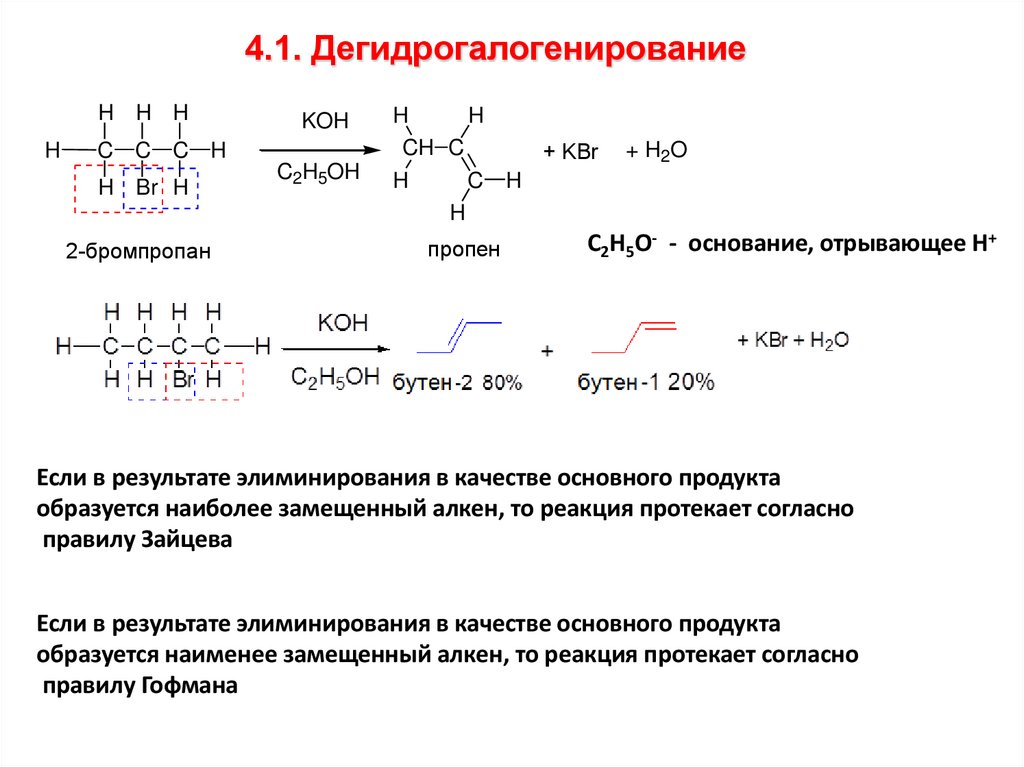
4.1. ДегидрогалогенированиеH H H
H
KOH
C C C H
H Br H
2-бромпропан
C2H5OH
H
H
CH C
+ KBr
H
C H
H
пропен
+ H2O
С2Н5О- - основание, отрывающее Н+
Если в результате элиминирования в качестве основного продукта
образуется наиболее замещенный алкен, то реакция протекает согласно
правилу Зайцева
Если в результате элиминирования в качестве основного продукта
образуется наименее замещенный алкен, то реакция протекает согласно
правилу Гофмана
11.
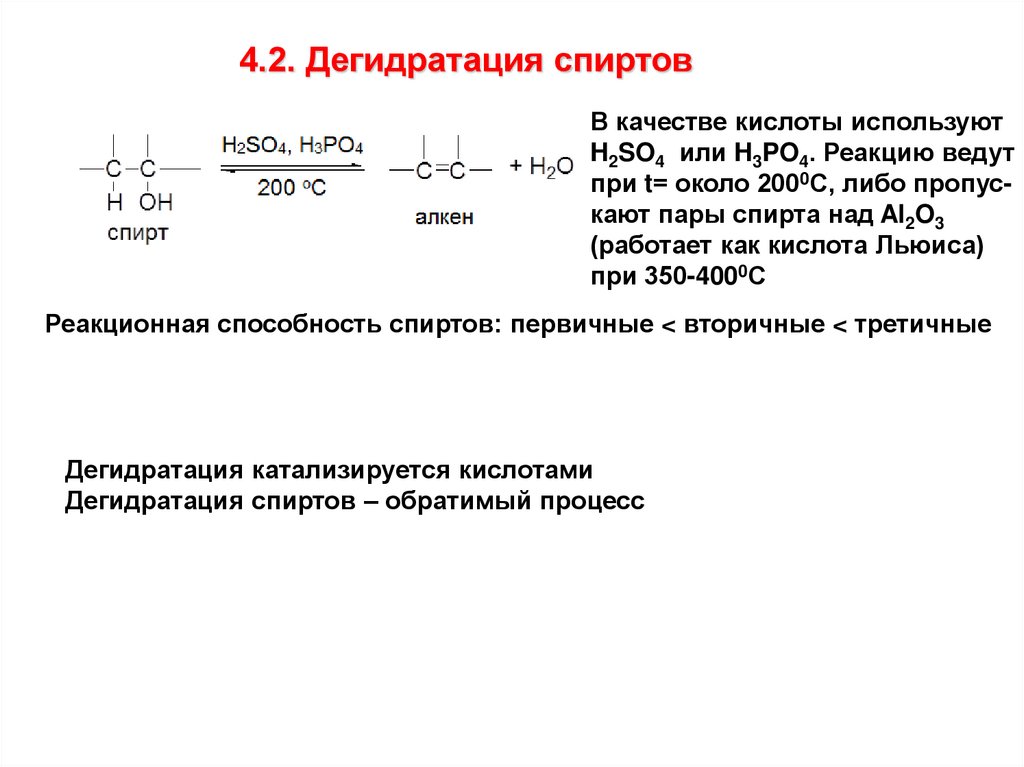
4.2. Дегидратация спиртовВ качестве кислоты используют
H2SO4 или H3PO4. Реакцию ведут
при t= около 2000С, либо пропускают пары спирта над Al2O3
(работает как кислота Льюиса)
при 350-4000С
Реакционная способность спиртов: первичные < вторичные < третичные
Дегидратация катализируется кислотами
Дегидратация спиртов – обратимый процесс
12.
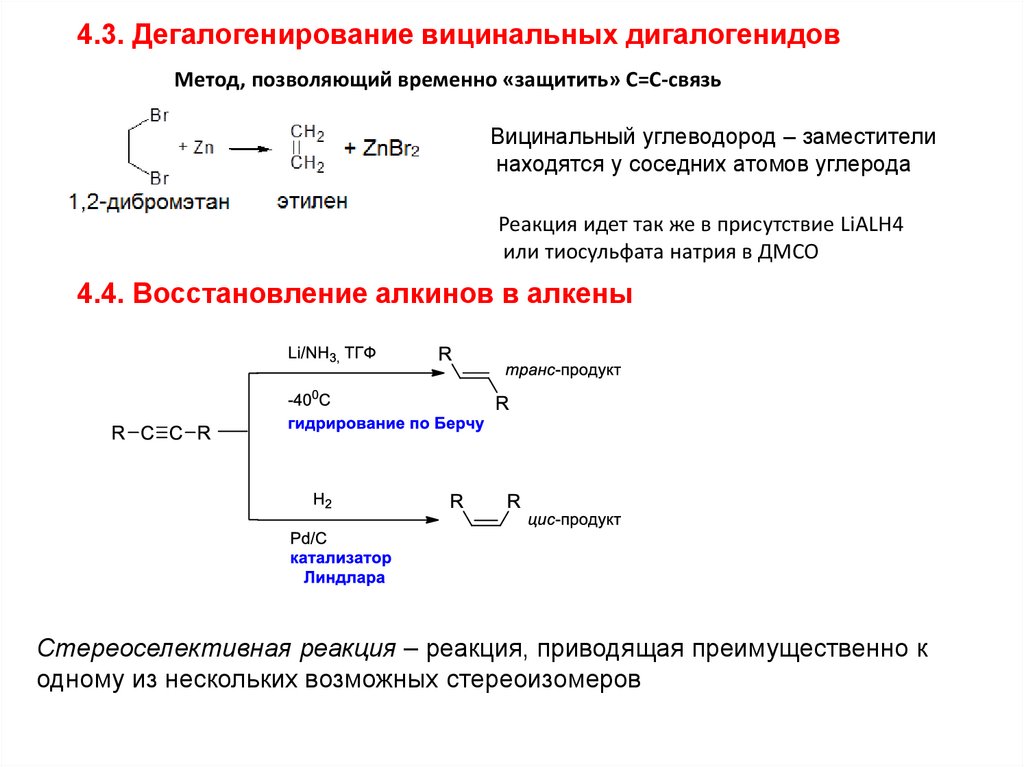
4.3. Дегалогенирование вицинальных дигалогенидовМетод, позволяющий временно «защитить» С=С-связь
Вицинальный углеводород – заместители
находятся у соседних атомов углерода
Реакция идет так же в присутствие LiALH4
или тиосульфата натрия в ДМСО
4.4. Восстановление алкинов в алкены
Стереоселективная реакция – реакция, приводящая преимущественно к
одному из нескольких возможных стереоизомеров
13.
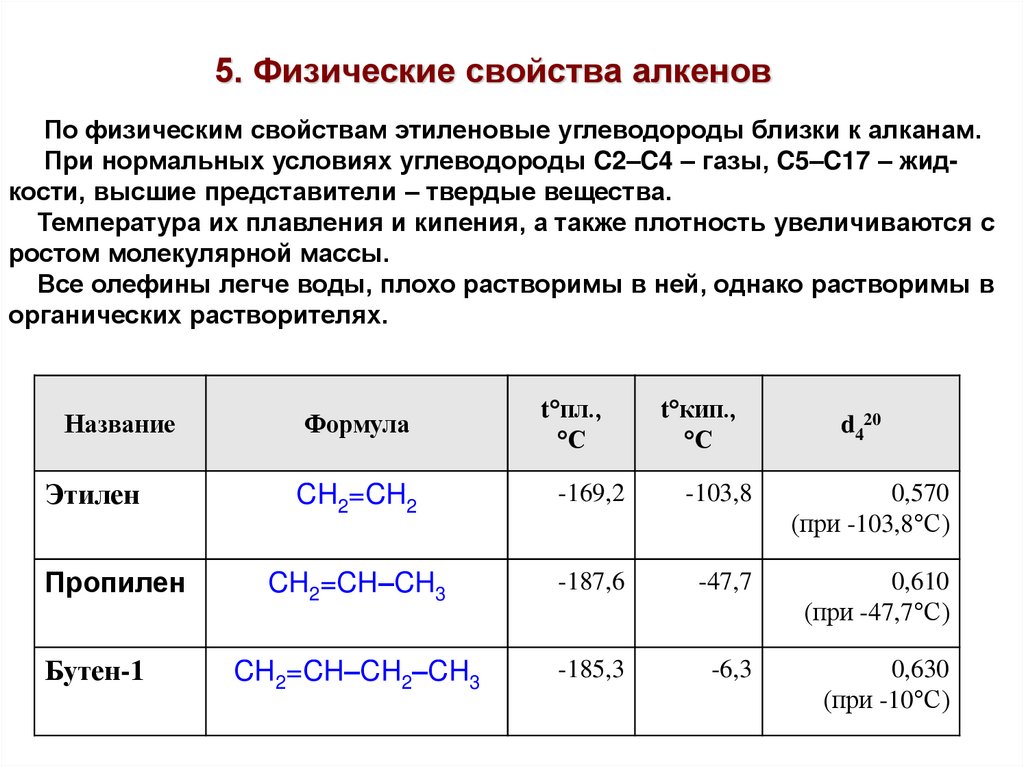
5. Физические свойства алкеновПо физическим свойствам этиленовые углеводороды близки к алканам.
При нормальных условиях углеводороды C2–C4 – газы, C5–C17 – жидкости, высшие представители – твердые вещества.
Температура их плавления и кипения, а также плотность увеличиваются с
ростом молекулярной массы.
Все олефины легче воды, плохо растворимы в ней, однако растворимы в
органических растворителях.
Название
Этилен
Пропилен
Бутен-1
Формула
t°пл.,
°С
t°кип.,
°С
CH2=CH2
-169,2
-103,8
0,570
(при -103,8°С)
CH2=CH–CH3
-187,6
-47,7
0,610
(при -47,7°С)
CH2=CH–CH2–CH3
-185,3
-6,3
0,630
(при -10°С)
d420
14.
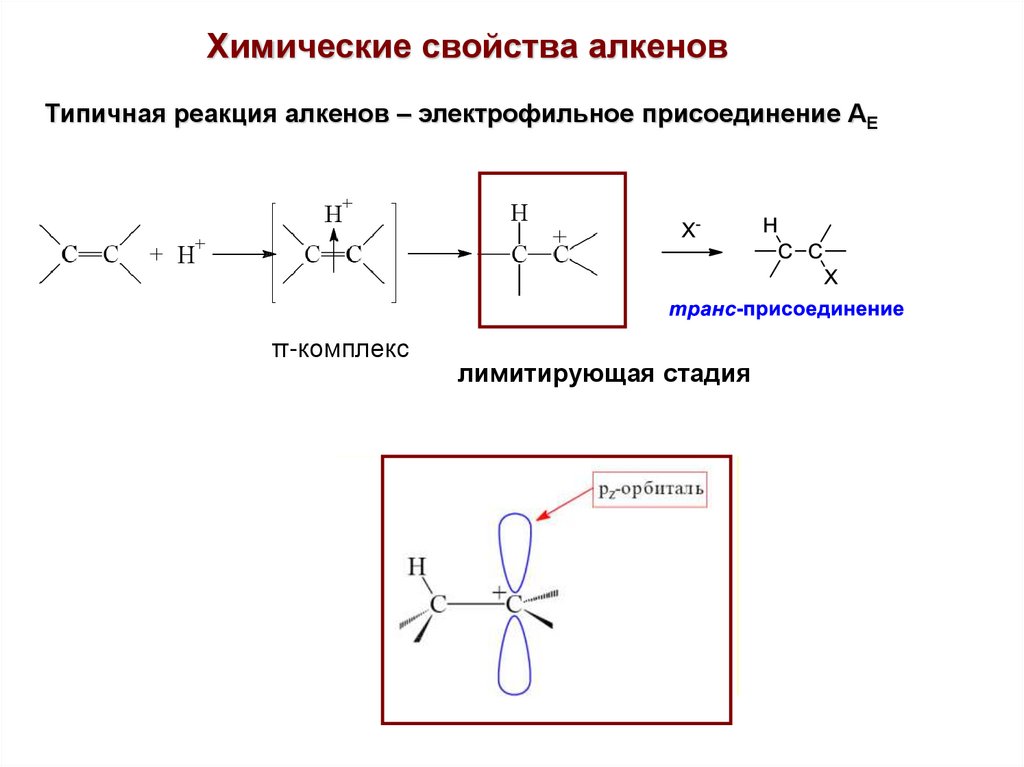
Химические свойства алкеновТипичная реакция алкенов – электрофильное присоединение АЕ
π-комплекс
лимитирующая стадия
15.
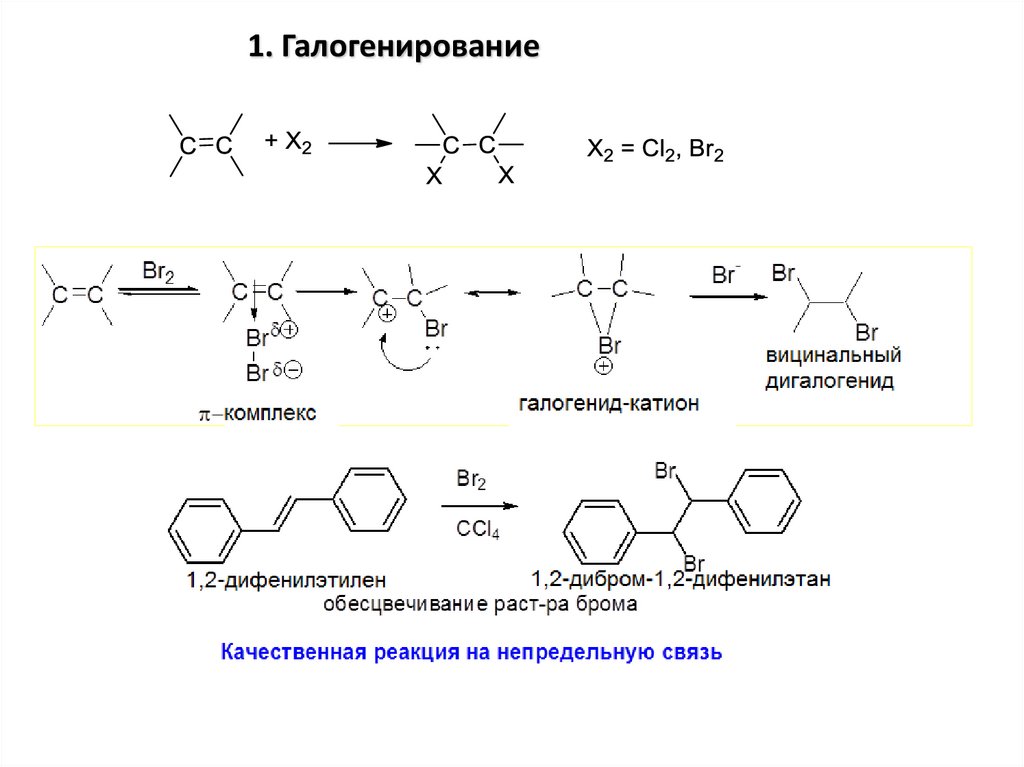
1. Галогенирование16.
• Присоединение гетероатомных молекулидет по правилу В.В. Марковникова
Атом водорода присоединяется
к наиболее гидрированному
атому углерода при двойной
связи, а гетероатом (галоген,
гидроксигруппа, кислотный
остаток) – к наименее
гидрированному атому углерода
17.
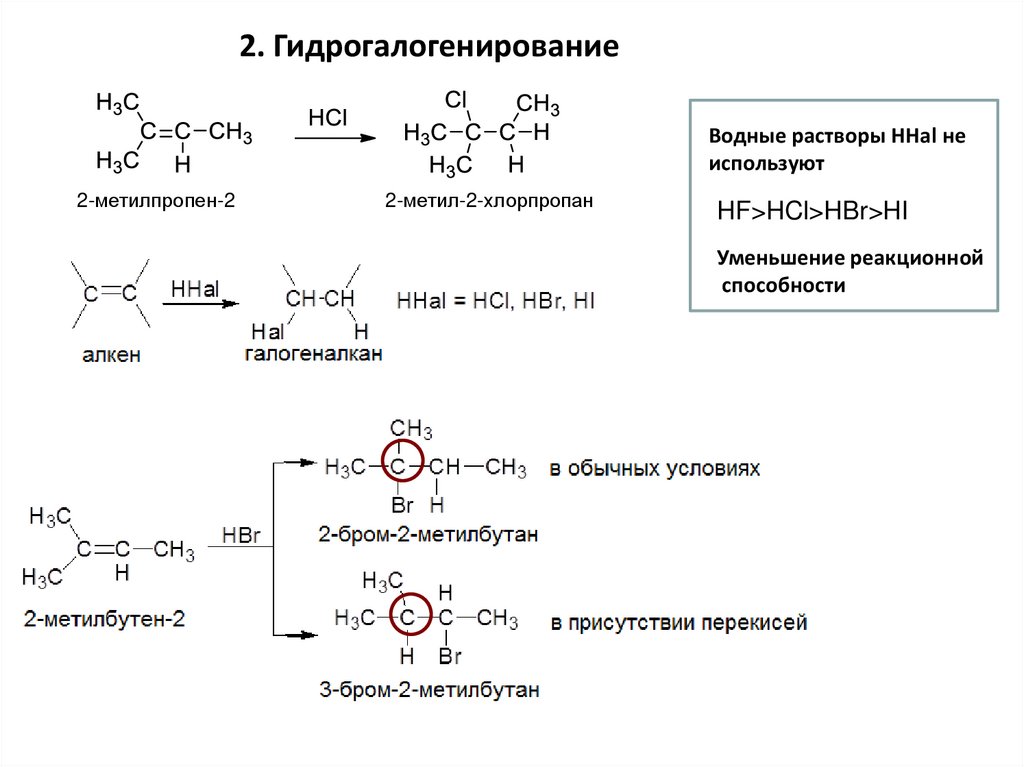
2. ГидрогалогенированиеВодные растворы НHal не
используют
2-метилпропен-2
2-метил-2-хлорпропан
HF>HCl>HBr>HI
Уменьшение реакционной
способности
18.
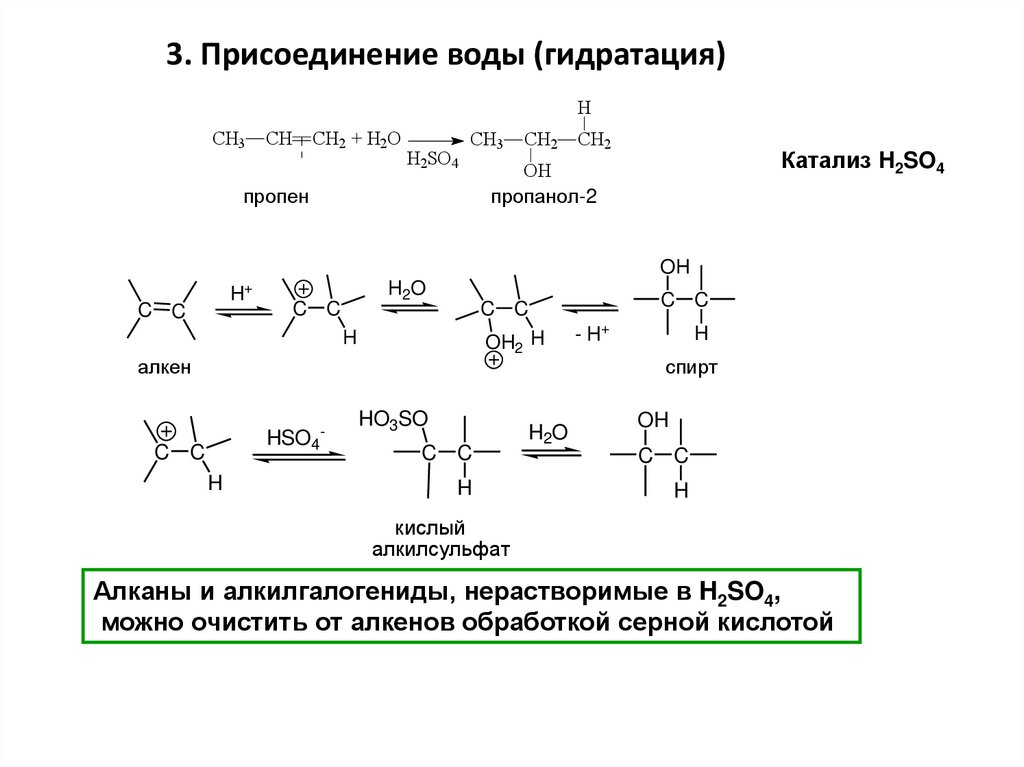
3. Присоединение воды (гидратация)H
СH3
CH
CH2 + H2O
H2SO4
CH3
пропен
CH2
CH2
Катализ H2SO4
OH
пропанол-2
OH
H2O
+
H
C C
C C
H
OH2 H
алкен
HSO4
C C
H
-
C C
C C
HO3SO
C C
H
H2O
- H+
H
спирт
OH
C C
H
кислый
алкилсульфат
Алканы и алкилгалогениды, нерастворимые в H2SO4,
можно очистить от алкенов обработкой серной кислотой
19.
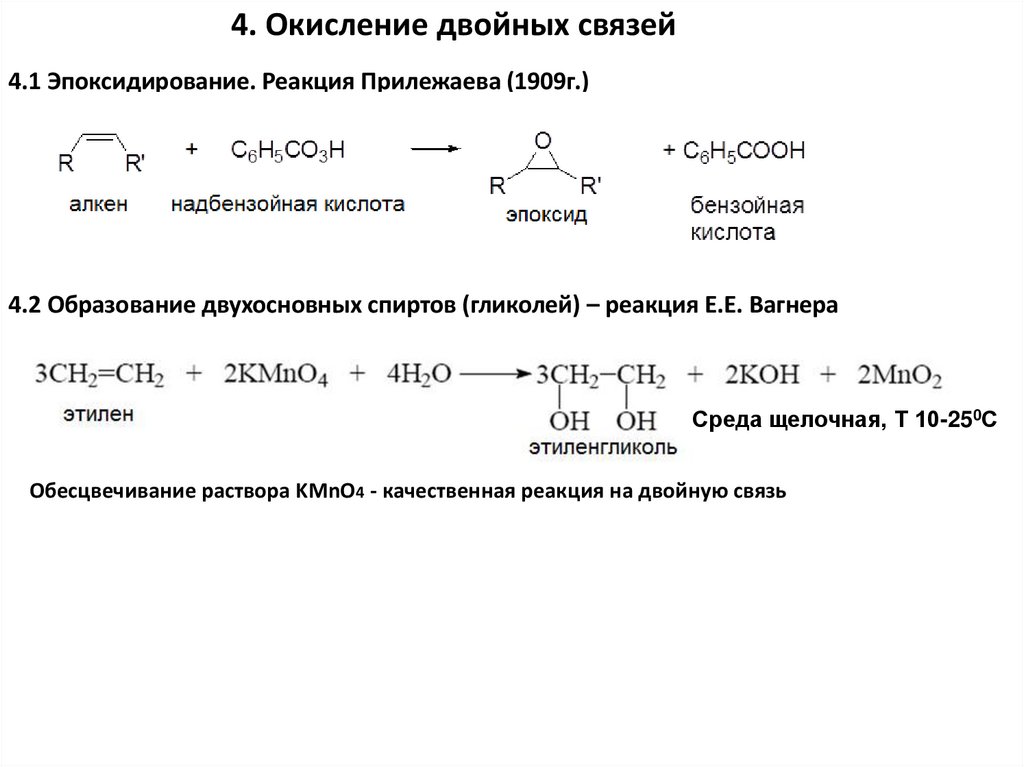
4. Окисление двойных связей4.1 Эпоксидирование. Реакция Прилежаева (1909г.)
4.2 Образование двухосновных спиртов (гликолей) – реакция Е.Е. Вагнера
Среда щелочная, Т 10-250С
Обесцвечивание раствора KMnO4 - качественная реакция на двойную связь
20.
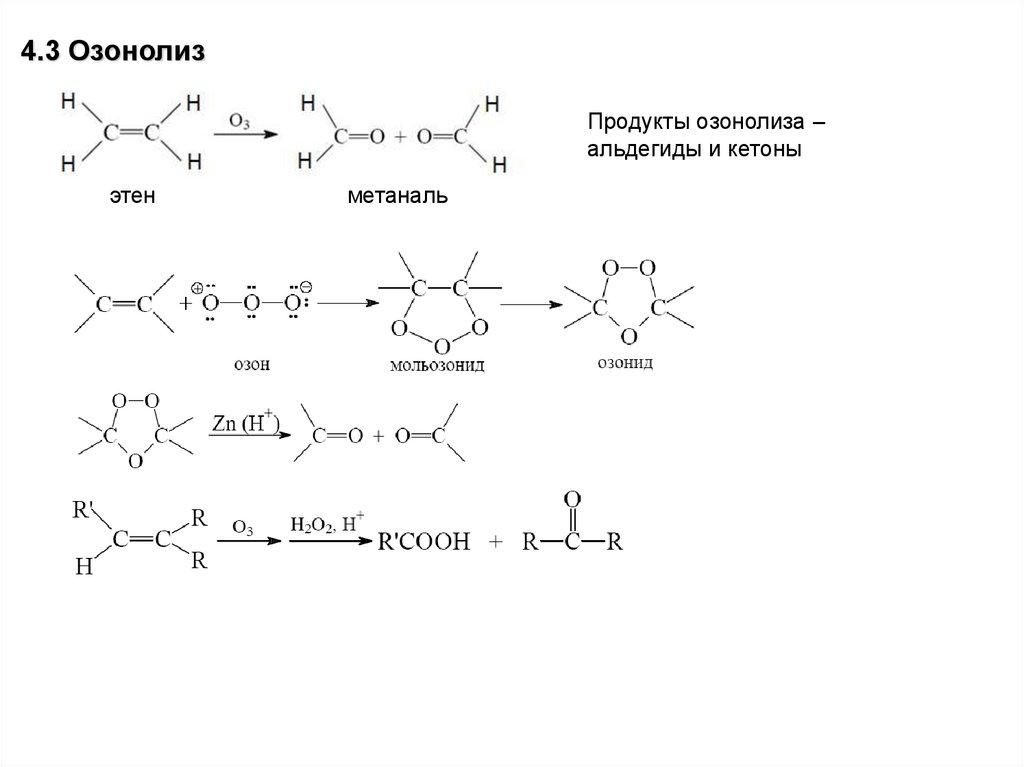
4.3 ОзонолизПродукты озонолиза –
альдегиды и кетоны
этен
метаналь
21.
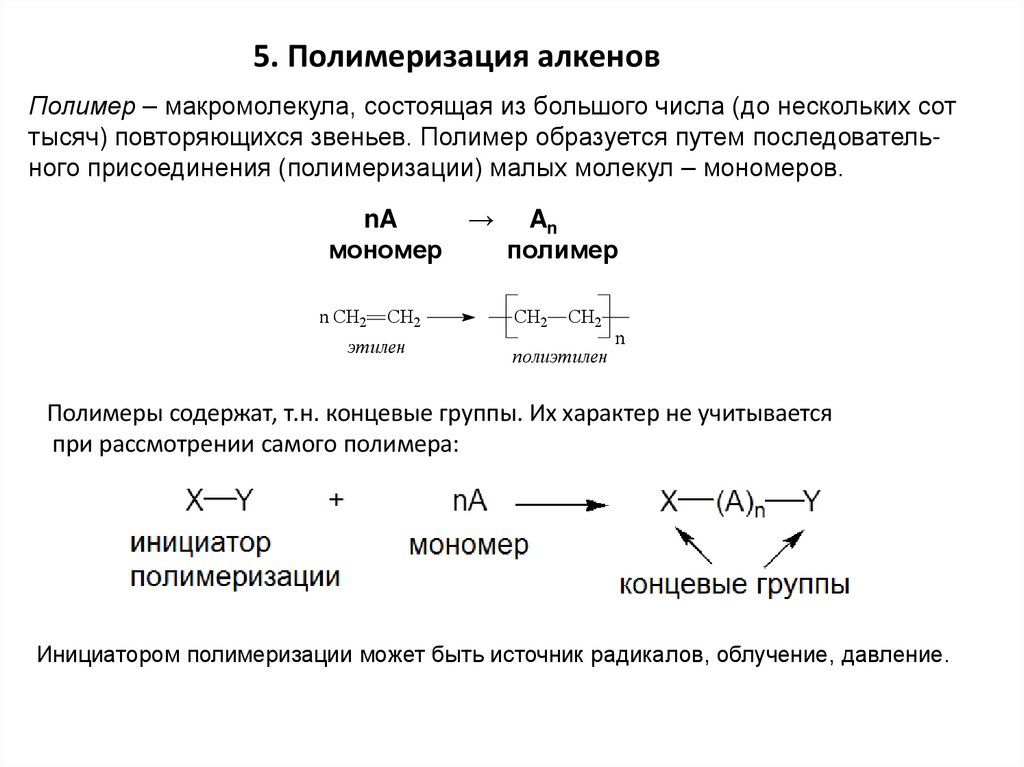
5. Полимеризация алкеновПолимер – макромолекула, состоящая из большого числа (до нескольких сот
тысяч) повторяющихся звеньев. Полимер образуется путем последовательного присоединения (полимеризации) малых молекул – мономеров.
nA
мономер
n CH2
CH2
этилен
→
An
полимер
CH2
CH2
полиэтилен
n
Полимеры содержат, т.н. концевые группы. Их характер не учитывается
при рассмотрении самого полимера:
Инициатором полимеризации может быть источник радикалов, облучение, давление.
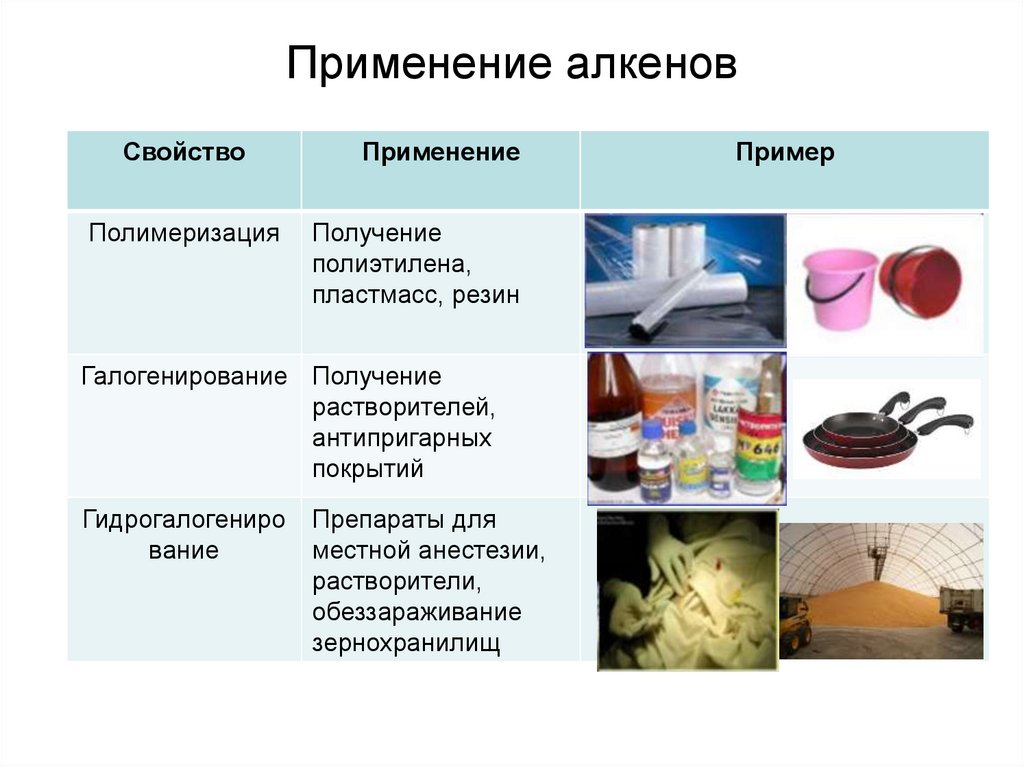
22.
Применение алкеновСвойство
Полимеризация
Применение
Получение
полиэтилена,
пластмасс, резин
Галогенирование Получение
растворителей,
антипригарных
покрытий
Гидрогалогениро
вание
Препараты для
местной анестезии,
растворители,
обеззараживание
зернохранилищ
Пример
23.
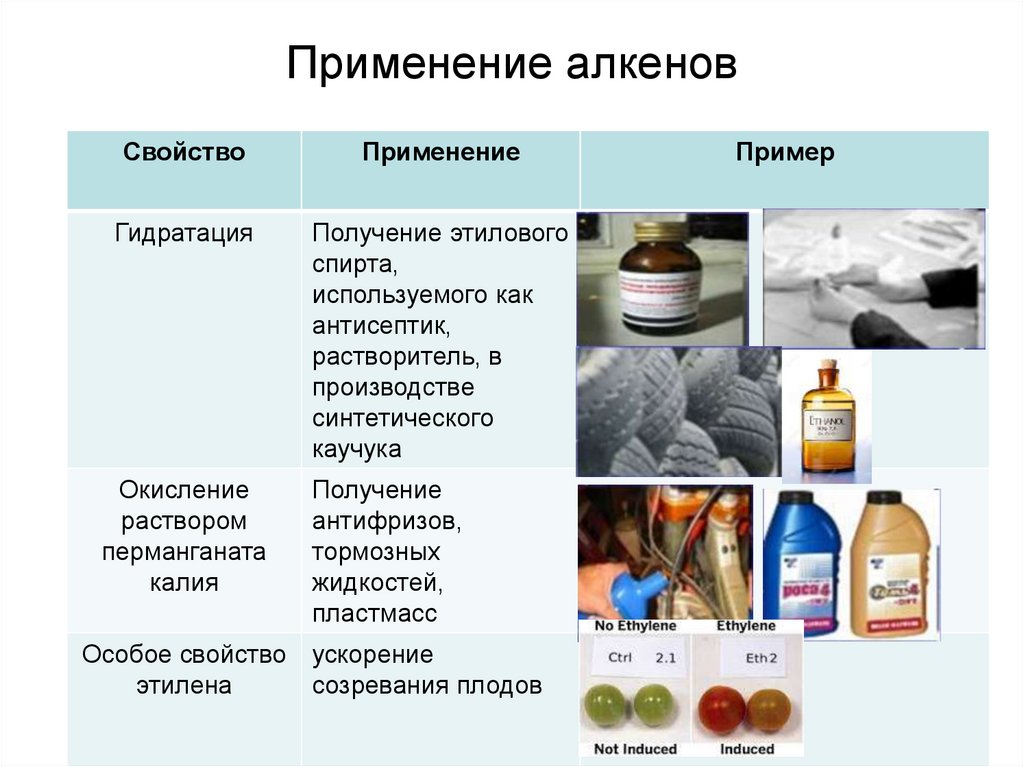
Применение алкеновСвойство
Применение
Гидратация
Получение этилового
спирта,
используемого как
антисептик,
растворитель, в
производстве
синтетического
каучука
Окисление
раствором
перманганата
калия
Получение
антифризов,
тормозных
жидкостей,
пластмасс
Особое свойство ускорение
этилена
созревания плодов
Пример
24.
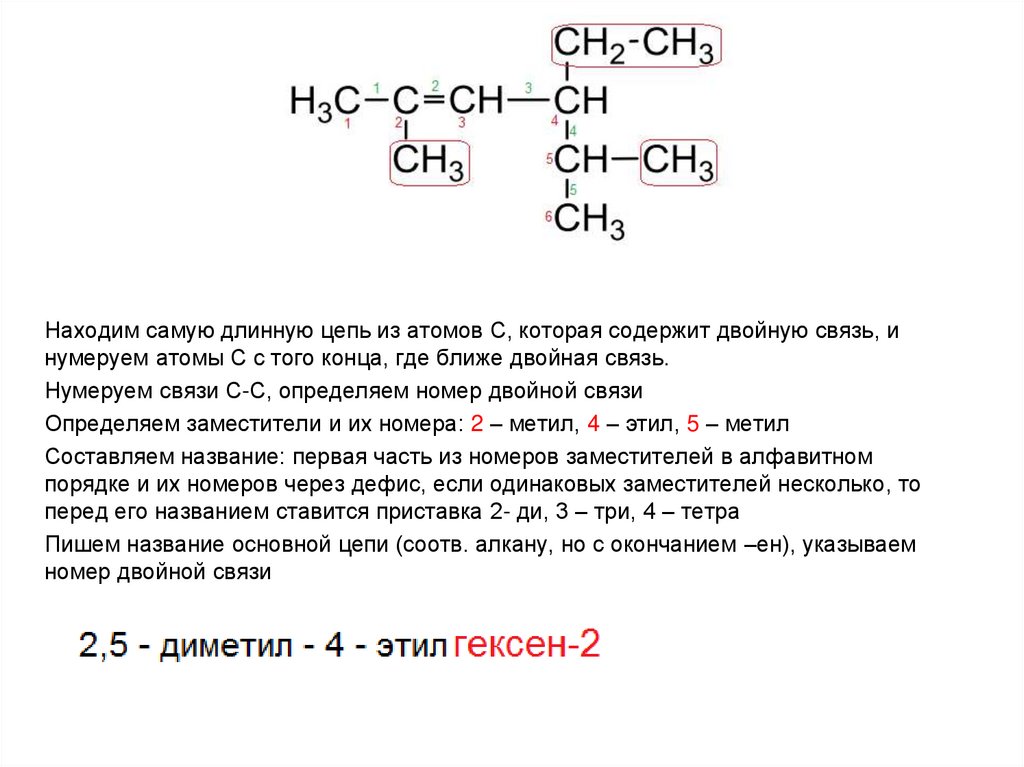
Находим самую длинную цепь из атомов С, которая содержит двойную связь, инумеруем атомы С с того конца, где ближе двойная связь.
Нумеруем связи С-С, определяем номер двойной связи
Определяем заместители и их номера: 2 – метил, 4 – этил, 5 – метил
Составляем название: первая часть из номеров заместителей в алфавитном
порядке и их номеров через дефис, если одинаковых заместителей несколько, то
перед его названием ставится приставка 2- ди, 3 – три, 4 – тетра
Пишем название основной цепи (соотв. алкану, но с окончанием –ен), указываем
номер двойной связи

 Химия
Химия








