Похожие презентации:
Соли. Определение солей
1. Соли.
Задачи:Рассмотреть
классификацию солей, их
химические свойства.
Учитель химии МОУ - СОШ № 13
г. Нерюнгри Республики Саха
(Якутия)
Вавилина Инна Анатольевна
2. Определение солей
Соли- это сложные вещества,
состоящие из ионов металлов и
кислотных остатков.
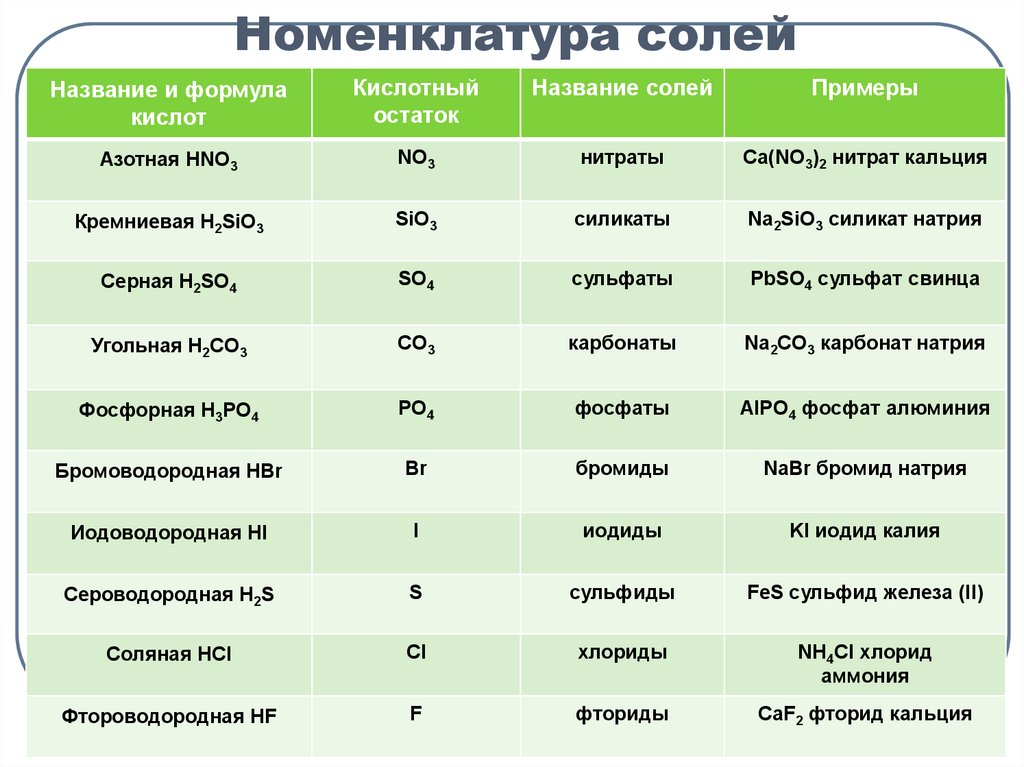
3. Номенклатура солей
Название и формулакислот
Кислотный
остаток
Название солей
Примеры
Азотная HNO3
NO3
нитраты
Ca(NO3)2 нитрат кальция
Кремниевая H2SiO3
SiO3
силикаты
Na2SiO3 силикат натрия
Серная H2SO4
SO4
сульфаты
PbSO4 сульфат свинца
Угольная H2CO3
CO3
карбонаты
Na2CO3 карбонат натрия
Фосфорная H3PO4
PO4
фосфаты
AlPO4 фосфат алюминия
Бромоводородная HBr
Br
бромиды
NaBr бромид натрия
Иодоводородная HI
I
иодиды
KI иодид калия
Сероводородная H2S
S
сульфиды
FeS сульфид железа (II)
Соляная HCl
Cl
хлориды
NH4Cl хлорид
аммония
Фтороводородная HF
F
фториды
CaF2 фторид кальция
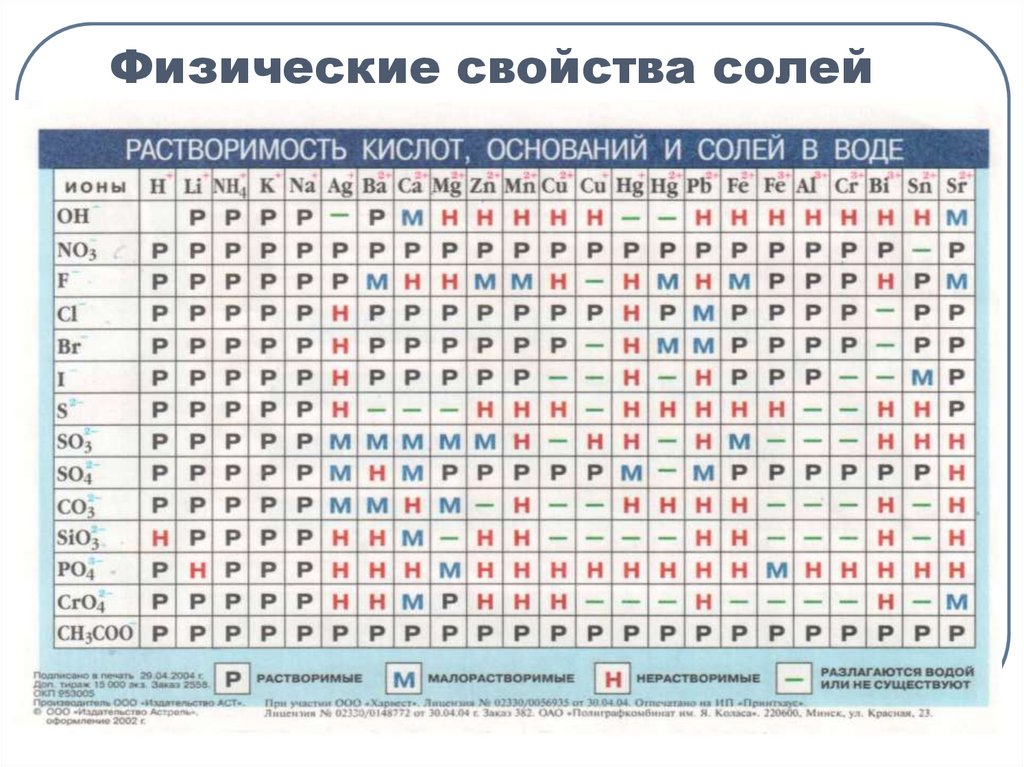
4. Физические свойства солей
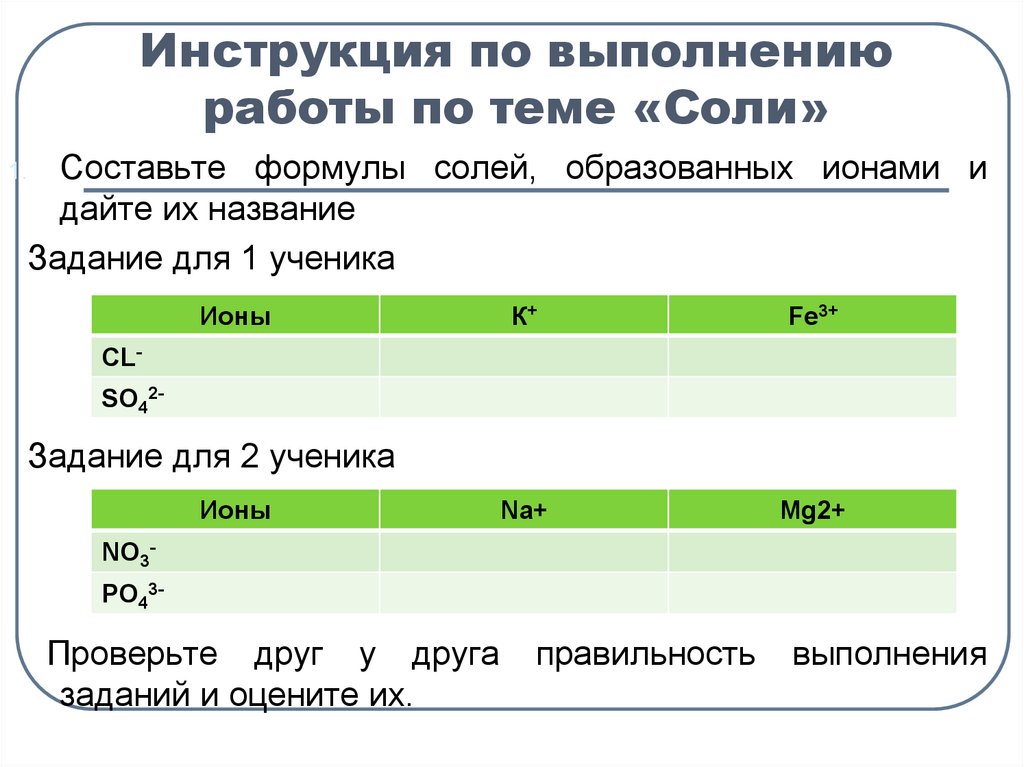
5. Инструкция по выполнению работы по теме «Соли»
Cоставьте формулы солей, образованных ионами идайте их название
Задание для 1 ученика
1.
Ионы
К+
Fe3+
Na+
Mg2+
CLSO42-
Задание для 2 ученика
Ионы
NO3PO43-
Проверьте друг у друга
заданий и оцените их.
правильность
выполнения
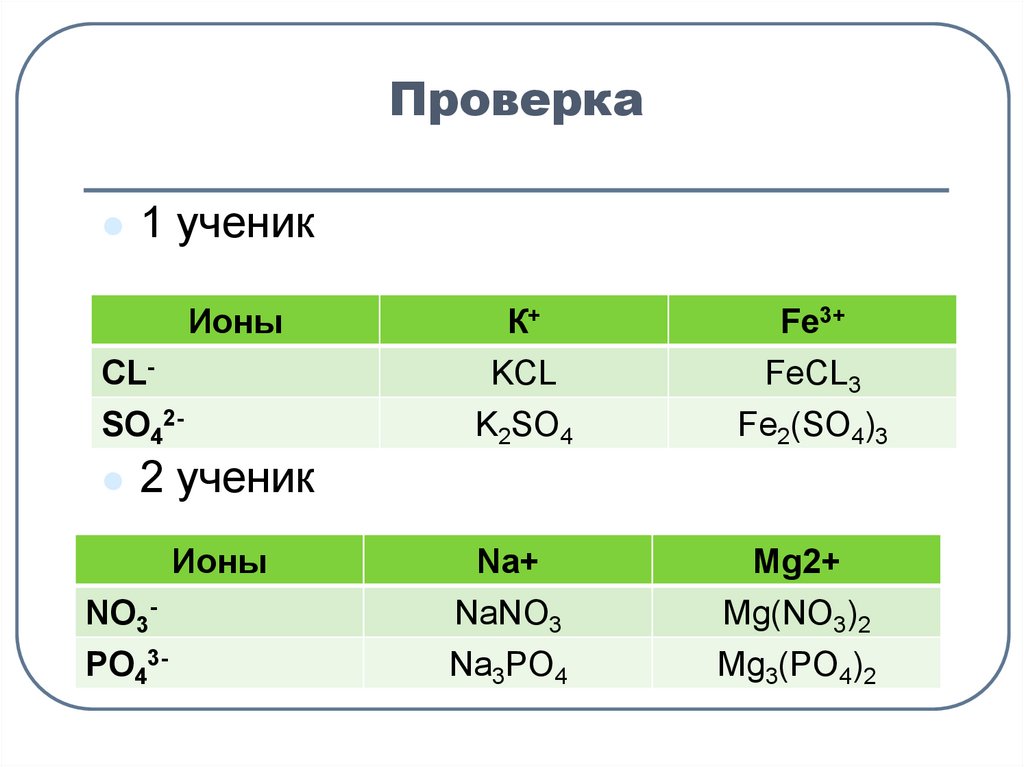
6. Проверка
1 ученикИоны
CLSO42
К+
Fe3+
KCL
K2SO4
FeCL3
Fe2(SO4)3
2 ученик
Ионы
NO3-
Na+
NaNO3
Mg2+
Mg(NO3)2
PO43-
Na3PO4
Mg3(PO4)2
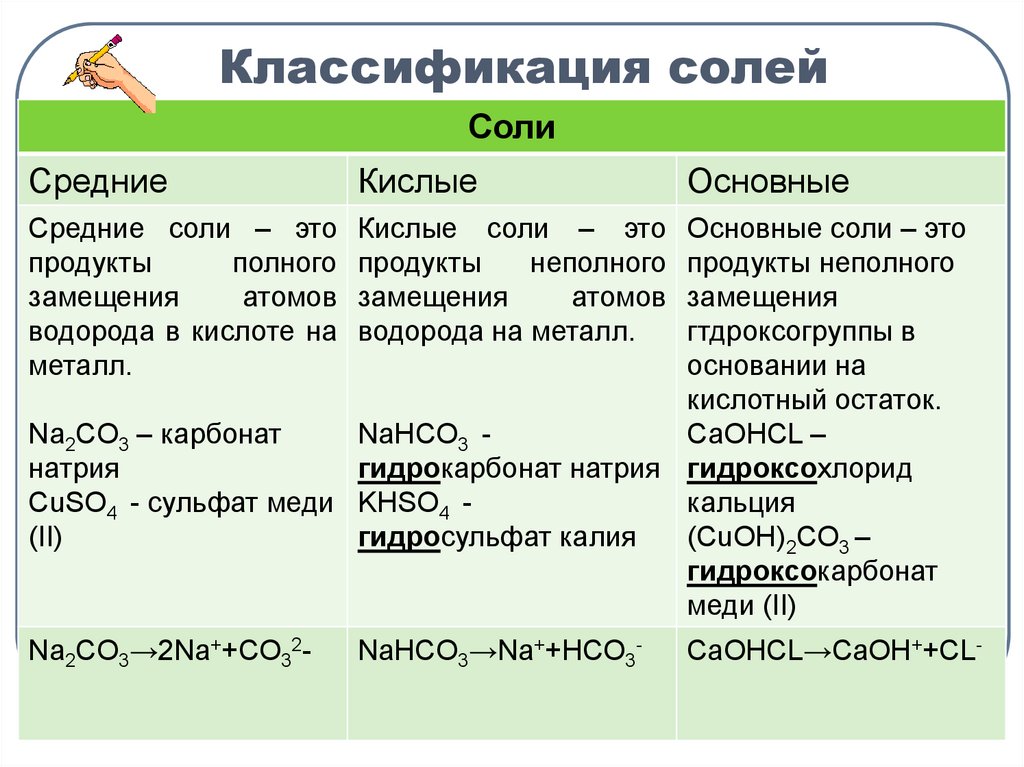
7. Классификация солей
СолиСредние
Кислые
Средние соли – это
продукты
полного
замещения
атомов
водорода в кислоте на
металл.
Кислые соли – это
продукты
неполного
замещения
атомов
водорода на металл.
Na2CO3→2Na++CO32-
NaHCO3→Na++HCO3-
Основные
Основные соли – это
продукты неполного
замещения
гтдроксогруппы в
основании на
кислотный остаток.
Na2CO3 – карбонат
NaHCO3 СаОНCL –
натрия
гидрокарбонат натрия гидроксохлорид
CuSO4 - сульфат меди KHSO4 кальция
(ΙΙ)
гидросульфат калия
(CuOH)2CO3 –
гидроксокарбонат
меди (ΙΙ)
CaOHCL→CaOH++CL-
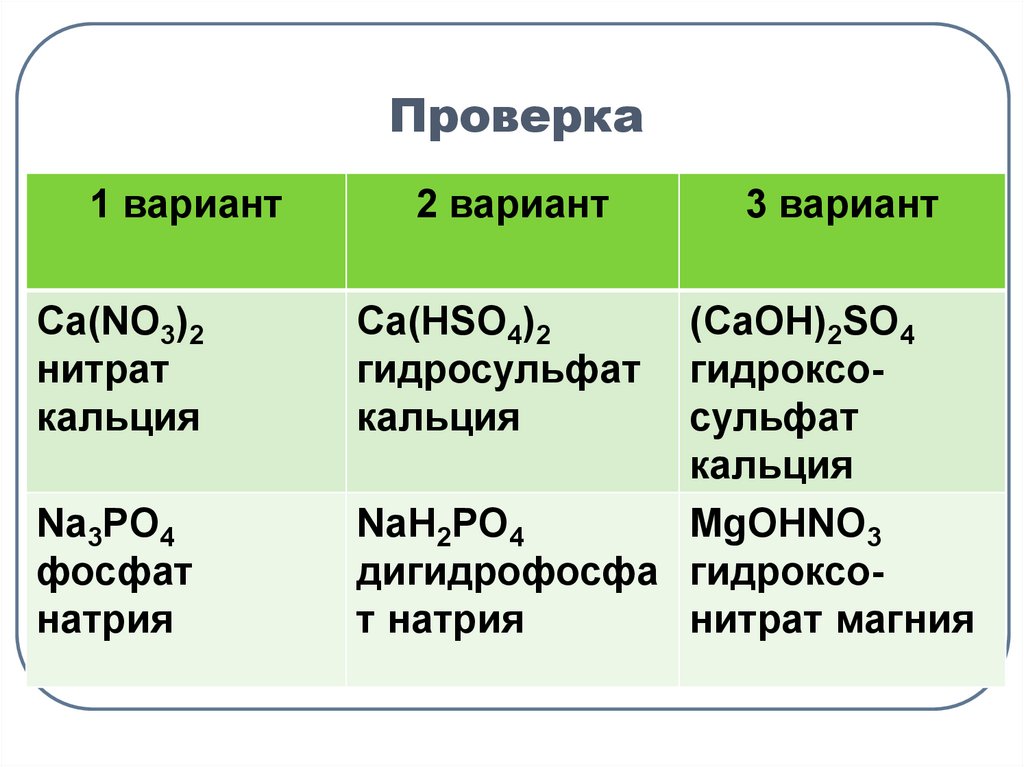
8. Классификация солей
Задание:Из перечня формул Сa(HSO4)2, (CaOH)2SO4,
Ca(NO3)2,
NaH2PO4,
Na3PO4,
MgOHNO3
выпишите отдельно
1 вариант - формулы средних солей,
2 вариант - формулы кислых солей,
3 вариант - формулы основных солей.
Дайте их название.
Проверьте друг у друга результаты работы.
9. Проверка
1 вариантCa(NO3)2
нитрат
кальция
Na3PO4
фосфат
натрия
2 вариант
Сa(HSO4)2
гидросульфат
кальция
3 вариант
(CaOH)2SO4
гидроксосульфат
кальция
NaH2PO4
MgOHNO3
дигидрофосфа гидроксот натрия
нитрат магния
10. Химические свойства солей
1. Соль + кислота → другая(реакция обмена)
2. Соль + щелочь → другая
основание (реакция обмена)
3. Соль1 + соль2 → соль3 +
обмена)
4. Соль + металл → другая соль
(реакция замещения)
соль + кислота
соль + другое
соль4 (реакция
+ другой металл
11. Химические свойства солей
K Ca Na Mg Al Zn Cr Fe Pb H2 Cu Hg Ag AuН.Н.Бекетов
1. Обе соли (и реагирующая и
образующая в результате реакции )
должны быть растворимыми;
2. Металлы
не
должны
взаимодействовать с водой, поэтому
металлы Ι и ΙΙ групп ПСХЭ
Д.И.Менделеева – щелочные и
щелочноземельные – не вытесняют
другие металлы из растворов их
солей
12. Химические свойства солей
1. HgCl2 + Cu → CuCl2 + HgHg2+ + 2Cl- + Cu0 → Cu2+ + 2Cl- + Hg0
Hg2+ + Cu0 → Cu2+ + Hg0
2. FeSO4 + Cu →
13. Инструкция по проведению химического исследования
Проделайтехимическую
реакцию
взаимодействия раствора нитрата серебра
AgNO3 с соляной кислотой HCL. Что
наблюдаете?
Составьте
уравнение
реакции в молекулярном и ионных видах.
2.
Проделайте
химическую
реакцию
взаимодействия раствора сульфата меди
(ΙΙ) СuSO4 с раствором гидроксида натрия
NaOH.
Что
наблюдаете?
Составьте
уравнение реакции в молекулярном и
ионных видах.
1.
14. Инструкция по проведению химического исследования
Проделайтехимическую
реакцию
взаимодействия раствора сульфата натрия
Na2SO4 с раствором хлорида бария ВаСL2.
Составьте уравнение реакции в молекулярном
и ионных видах.
4.
Проделайте
химическую
реакцию
взаимодействия сульфата меди (ΙΙ) CuSO4 с
железом Fe. Составьте уравнение реакции в
молекулярном и ионных видах.
5. Проверьте правильность уравнений реакций.
3.
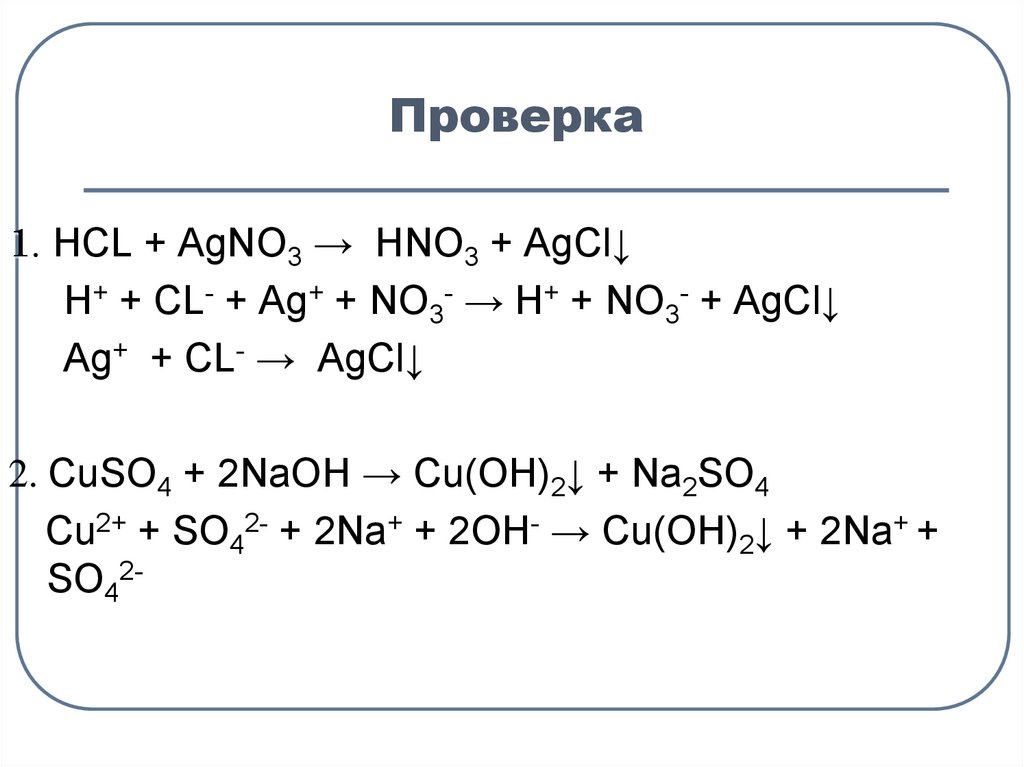
15. Проверка
1. HCL + AgNO3 → HNO3 + AgCl↓Н+ + СL- + Ag+ + NO3- → H+ + NO3- + AgCl↓
Ag+ + СL- → AgCl↓
2. СuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
Сu2+ + SO42- + 2Na+ + 2OH- → Cu(OH)2↓ + 2Na+ +
SO42-
16. Проверка
3. Na2SO4 + BaCl2 → BaSO4↓+ 2NaCl2Na+ +SO42- + Ba2+ + 2CL-→ BaSO4↓ + 2Na+ + 2CLSO42- + Ba2+ → BaSO4↓
4. Fе + CuSO4 → FеSO4 +Cu
Fe0 + Cu2+ SO42- → Fe2+ + SO42- + Cu0
Fe0 + Cu2+ → Fe2+ + Cu0
17. Соли
КислотыЩелочи
Соли
Металлы
Контрольны
е вопросы
18. Домашнее задание.
§41, упр. 2,4.












 Химия
Химия








