Похожие презентации:
Электрохимические методы анализа. Лекция 3
1. Аналитическая химия II. Физические и физико-химические методы анализа
Аналитическая химия II.Физические и физикохимические методы анализа
Лекция 3. Электрохимические методы анализа
лекция3
Аналитическая химия 2. ФХМА
1
2.
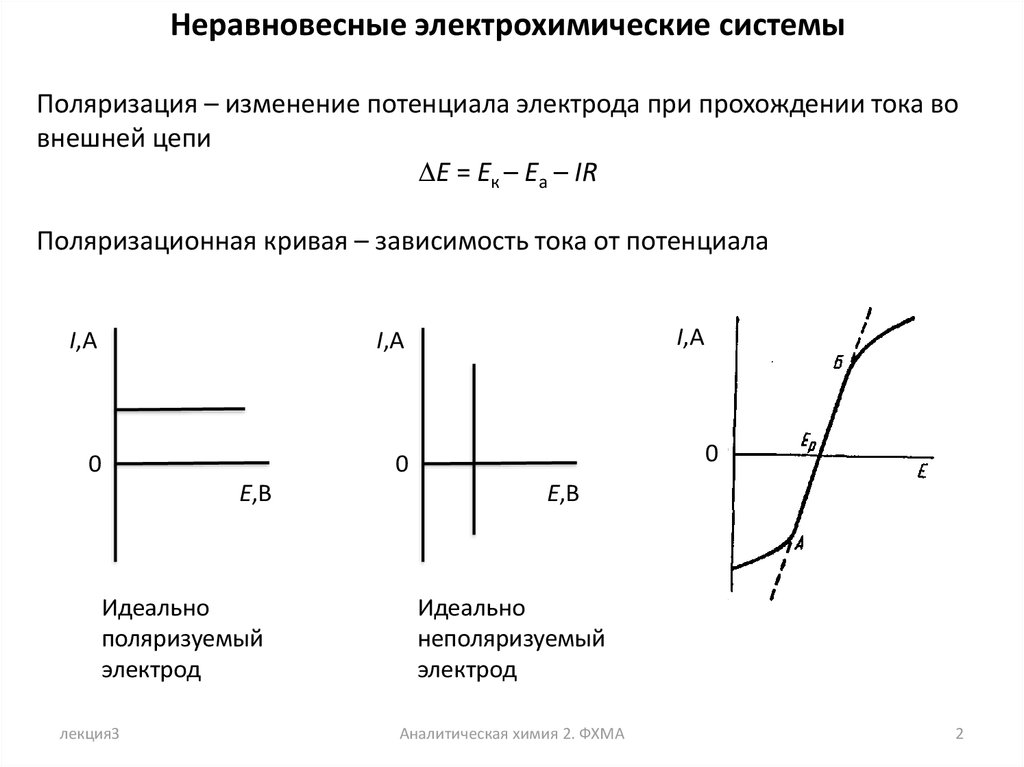
Неравновесные электрохимические системыПоляризация – изменение потенциала электрода при прохождении тока во
внешней цепи
DE = Eк – Еа – IR
Поляризационная кривая – зависимость тока от потенциала
I,A
I,A
0
0
Е,В
Идеально
поляризуемый
электрод
лекция3
I,A
0
Е,В
Идеально
неполяризуемый
электрод
Аналитическая химия 2. ФХМА
2
3.
Ox + neRed
Кинетическая поляризация (перенапряжение) - поляризация, вызванная
замедленной стадией процесса разряда – ионизации. Характеризуется
величиной дополнительной энергии , которую необходимо сообщить
электроду в случае, когда скорость переноса электронов мала.
ht =E-EI=0
Концентрационная поляризация - поляризация, вызванная обеднением
приэлектродного слоя электроактивным веществом, расходующимся в
электрохимической реакции, из-за медленной его диффузии из глубины
раствора.
лекция3
Аналитическая химия 2. ФХМА
3
4.
ВольтамперометрияВольтамперометрия включает электрохимические методы анализа в которых
потенциал рабочего электрода создается внешним источником и является
известной функцией времени, а получаемые зависимости ток-потенциал и
ток – время служат источником качественной и количественной информации
о составе раствора.
Электрохимическая ячейка для проведения вольтамперометрических измерений
лекция3
Аналитическая химия 2. ФХМА
4
5.
Рабочие (индикаторные) электродыРабочий электрод в вольтамерометрических методах должен быть близким к
идеально поляризуемому электроду, т.е. характеризоваться большим
сдвигом потенциала при протекании даже небольших токов.
Ртутный капающий электрод
-постоянное
обновление
поверхности
электрода
предотвращает загрязнение поверхности электрода;
-ртутный электрод является почти
идеально
поляризуемым в широком интервале потенциалов:
от +0,4 ̶ 0,06 (окисление ртути в кислой или щелочной
среде) до -2 ̶ -2.7 (восстановление катиона фонового
электролита)
Капля
ртути
S = 0,85m2/3t2/3
Статический ртутный капельный электрод
-электрод с заданной площадью
лекция3
Аналитическая химия 2. ФХМА
5
6.
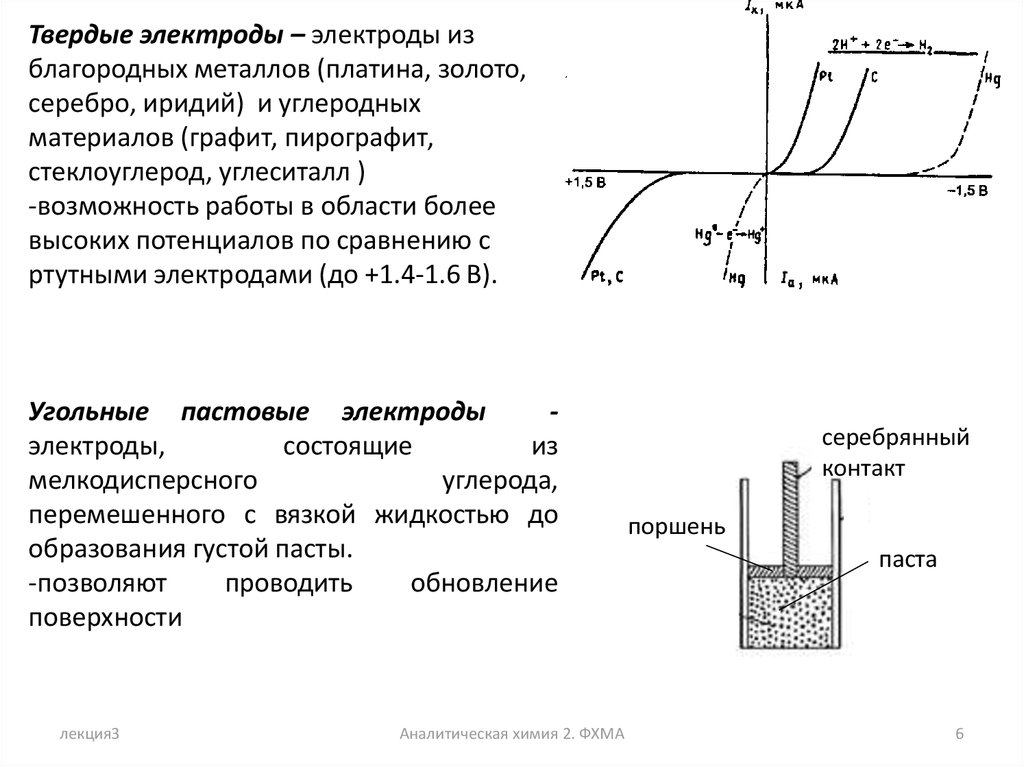
Твердые электроды – электроды изблагородных металлов (платина, золото,
серебро, иридий) и углеродных
материалов (графит, пирографит,
стеклоуглерод, углеситалл )
-возможность работы в области более
высоких потенциалов по сравнению с
ртутными электродами (до +1.4-1.6 В).
Угольные пастовые электроды
электроды,
состоящие
из
мелкодисперсного
углерода,
перемешенного с вязкой жидкостью до
образования густой пасты.
-позволяют
проводить
обновление
поверхности
лекция3
Аналитическая химия 2. ФХМА
серебрянный
контакт
поршень
паста
6
7.
Пленочные электроды – амальгамные электроды (проволока или диск изсеребра, золота или платины в металлической ртути), золотые пленочные
электроды и т.д.
Ртутно-графитовые электроды – элетролитически осажденная ртуть на
поверхности графита или стеклоуглерода
Вращающийся дисковый электрод - особая форма
твердого электрода. Рабочей частью
дискового электрода служит диск из проводящего
материала, запрессованный (или впаянный) в изолирующую
оболочку. электрод приводится во вращение вокруг своей
оси при помощи электромотора.
Ультрамикроэлектроды – электроды, сечение которых хотя бы в одном
измерении имеет размер менее 10 мкм.
Одноразовые электроды – электроды, напечатанные на полимерной
пленке чернилами, содержащими мелкодисперсный углерод.
лекция3
Аналитическая химия 2. ФХМА
7
8.
Полярография – вольтамперометрия с линейнойразверткой потенциала на ртутном капающем
электроде
Потенциал, E
Полярография
E0
E=E0+vt
v - скорость развертки
потенциала
Время, t
Ток,
контролируемый
переносом
Остаточный
ток (участок
A-Б)заряда
= Iф+Ic
Предельный
диффузионный
ток
(участок
ток, возникающий
(участокВ-Г)
Б-В)– –максимальный
ток, возникающий
за счет
-фарадеевский
ток,
возникающий
за счет
при
установлении
динамического равновесия
при
протекания
электрохимической
реакции
на
окисление
или деполяризатора,
восстановление
примесей
котором
все ионы
достигшие
электроде.
поверхности
электрода, немедленно
из раствора;
восстанавливаются. Определяется только
диффузией
поляризатора из объема
раствора в
-ток заряжения(емкостный
тока),
приэлектродный слой.
возникающего за счет заряжения или
0-cs); I
0 s
Vразряда
двойного
электрического
диф = k’(c
диф = k(c -c ) слоя:
Ic=kCim2/3t-1/3(E-E
M)2/3 1/6
Iдиф = 607nD1/2m
t c (у-е Ильковича),
Полярограмма обратимого процесса восстановления
лекция3
n – число электронов, m- скорость вытекания ртути
, D – коэффициент диффузии , t – период капания
Аналитическая химия 2. ФХМА
8
9.
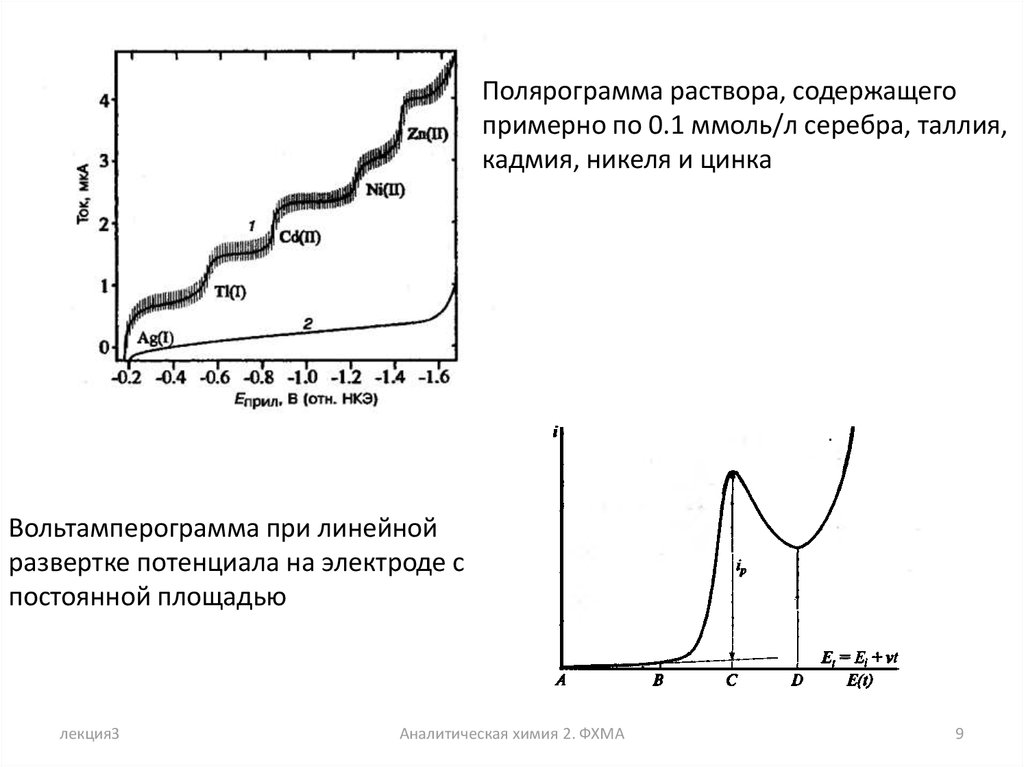
Полярограмма раствора, содержащегопримерно по 0.1 ммоль/л серебра, таллия,
кадмия, никеля и цинка
Вольтамперограмма при линейной
развертке потенциала на электроде с
постоянной площадью
лекция3
Аналитическая химия 2. ФХМА
9
10.
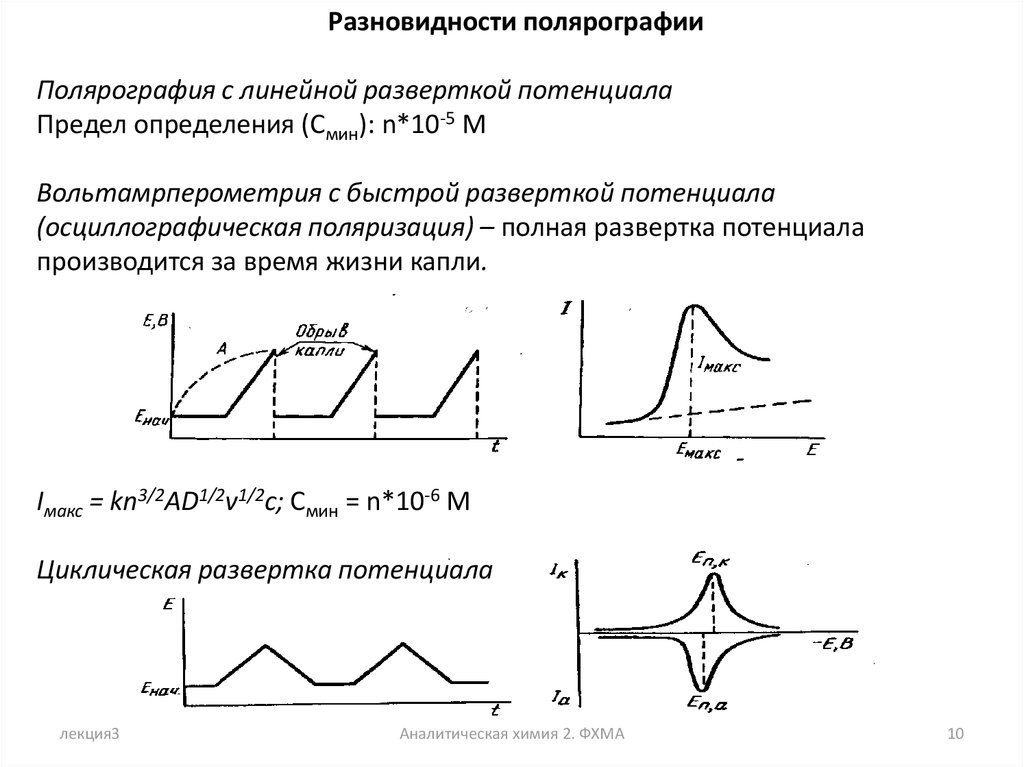
Разновидности полярографииПолярография с линейной разверткой потенциала
Предел определения (Смин): n*10-5 M
Вольтамрперометрия с быстрой разверткой потенциала
(осциллографическая поляризация) – полная развертка потенциала
производится за время жизни капли.
Iмакс = kn3/2AD1/2v1/2c; Смин = n*10-6 M
Циклическая развертка потенциала
лекция3
Аналитическая химия 2. ФХМА
10
11.
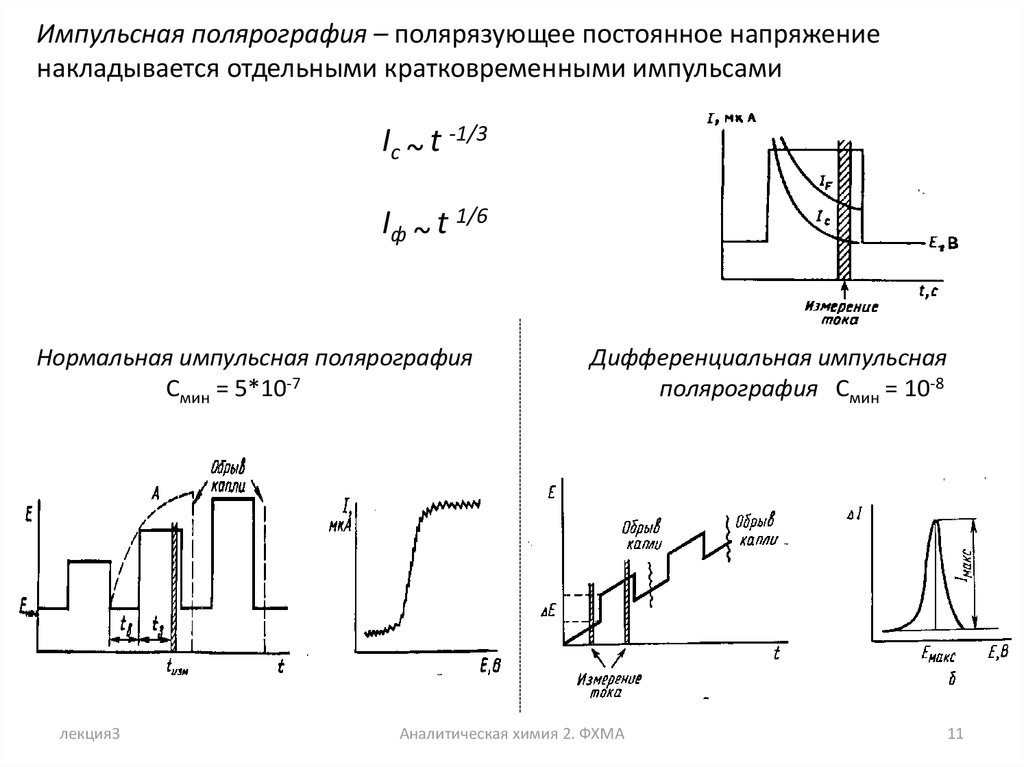
Импульсная полярография – полярязующее постоянное напряжениенакладывается отдельными кратковременными импульсами
Ic ~ t -1/3
Iф ~ t 1/6
Нормальная импульсная полярография
Смин = 5*10-7
лекция3
Дифференциальная импульсная
полярография Смин = 10-8
Аналитическая химия 2. ФХМА
11
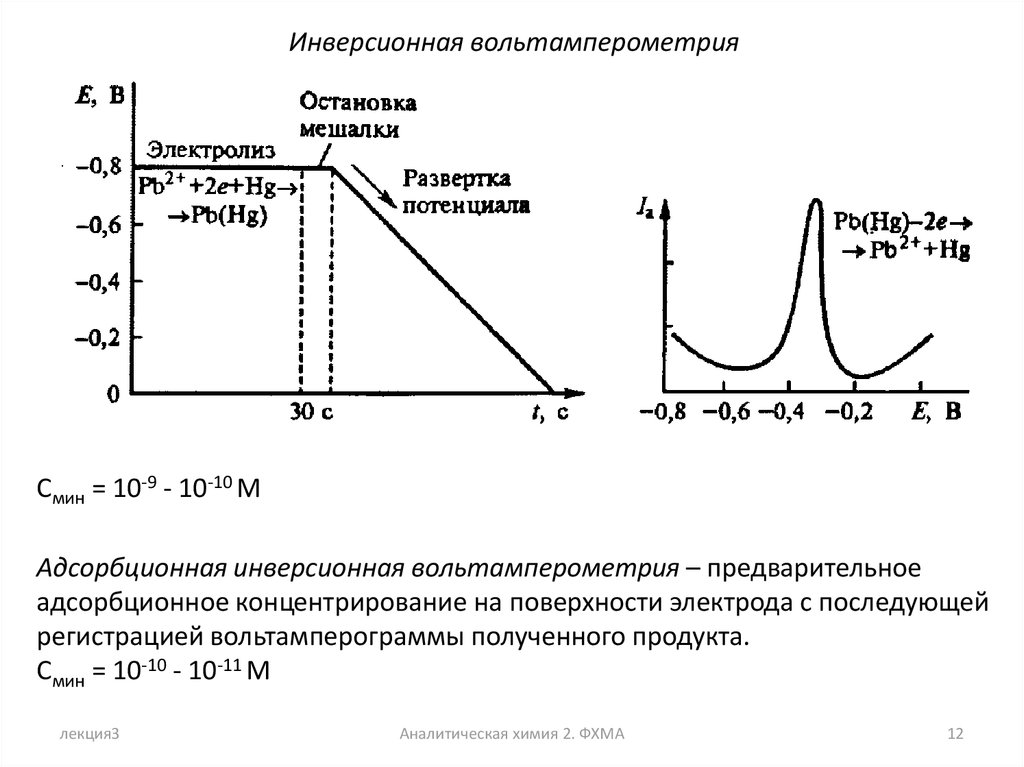
12.
Инверсионная вольтамперометрияСмин = 10-9 - 10-10 M
Адсорбционная инверсионная вольтамперометрия – предварительное
адсорбционное концентрирование на поверхности электрода с последующей
регистрацией вольтамперограммы полученного продукта.
Смин = 10-10 - 10-11 M
лекция3
Аналитическая химия 2. ФХМА
12
13.
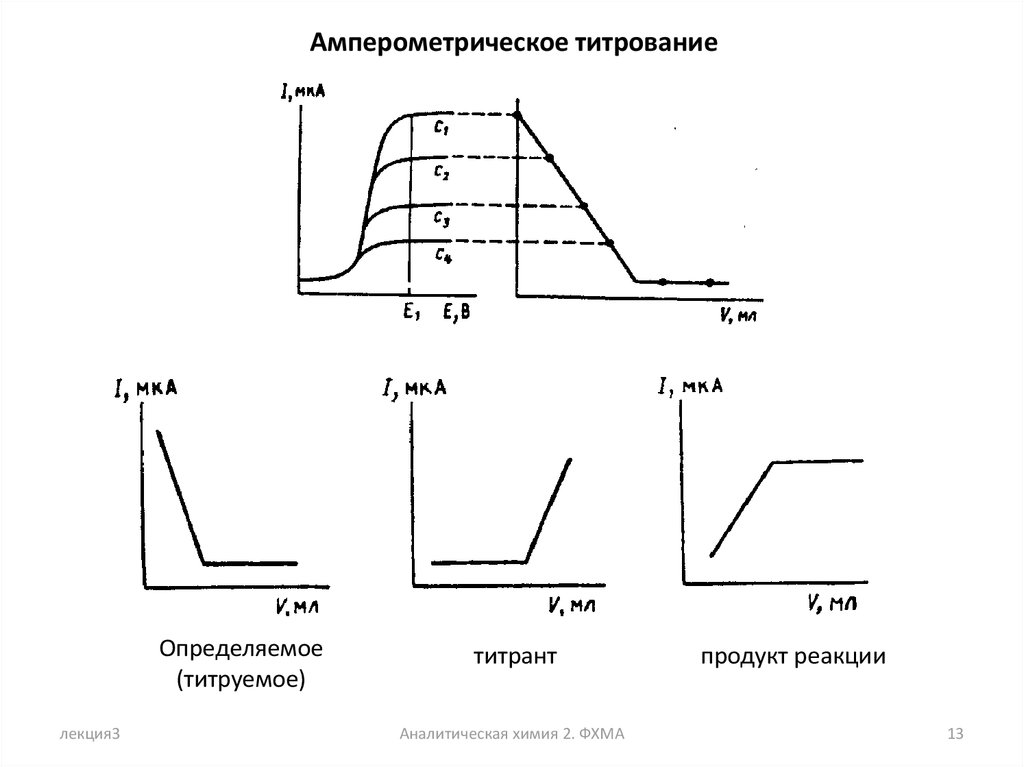
Амперометрическое титрованиеОпределяемое
(титруемое)
лекция3
титрант
Аналитическая химия 2. ФХМА
продукт реакции
13
14.
Преимущества вольтамперометрии-Возможность качественного и количественного определения неорганических
и органических соединений
-Одновременный многоэлементный(многокомпонентный) анализ
-Низкие пределы определения (до 10-11 M в варианте инверсионной
вольтамперолметрии)
-Большой динамический концентрационный диапазон определения (10-11 –
10-2M)
-Возможность миниатюризации сенсоров
-Широкий круг анализируемых объектов – химические, биологические,
геологические и т.д.
Ограничения вольтамперометрии
-Определяемое вещество должно быть электроактивно
-При использовании статических электродов возможно загрязнение их
поверхности, что приведет к невоспроизводимым результатам анализа; при
использовании капающего электрода необходимо использовать токсичную
ртуть.
лекция3
Аналитическая химия 2. ФХМА
14
15.
КулонометрияЗаконы Фарадея
1.
Количество электропревращенного (восстановленного или окисленного)
в процессе электролиза вещества прямо пропорционально количеству
прошедшего электричества
2.
Массы различных веществ, выделенных или растворенных при
прохождении одного и того же количества электричества,
пропорциональны их электрохимическим эквивалентам.
Электрохимический эквивалент – это масса вещества, выделившегося на
электроде (или растворившегося с электрода ) в процессе электролиза при
протекании единицы количества электричества.
,
Q – количество электричества, Кл; m – масса выделившегося на электроде
вещества, г.; M – молярная масса определяемого вещества, г/моль; n –
число электронов, участвующих в электродной реакции.
F =лекция3
96484 Кл/моль
Аналитическая химия 2. ФХМА
15
16.
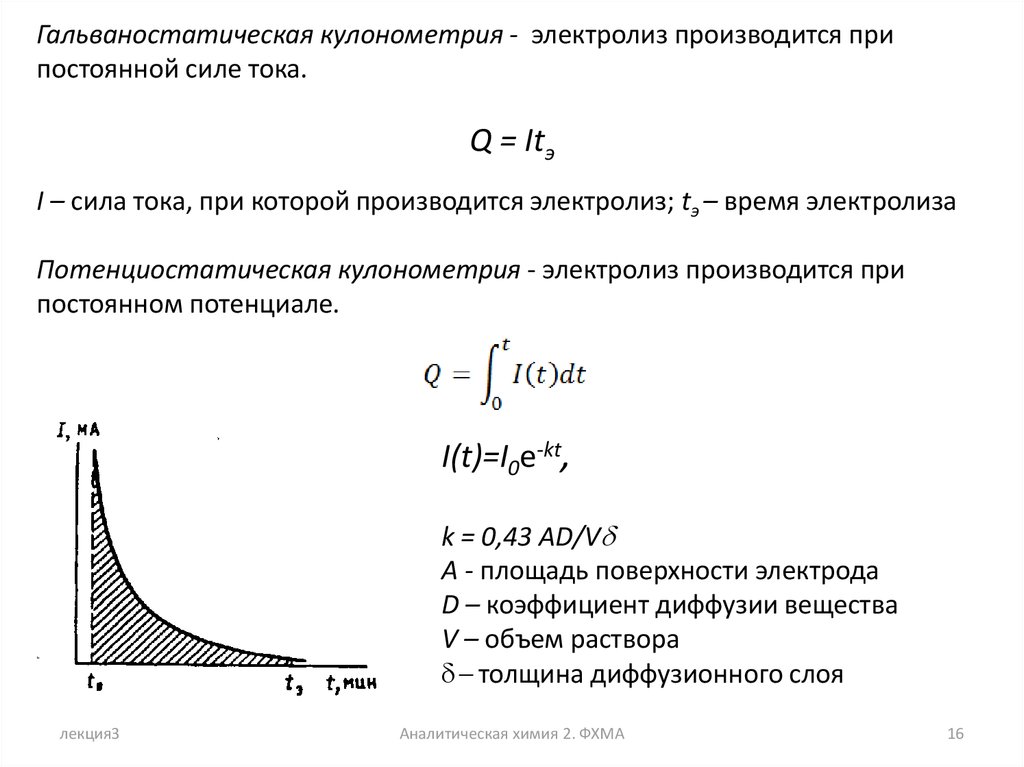
Гальваностатическая кулонометрия - электролиз производится припостоянной силе тока.
Q = Itэ
I – сила тока, при которой производится электролиз; tэ – время электролиза
Потенциостатическая кулонометрия - электролиз производится при
постоянном потенциале.
I(t)=I0e-kt,
k = 0,43 AD/Vd
A - площадь поверхности электрода
D – коэффициент диффузии вещества
V – объем раствора
d- толщина диффузионного слоя
лекция3
Аналитическая химия 2. ФХМА
16
17.
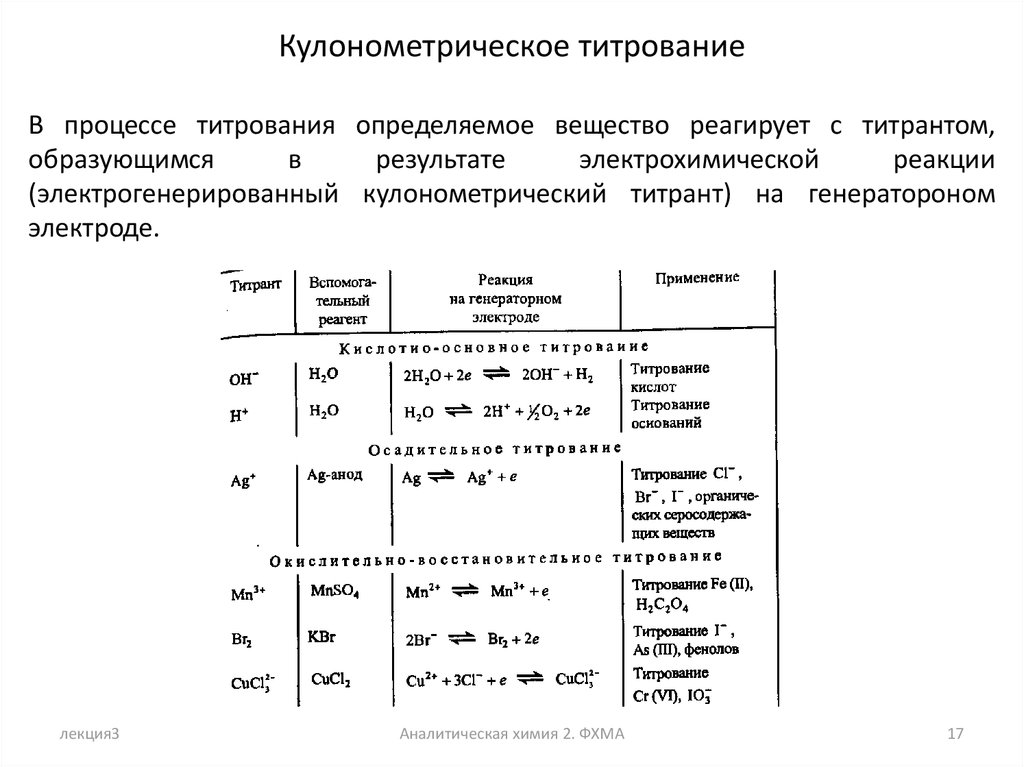
Кулонометрическое титрованиеВ процессе титрования определяемое вещество реагирует с титрантом,
образующимся
в
результате
электрохимической
реакции
(электрогенерированный кулонометрический титрант) на генератороном
электроде.
лекция3
Аналитическая химия 2. ФХМА
17
18.
КондуктометрияКондуктометрия основана на измерении удельной электропроводности
анализируемого раствора.
Сопротивление раствора
, где r - удельное сопротивление (Ом·см),
d – расстояние между электродами (см), A – площадь электрода (см2 )
Удельная электропроводность c = 1/r
c= 10-3A/dSlici , li - эквивалентная электропроводность i-го иона (Ом-1·см2/г·экв)
лекция3
Аналитическая химия 2. ФХМА
18
19.
Кондуктометрическое титрованиеH++Cl-+(Na++OH-)-> Na++Cl-+(H2O)
лекция3
Аналитическая химия 2. ФХМА
19










 Химия
Химия








