Похожие презентации:
Электрохимические методы анализа, часть 2. Кулонометрия. Вольтамперометрия
1. Электрохимические методы анализа, часть 2 Кулонометрия. Вольтамперометрия
2.
4. Кулонометрия• Кулонометрия
(кулонометрический
метод) - электрохимический метод
анализа, который основан на измерении
количества
электричества
(кулонов),
затраченного на электроокисление или
восстановление анализируемого вещества
при электролизе его раствора.
3.
• Связь между количеством затраченного электричества имассой
определяемого
вещества
определяется
объединенной формулой законов Фарадея:
m = M ∙Q / F ∙ n
М – молярная масса анализируемого компонента
(вещества или иона);
Q - количество электричества, затраченное на
электрохимическое окисление или восстановление
анализируемого компонента, Кл;
F - число Фарадея, равное 96 500 Кл/моль;
п - количество электронов, участвующих в
электрохимическом процессе.
Количество электричества рассчитывается по
формуле: Q = I t
где I - сила тока, А; t - продолжительность
электролиза, с.
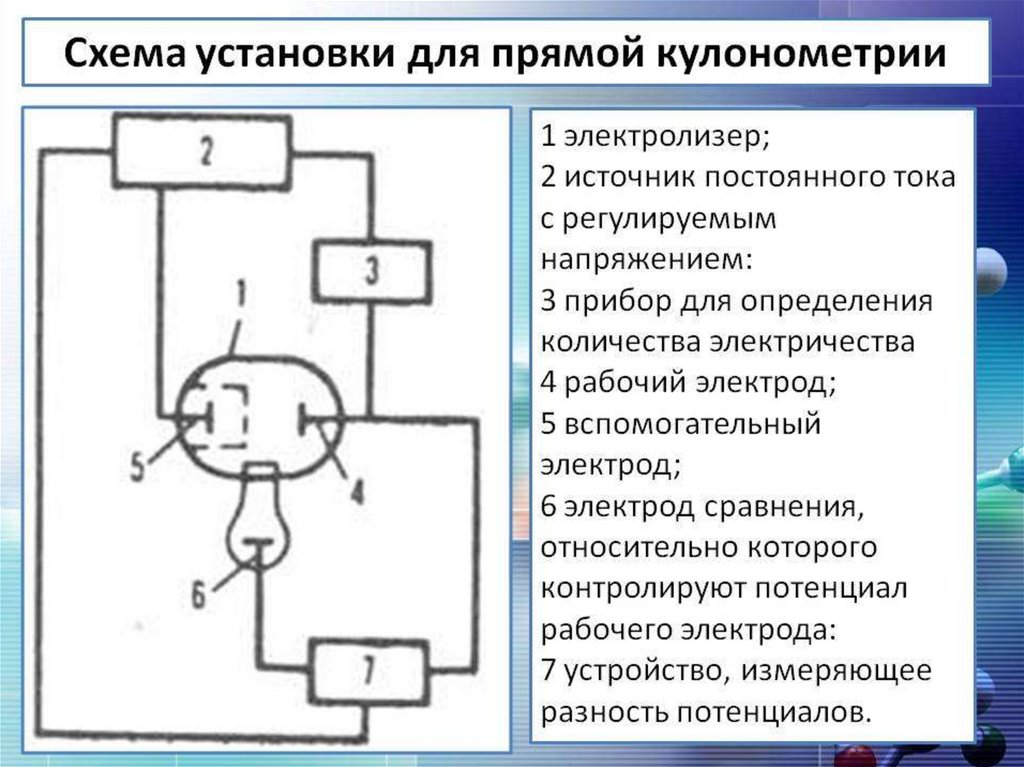
4.
В кулонометрии различают два вида анализа:1) прямую кулонометрию;
2) кулонометрическое титрование.
5.
Прямая кулонометрияМетод прямой кулонометрии основан на
непосредственном окислении или восстановлении
анализируемого вещества на рабочем электроде,
исключающем
прохождение
побочных
электрохимических реакций.
Метод
пригоден
только
для
определения
электроактивных веществ, т. е. веществ, способных
окисляться или восстанавливаться на электроде.
Количество электричества, затраченное на анализ,
измеряют с помощью специальных устройств кулонометров.
6.
Два режима кулонометрииПрямая кулонометрия может быть выполнена в
одном из следующих режимов:
при постоянном потенциале рабочего
электрода в течение всего времени электролиза такой режим называют потенциостатическим;
- при постоянной силе тока в течение всего
времени
электролиза
режим
называют амперостатическим.
7.
В методе прямой кулонометрии впотенциостатическом режиме сила тока в
течение всего времени электролиза непрерывно
уменьшается,
так
как
происходит
уменьшение
концентрации анализируемого
вещества.
Электролиз
заканчивают
при
уменьшении силы тока практически до нуля.
8.
Привыполнении
кулонометрического
анализа в амперометрическом режиме сила
тока на протяжении всего времени электролиза
поддерживается постоянной.
Количество электричества в этом случае легко
рассчитывается по уравнению:
Q=It
9.
Применение. Методом прямой кулонометрииопределяют ионы меди, свинца, висмута, мышьяка,
урана и других металлов, а также для анализа
органических соединений, в том числе и лекарственных
препаратов
(аскорбиновой
кислоты,
новокаина,
пикриновой кислоты, оксихинолина и пр.).
Метод прямой кулонометрии очень чувствителен.
Им можно определить до 10-9 г вещества в пробе.
Ошибка определений не превышает 0,5 %.
10.
11.
Кулонометрическое титрованиеКулонометрическое титрование основано на
электрохимическом
получении
титранта
(электрогенерировании титранта) с последующей
реакцией его с анализируемым веществом.
Если
титрант
электрогенерируется
непосредственно в растворе анализируемого вещества,
то такое титрование называется кулонометрическим
титрованием с внутренней генерацией.
Если титрант получают электрогенерированием в
отдельном сосуде, а затем подают его в анализируемый
раствор,
такое
титрование
называют
кулонометрическим
титрованием
с
внешней
генерацией.
12.
13.
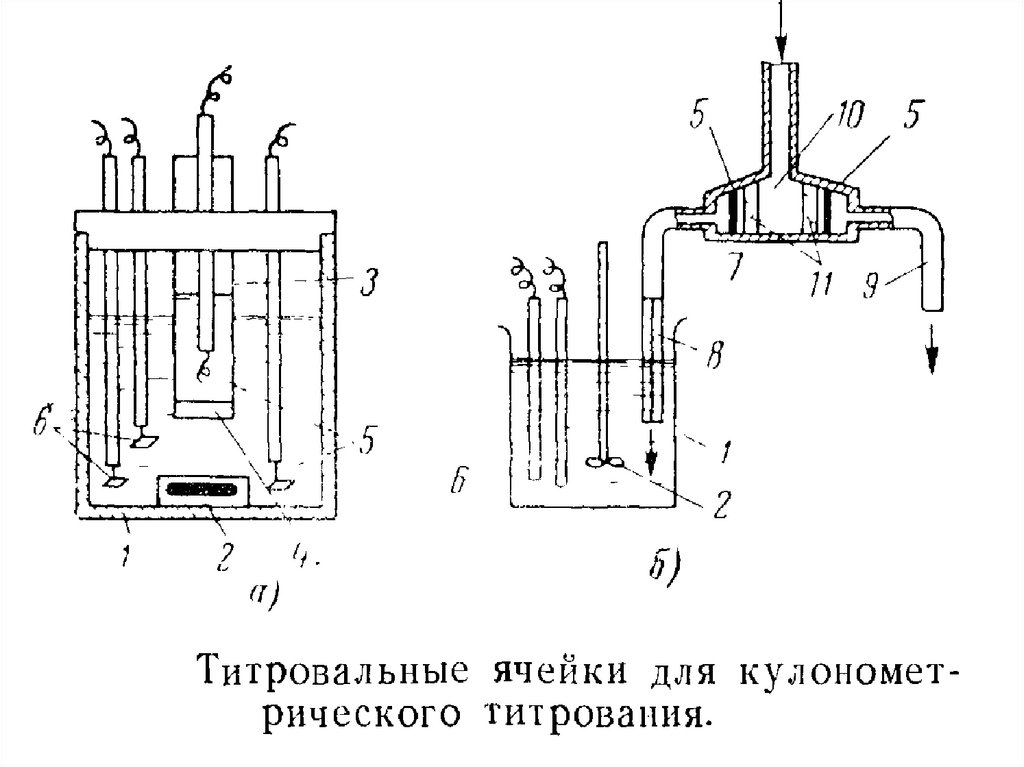
Схема кулонометрической титровальной установки. Типичнаяячейка для кулонометрического титрования с внутренней генерацией
титранта (рис. а). В титровальной ячейке находятся магнитная
мешалка 2, трубка 3 с пористой перегородкой 4, генераторные
электроды 5, а также индикаторные электроды 6.
Титровальная ячейка для кулонометрического титрования с внешней
генерацией титранта (рис. б) отличается тем, что она комплектуется
специальным электролизером, где генерируется титрант. В титровальную
ячейку тигрант поступает из электролизера 7, где он генерируется при
пропускании тока через электроды 5. Электроды разделены от входной
камеры 10, куда поступает генерируемый реагент, пористыми
перегородками. Титрант в титровальную ячейку направляется через
капиллярную трубку 8, а второй компонент, получающийся при
электролизе, через трубку 9 сбрасывается в слив. Титровальная ячейка
оснащена мешалкой 2 и электродами 6 для индикации конечной точки
титрования.
14.
Кулонометрическое титрование всегда проводят вамперостатическом режиме. Затраченное количество
электричества
на
генерацию
титранта
будет
эквивалентно содержанию анализируемого вещества в
анализируемой пробе.
Титрант можно получить из растворителя,
например, воды на катоде:
Н2О + е-
½Н2 + ОН-
е
или на аноде:
Н2О - 2 е½О2 + 2Н+.
Электрогенерированные ионы ОН- и Н+ можно использовать
для титрования кислот или оснований.
15.
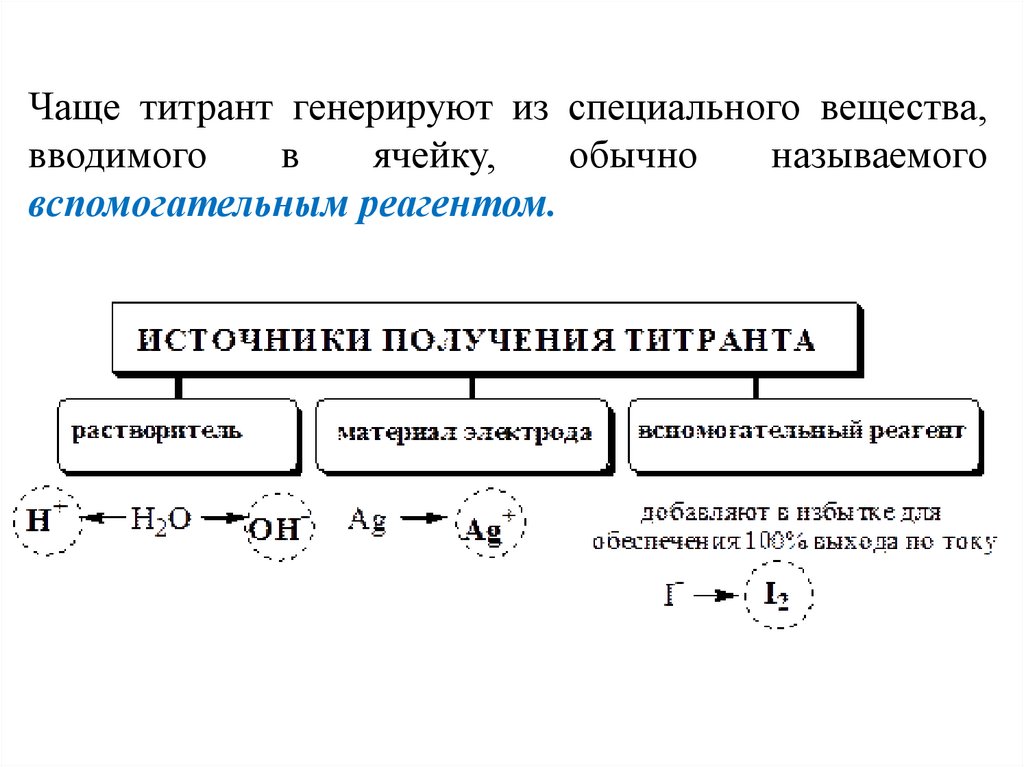
Чаще титрант генерируют из специального вещества,вводимого
в
ячейку,
обычно
называемого
вспомогательным реагентом.
16.
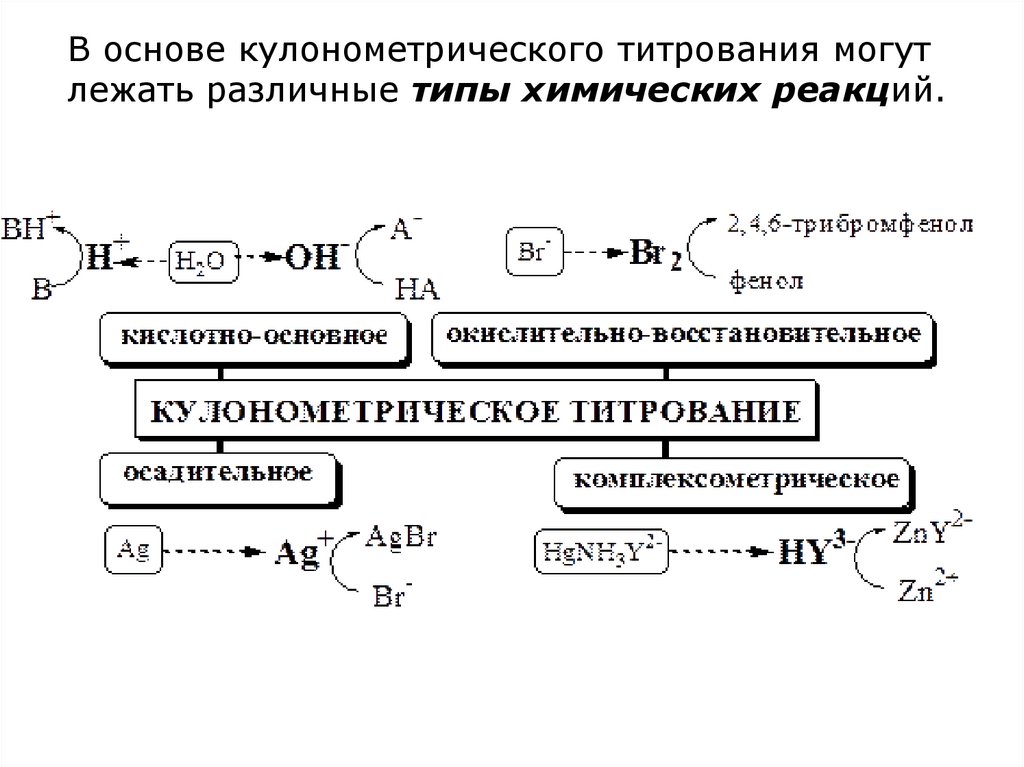
В основе кулонометрического титрования могутлежать различные типы химических реакций.
17.
Титратор МКС-500 для кулонометрического титрования сгенерируемым титрантом
18.
Преимуществакулонометрического
титрования перед другими титриметрическими
методами анализа:
· титрант не нужно готовить, стандартизировать
и хранить;
· можно получать титранты (например, Fe2+ или
Cl2),
которые
сложно
или
невозможно
приготовить обычным способом;
· титрант легче «дозируется» (отрегулировать
силу тока значительно легче, чем добавить точный
объём титранта);
·
раствор
в
процессе
титрования
не
разбавляется;
· одну и ту же ячейку можно использовать для
любого вида титрования;
·
процесс
анализа
можно
легко
автоматизировать.
19.
5. ВольтамперометрияВольтамперометрические методы – это группа
электрохимических
методов,
основанных
на
изучении зависимостей силы тока от внешнего
наложенного
напряжения
(I
=
f(E))
в
электрохимической ячейке с поляризуемым
микроэлектродом (индикаторный электрод) и
неполяризуемым электродом с большой
поверхностью (электрод сравнения).
Поляризацией называют смещение потенциала
электрода от равновесного значения под действием
прилагаемого напряжения.
20.
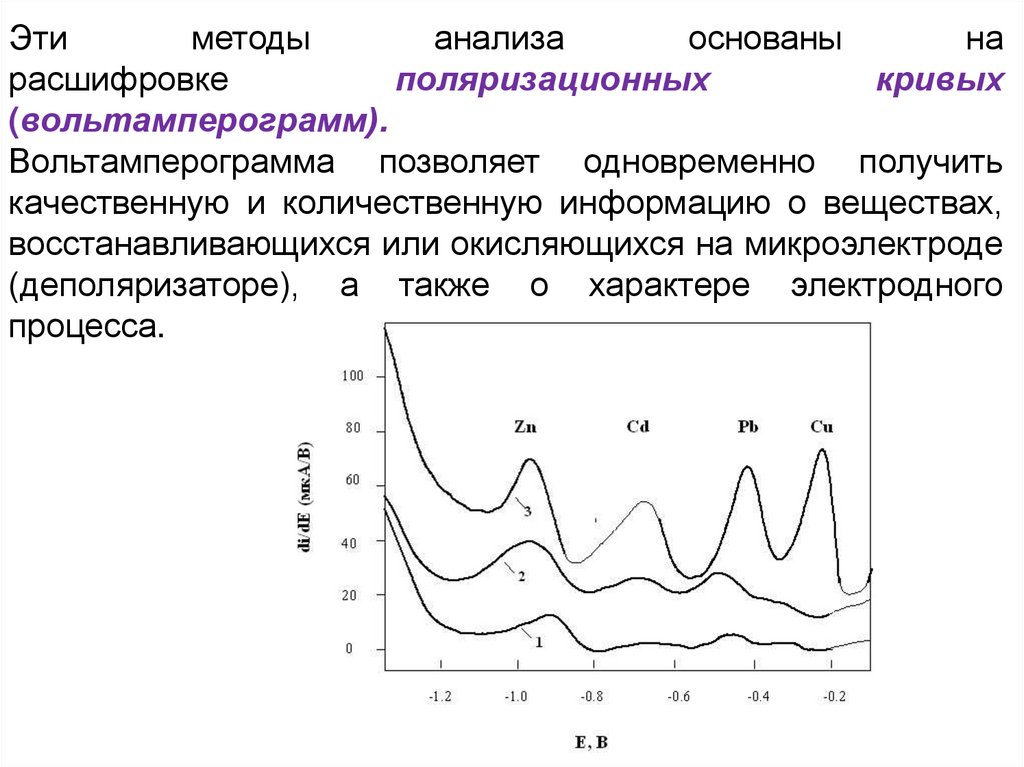
Этиметоды
анализа
основаны
на
расшифровке
поляризационных
кривых
(вольтамперограмм).
Вольтамперограмма позволяет одновременно получить
качественную и количественную информацию о веществах,
восстанавливающихся или окисляющихся на микроэлектроде
(деполяризаторе), а также о характере электродного
процесса.
21.
В зависимости от типа индикаторного электродаразличают:
Полярографию (капающий ртутный
микроэлектрод - РКЭ) и
Вольтамперометрию (любой микроэлектрод
кроме РКЭ)
Вольтамперометрию разделяют на
- прямую и
- косвенную (амперометрическое
титрование).
22.
Чешский электрохимикЯрослав
Гейровский,
открывший метод (1922
г.) и получивший за него
Нобелевскую
премию
(1958 г.), использовал в
качестве индикаторного
электрода
ртутнокапельный
электрод (РКЭ).
23.
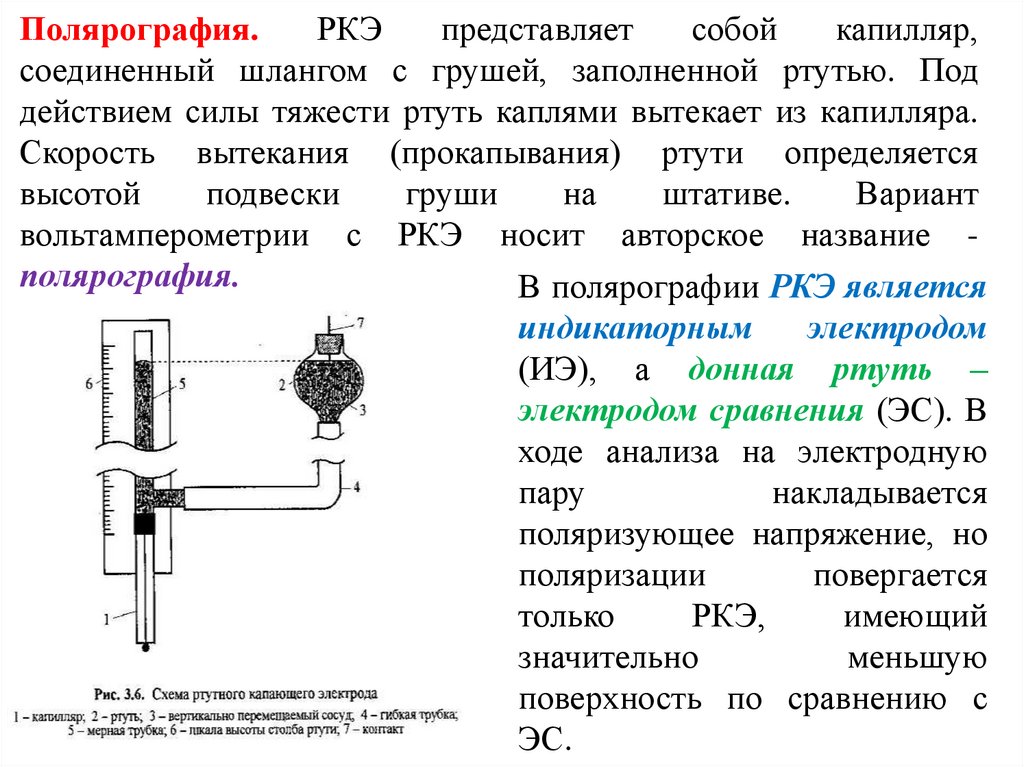
Полярография.РКЭ
представляет
собой
капилляр,
соединенный шлангом с грушей, заполненной ртутью. Под
действием силы тяжести ртуть каплями вытекает из капилляра.
Скорость вытекания (прокапывания) ртути определяется
высотой
подвески
груши
на
штативе.
Вариант
вольтамперометрии с РКЭ носит авторское название полярография.
В полярографии РКЭ является
индикаторным
электродом
(ИЭ), а донная ртуть –
электродом сравнения (ЭС). В
ходе анализа на электродную
пару
накладывается
поляризующее напряжение, но
поляризации
повергается
только
РКЭ,
имеющий
значительно
меньшую
поверхность по сравнению с
ЭС.
24.
Преимущества: Постоянное обновление поверхностиРКЭ, за счет непрерывного прокапывания ртути из его
капилляра, препятствует загрязнению поверхности РКЭ
разряжающимися на нем в ходе анализа веществами,
что исключает операцию очистки и стабилизирует
характеристики
РКЭ
(площадь
поверхности,
электросопротивление и др.).
Недостатки: РКЭ громоздок, неудобен (например, в
полевых условиях) и токсичен, вследствие применения
ртути, поэтому вместо него чаще используют
различные твердые ИЭ из платины, графита и др.
25.
Твердые ИЭ отличаются от РКЭ:1) компактностью;
2) безопасностью применения;
3) загрязнением поверхности во время анализа,
поэтому между анализами требуется механическая или
химическая очистка.
(Однако и донная ртуть в РКЭ тоже требует
периодической очистки.)
26.
Инверсионно–вольтамперометрический(ИВ) метод заключается в выделении
электролизом определяемого элемента из
очень
разбавленного
раствора
на
стационарном индикаторном электроде с
последующим
анодным
растворением
полученной амальгамы и регистрацией
вольтамперной кривой.
27.
Применение. Применяют для качественного иколичественного определения неорганических и
органических веществ. Чаще всего для
определения содержания тяжелых металлов свинца,
кадмия, меди, цинка,
ртути,
мышьяка и др. в пищевых продуктах,
биологических, медицинских, фармацевтических
объектах и объектах окружающей среды
28.
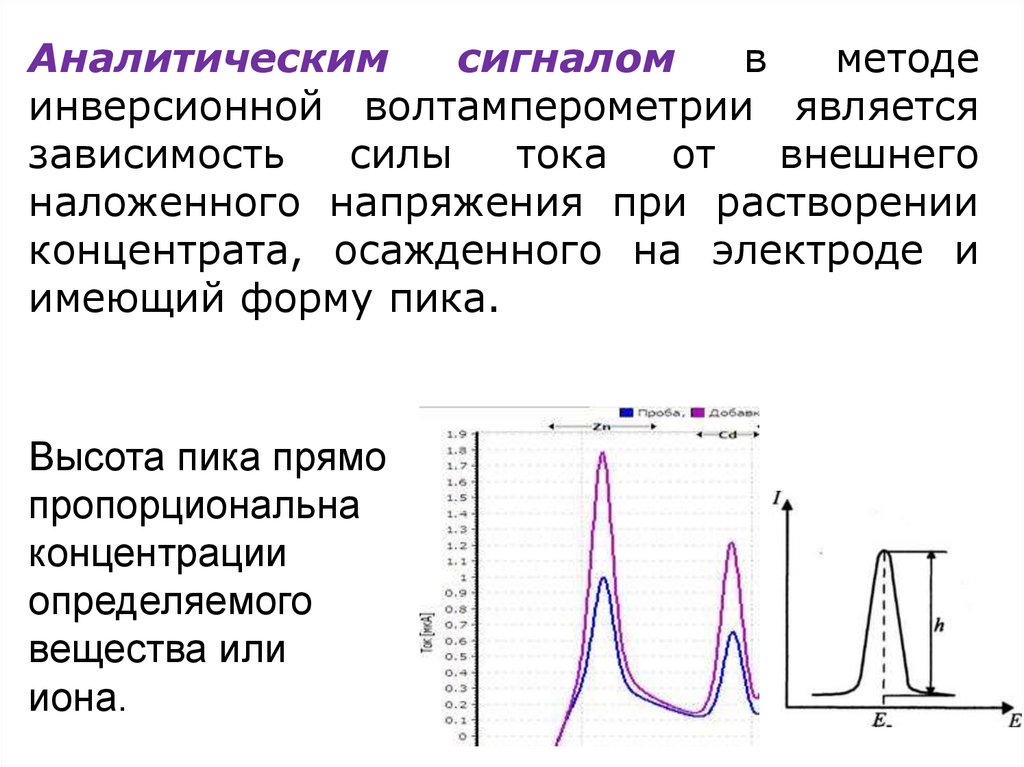
Аналитическимсигналом
в
методе
инверсионной волтамперометрии является
зависимость
силы
тока
от
внешнего
наложенного напряжения при растворении
концентрата, осажденного на электроде и
имеющий форму пика.
Высота пика прямо
пропорциональна
концентрации
определяемого
вещества или
иона.
29.
Метод ИВ состоит из двух стадий:1) электрохимическое
осаждение
(концентрирование) исследуемого иона на
индикаторном электроде из анализируемого
раствора при заданном постоянном потенциале
электролиза в течение заданного времени
электролиза. Процесс проводят в растворе
фонового
электролита
при
постоянном
перемешивании.
2) электрохимическое растворение концентрата
при линейно меняющемся потенциале.
30.
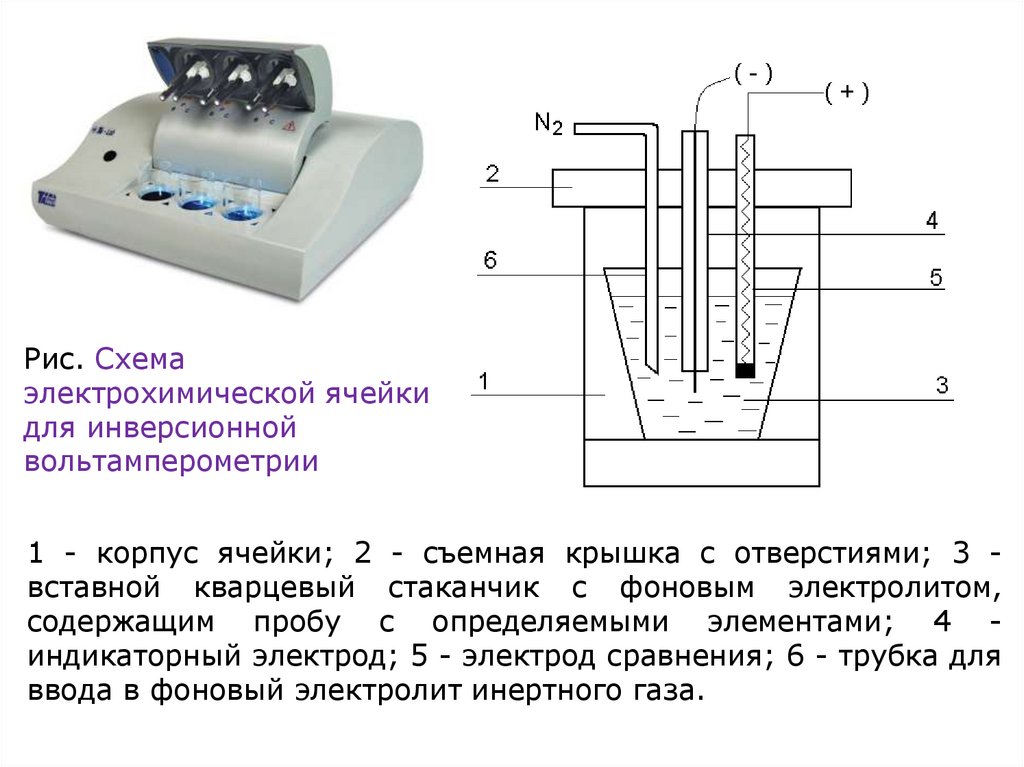
Рис. Схемаэлектрохимической ячейки
для инверсионной
вольтамперометрии
1 - корпус ячейки; 2 - съемная крышка с отверстиями; 3 вставной кварцевый стаканчик с фоновым электролитом,
содержащим пробу с определяемыми элементами; 4 индикаторный электрод; 5 - электрод сравнения; 6 - трубка для
ввода в фоновый электролит инертного газа.
31.
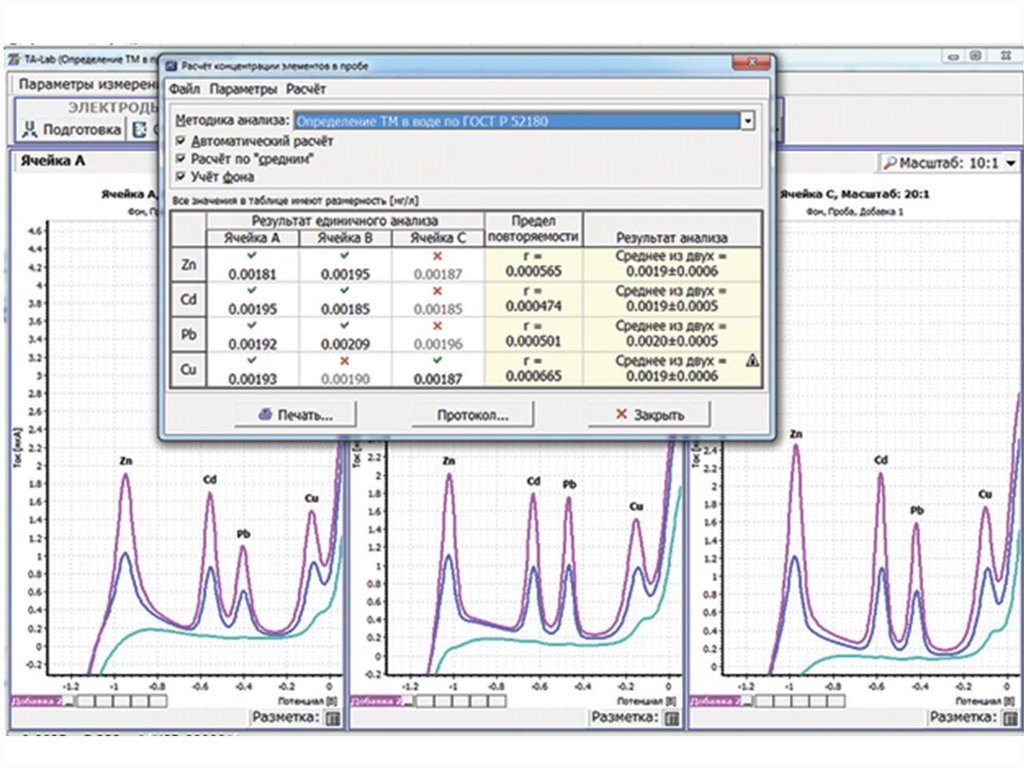
Массовые концентрации элементов в испытуемомрастворе пробы определяют по методу добавок
аттестационных смесей определяемых элементов.
Аттестованная смесь (АС) - средство измерения в виде смеси
веществ, не предназначенное для серийного производства,
метрологические характеристики которого установлены методом
аттестации по процедуре приготовления. АС готовят на месте
применения в соответствии с методикой, регламентированной в
утвержденной документации [ГОСТ Р 51301-99 Продукты пищевые
и
продовольственное
сырье.
Инверсионновольтамперометрические методы определения содержания
токсичных элементов (кадмия, свинца, меди и цинка)].
32.
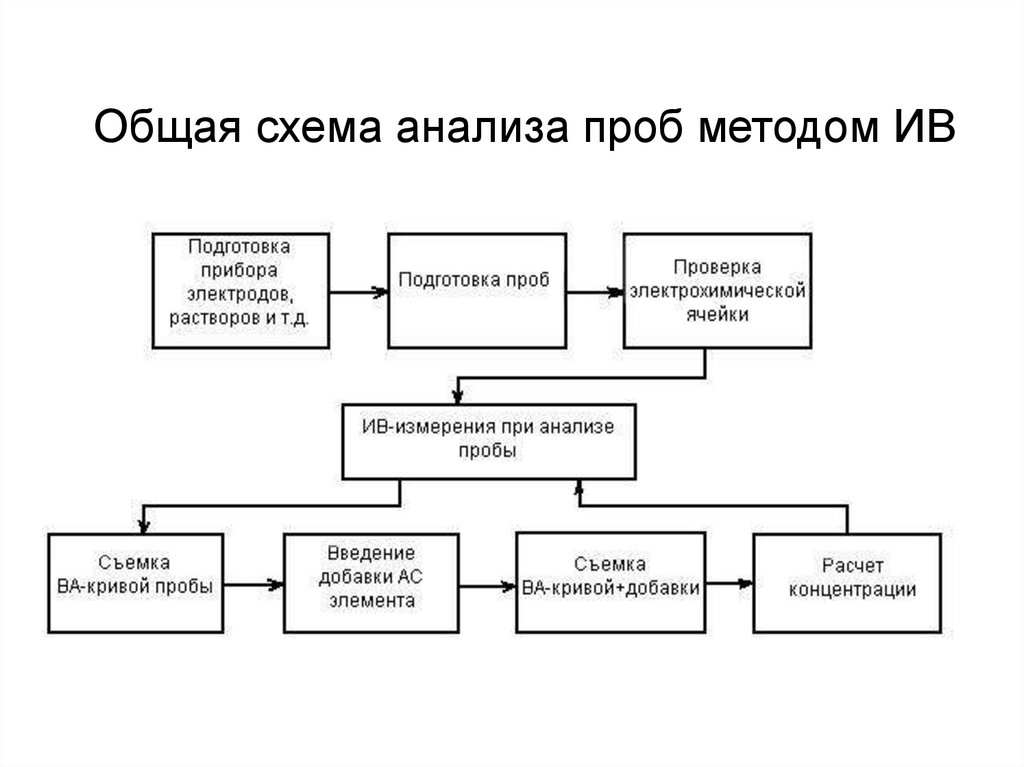
Общая схема анализа проб методом ИВ33.
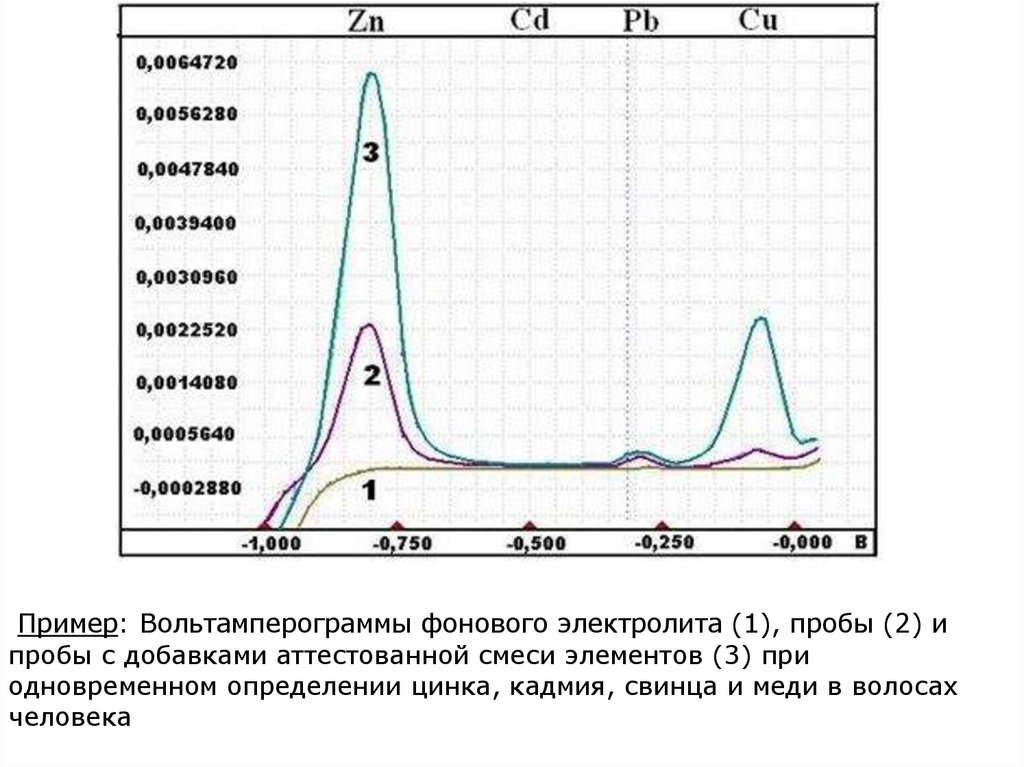
Пример: Вольтамперограммы фонового электролита (1), пробы (2) ипробы с добавками аттестованной смеси элементов (3) при
одновременном определении цинка, кадмия, свинца и меди в волосах
человека
34.
35.
Содержание определяемого вещества методоминверсионной вольтамперометрии в анализируемой
пробе Хi, мг/кг, с вычисляют по формуле:
Хi — содержание анализируемого вещества в анализируемой пробе,
мг/кг;
СД — концентрация определяемого вещества в аттестованной смеси,
из которого берется добавка к анализируемой пробе мг/дм3;
Vд - объём добавки контрольного раствора элемента, мл;
I 1 - величина пика элемента в анализируемой пробе, мкА;
I 2 - величина пика элемента в пробе с добавкой контрольного
раствора, мкА;
m - навеска пробы, взятой для анализа, г;
Vмин - объём обессоленной воды, в котором растворена зола, мл;
Vал. - объём минерализата, добавленный для анализа в стаканчик, мл
36.
37.
Пример. Для анализа взяли 0,5 гпочвы провели мокрое озоление с
50%-ным
раствором
HNO3.
Золу
растворили
в
10
мл
бидистиллированной воды, после чего
отобрали 0,2 мл вытяжки для анализа.
Определить массу цинка и свинца по
вольтамперограммам.
38.
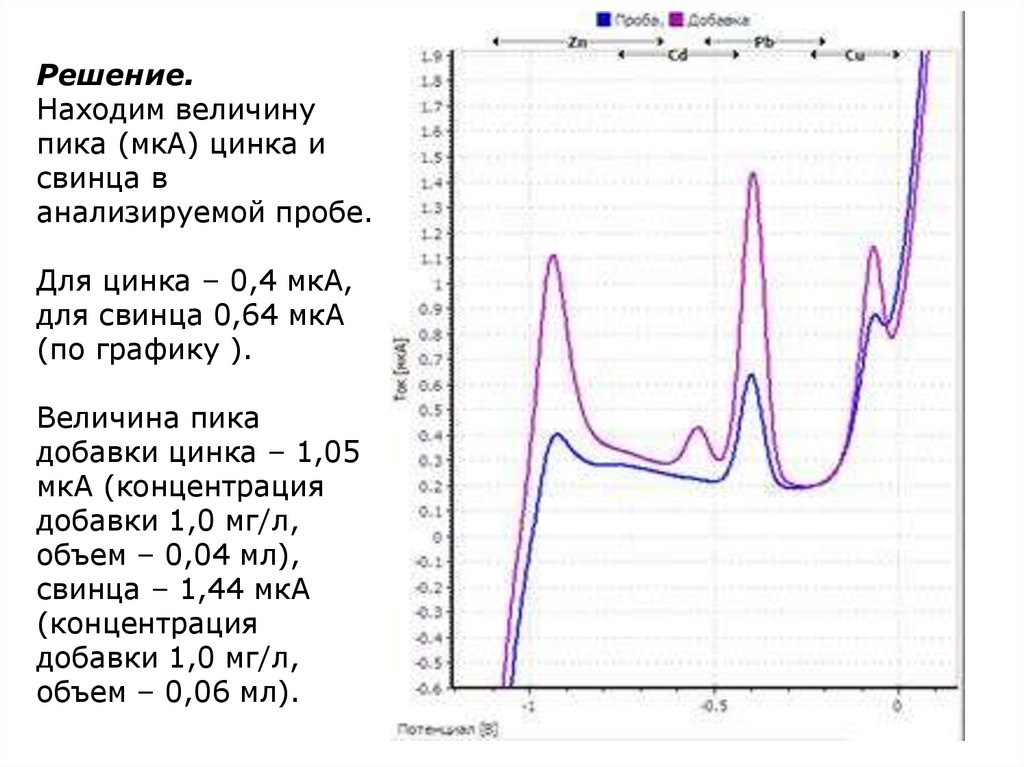
Решение.Находим величину
пика (мкА) цинка и
свинца в
анализируемой пробе.
Для цинка – 0,4 мкА,
для свинца 0,64 мкА
(по графику ).
Величина пика
добавки цинка – 1,05
мкА (концентрация
добавки 1,0 мг/л,
объем – 0,04 мл),
свинца – 1,44 мкА
(концентрация
добавки 1,0 мг/л,
объем – 0,06 мл).

























 Химия
Химия








