Похожие презентации:
Алканы. Предельные углеводороды. Насыщенные углеводороды. Парафины
1. Алканы
Предельные углеводороды.Насыщенные углеводороды.
Парафины
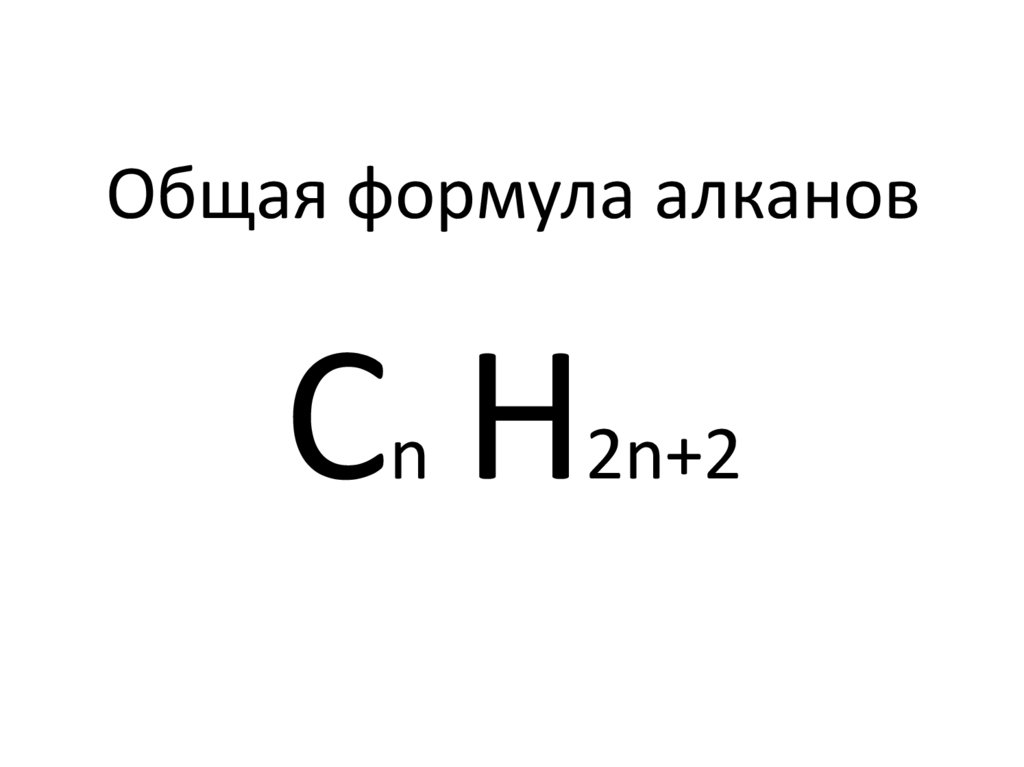
2. Общая формула алканов
СHn
2n+2
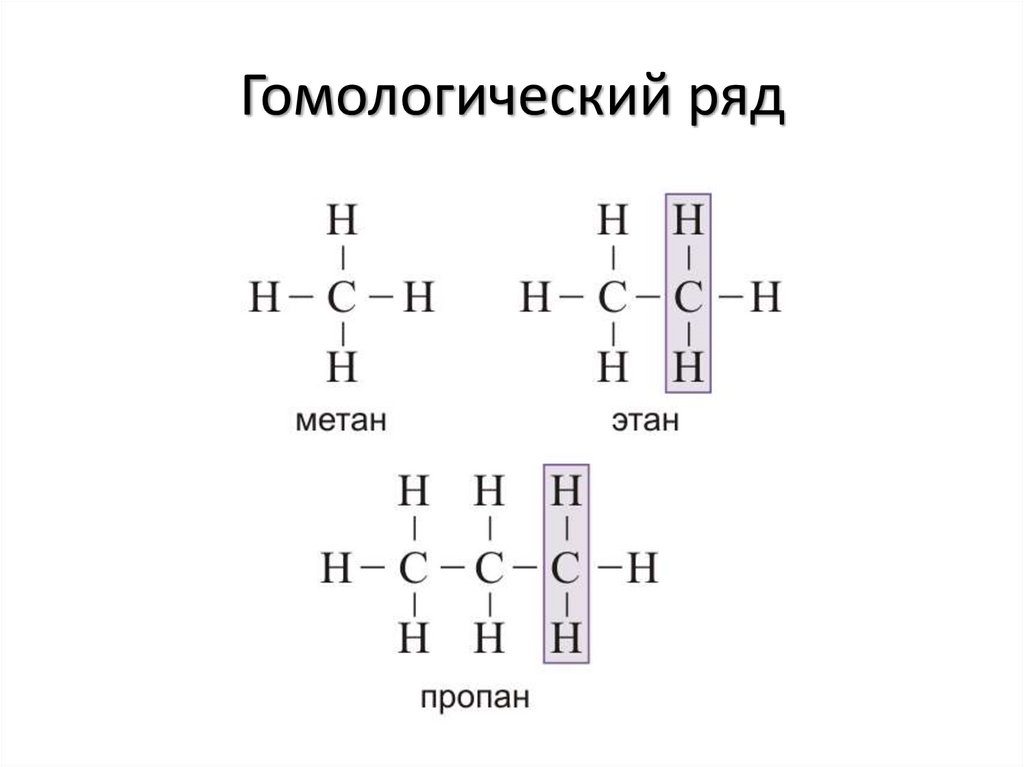
3. Гомологический ряд
4. Гомологический ряд
СН4 метанС2Н6 этан
С3Н8 пропан
С4Н10 бутан
С5Н12 пентан
С6Н14 гексан
5. Название радикалов
• CH3• C2H5
• C3H7
• C4H9
• C5H11
• C6H13
метил
этил
пропил
бутил
пентил
…….
6. Физические свойства
С1 – С4 – газы,С5 –С15 – жидкости,
С16 - ∞ – твердые вещества
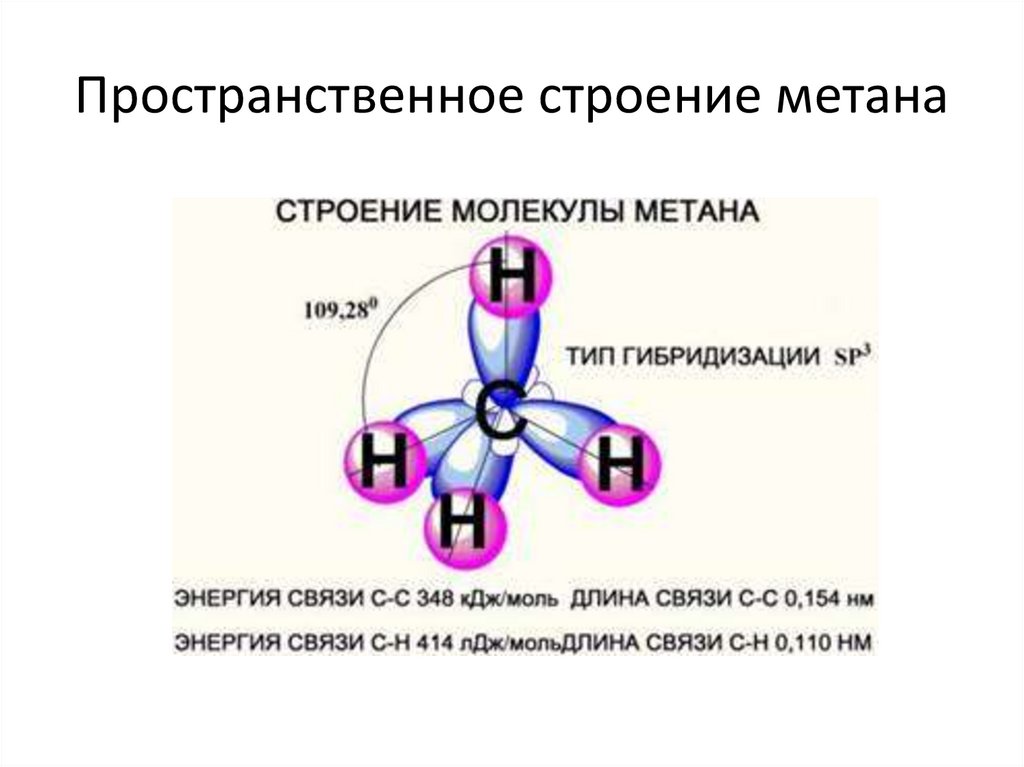
7. Пространственное строение метана
8. Виды изомерии
• СтруктурнаяУглеродного скелета
=Положения кратной связи
=Положения функциональной группы
=Межклассовая
9. Алгоритм составления названия алканов
1.Выбор главной цепи.
2. Нумерация главной цепи.
3. Формирование названия.
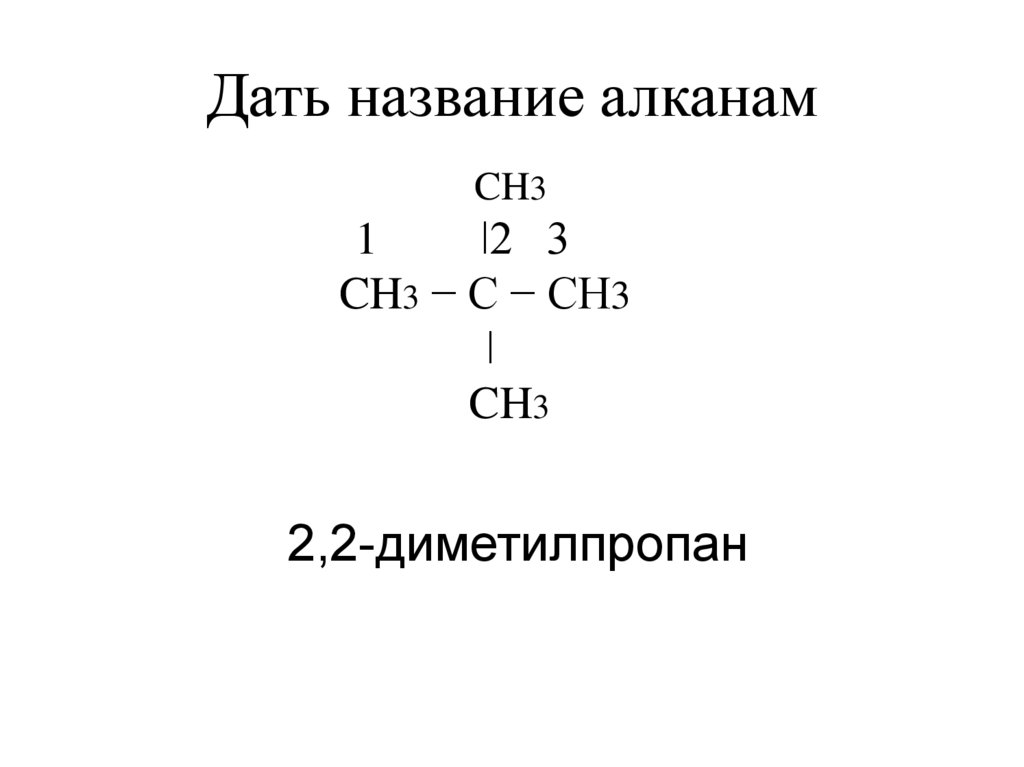
10. Дать название алканам
CH31
ǀ2 3
CH3 − C − CH3
ǀ
CH3
2,2-диметилпропан
11. Дать название алканам
12
3
4
CH3 − CH − CH2 − CH3
ǀ
CH3
2-метилбутан
1
2
3
4
5
CH3 − CH − CH2 − CH − CH3
ǀ
ǀ
CH3
CH3
2,4-диметилпентан
12. Составления названия алканов.
76
5
4
3
2
1
CH3 −CH2 − CH − CH2 − CH2− CH − CH3
ǀ
ǀ
C2H5
CH3
2-метил-5-этилгептан
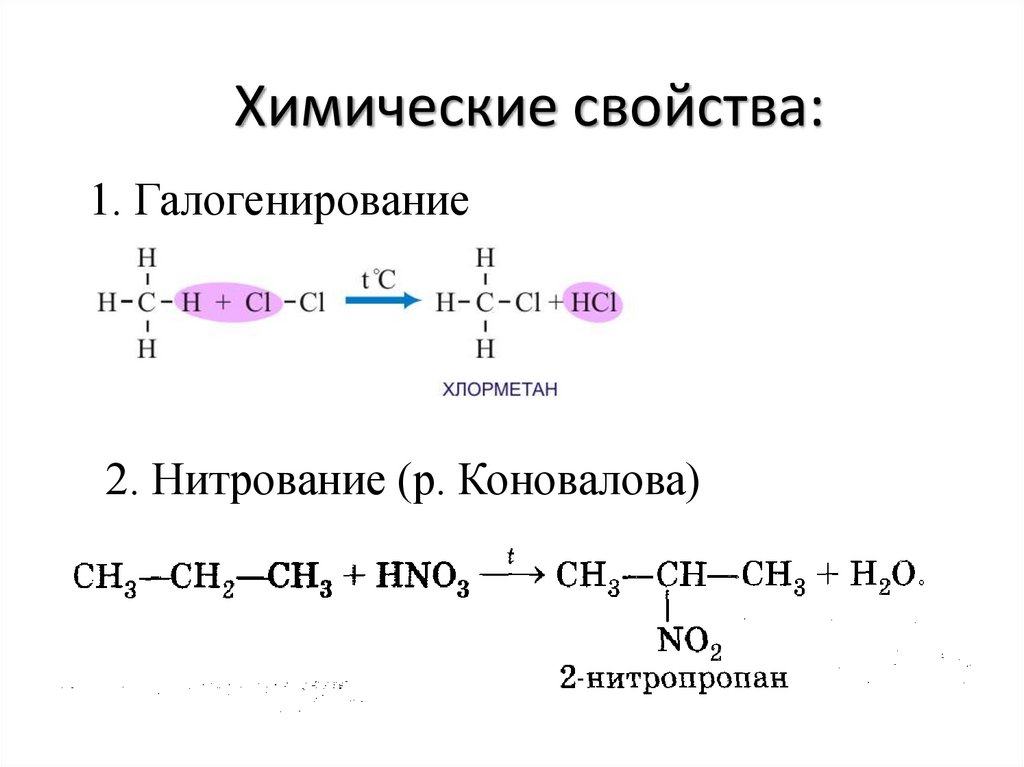
13. Химические свойства:
1. Галогенирование2. Нитрование (р. Коновалова)
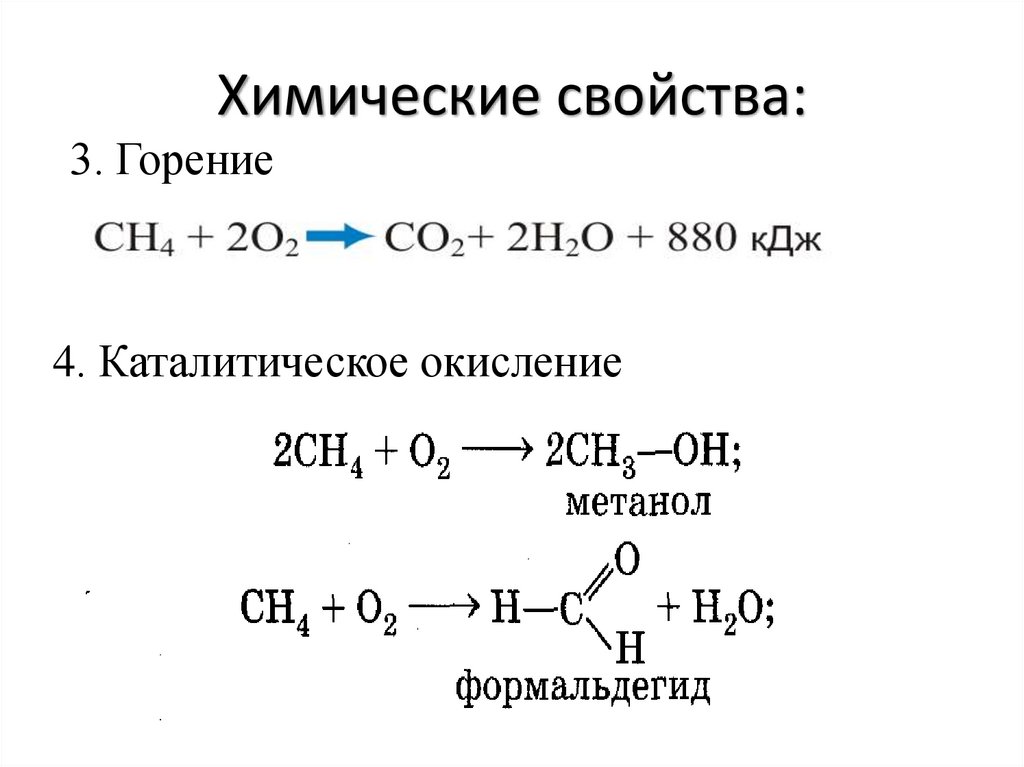
14. Химические свойства:
3. Горение4. Каталитическое окисление
15. Химические свойства:
5. Пиролиз (t выше 600 градусов С)16. Химические свойства:
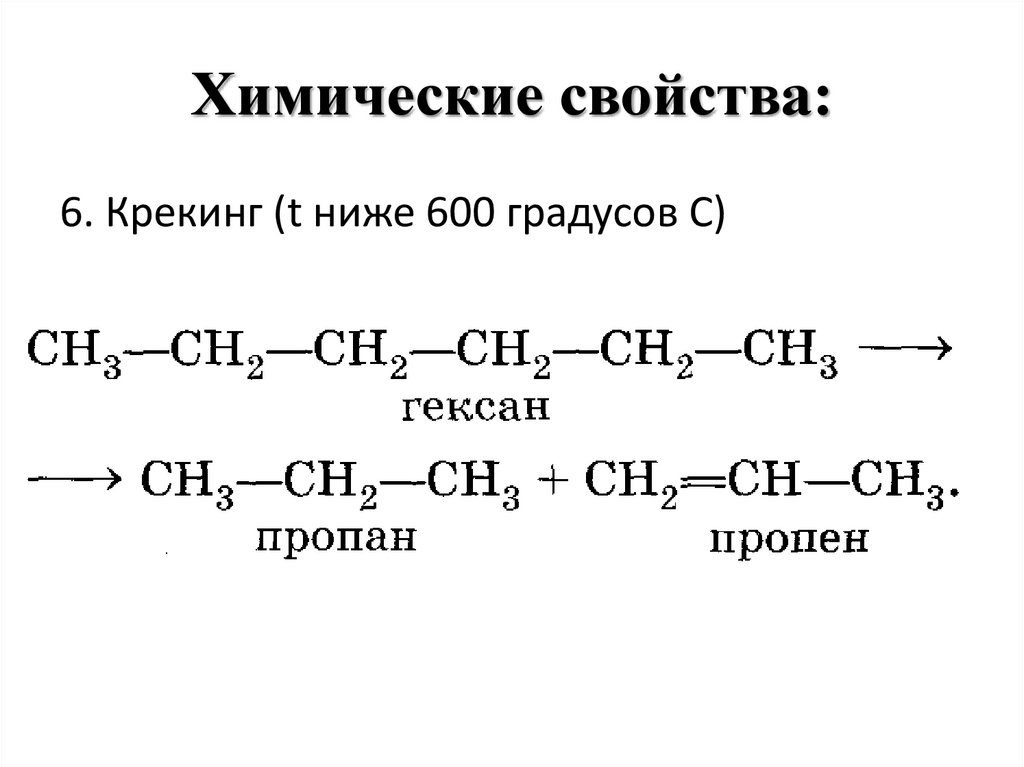
6. Крекинг (t ниже 600 градусов С)17. Химические свойства:
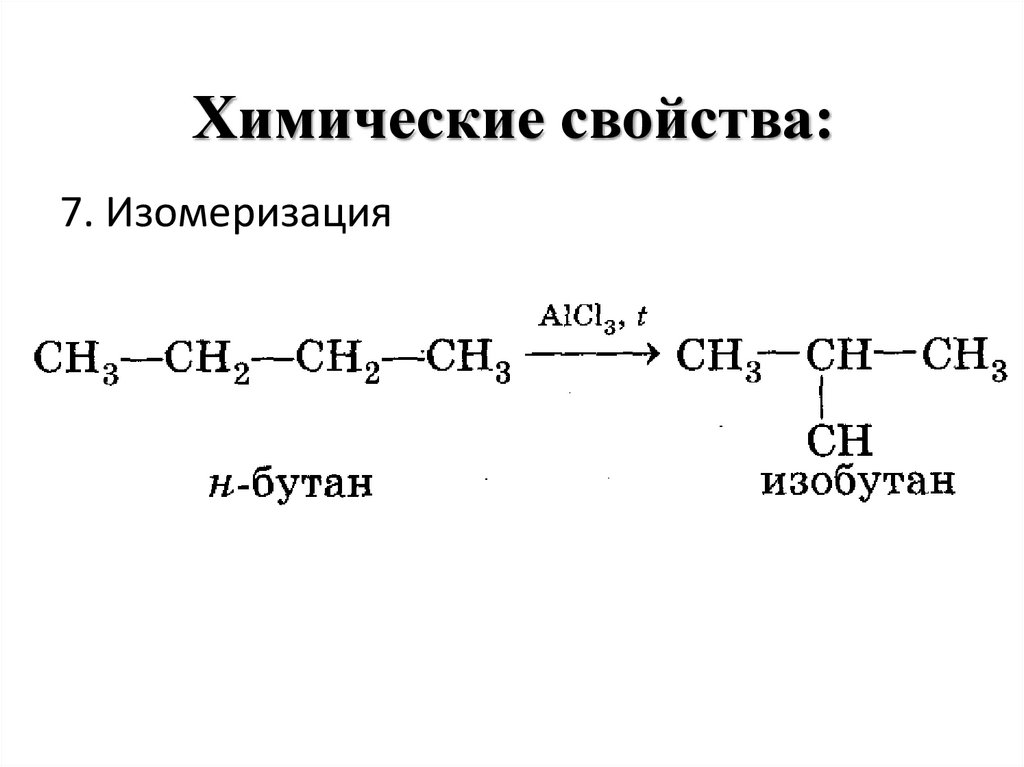
7. Изомеризация18. Получение алканов
Получение метана1.В п р о м ы ш л е н н о с т и:
а) из природного газа
б) синтез из оксида углерода (II) и
водорода
Ni,300˚C
CO + 3H2 →
CH4 ↑ +H2O
19. Получение метана
В лабораторииа) гидролиз карбида алюминия
Al4C3 +12H2O → 3CH4 ↑ +4Al(OH)3
б) сплавление солей уксусной кислоты со
щелочами
CH3COONa +NaOH → CH4 ↑ +Na2CO3
20. Получение гомологов метана
В промышленностиа) из природного сырья (нефть, газ,
горный воск)
б) синтез из оксида углерода (II) и
водорода
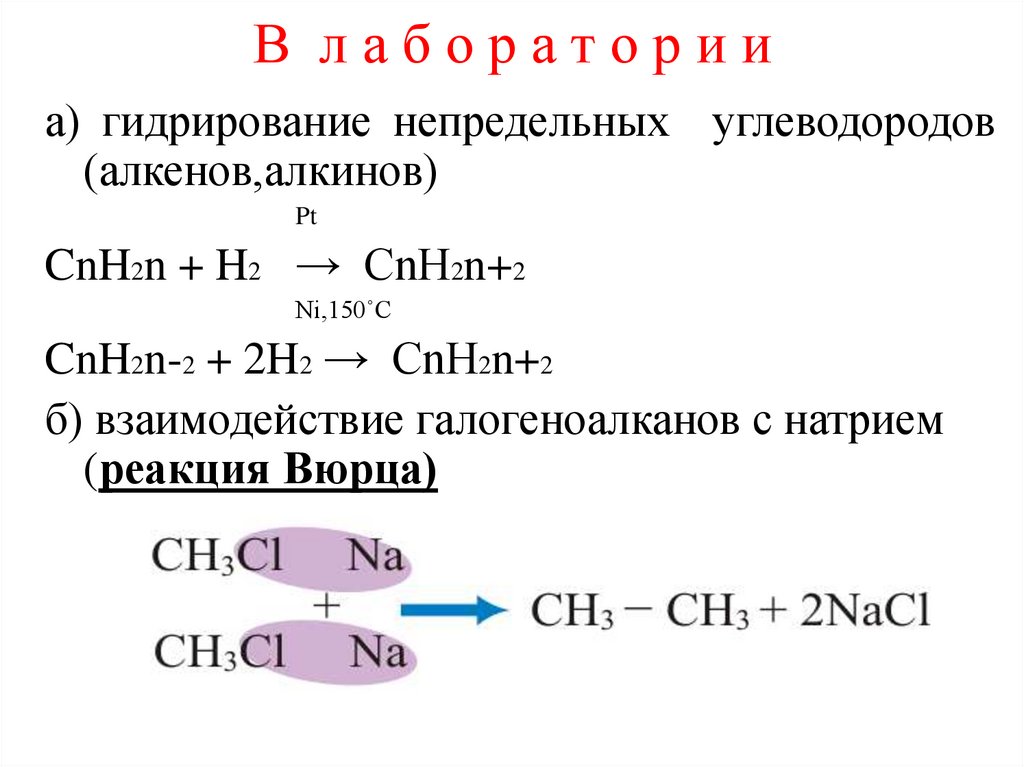
21. В л а б о р а т о р и и
В лабораторииа) гидрирование непредельных углеводородов
(алкенов,алкинов)
Pt
CnH2n + H2 → CnH2n+2
Ni,150˚C
CnH2n-2 + 2H2 → CnH2n+2
б) взаимодействие галогеноалканов с натрием
(реакция Вюрца)












 Химия
Химия








