Похожие презентации:
Непредельные углеводороды ряда этилена. Олефины
1. Непредельные углеводороды ряда этилена. Олефины
АЛКЕНЫ2. Понятие об алкенах
• Алкены – углеводороды, содержащие в молекуле однудвойную связь между атомами углерода, а качественный
и количественный состав выражается общей формулой
СnН2n, где n ≥ 2.
Алкены относятся к непредельным углеводородам,
так как их молекулы содержат меньшее число атомов
водорода, чем насыщенные.
3. Характеристика двойной связи (С ═ С)
• Вид гибридизации –sp2
• Валентный угол –
120º
0,134 нм
• Длина связи С = С –
• Строение ─ плоскостное
• Вид связи – ковалентная неполярная
σиπ
• По типу перекрывания –
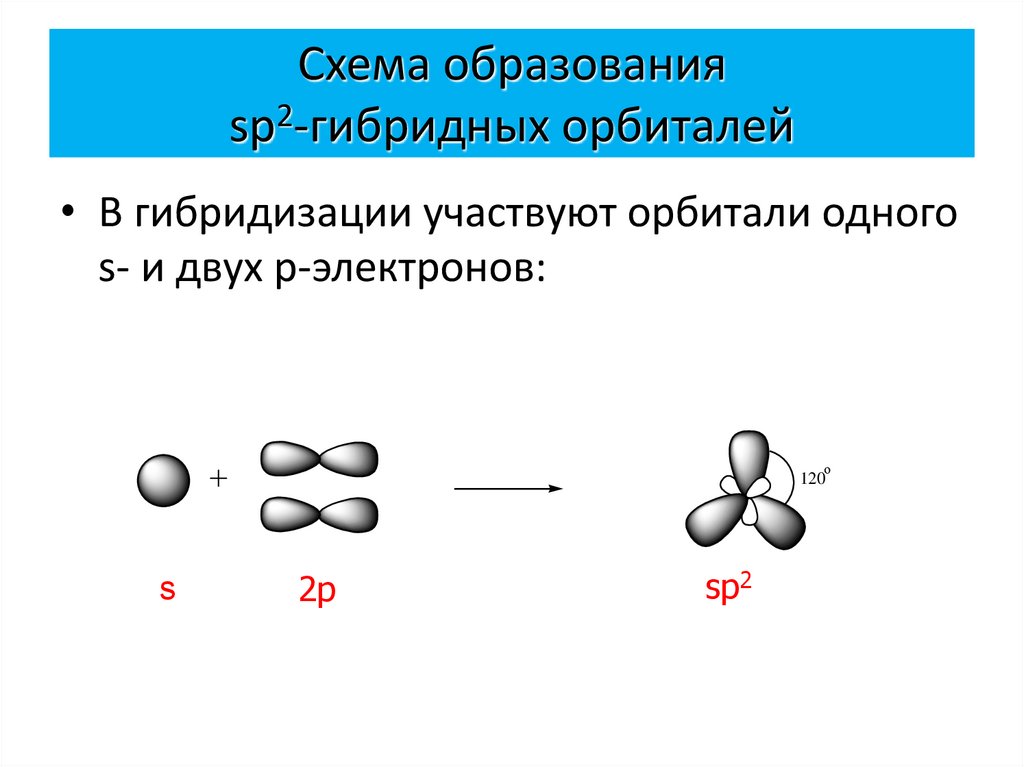
4. Схема образования sp2-гибридных орбиталей
• В гибридизации участвуют орбитали одногоs- и двух p-электронов:
о
120
s
2p
sp2
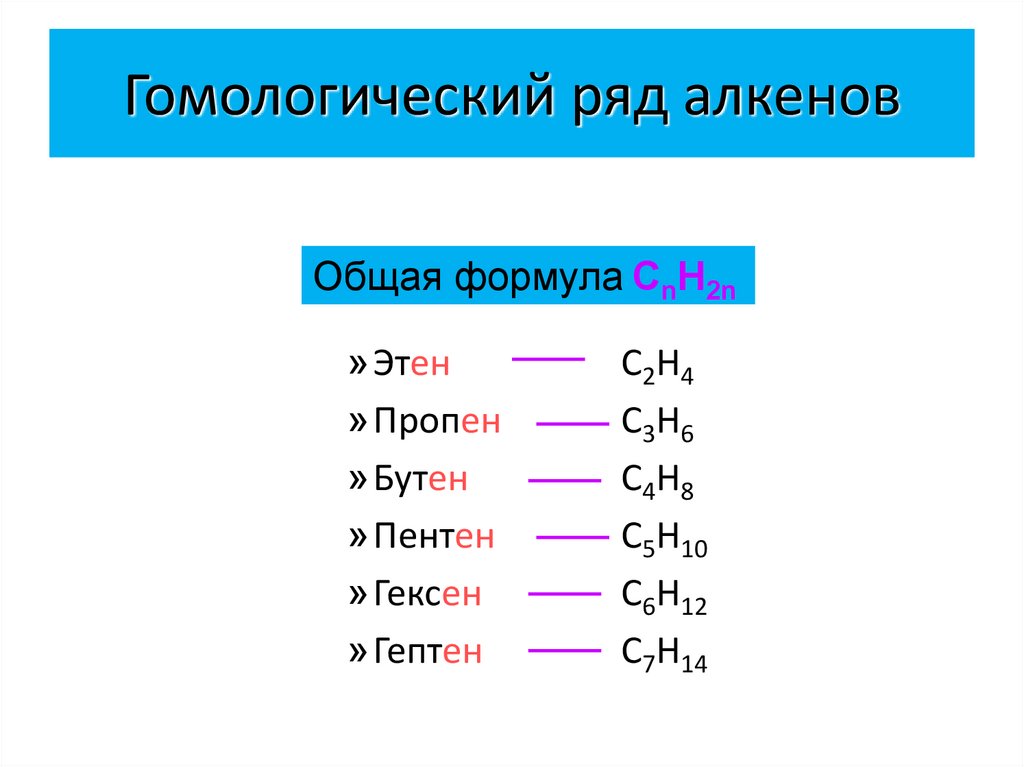
5. Гомологический ряд алкенов
Общая формула СnН2n»Этен
»Пропен
»Бутен
»Пентен
»Гексен
»Гептен
C2H4
C3H6
C4H8
C5H10
C6H12
C7H14
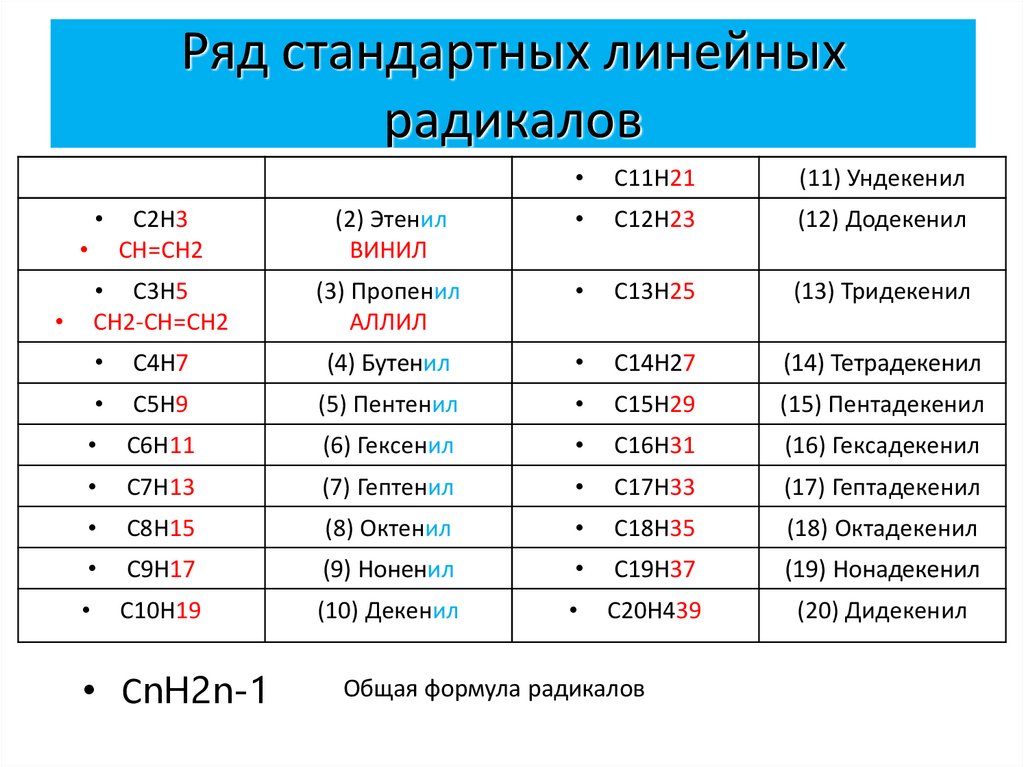
6. Ряд стандартных линейных радикалов
C11H21
(11) Ундекенил
C2H3
СН=СН2
(2) Этенил
ВИНИЛ
C12H23
(12) Додекенил
• C3H5
СН2-СН=СН2
(3) Пропенил
АЛЛИЛ
C13H25
(13) Тридекенил
C4H7
(4) Бутенил
C14H27
(14) Тетрадекенил
C5H9
(5) Пентенил
C15H29
(15) Пентадекенил
C6H11
(6) Гексенил
C16H31
(16) Гексадекенил
С7Н13
(7) Гептенил
C17H33
(17) Гептадекенил
С8H15
(8) Октенил
C18H35
(18) Октадекенил
C9H17
(9) Ноненил
C19H37
(19) Нонадекенил
C10H19
(10) Декенил
C20H439
(20) Дидекенил
• СnH2n-1
Общая формула радикалов
7. Номенклатура
1. Название алкенов по систематической номенклатуреобразуют из названий алканов, заменяя суффикс –ан на
–ен. Цифрой указывается номер того атома углерода, от
которого начинается двойная связь.
2. Главная цепь атомов углерода должна обязательно
включать двойную связь, и ее нумерацию проводят с того
конца главной цепи, к которому она ближе.
3. В начале названия перечисляют радикалы с указанием
номеров атомов углерода, с которыми они связаны. Если
в молекуле присутствует несколько одинаковых
радикалов, то цифрой указывается место каждого из них
в главной цепи и перед их названием ставят
соответственно приставки: ди-, три-, тетра- и т.д.
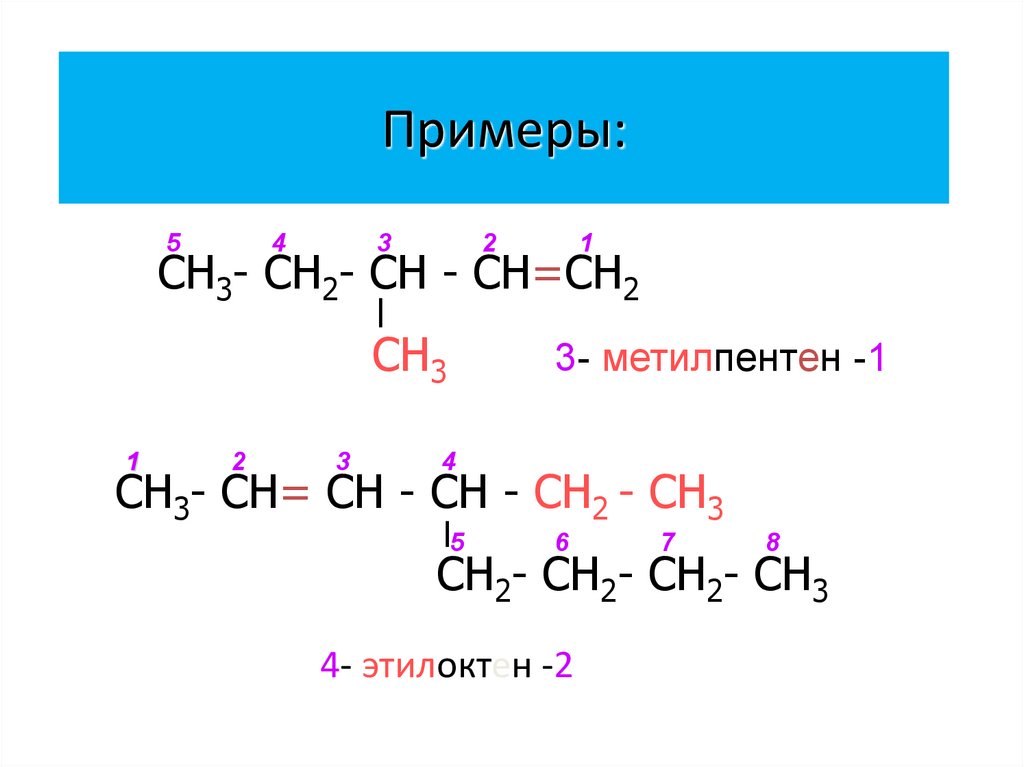
8. Примеры:
54
3
2
1
СН3- СН2- СН - СН=СН2
СН3
1
2
3
3- метилпентен -1
4
СН3- СН= СН - СН - СН2 - СН3
5
6
7
8
СН2- СН2- СН2- СН3
4- этилоктен -2
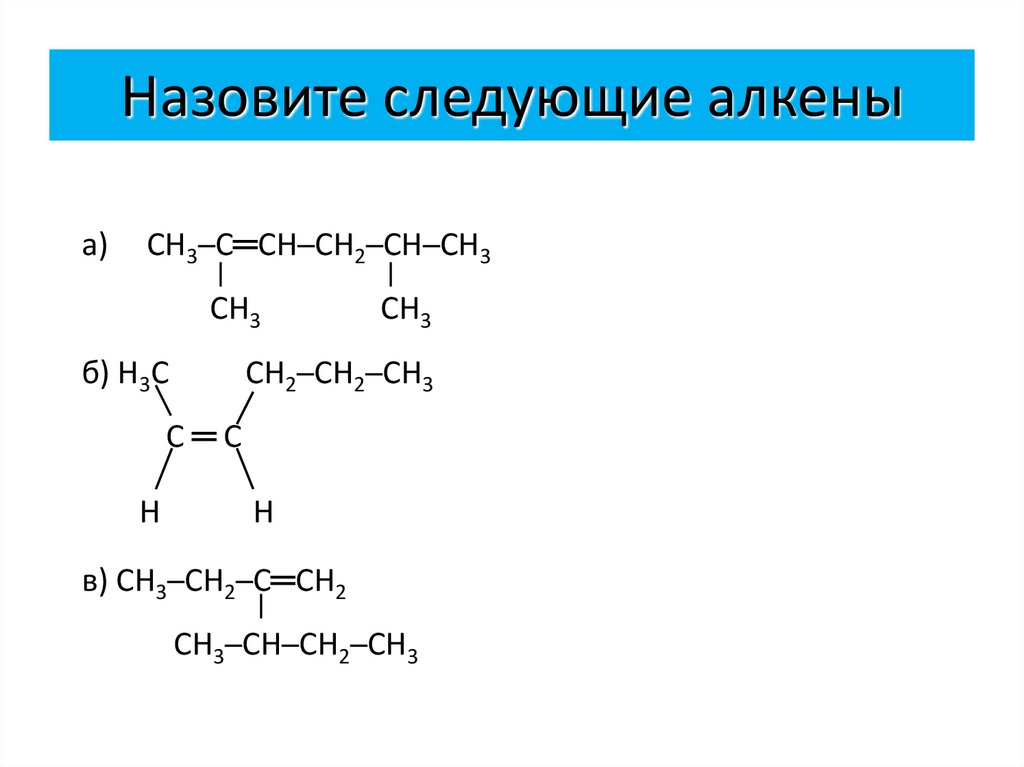
9. Назовите следующие алкены
а)СН3─С═СН─СН2─СН─СН3
СН3
б) Н3С
СН3
СН2─СН2─СН3
С═С
Н
Н
в) СН3─СН2─С═СН2
СН3─СН─СН2─СН3
10.
Определите структурную формулу по названию1,2,3-трихлорпропен-1
2-бром-3,4-диметилгептен-3
3-метил-5-этилоктен-2
2-метилоктен-2
11. Изомерия алкенов
Для алкенов возможны два типа изомерии:1-ый тип – структурная изомерия:
1) углеродного скелета
2) положения двойной связи
3) межклассовая
2-ой тип – пространственная изомерия:
геометрическая
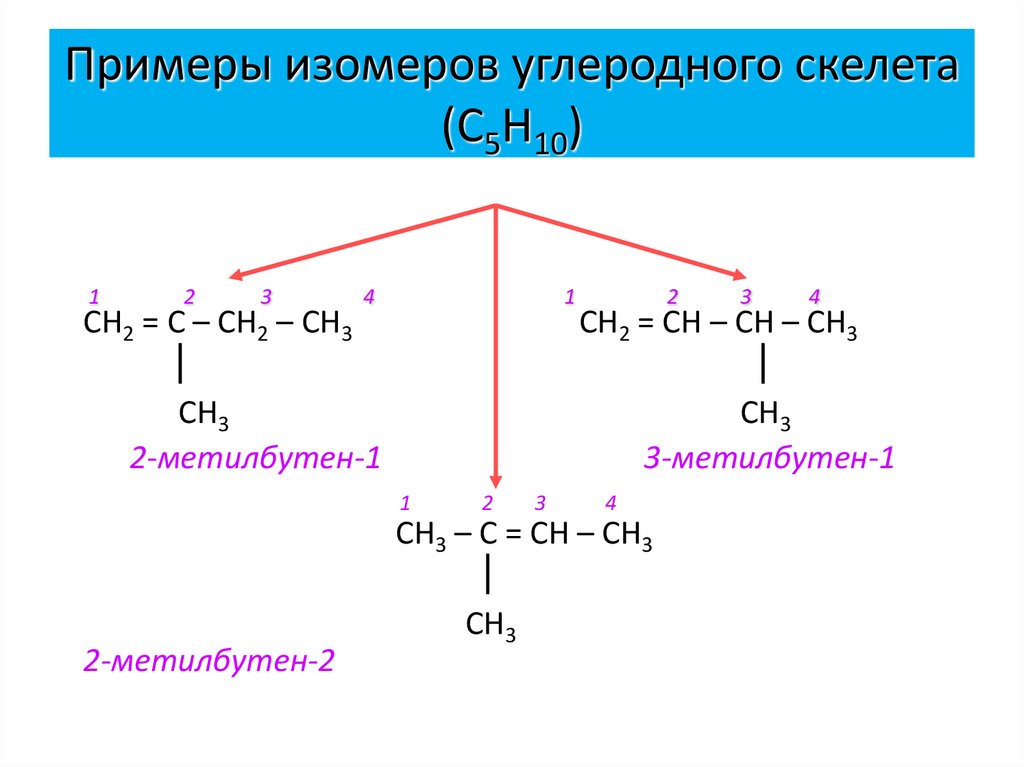
12. Примеры изомеров углеродного скелета (С5Н10)
12
3
СН2 = С – СН2 – СН3
4
1
2
4
СН2 = СН – СН – СН3
СН3
2-метилбутен-1
СН3
3-метилбутен-1
1
2
3
4
СН3 – С = СН – СН3
2-метилбутен-2
3
СН3
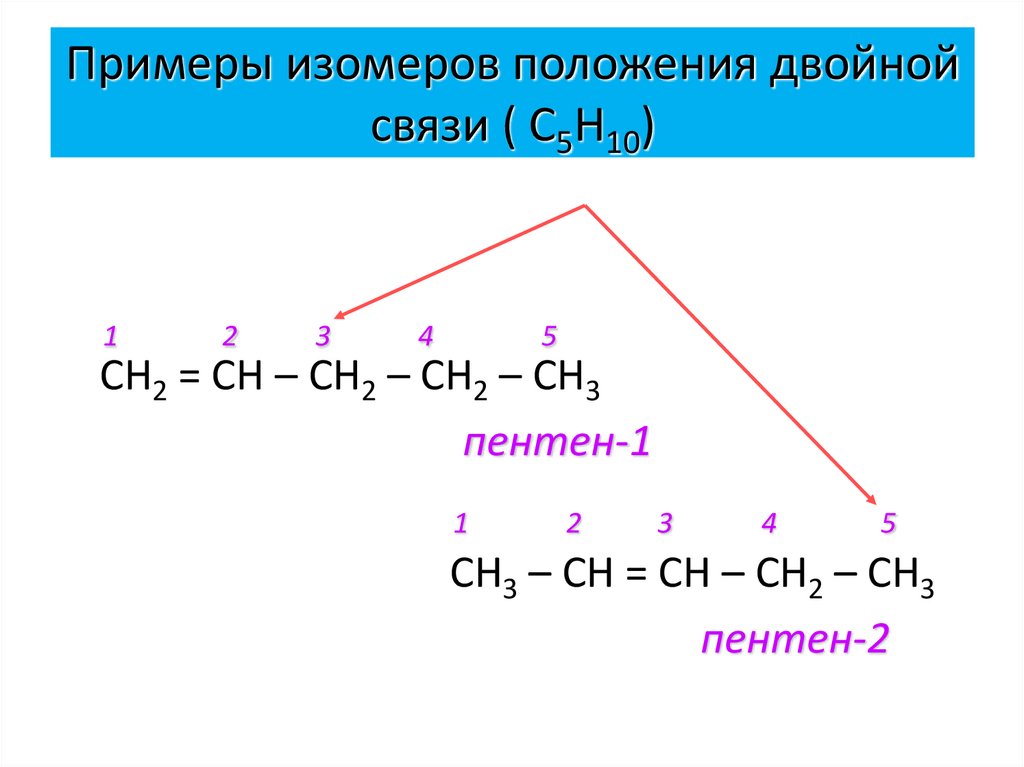
13. Примеры изомеров положения двойной связи ( С5Н10)
12
3
4
5
СН2 = СН – СН2 – СН2 – СН3
пентен-1
1
2
3
4
5
СН3 – СН = СН – СН2 – СН3
пентен-2
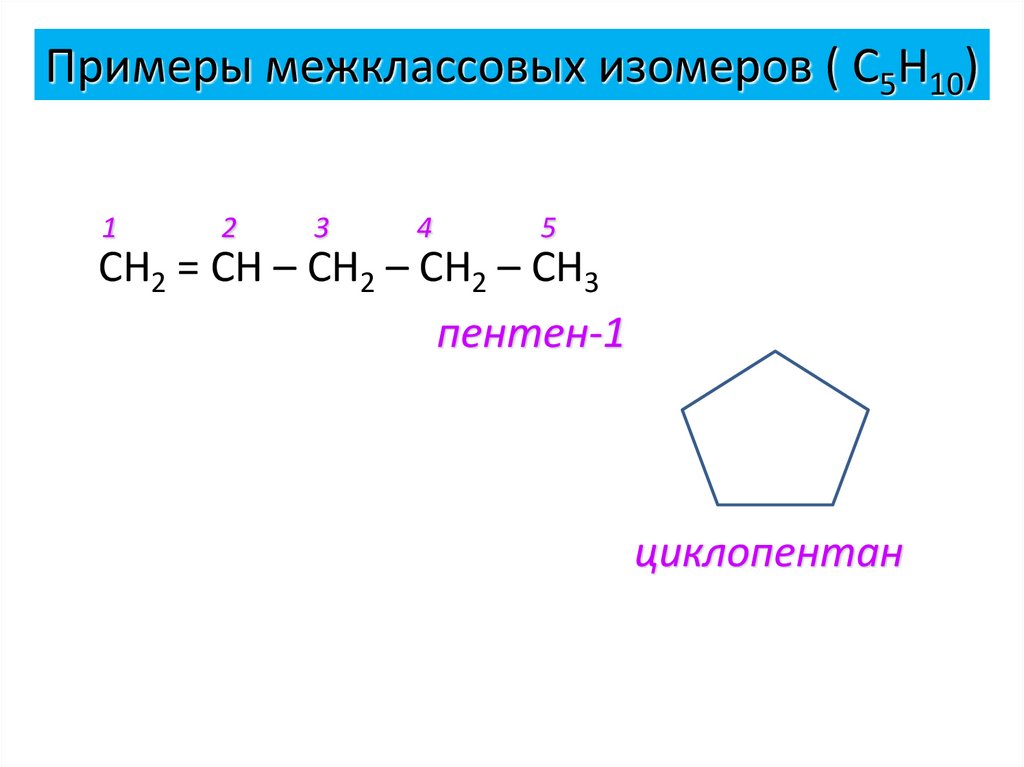
14. Примеры межклассовых изомеров ( С5Н10)
12
3
4
5
СН2 = СН – СН2 – СН2 – СН3
пентен-1
циклопентан
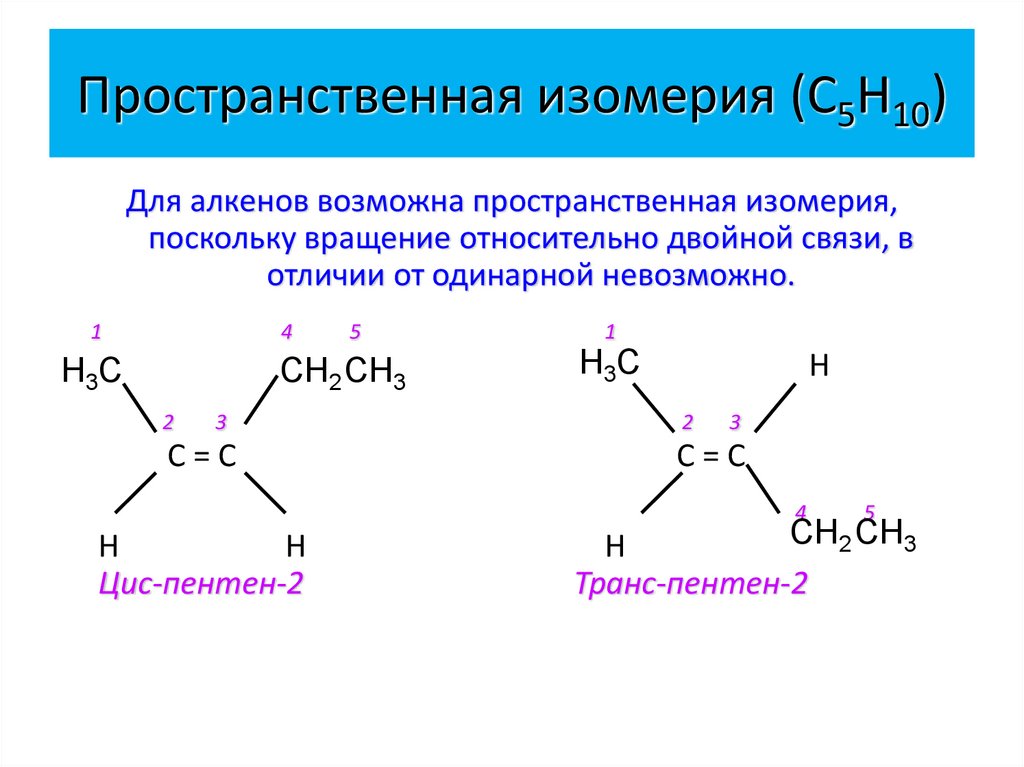
15. Пространственная изомерия (С5Н10)
Для алкенов возможна пространственная изомерия,поскольку вращение относительно двойной связи, в
отличии от одинарной невозможно.
1
4
Н3С
5
СН2 СН3
2
3
С=С
1
Н3С
Н
2
3
С=С
4
Н
Н
Цис-пентен-2
5
СН2 СН3
Н
Транс-пентен-2
16. Напишите 3 вида структурных и пространственный изомеры н-бутена-1
17. Физические свойства алкенов
• Алкены плохо растворимы в воде, но хорошорастворяются в органических растворителях.
• С2– С4 - газы
• С5– С16 - жидкости
• С17… - твёрдые вещества
• С увеличением молекулярной массы алкенов, в
гомологическом ряду, повышаются температуры
кипения и плавления, увеличивается плотность
веществ.
18. Химические свойства алкенов
• По химическим свойствам алкены резкоотличаются от алканов. Алкены более химически
активные вещества, что обусловлено наличием
двойной связи, состоящей из σ- и π-связей.
Алкены способны присоединять два
одновалентных атома или радикала за счёт
разрыва π-связи, как менее прочной.
19. Типы химических реакций, которые характерны для алкенов
• Реакции присоединения.• Реакции полимеризации.
• Реакции окисления.
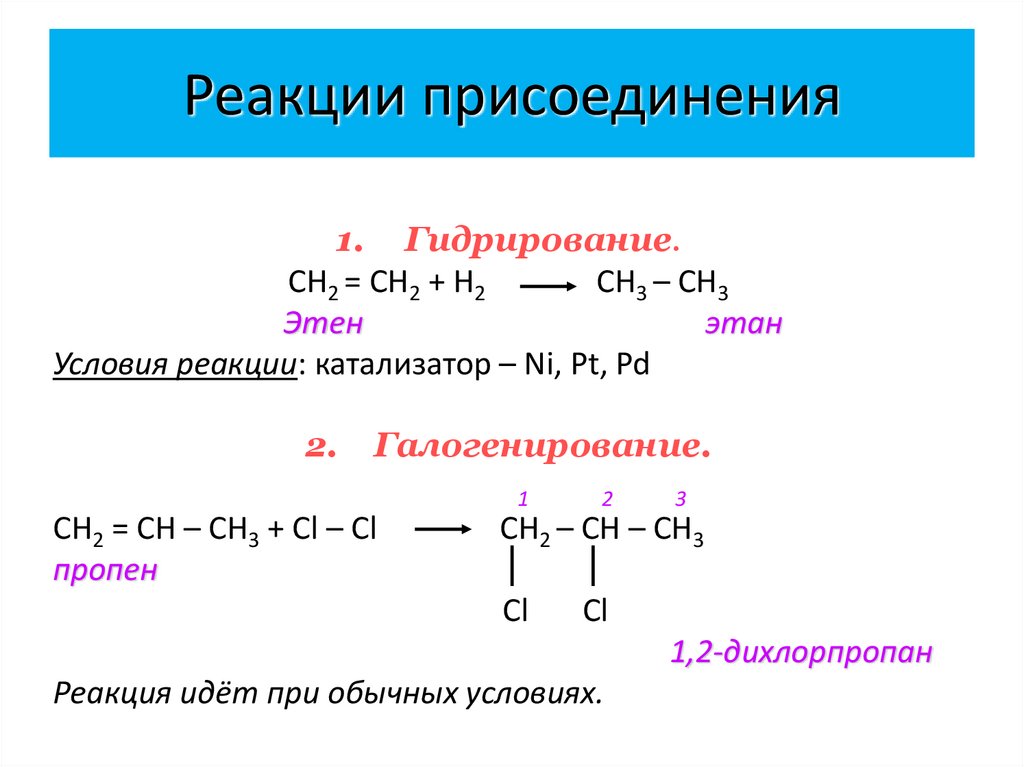
20. Реакции присоединения
1. Гидрирование.CН2 = СН2 + Н2
СН3 – СН3
Этен
этан
Условия реакции: катализатор – Ni, Pt, Pd
2.
Галогенирование.
1
CН2 = СН – СН3 + Сl – Сl
пропен
2
3
СН2 – СН – СН3
Cl
Cl
1,2-дихлорпропан
Реакция идёт при обычных условиях.
21. Реакции присоединения
3.1
2
3
Гидрогалогенирование.
4
СН2 = СН – СН2 – СН3 + Н – Сl
1
2
3
4
CН3 – СН – СН2 – СН3
Бутен-1
Cl
2-хлорбутан
4.
1
2
3
CН2 = СН – СН3 + Н – ОН
пропен
Гидратация.
1
2
3
СН3 – СН – СН3
ОН
пропанол-2
Условия реакции: катализатор – серная кислота, температура.
Присоединение молекул галогеноводородов и воды к молекулам алкенов
происходит в соответствии с правилом В.В. Марковникова.
22. Гидрогалогенирование гомологов этилена
ПравилоВ.В. Марковникова
• Атом водорода
присоединяется к
наиболее
гидрированному атому
углерода при двойной
связи, а атом галогена или
гидроксогруппа – к
наименее
гидрированному.
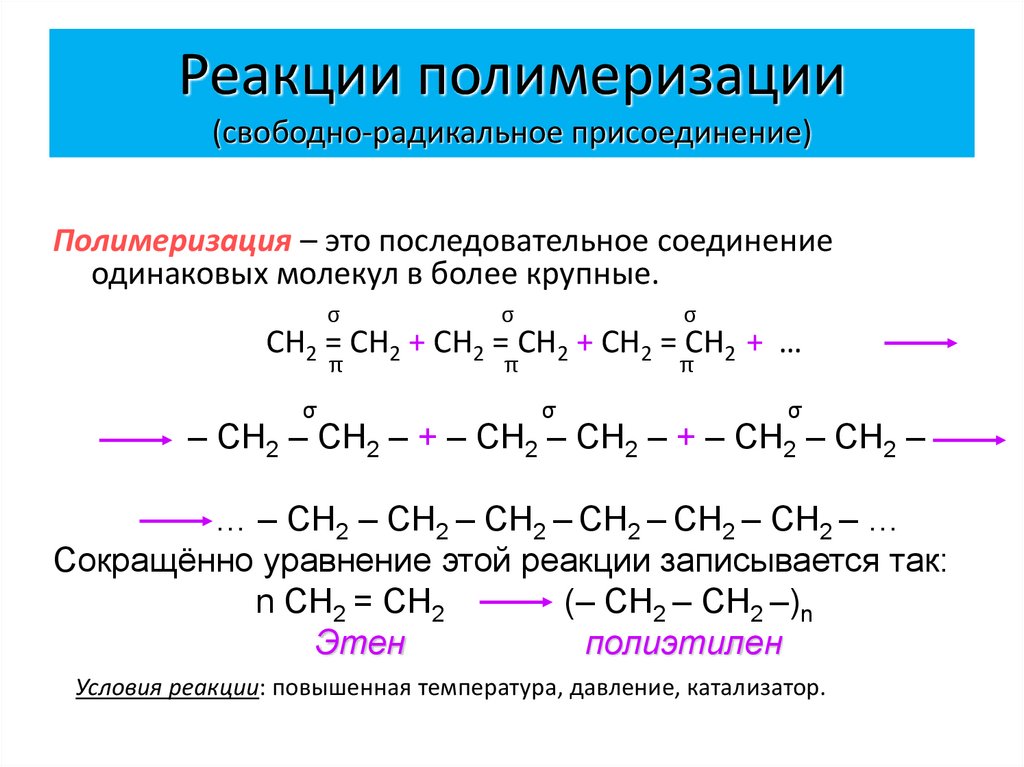
23. Реакции полимеризации (свободно-радикальное присоединение)
Полимеризация – это последовательное соединениеодинаковых молекул в более крупные.
σ
σ
σ
π
π
π
СН2 = СН2 + СН2 = СН2 + СН2 = СН2 + …
σ
σ
σ
– СН2 – СН2 – + – СН2 – СН2 – + – СН2 – СН2 –
… – СН2 – СН2 – СН2 – СН2 – СН2 – СН2 – …
Сокращённо уравнение этой реакции записывается так:
n СН2 = СН2
(– СН2 – СН2 –)n
Этен
полиэтилен
Условия реакции: повышенная температура, давление, катализатор.
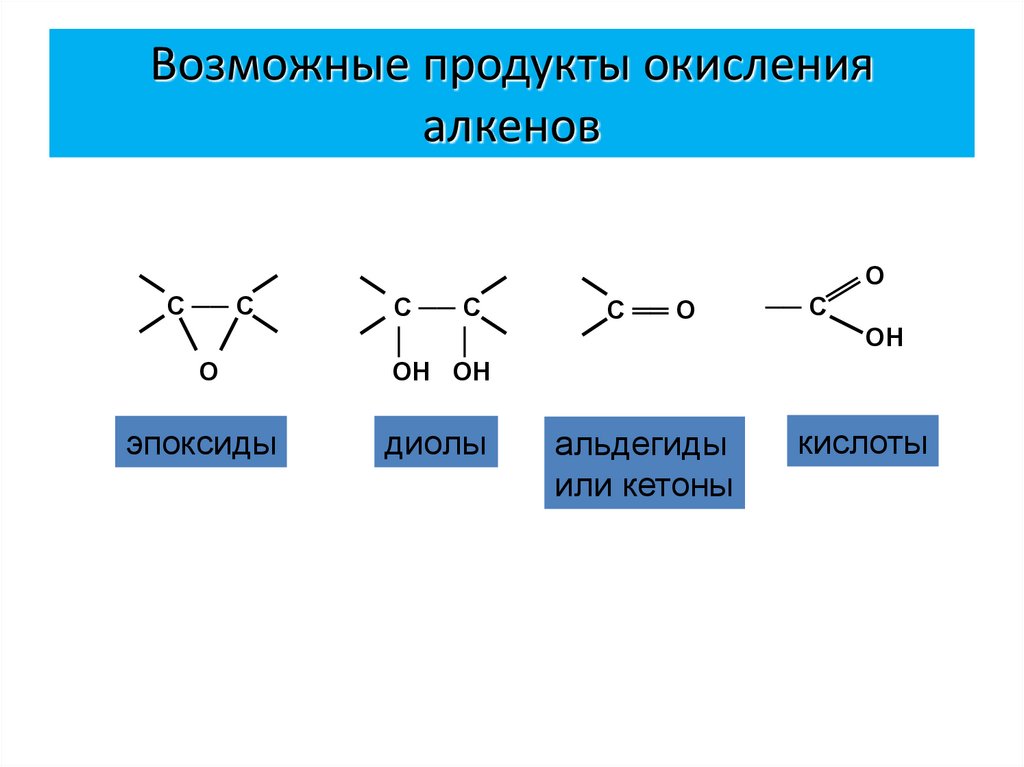
24. Возможные продукты окисления алкенов
ОС ── С
С ══ О
О
С ── С
│
│
ОН ОН
эпоксиды
диолы
альдегиды
или кетоны
── С
ОН
кислоты
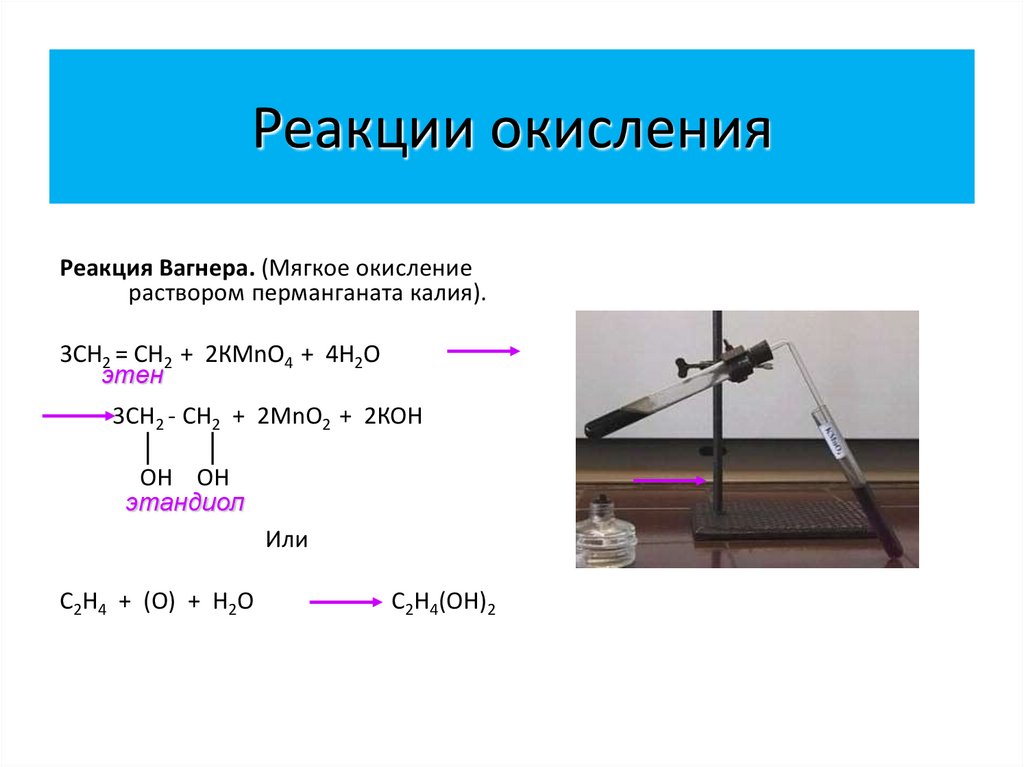
25. Реакции окисления
Реакция Вагнера. (Мягкое окислениераствором перманганата калия).
3СН2 = СН2 + 2КМnО4 + 4Н2О
этен
3СН2 - СН2 + 2МnО2 + 2КОН
ОН ОН
этандиол
Или
С2Н4 + (О) + Н2О
С2Н4(ОН)2
26. Реакции окисления
Жесткое окисление раствором перманганата калия в кислой среде (K2Cr2O7, KMnO4).Происходит полный разрыв двойной связи с образованием:
а) укглекислого газа
CH2=CH2 + [О] + H⁺ → 2CO2 + Н2О
б) карбоновых кислот
CH2=CH-CH3 + [О] + H⁺ → CO2 + Н2О + HOOC-CH3
CH3-CH=CH-CH3 + [О] + H⁺ → CH3-COOH + HOOC-CH3
в) кетонов (если атом углерода при двойной связи содержит два заместителя)
CH3-C=CH-CH3 + [О] + H⁺ → CH3-C-CH3 + HOOC-CH3
CH3
О
5CH3-C=CH-CH3+6KMnO4+9H2SO4 → 5CH3-C-CH3+5HOOC-CH3+6MnSO4+3K2SO4+9H2O
CH3
О
CH3-C=C-CH3 + [О] + H⁺ → CH3-C-CH3 + CH3-C-CH3
CH3 CH3
О
О
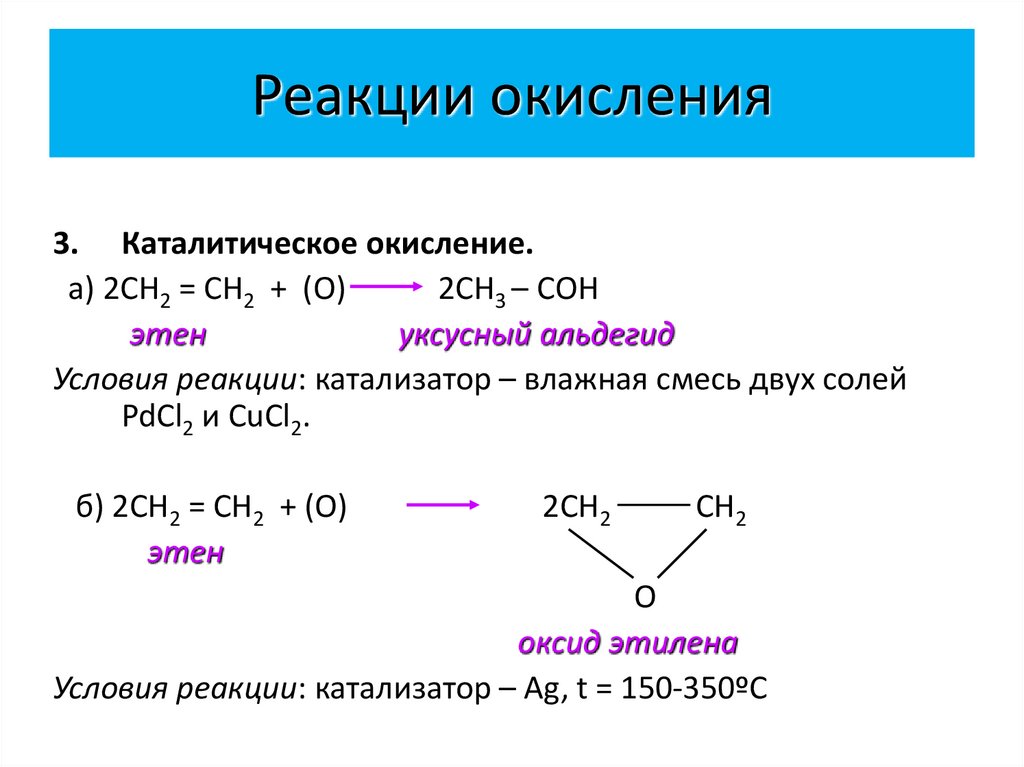
27. Реакции окисления
3. Каталитическое окисление.а) 2СН2 = СН2 + (О)
2СН3 – CОН
этен
уксусный альдегид
Условия реакции: катализатор – влажная смесь двух солей
PdCl2 и CuCl2.
б) 2СН2 = СН2 + (О)
этен
2СН2
СН2
О
оксид этилена
Условия реакции: катализатор – Ag, t = 150-350ºС
28. Горение алкенов
Алкены горят красноватым светящимсяпламенем, в то время как пламя предельных
углеводородов голубое. Массовая доля углерода в
алкенах несколько выше, чем в алканах с тем же
числом атомов углерода.
С4Н8 + 8О2
бутен
4СО2 + 4Н2О
При недостатке кислорода
С4Н8 + 6О2
бутен
4СО + 4Н2О
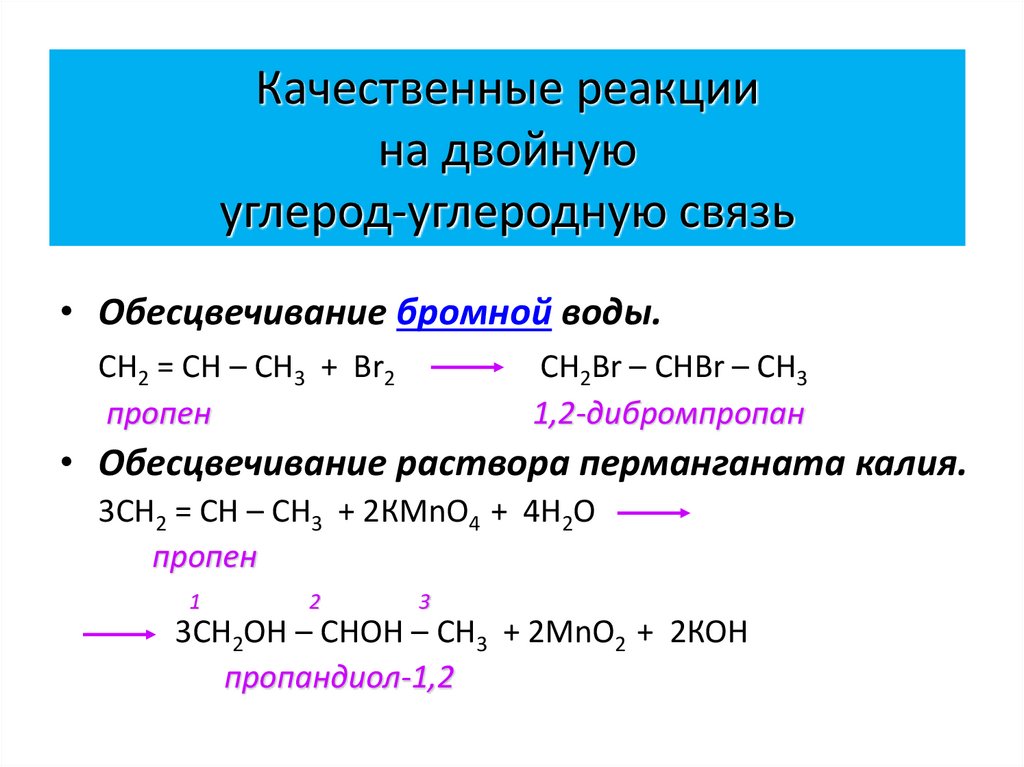
29. Качественные реакции на двойную углерод-углеродную связь
• Обесцвечивание бромной воды.СН2 = СН – СН3 + Вr2
пропен
CH2Br – CHBr – CH3
1,2-дибромпропан
• Обесцвечивание раствора перманганата калия.
3СН2 = СН – СН3 + 2КМnО4 + 4Н2О
пропен
1
2
3
3СН2ОН – СНОН – СН3 + 2МnО2 + 2КОН
пропандиол-1,2
30. Применение
• Алкены широко используются в промышленностив качестве исходных веществ для получения
растворителей (спирты, дихлорэтан, эфиры
гликолей и пр.), полимеров (полиэтилен,
поливинилхлорид, полиизобутилен и др.), а также
многих других важнейших продуктов.
31. Это интересно
• Всем известный полиэтилен был получен был получен в1933 году Э. Фосеттом и Р. Гибсоном
• В 1943 году из полиэтилена стали изготавливать посуду,
ящики, бутылки, упаковку, предметы домашнего обихода
• Благодаря Его Величеству Случаю в 1938 году
американский учёный Р. Планкетт получил тефлон,
обладающий исключительной химической устойчивостью.
32.
Используя правило В.В.Марковникова, напишитеуравнения следующих реакций
присоединения:
а) СН3-СН=СН2 + НСl ?
б) СН2=СН-СН2-СН3 + НBr ?
В) СН3-СН2-СН=СН2 + НОН ?
33.
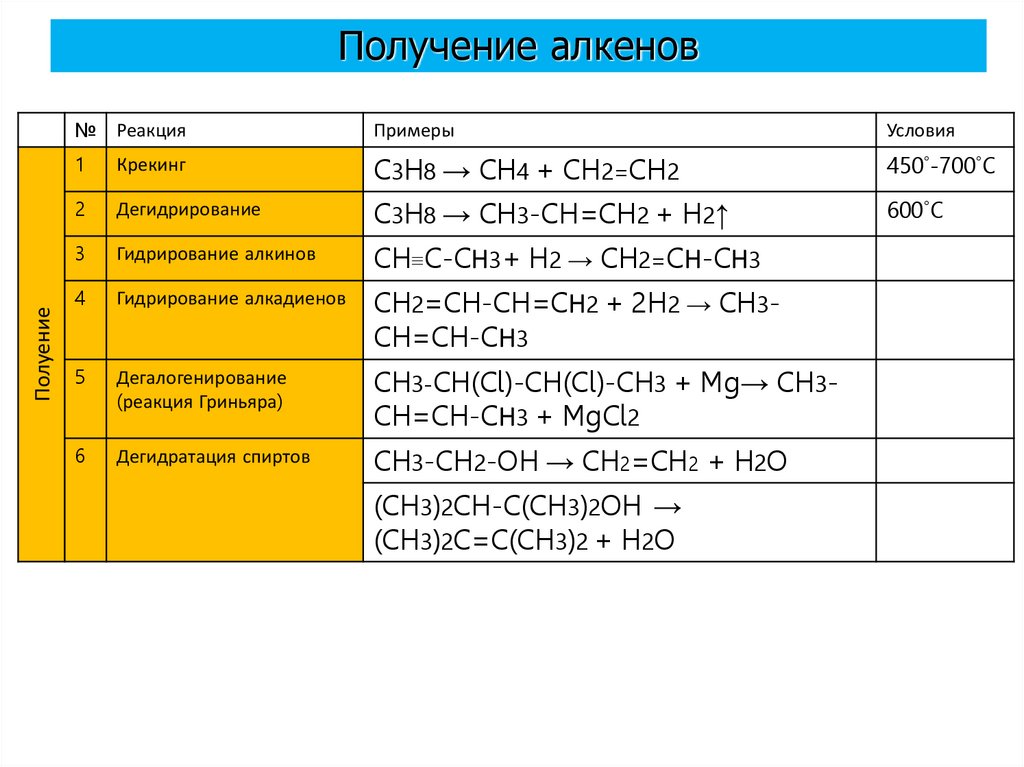
ПолуениеПолучение алкенов
№
Реакция
Примеры
Условия
1
Крекинг
C3H8 → CH4 + CH2=CH2
450˚-700˚C
2
Дегидрирование
C3H8 → CH3-CH=CH2 + H2↑
600˚C
3
Гидрирование алкинов
CH≡C-CН3+ H2 → CH2=CН-CН3
4
Гидрирование алкадиенов
CH2=CH-CH=CН2 + 2H2 → CH3CH=CH-CН3
5
Дегалогенирование
(реакция Гриньяра)
CH3-CH(Cl)-CH(Cl)-CH3 + Mg→ CH3CH=CH-CН3 + MgCl2
6
Дегидратация спиртов
CH3-CH2-OH → CH2=CH2 + H2O
(CH3)2CH-C(CH3)2OH →
(CH3)2C=C(CH3)2 + H2O


















 Химия
Химия








