Похожие презентации:
Непредельные углеводороды. Алкены
1. Непредельные углеводороды. Алкены.
ХИМИЯ, 10 КЛАСС2.
Общая формула:СnH2n
Алкены – ациклические
углеводороды, в молекуле
которых кроме одинарных связей
содержится одна двойная связь
между атомами углерода.
20.11.2024
2
3. В молекулах алкенов - SP2 –гибридизация
В молекулах алкенов SP2 –гибридизацияS1
120º
P2
гибриди
зация
Негибридизованное электронное облако
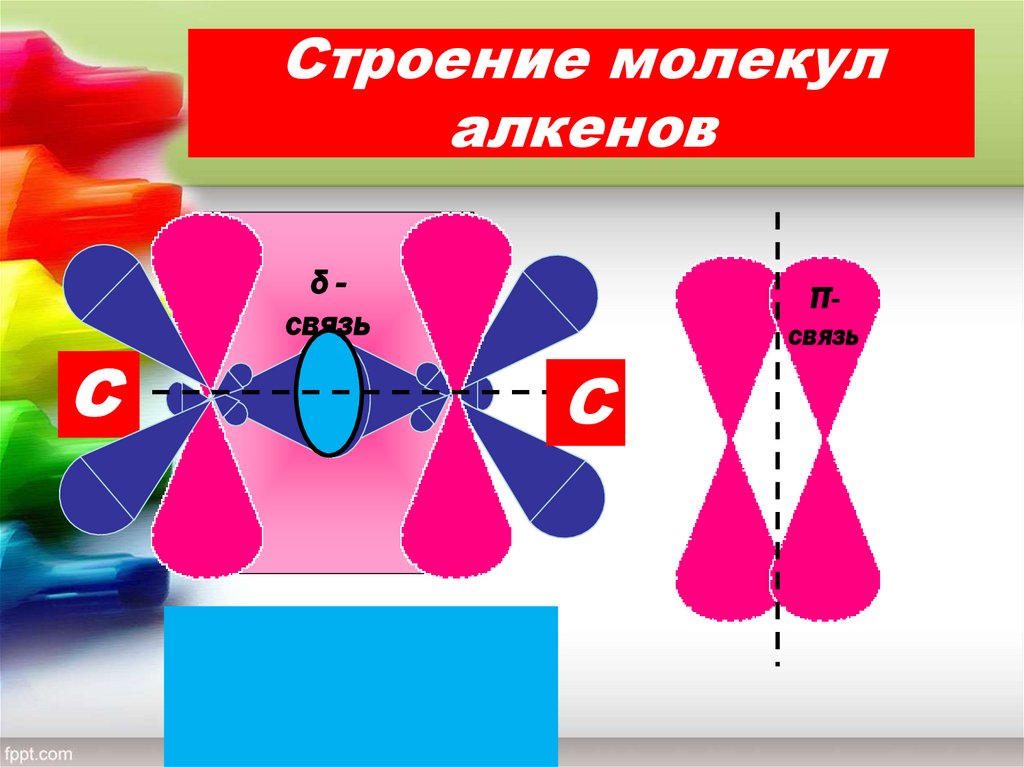
4. Строение молекул алкенов
δсвязьС
πсвязь
С
δ
С=
С
π
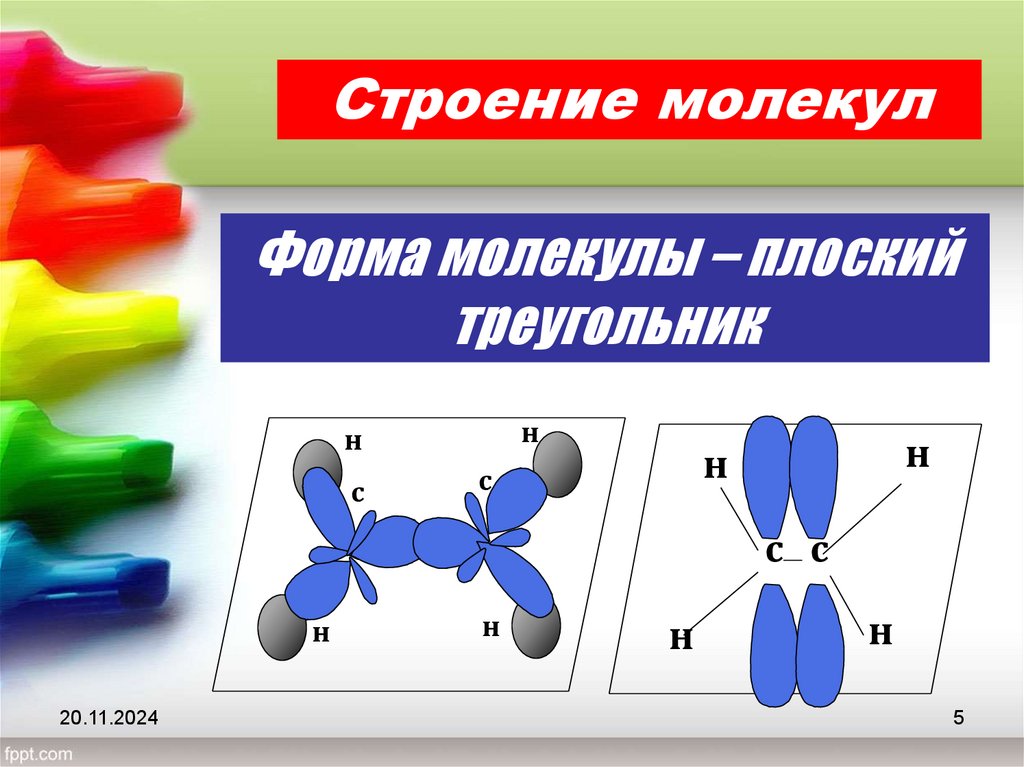
5.
Строение молекулФорма молекулы – плоский
треугольник
н
н
с
н
н
с
с с
н
20.11.2024
н
н
н
5
6. Характеристика двойной связи (С ═ С)
2sp
Вид гибридизации –
Валентный угол – 120 º
0,134 нм
Длина связи С = С –
Строение ─
плоскостное
Вид связи –
ковалентная неполярная
По типу перекрывания –
σиπ
7. Характеристика двойной связи (С ═ С)
π – связь одинаковораспределена над и под
плоскостью молекулы
этилена;
π – связь менее прочная,
чем
σ – связь;
π – связь легче
поляризуется
8. Гомологический ряд алкенов
Общая формулаЭтен
Пропен
Бутен
Пентен
Гексен
Гептен
СnН2n
C2H4
C3H6
C4H8
C5H10
C6H12
C7H14
9. Изомерия алкенов
Для алкенов возможны два типаизомерии:
1-ый тип – структурная изомерия:
1) углеродного скелета
2) положения двойной связи
3) межклассовая
2-ой тип – пространственная изомерия:
геометрическая
10. Номенклатура
Названиеалкенов
по
систематической
номенклатуре образуют из названий аналогично
построенных алканов, заменяя суффиксы –ан на –
ен, цифрой указывается номер того атома углерода,
от которого начинается двойная связь.
Главная цепь атомов углерода должна обязательно
включать двойную связь, и ее нумерацию проводят
с того конца главной цепи, к которому она ближе.
В начале названия перечисляют радикалы с
указанием номеров атомов углерода, с которыми
они связаны. Если в молекуле присутствует
несколько одинаковых радикалов, то цифрой
указывается место каждого из них в главной цепи и
перед их названием ставят соответственно частицы
ди-, три-, тетра- и т.д.
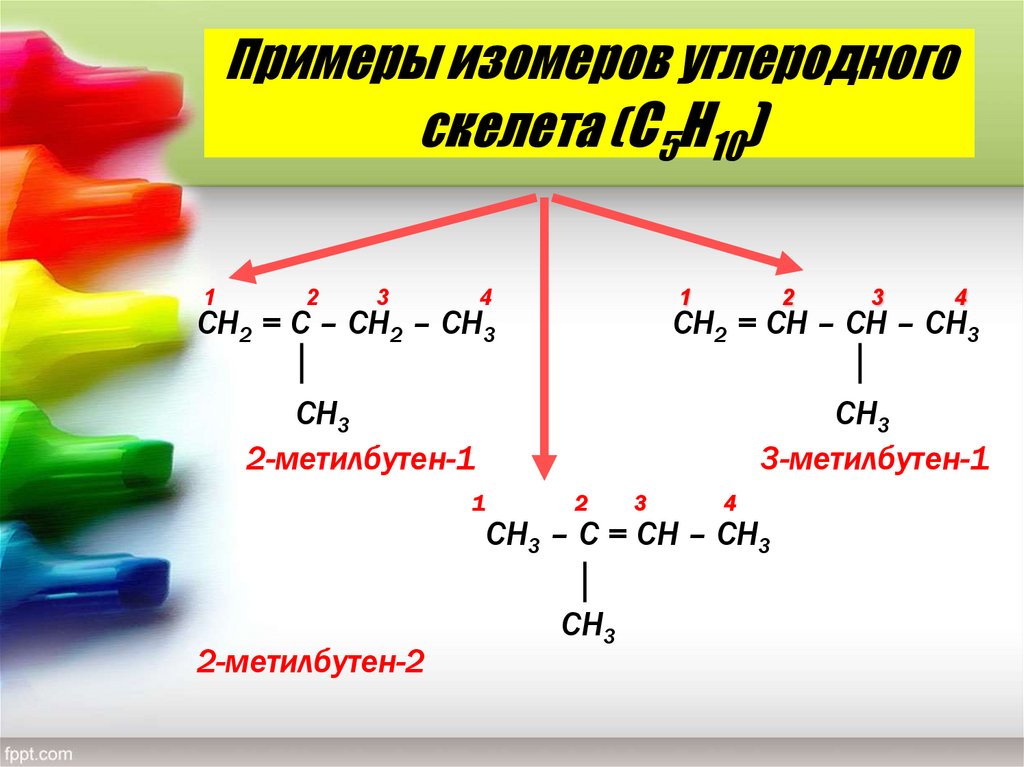
11. Примеры изомеров углеродного скелета (С5Н10)
12
3
4
1
2
3
4
СН2 = С – СН2 – СН3
СН2 = СН – СН – СН3
СН3
2-метилбутен-1
СН3
3-метилбутен-1
1
2
3
4
СН3 – С = СН – СН3
2-метилбутен-2
СН3
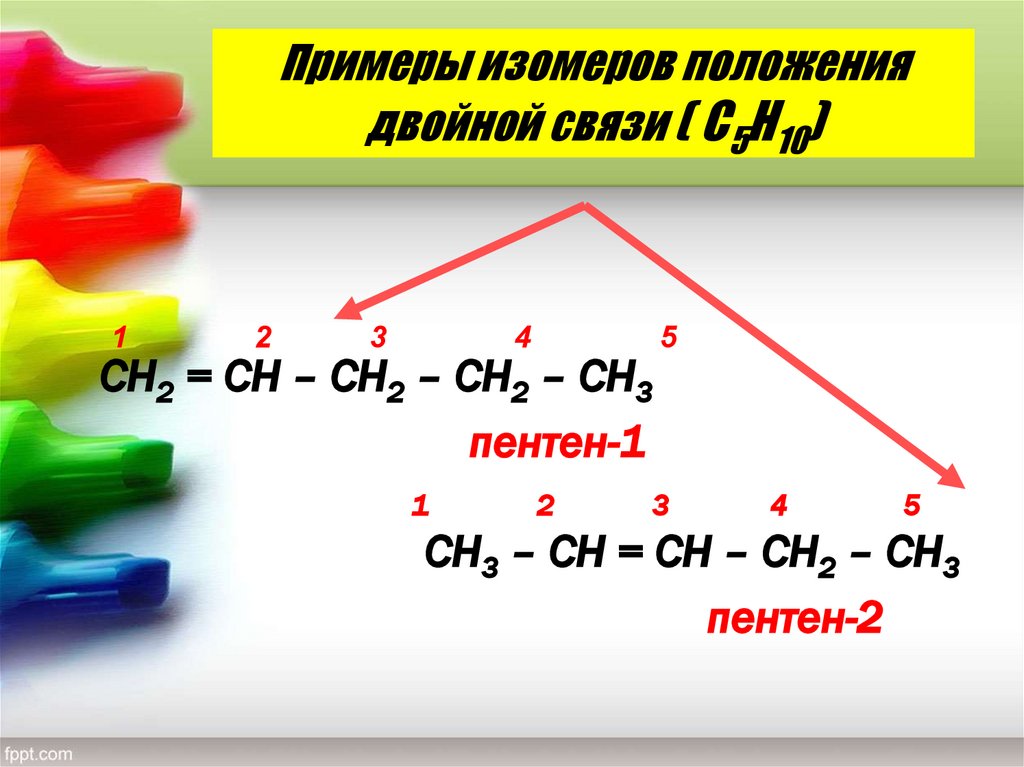
12. Примеры изомеров положения двойной связи ( С5Н10)
12
3
4
СН2 = СН – СН2 – СН2 – СН3
пентен-1
1
2
5
3
4
5
СН3 – СН = СН – СН2 – СН3
пентен-2
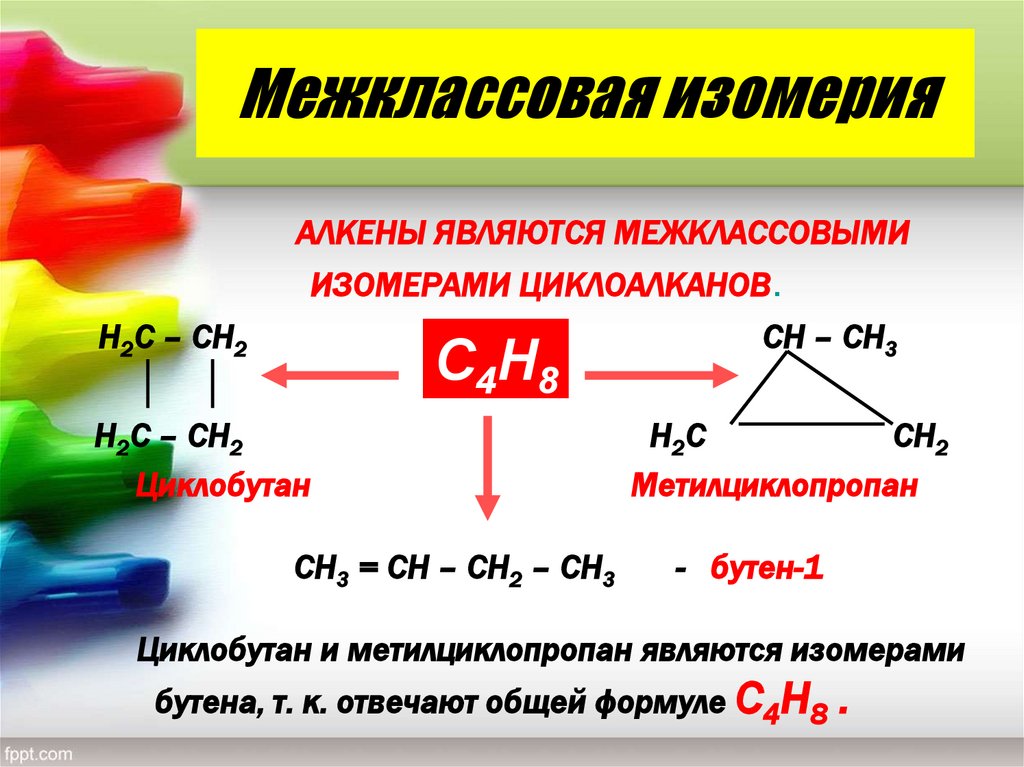
13. Межклассовая изомерия
АЛКЕНЫ ЯВЛЯЮТСЯ МЕЖКЛАССОВЫМИИЗОМЕРАМИ ЦИКЛОАЛКАНОВ.
Н2С – СН2
С4Н8
Н2С – СН2
Циклобутан
СН3 = СН – СН2 – СН3
СН – СН3
Н2 С
СН2
Метилциклопропан
- бутен-1
Циклобутан и метилциклопропан являются изомерами
бутена, т. к. отвечают общей формуле С4Н8 .
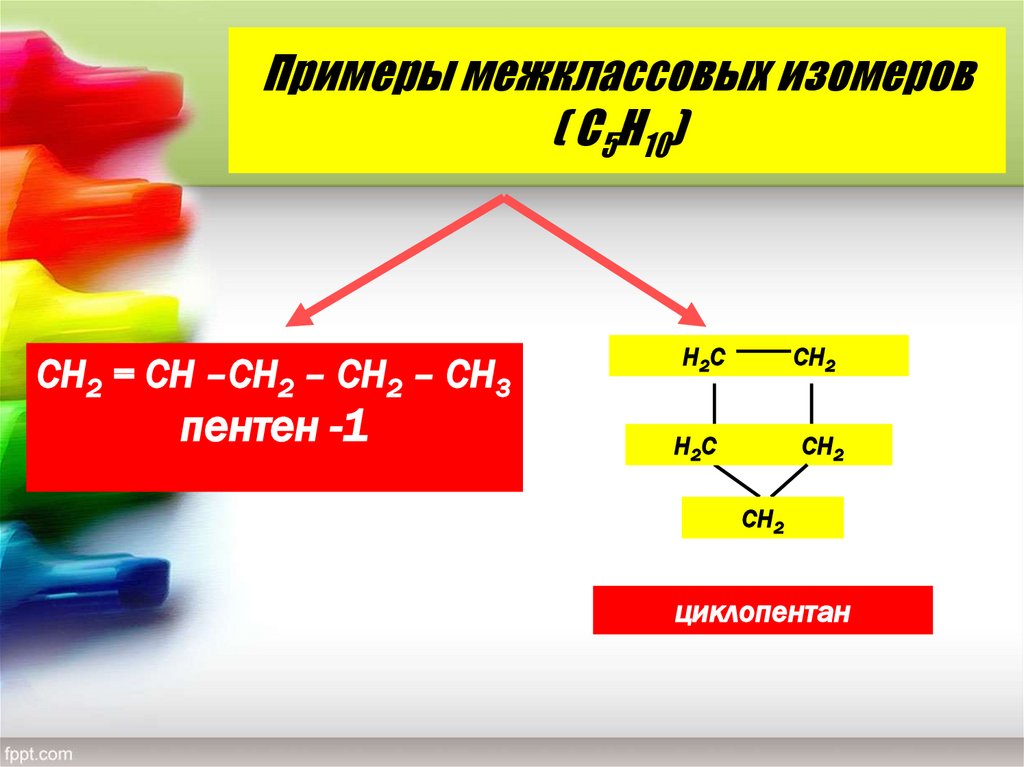
14. Примеры межклассовых изомеров ( С5Н10)
СН2 = СН –СН2 – СН2 – СН3пентен -1
Н2 С
СН2
Н2С
СН2
СН2
циклопентан
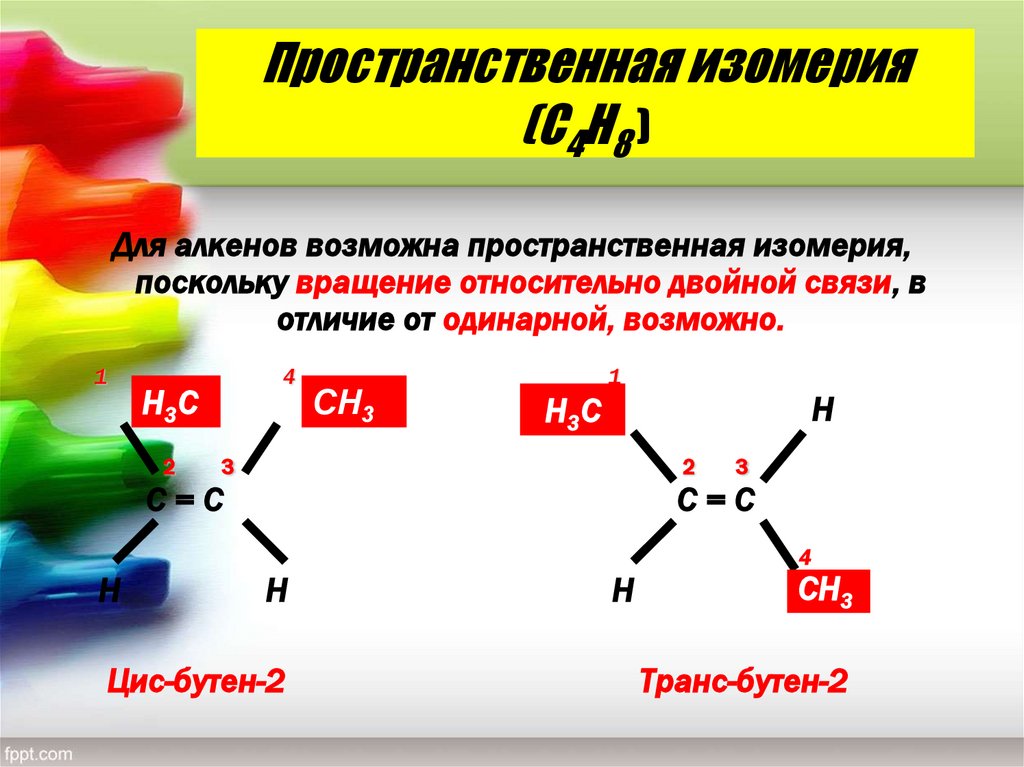
15. Пространственная изомерия (С4Н8 )
Для алкенов возможна пространственная изомерия,поскольку вращение относительно двойной связи, в
отличие от одинарной, возможно.
1
4
Н3 С
2
СН3
1
Н
Н3 С
3
2
С=С
3
С=С
4
Н
Н
Цис-бутен-2
Н
СН3
Транс-бутен-2
16. Физические свойства алкенов
Алкены плохо растворимы в воде, но хорошорастворяются в органических растворителях.
С2– С4 - газы
С5– С16 - жидкости
С17 … - твёрдые вещества
С увеличением молекулярной массы алкенов, в
гомологическом ряду, повышаются
температуры кипения и плавления,
увеличивается плотность веществ.
Алкены имеют молекулярную
кристаллическую решетку
17. Химические свойства алкенов
По химическим свойствам алкенырезко отличаются от алканов. Алкены
более химически активные вещества,
что обусловлено наличием двойной
связи, состоящей из σ- и π-связей.
Алкены способны присоединять два
одновалентных атома или радикала за
счёт разрыва π-связи, как менее
прочной.
18. Типы химических реакций, которые характерны для алкенов
Реакции присоединения.Реакции полимеризации.
Реакции окисления.
19. Реакции присоединения
1. Гидрирование.CН2 = СН2 + Н2
этен
СН3 – СН3
этан
Условия реакции: катализатор – Ni, Pt, Pd
2. Галогенирование.
пропен
CН2 = СН – СН3 + Сl – Сl
1
2
3
СН2 – СН – СН3
Cl
Cl
1,2-дихлорпропан
Реакция идёт при обычных условиях.
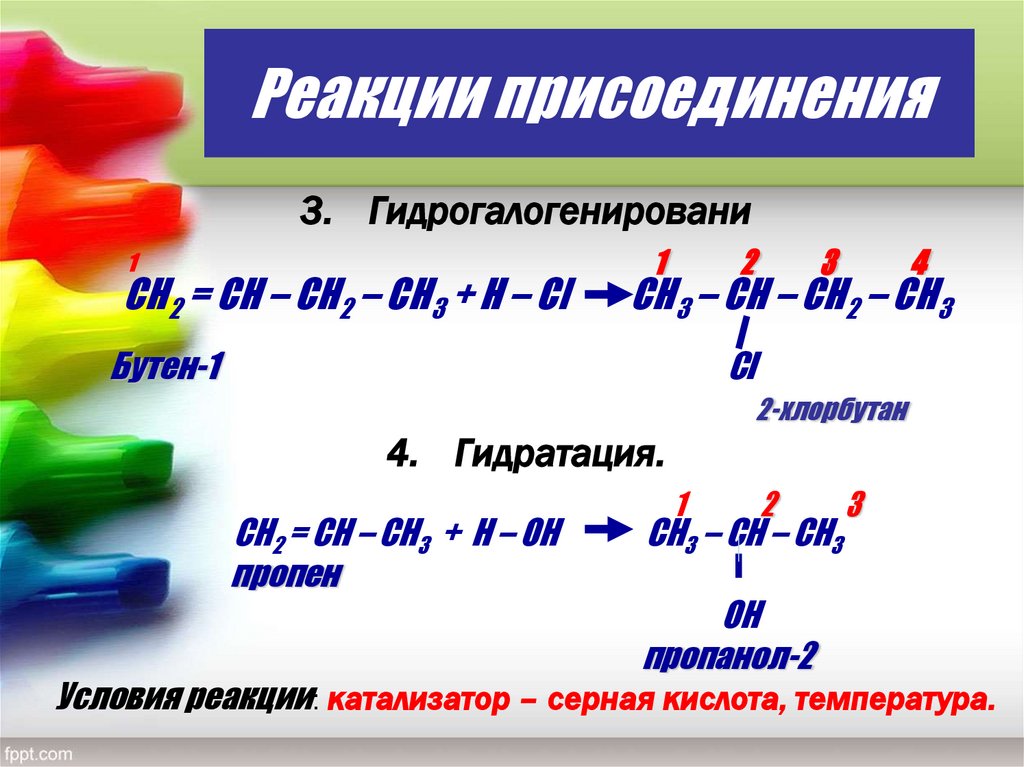
20. Реакции присоединения
3. Гидрогалогенировани1
СН2 = СН – СН2 – СН3 + Н – Сl
1
2
3
4
CН3 – СН – СН2 – СН3
Бутен-1
Cl
2-хлорбутан
4. Гидратация.
CН2 = СН – СН3 + Н – ОН
пропен
1
2
СН3 – СН – СН3
3
ОН
пропанол-2
Условия реакции: катализатор – серная кислота, температура.
21.
Присоединение молекулгалогеноводородов и воды
к молекулам алкенов
происходит в соответствии
с правилом
В.В. Марковникова.
22. Правило В.В. Марковникова
Атом водородаприсоединяется к
наиболее
гидрированному
атому углерода при
двойной связи, а
атом галогена или
гидроксогруппа – к
наименее
гидрированному.
23. Реакции полимеризации (свободно-радикальное присоединение)
Полимеризация – это последовательное соединениеодинаковых молекул в более крупные.
σ
σ
σ
π
π
π
СН2 = СН2 + СН2 = СН2 + СН2 = СН2 + …
σ
σ
σ
– СН2 – СН2 – + – СН2 – СН2 – + – СН2 – СН2 –
… – СН2 – СН2 – СН2 – СН2 – СН2 – СН2 – …
Сокращённо уравнение этой реакции записывается так:
n СН2 = СН2
Этен
Условия реакции:
(– СН2 – СН2 –)n
полиэтилен
повышенная температура, давление, катализатор.
24. Реакции окисления
Реакция Вагнера. (Мягкоеокисление раствором
перманганата калия).
3СН2 = СН2 + 2КМnО4 + 4Н2О
этен
3СН2 - СН2 + 2МnО2 + 2КОН
ОН
ОН
этандиол
С2Н4 + (О) + Н2О
С2Н4(ОН)2
25. Реакции окисления
3. Каталитическое окисление.а) 2СН2 = СН2 + О2
2СН3 – CОН
этен
уксусный альдегид
Условия реакции: катализатор – влажная смесь двух солей
PdCl2 и CuCl2.
б) 2СН2 = СН2 + О2
этен
2СН2
СН2
О
оксид этилена
Условия реакции: катализатор – Ag, t = 150-350ºС
26. Горение алкенов
Алкены горят красноватым светящимсяпламенем, в то время как пламя предельных
углеводородов голубое. Массовая доля углерода в
алкенах несколько выше, чем в алканах с тем же
числом атомов углерода.
С4Н8 + 8О2
бутен
4СО2 + 4H2O
При недостатке кислорода
С4Н8 + 6О2
бутен
4СО + 4Н2О
27. Качественные реакции на двойную углерод-углеродную связь
Обесцвечивание бромной воды.СН2 = СН – СН3 + Вr2
пропен
CH2Br – CHBr – CH3
1,2-дибромпропан
Обесцвечивание раствора перманганата
калия.
3СН2 = СН – СН3 + 2КМnО4 + 4Н2О
пропен
1
2
3
3СН2ОН – СНОН – СН3 + 2МnО2 + 2КОН
пропандиол-1,2
28. ВЫВОД:
Гидрирование алкенов является реакциейобратимой дегидрированию алканов
СnH2n + H2 ↔ CnH2n+2
Гидрирование процесс экзотермический
(200 0C) ,
Дегидрирование процесс
эндотермический (400-600 0C) .
29.
При получении алкенов необходимоучитывать правило А.М. Зайцева:
При отщеплении
галогеноводорода или воды от
вторичных и третичных
галогеналканов или спиртов
атом водорода отщепляется от
наименее гидрированного атома
углерода.
30. Лабораторные способы получения алкенов
1) Дегидрогалогенирование галогеналкенов.Н3С ─ СН2─ СНСl ─ СН3 + КОН Н3С ─ СН ═ СН ─ СН3 + КСl + Н2О
2-хлорбутан
бутен-2
Условия реакции: нагревание.
2) Дегидратация спиртов.
Н3С ─ СН2 ─ ОН Н2С ═ СН2 + Н2О
этанол
этен
Условия реакции: катализатор – Н2SO4(конц.), t = 180ºС.
3) Дегалогенирование дигалогеналканов
Н3С ─ СНCl ─ СН2Сl + Мg Н3С─СН ═ СН2 + MgCl2
1,2-дихлорпрпан
пропен
31. Промышленные способы получения алкенов
1. Крекинг алканов.С10Н20
Декан
С5Н12 + С5Н8
пентан пентен
Условия реакции: температура и катализатор.
2. Дегидрирование алканов.
СН3 – СН2 – СН3
СН2 ═ СН – СН3 + Н
пропан
пропен
Условия реакции: t = 400-600ºС и катализатор
(Ni, Pt, Al2O3 или Cr2O3).
3) Гидрирование алкинов.
CН ≡ СН + Н2
этин
СН2 ═ СН2
этен
Условия реакции: катализатор – Pt, Pd, Ni.
32. ПРИМЕНЕНИЕ ЭТИЛЕНА
СвойствоПрименение
Полимеризация
Производство
полиэтилена,
пластмасс
Галогенирование
Получение
растворителей
Гидрогалогени
рование
Для местная анестезия,
получения растворителей,
в с/х для
обеззараживания
зернохранилищ
Пример
33.
СвойствоГидратация
Применение
Получение этилового спирта,
используемого как
растворитель, анти-септик в
медицине , в производстве
синтетического каучука
Окисление
раствором
KMnO4
Получение антифризов,
тормозных жидкостей, в
производстве пластмасс
Особое
свойство
этилена:
Этилен ускоряет созревание
плодов
Пример

























 Химия
Химия








