Похожие презентации:
Коррозия металлов
1.
2.
3.
Коррозия – называютсамопроизвольный
процесс разрушения
материалов и изделий из
них под химическим
воздействием
окружающей среды.
4.
Виды коррозии металлов:1. Химическая коррозия
2. Электрохимическая
коррозия
5.
Химическая коррозия.• разрушение металла при взаимодействии
его с сухими газами, в полном отсутствии
влаги.
• При взаимодействии меди с кислородом
идет реакция:
2Cu + O2 → 2CuO
Cu0 – 2e → Cu2+ | 2| - восстановитель,
процесс окисления
O20 + 4e → 2O2- | 1| - окислитель, процесс
восстановления.
6.
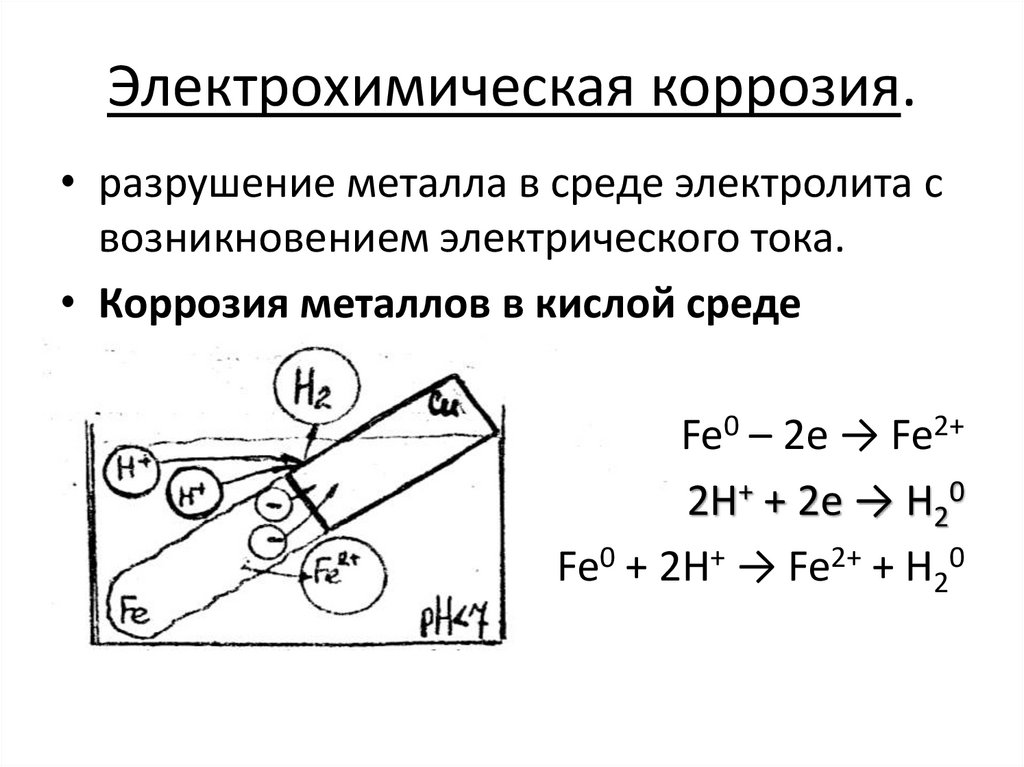
Электрохимическая коррозия.• разрушение металла в среде электролита с
возникновением электрического тока.
• Коррозия металлов в кислой среде
Fe0 – 2e → Fe2+
2H+ + 2e → H20
Fe0 + 2H+ → Fe2+ + H20
7.
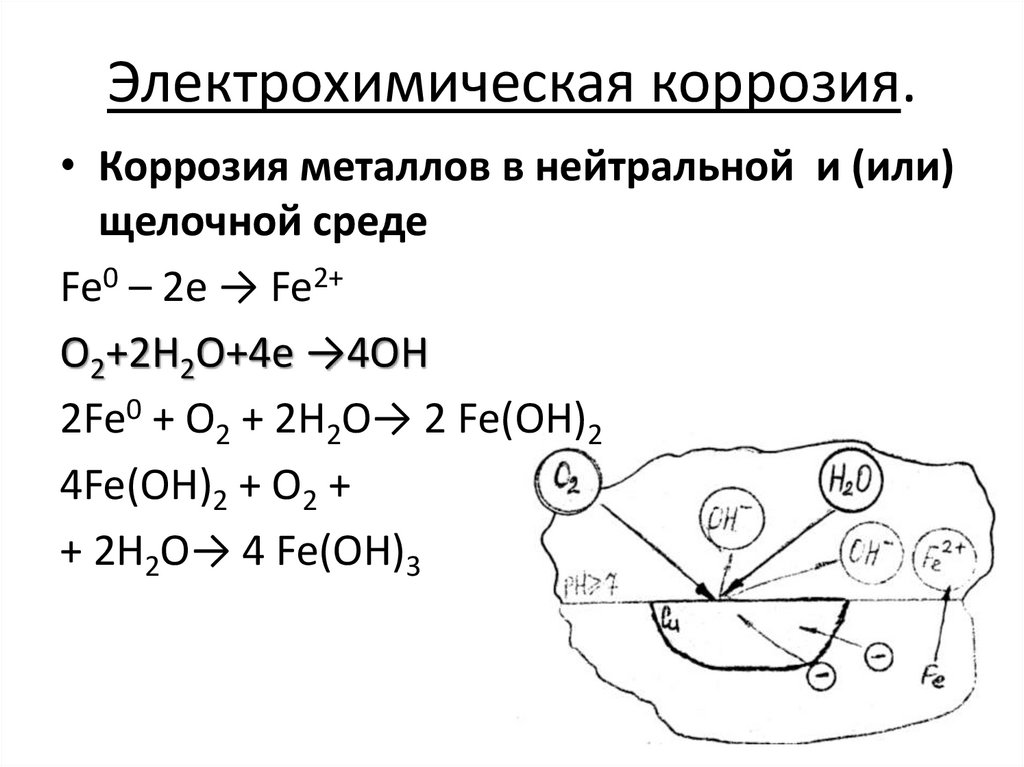
Электрохимическая коррозия.• Коррозия металлов в нейтральной и (или)
щелочной среде
Fe0 – 2e → Fe2+
O2+2H2O+4e →4OH
2Fe0 + O2 + 2H2O→ 2 Fe(OH)2
4Fe(OH)2 + O2 +
+ 2H2O→ 4 Fe(OH)3
8.
Способы защиты от коррозии:• Неметаллическое покрытие (лаки, масла, краски
и т.д.). Эти вещества изолируют металл от
внешней среды.
• Металлическое покрытие – некорродирующими
металлами (Zn, Cr, Ag, Ni, Sn и т.д.)
• Нержавеющие стали (введение легирующих
металлов: Cr, Ni, Co, Cu и т.д.)
• Введение ингибитора. Ингибитор – это
вещество, способное в малых количествах
замедлять протекание химических процессов
или останавливать их.
9.
Способы защиты от коррозии:• Протекторная. Более активный металл, стоящий
левее в ряду электрохимического напряжения
металлов – легко разрушается. Протекторная
защита применяется в тех случаях, когда
защищается конструкция (подземный
трубопровод, корпус корабля), находящаяся в
среде электролита (морская вода, подземные
почвенные воды и т.д.).
10.
Проверка знаний:• На стальной крышке поставлена медная
заклепка. Что разрушится раньше – крышка
или заклепка? Почему?
• Почему луженный (покрытый оловом)
железный бак на месте повреждения
защитного слоя быстро разрушается?
• Почему на оцинкованном баке, на месте
царапины, цинк разрушается, а железо не
ржавеет?








 Химия
Химия








