Похожие презентации:
Оксиды, их классификация и свойства
1.
Оксиды, ихклассификация
и свойства
2.
Оксиды - сложныевещества, состоящие
из двух элементов,
один из которых
кислород в степени
окисления -2
3.
Выпишите формулы оксидов. Определитестепени окисления элементов в оксидах.
• K2O
• BaCL2
• SO3
• MgO
• Ba3N2
• CuS
CO2
• P2O5
• NaCL
• СО
4.
Классификация оксидовнесолеобазующие солеобразующие
СО, NO, N2O
1.Основные СаО, Na2O
2. Кислотные SO3, P2O5
3. Амфотерные Al2O3, ZnO
5.
Получение оксидов1способ: окисление металлов
при нагревании кислородом
воздуха:
2Mg + О2 → 2МgО
2Сu + О2 → 2СuО
6.
2 способ:окисление неметаллов
t
C O2 CO2
7.
3 способ: разложение кислотt C
H 2 SO3 SO2 H 2O
4 способ: разложение солей
t C
CaCO3 CaO CO2
8.
5 способ: разложениенерастворимых оснований
t C
Fe(OH ) 2 FeO H 2O
9.
6 способ: вытеснение из солейдругими оксидами
t C
Na2CO3 SiO2 Na2 SiO3 CO2
7 способ: горение сложных веществ
t C
C2 H 5OH 3O2 2CO2 3H 2O Q
10.
Химические свойстваосновных оксидов
1.Основный оксид + вода → щелочь
Na2O + H2O→NaOH
2. Основный оксид + кислотный оксид→
соль
Na2O + SO3→ Na2SO4
11.
Химические свойстваосновных оксидов
3. Основный оксид + кислота → соль + вода
Na2O + Н2SO4→ Na2SO4 +Н2О
12.
Химические свойствакислотных оксидов
1.Кислотный оксид + вода → кислота
SO3 + H2O→ Н2SO4
2. Кислотный оксид + основный оксид→
соль
SO3 + СaO→ СaSO4
13.
Химические свойствакислотных оксидов
3. Кислотный оксид + основание → кислота
SO3 + NaOН→Na2SO4+Н2О
14.
Закончите уравненияхимических реакций, дайте
название веществам:
а) P + O2 →
б) Al + O2 →
в) H2SO4 + Fe2O3 →
г) BaO + HCl →
д) C2H4 + O2 →





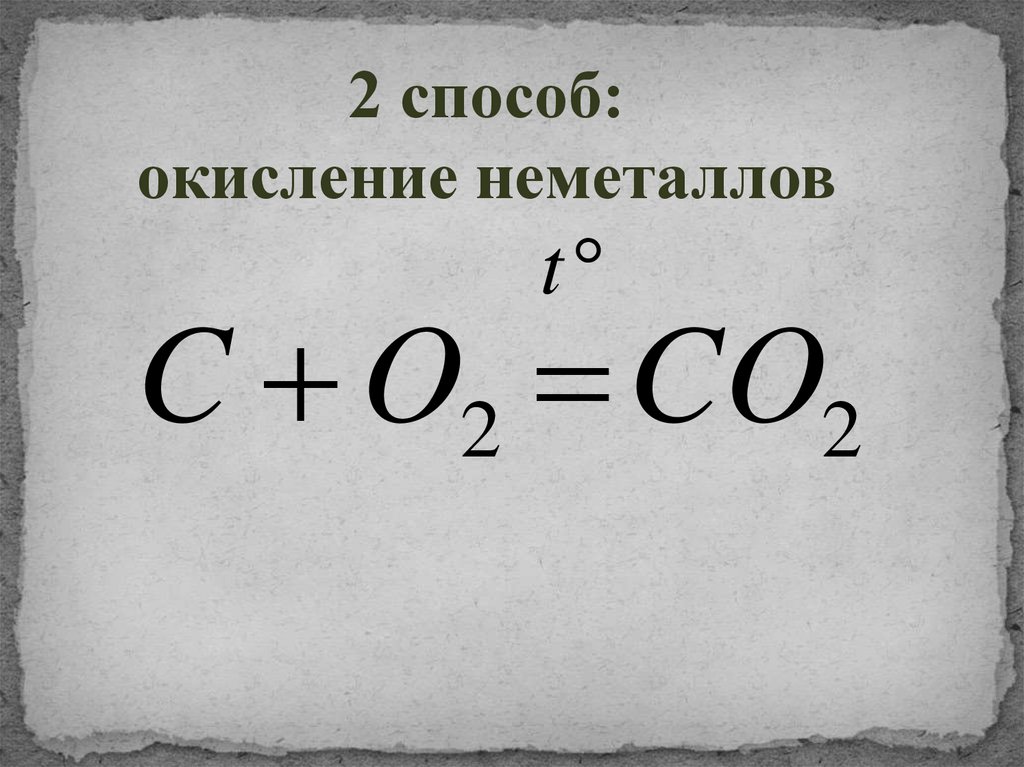
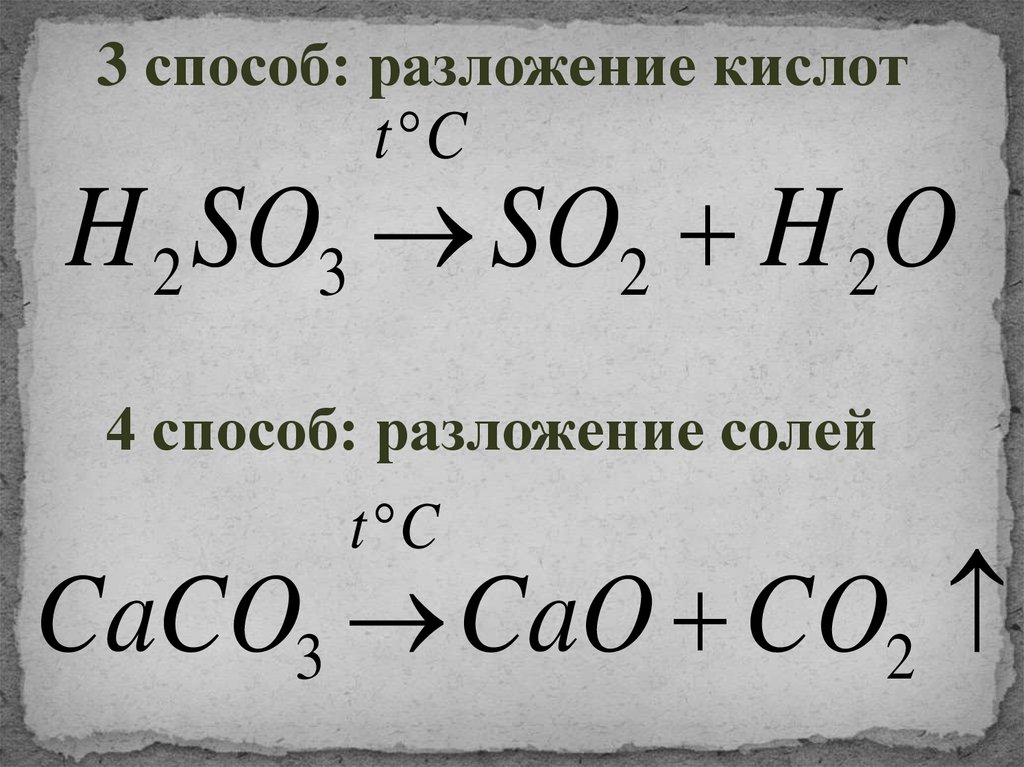







 Химия
Химия








