Похожие презентации:
Оксиды. Классификация, химические и физические свойства. Определение групп оксидов. Получение оксидов
1.
( 8 класс)2. Что такое оксиды?
Оксиды – это сложные вещества, состоящиеиз двух химических элементов, один из
которых кислород в степени окисления -2.
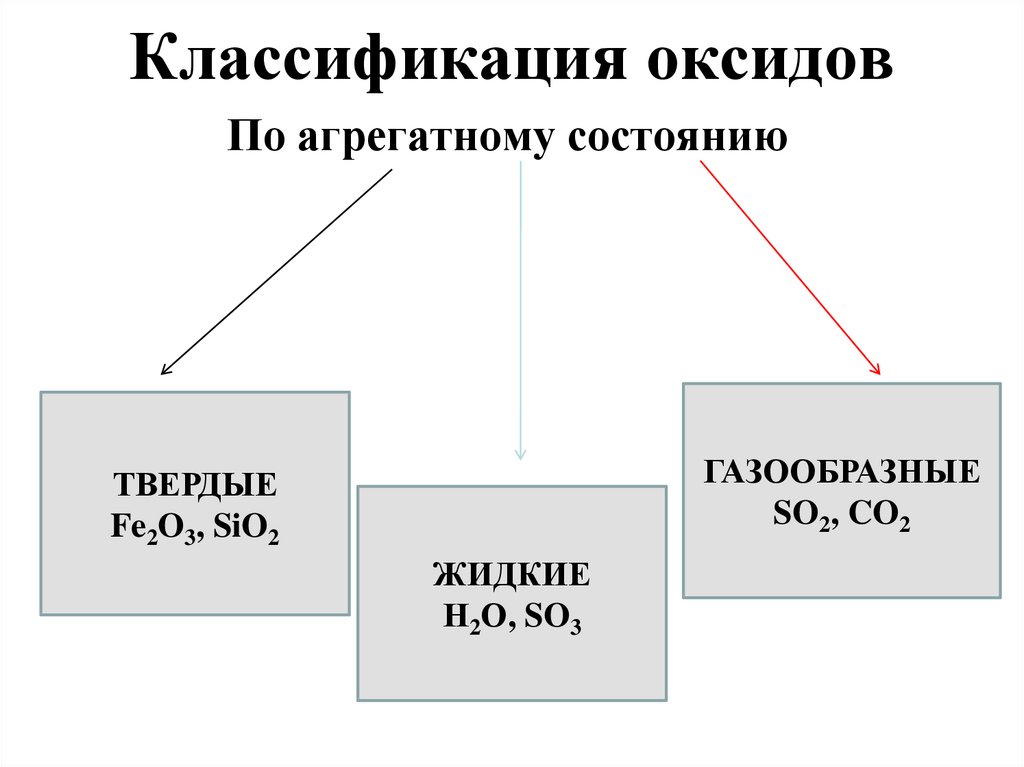
3. Классификация оксидов
По агрегатному состояниюГАЗООБРАЗНЫЕ
SO2, CO2
ТВЕРДЫЕ
Fe2O3, SiO2
ЖИДКИЕ
Н2О, SO3
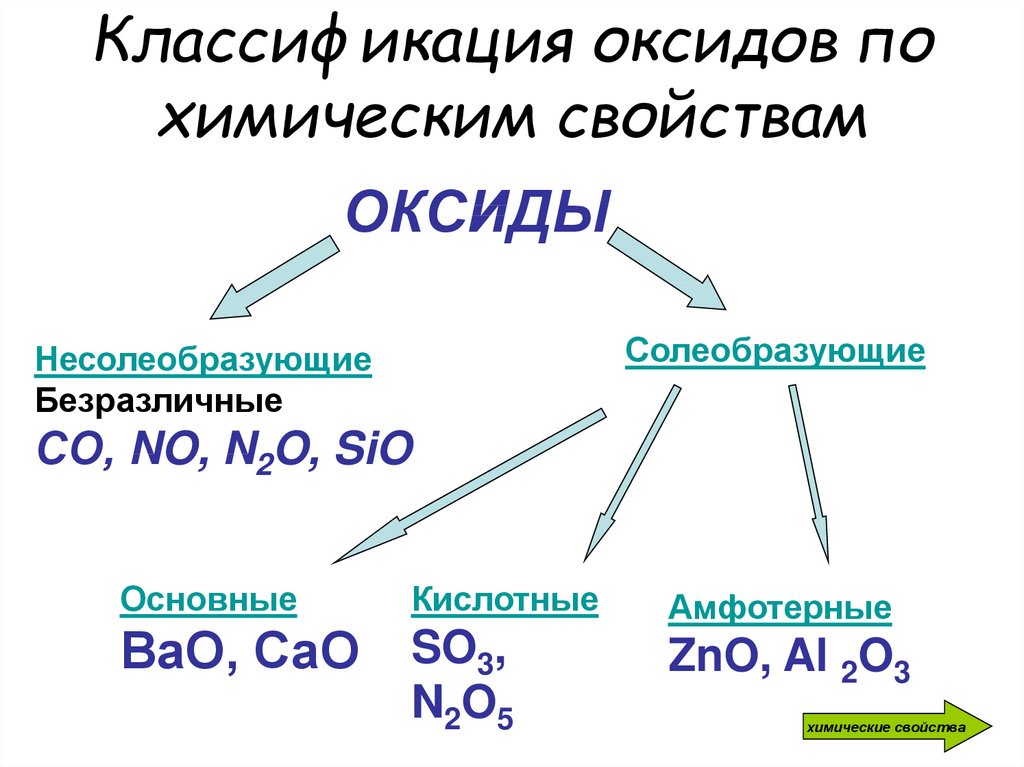
4. Классификация оксидов по химическим свойствам
ОКСИДЫСолеобразующие
Несолеобразующие
Безразличные
СО, NO, N2O, SiO
Основные
Кислотные
ВаО, СаО SO3,
N 2O 5
Амфотерные
ZnO, Al 2O3
химические свойства
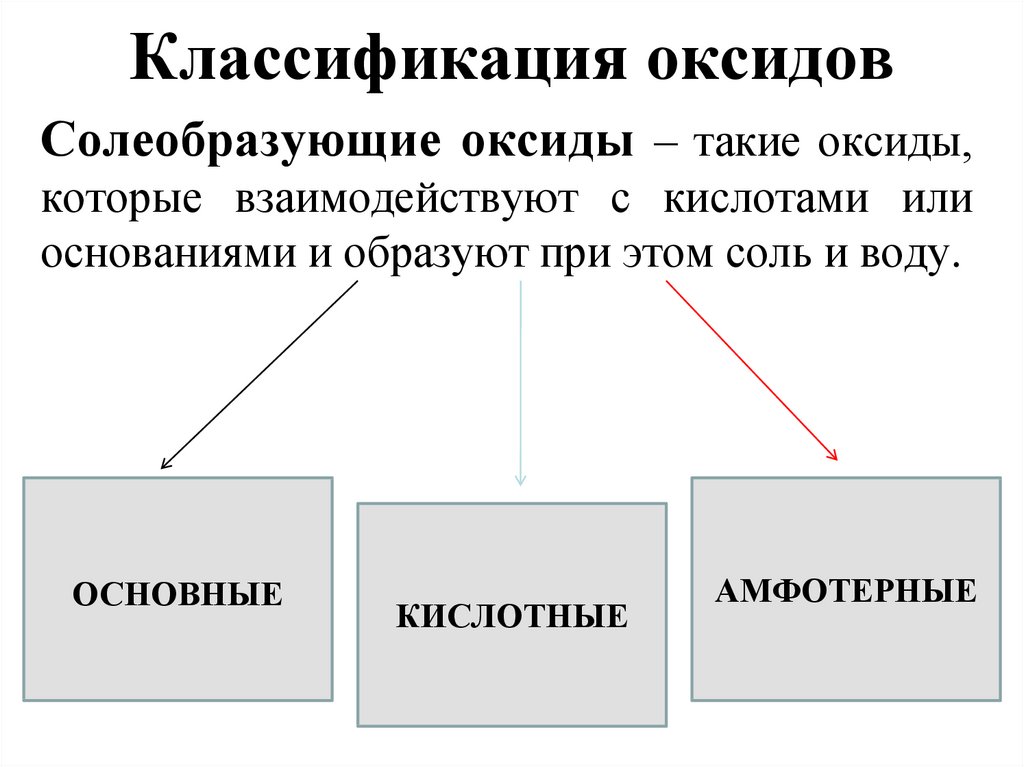
5. Классификация оксидов
Несолеобразующие оксиды – такие оксиды,которые не взаимодействуют ни с кислотами,
ни с щелочами и не образуют солей.
Например:
oксиды азота (I), (II) и (IV) - N2O, NO, NO2
oксид углерода (II) – СО
oксид кремния (II) - SiO
6. Классификация оксидов
Солеобразующие оксиды – такие оксиды,которые взаимодействуют с кислотами или
основаниями и образуют при этом соль и воду.
ОСНОВНЫЕ
КИСЛОТНЫЕ
АМФОТЕРНЫЕ
7. ОПРЕДЕЛЕНИЕ ГРУПП ОКСИДОВ
• Основными называются оксиды, которыеобразуют соли при взаимодействии с
кислотами или кислотными оксидами.
• Кислотными называются оксиды, которые
образуют соли при взаимодействии с
основаниями или основными оксидами.
• Амфотерными оксидами, называют
оксиды которые проявляют свойства как
кислот, так и оснований.
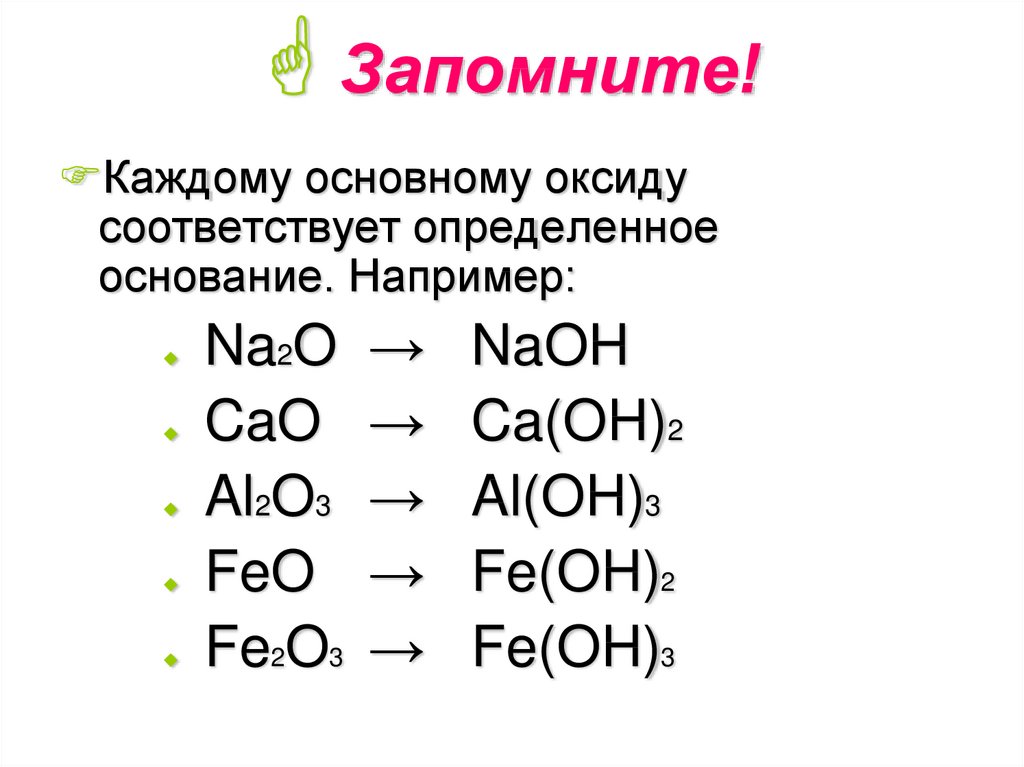
8. Запомните!
Каждому основному оксидусоответствует определенное
основание. Например:
Na2O
CaO
Al2O3
FeO
Fe2O3
→
→
→
→
→
NaOH
Ca(OH)2
Al(OH)3
Fe(OH)2
Fe(OH)3
9. Запомните!
Каждому кислотному оксидусоответствует определенная кислота.
Например:
СО2
SО2
SО3
N2О5
P2О5
→
→
→
→
→
Н2СО3
H2SО3
Н2SО4
HNO3
H3PO4
10. Типичные реакции основных оксидов
1) Основной оксид + кислота = соль + вода2) Основной оксид + кислотный оксид = соль
3) Основной оксид + вода = щелочь
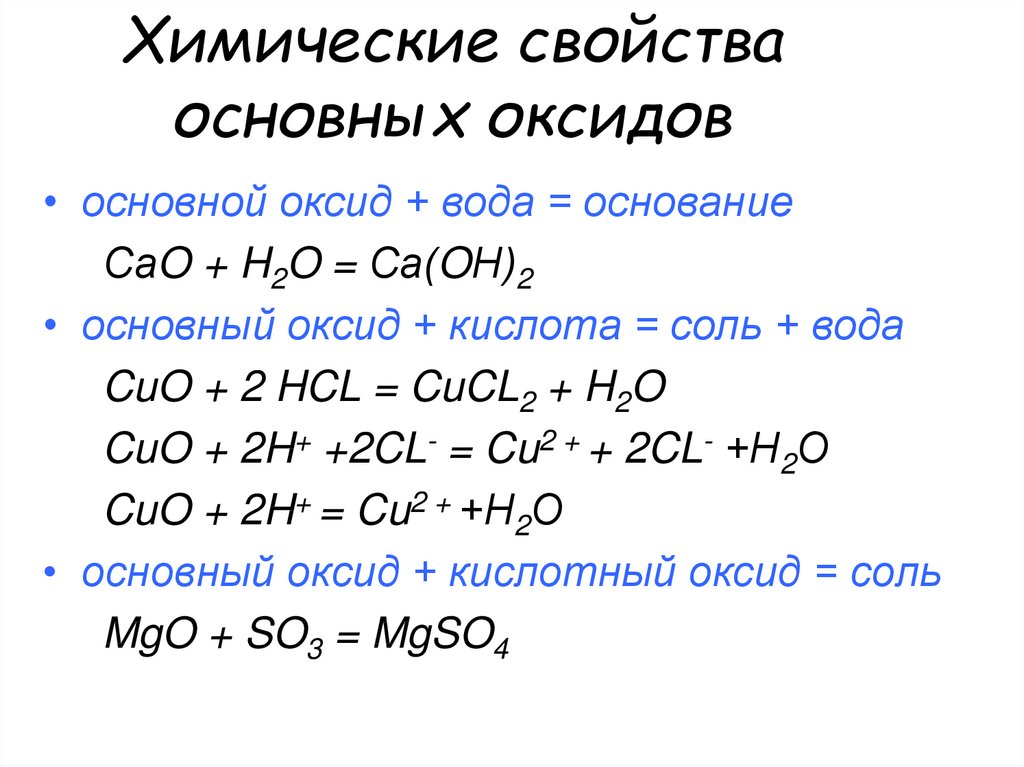
11. Химические свойства основных оксидов
• основной оксид + вода = основаниеСаO + H2O = Са(OН)2
• основный оксид + кислота = соль + вода
CuO + 2 HCL = CuCL2 + H2O
CuO + 2H+ +2CL- = Cu2 + + 2CL- +Н2О
CuO + 2H+ = Cu2 + +Н2О
• основный оксид + кислотный оксид = соль
MgO + SO3 = MgSO4
12. Типичные реакции кислотных оксидов
1) Кислотный оксид + основание = соль + вода2) Кислотный оксид + основной оксид = соль
3) Кислотный оксид + вода = кислота
13. Химические свойства кислотных оксидов
• кислотный оксид + вода = кислотаР2O5 + 3H2O = 2H3РO4
• кислотный оксид + основание = соль +
вода
CO2 + Mg(OН)2= MgCO3 + H2O
CO2 + Mg+ +2OН- = MgCO3 + Н2О
• кислотный оксид + основный оксид = соль
SO3 + MgO = MgSO4
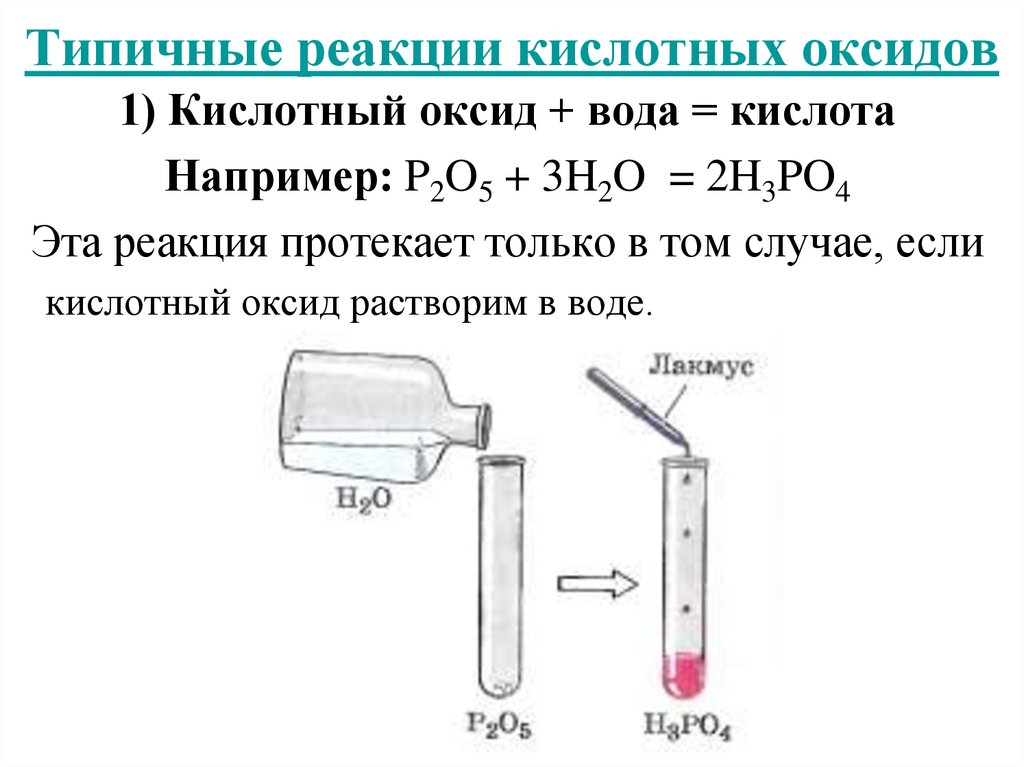
14. Типичные реакции кислотных оксидов
1) Кислотный оксид + вода = кислотаНапример: P2O5 + 3H2O = 2H3PO4
Эта реакция протекает только в том случае, если
кислотный оксид растворим в воде.
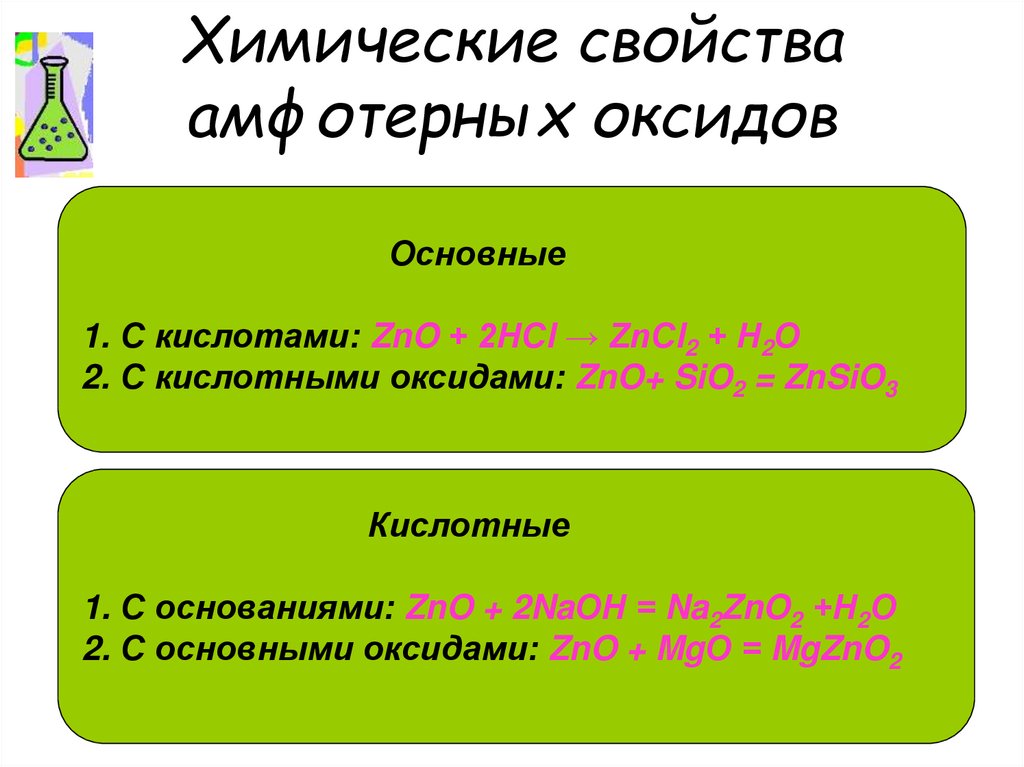
15. Химические свойства амфотерных оксидов
Основные1. С кислотами: ZnO + 2НСl → ZnСl2 + Н2О
2. С кислотными оксидами: ZnO+ SiO2 = ZnSiO3
Кислотные
1. С основаниями: ZnO + 2NaОН = Na2ZnO2 +Н2О
2. С основными оксидами: ZnO + MgО = MgZnO2
16. Получение оксидов
17.
• 1 способ: окисление металловt
2Cu O2 2CuO
где CuO – оксид меди (II)
18.
• 2 способ: окисление неметалловt
C O2 CO2
где CO2 – оксид углерода (IV)
19.
• 3 способ: разложение кислотt C
H 2 SO3 SO2 H 2 O
где H SO - сернистая кислота,
2
3
SO2 – оксид серы (IV)
20.
• 4 способ: разложение солейt C
CaCO3 CaO CO2
где CaCO - карбонат кальция
3
CаO – оксид кальция (II)
21.
• 5 способ: разложение нерастворимыхоснований
t C
Fe(OH ) 2 FeO H 2 O
где Fe(OH ) - гидроксид железа (II),
2
FeO – оксид железа (II)
22.
• 6 способ: вытеснение из солей другимиоксидами
t C
Na2 CO3 SiO 2 Na2 SiO3 CO2
где Na CO - карбонат натрия,
SiO2 – оксид кремния (IV),
Na2SiO3 - силикат натрия
2
3
23.
• 7 способ: горение сложных веществt C
C 2 H 5 OH 3O2 2CO2 3H 2 O Q
где C H OH - этанол (этиловый
2 5
спирт),
СO2 – оксид углерода (IV)
24. Обобщение темы:
Тест: «Правильный ответ»1) Какой из оксидов несолеобразующий:
а) P2O5
б) NO
в) SO3
г) CaO
2) Какой из предложенных оксидов кислотный:
а) K2O
б) MgO
в) CO2
г) Na2O
3) Какой класс соединений образуется при
взаимодействии кислотного оксида с водой:
а) кислота б) основание
в) соль
г) соль и основание
25. Наша лаборатория получила заказ на получение оксидов из следующих веществ:
а) серы; б) фосфора; в)магния; г) железа.Запишите уравнения реакций получения этих оксидов.
Дайте названия полученным веществам.
Как называется тип
протекающих химических
реакций?
Дайте определение реакции
горения.
26.
Был найден лист ок, но записи на немчаст ично исчезли, необходимо восст ановит ь
их.
• C + ? = CO
• ? + O2 =BaO
• Al + O2 = ?
Na + ? =Na2O
SO2 + ? = SO3
? + O2 = CaO
Дайт е названия полученным вещест вам.
27. В нашу лабораторию пришло ещё одно письмо:
Здравствуйте, здравствуйте!Не могли бы вы мне ответить на
такой вопрос: почему алюминиевая
посуда служит долго и не ржавеет?
Правда ли, что при
соприкосновении с кислородом
воздуха на её поверхности
образуется оксидная плёнка,
которая защищает металл от
дальнейшего разрушения? Сам я
плохо знаю химию и не могу
написать уравнение реакции.
Помогите разобраться!
С уважением Иванов.
28. Самостоятельная работа
Напишите уравнения реакций химическихсвойств следующих оксидов:
1 вариант
a) SO2
б) Na2O
2 вариант
a) MgO
б) CO2
29. Домашнее задание:
§ 41(белый учебник)§ 40 (зеленый)
выполнить задания






















 Химия
Химия








