Похожие презентации:
Щелочные металлы
1.
2.
I A группа – щелочные металлыЭлектронное
строение
На внешнем
энергетическом уровне – nS1
Атомы щелочных металлов
имеют низкие Еион. и легко
2
1
1S 2S
превращаются в ион Ме+:
2P6 3S1 Ме0 – ē → Ме+
1S2 3S
[Ne]
В – ль
Степени окисления:
Ме0
Простое
вещество
Ме+
В соединениях: Ме2О
МеОН
МеАn
(An- - кислотный
остаток)
3.
Физические свойства:4.
Физические свойства:5.
Физические свойства:6.
Получение:Электролизом расплавов солей или щелочей
КCl
2KCl
Электролиз
К + Cl2
→ 2К + Cl2
Эл-з
Электролиз
Эл-з
КОН
4KОН → 4К
2↑+
2О
+КО+2↑О+
2НН2О
7.
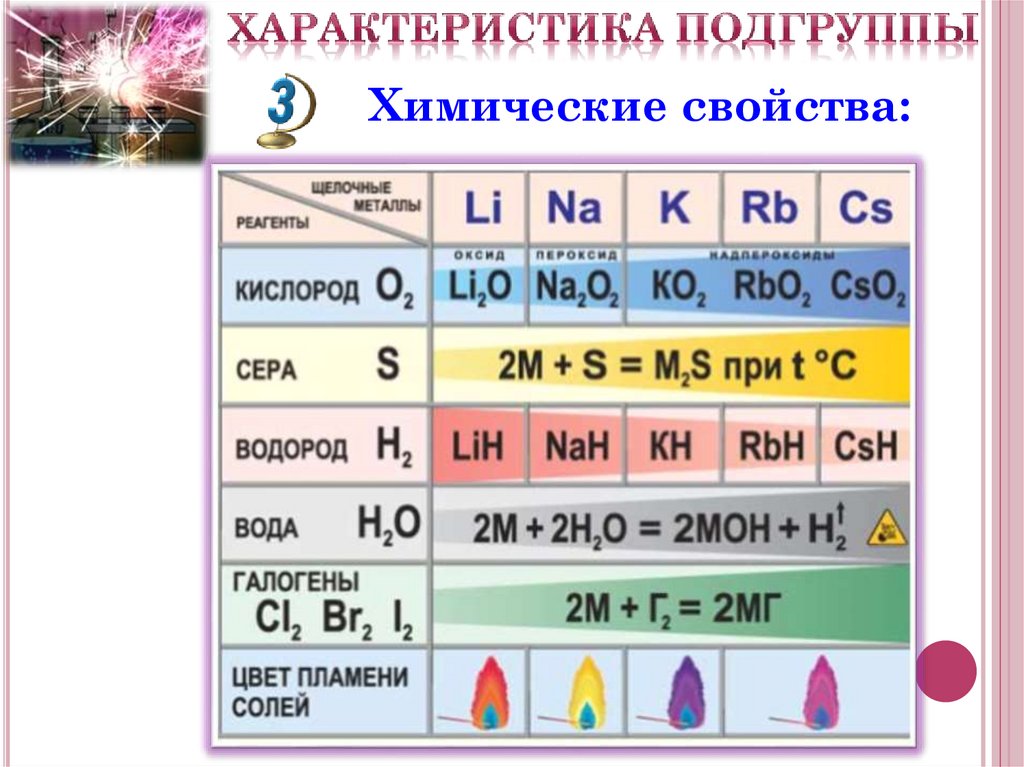
Химические свойства:Ме0 – ē →Ме+
восстановитель
I. Взаимодействие с простыми веществами:
Наl2 → 2MeHal
+ О2 → Mе2О
+ S → Mе2S
(галогениды )
+ N2 → Mе3N при t0
+ Р → Mе3Р
+ С → Mе4С
+ Н2 → 2MeH
кроме Li (нитриды)
(фосфиды)
(карбиды)
(гидриды)
(сульфиды)
8.
Химические свойства:Ii. Взаимодействие со сложными
веществами:
Н2О → MeОH + Н2↑
НAn → MeAn + Н2↑
9.
Химические свойства:Ii. Взаимодействие со сложными
веществами:
Н2О → MeОH + Н2↑
НAn → MeAn + Н2↑















 Химия
Химия








