Похожие презентации:
Щелочные металлы
1.
2.
Щелочные металлы3.
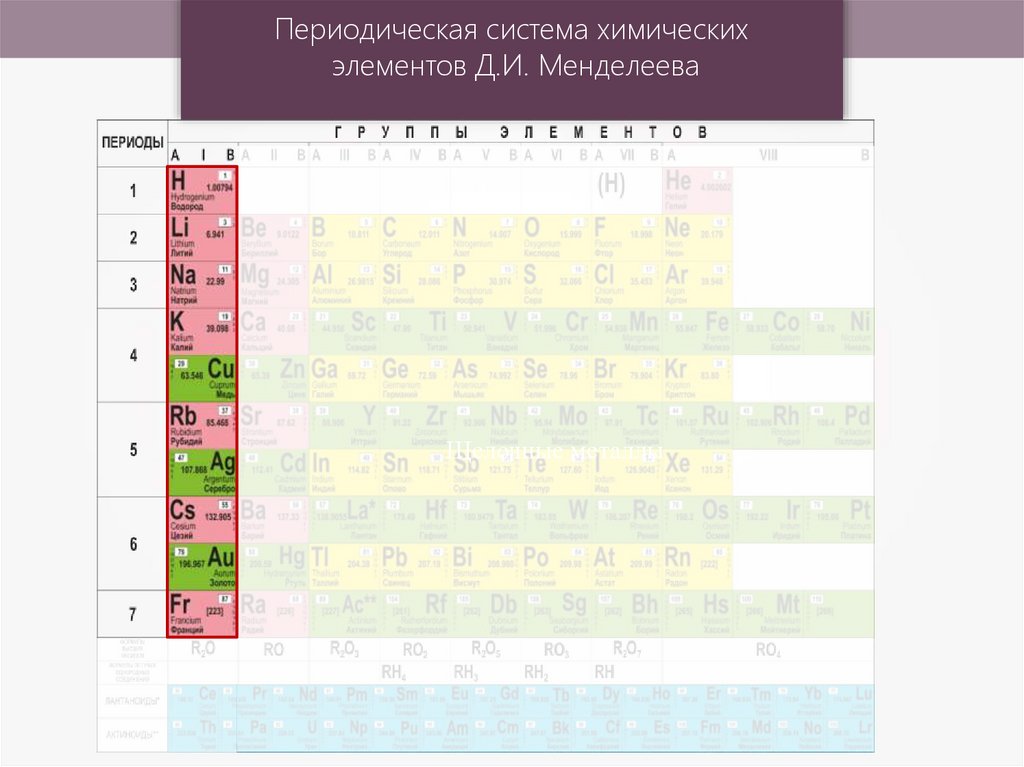
Периодическая система химическихэлементов Д.И. Менделеева
Щелочные металлы
4.
Щелочные металлыЛитий
Натрий
Фрайций
История
открытия
Калий
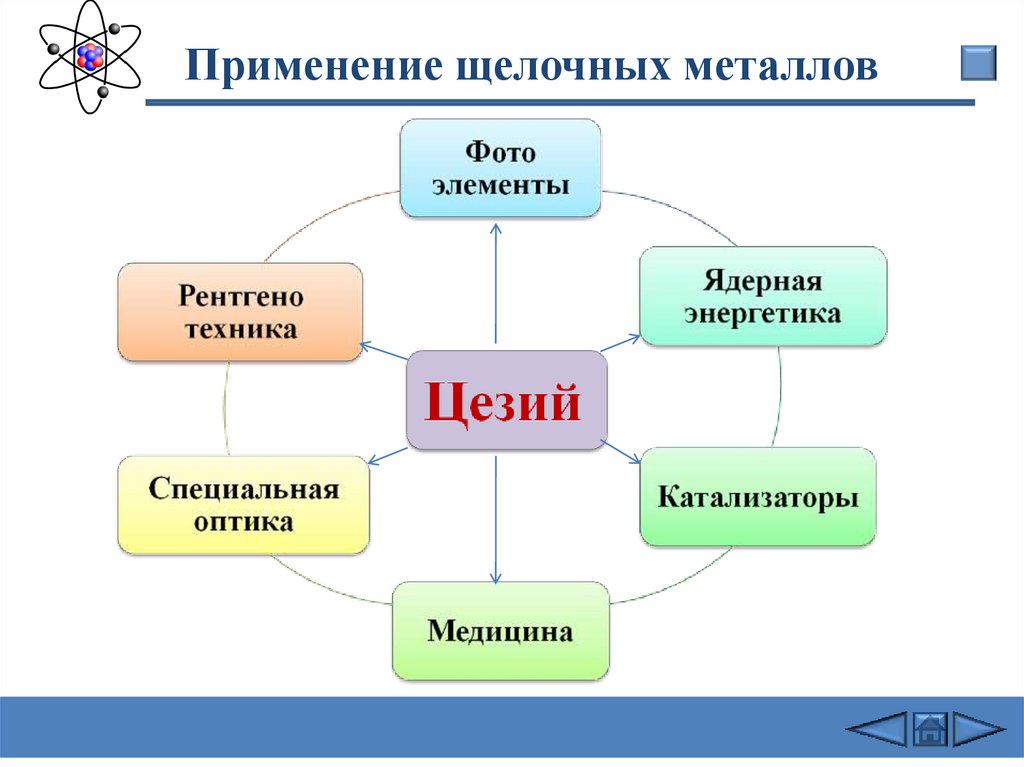
Цезий
Рубидий
5.
Литий был открыт в 1817 г.шведским химиком
А. Арфведсоном. Металл назвали
литием, что в переводе с
греческого означает «камень».
А. Арфведсон
1792–1841 гг.
6.
Впервые литий был полученанглийским химиком Г. Дэви в
1818 г.
Г. Деви
1778–1829 гг.
7.
В 1807 г. английский химик ифизик
Г. Дэви впервые получил натрий в
чистом виде при электролизе
едкого натра.
Он первым изучил его свойства.
Г. Деви
1778–1829 гг.
8.
НатрийDnn87
9.
История открытия калияКалий (англ. Potassium, франц. Potassium,
нем. Kalium) открыл в 1807 г. Г.Дэви,
производивший электролиз твердого, слегка
увлажненного едкого кали. Дэви именовал
новый металл потассием (Potassium), но это
название не прижилось. Крестным отцом
металла оказался Гильберт, известный
издатель журнала "Annalen deг Physik",
предложивший название "калий"; оно было
принято в Германии и России.
Гемфри Дэви
(17.12.1778 г –
29.05.1829 г)
10.
Калий11.
История открытия рубидияРоберт Вильгельм Бунзен
(31.03.1811 - 16.08.1899)
Густав Роберт Кирхгоф
(12.03.1824 – 17.10.1887)
При
спектроскопическом
анализе
минерала лепидолит (фторсиликат
лития и алюминия) и обнаружились
две новые красные линии в красной
части спектра. Эти линии Р. Бунзен и
Г.Кирхгофф правильно отнесли к
новому металлу, который назвали
рубидием (лат. rubidus - красный) из-за
цвета
его
спектральных
линий.
Получить рубидий в виде металла
Бунзену удалось в 1863 году.
12.
Рубидий13.
История открытия цезияРоберт Вильгельм Бунзен
(31.03.1811 - 16.08.1899)
Густав Роберт Кирхгоф
(12.03.1824 – 17.10.1887)
Цезий (англ. Cesium, франц. Cesium, нем.
Caesium) - первый элемент, открытый с
помощью спектрального анализа. Р.Бунзен и
Г.Кирхгофф
обнаружили
спектральные
линии нового элемента: одну слабо-голубую и
другую ярко-голубую в области фиолетовой
части спектра.
Р.Бунзен назвал вновь открытый металл
цезием (Casium) от лат. caesius -- голубой,
светло-серый; в древности этим словом
обозначали голубизну ясного неба. Чистый
металлический
цезий
получен
электролитическим путем в 1882 г.
14.
ЦезийMagnus Manske
15.
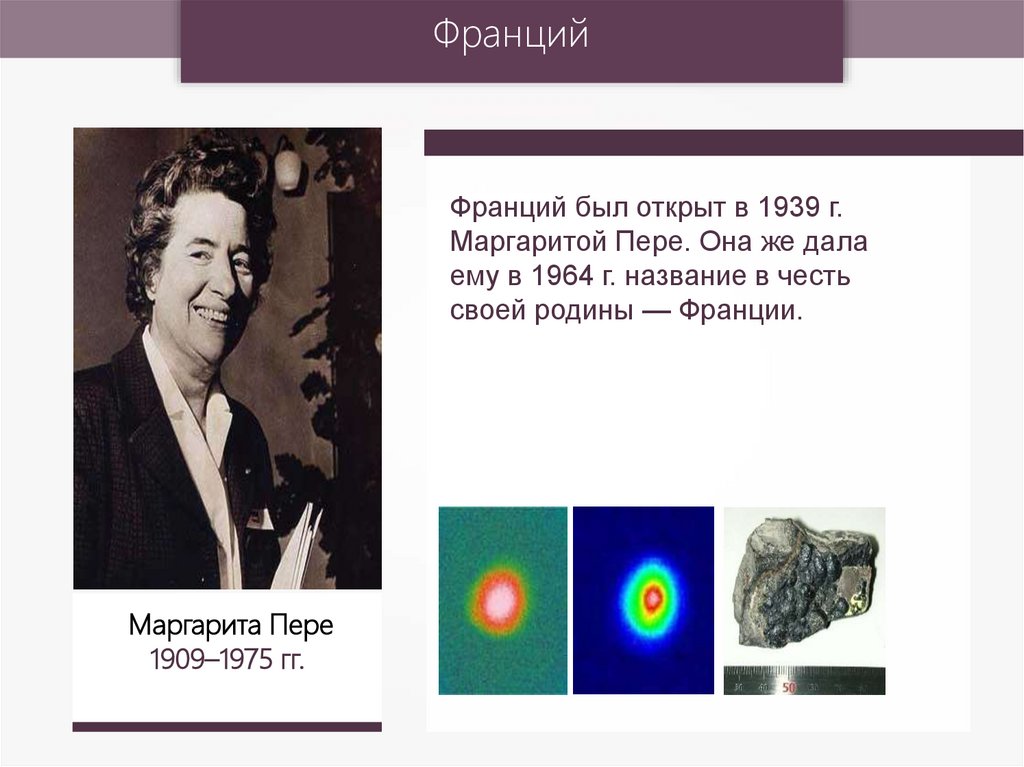
ФранцийФранций был открыт в 1939 г.
Маргаритой Пере. Она же дала
ему в 1964 г. название в честь
своей родины — Франции.
Маргарита Пере
1909–1975 гг.
16.
Периодическая система химических элементов Д.И.МенделееваI
I
1
II
2
Li
III
3
Na
4
K
IV
II
6,939
3
Литий
11
22,9898
Натрий
V
Калий
Rb
VI
37
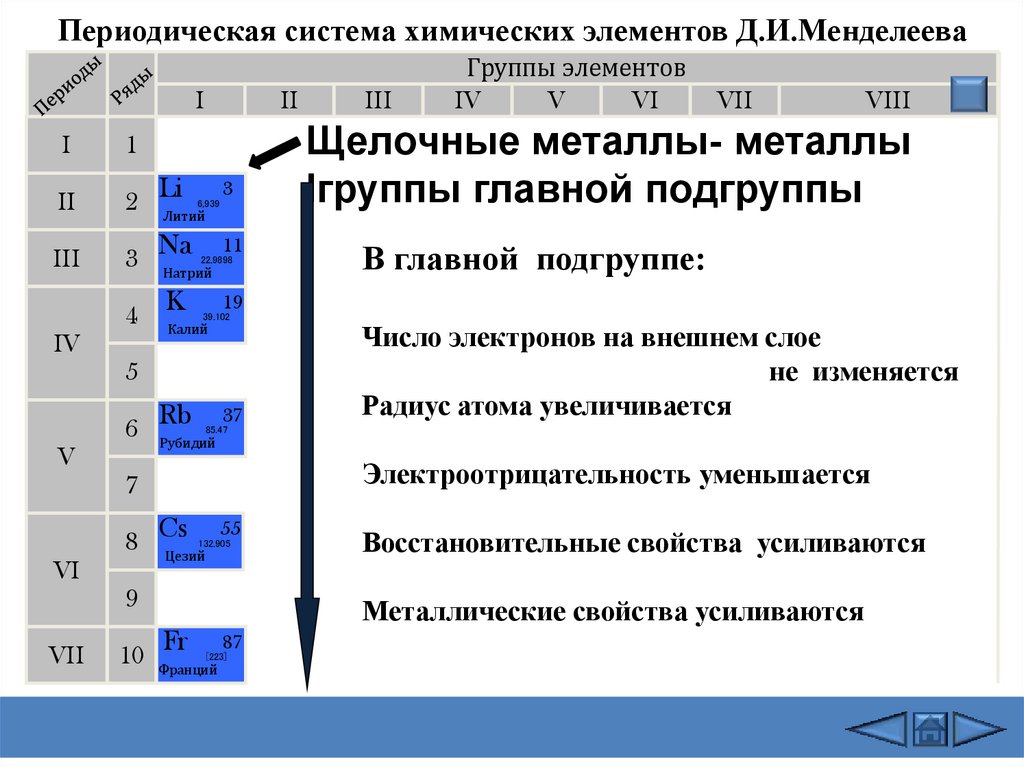
Щелочные металлы- металлы
Iгруппы главной подгруппы
В главной подгруппе:
Число электронов на внешнем слое
не изменяется
Радиус атома увеличивается
Рубидий
Электроотрицательность уменьшается
Cs
55
132.905
Цезий
9
VII
VIII
85.47
7
8
VII
19
39.102
5
6
III
Группы элементов
IV
V
VI
Восстановительные свойства усиливаются
Металлические свойства усиливаются
Fr
10 Франций
87
[223]
17.
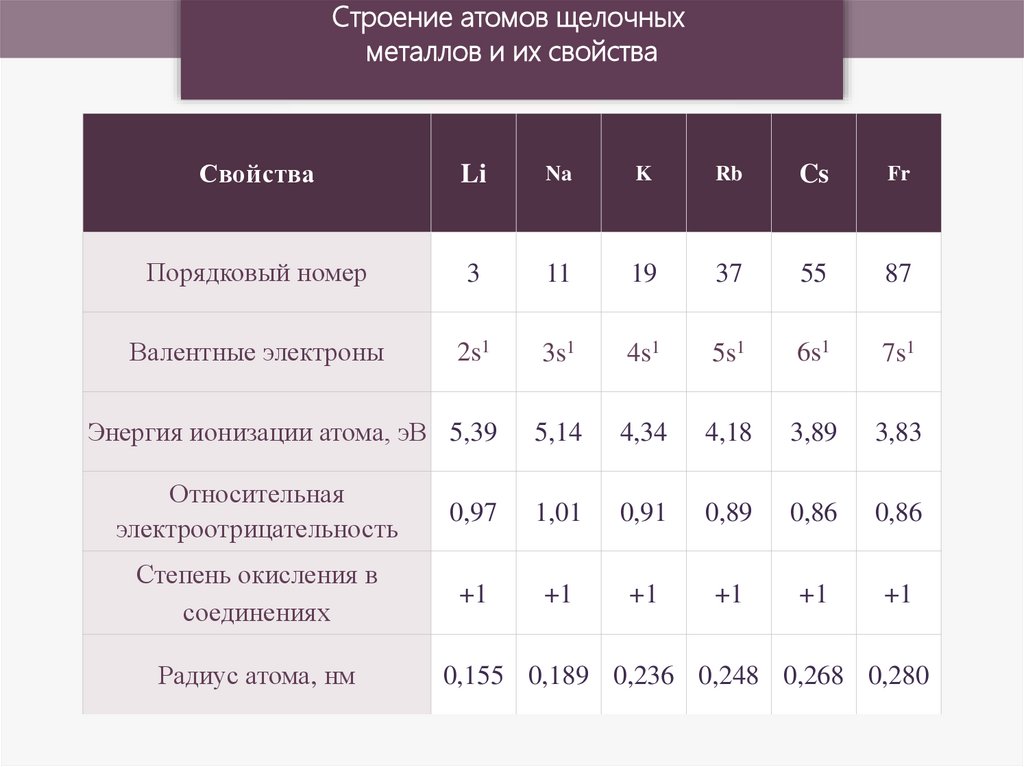
Строение атомов щелочныхметаллов и их свойства
Свойства
Li
Na
K
Rb
Cs
Fr
Порядковый номер
3
11
19
37
55
87
Валентные электроны
2s1
3s1
4s1
5s1
6s1
7s1
Энергия ионизации атома, эВ 5,39
5,14
4,34
4,18
3,89
3,83
Относительная
электроотрицательность
0,97
1,01
0,91
0,89
0,86
0,86
Степень окисления в
соединениях
+1
+1
+1
+1
+1
+1
Радиус атома, нм
0,155 0,189 0,236 0,248 0,268 0,280
18.
Металлические свойстваМеталлический блеск
Пластичность
Мягкость
Хорошая электропроводность
Хорошая теплопроводность
19.
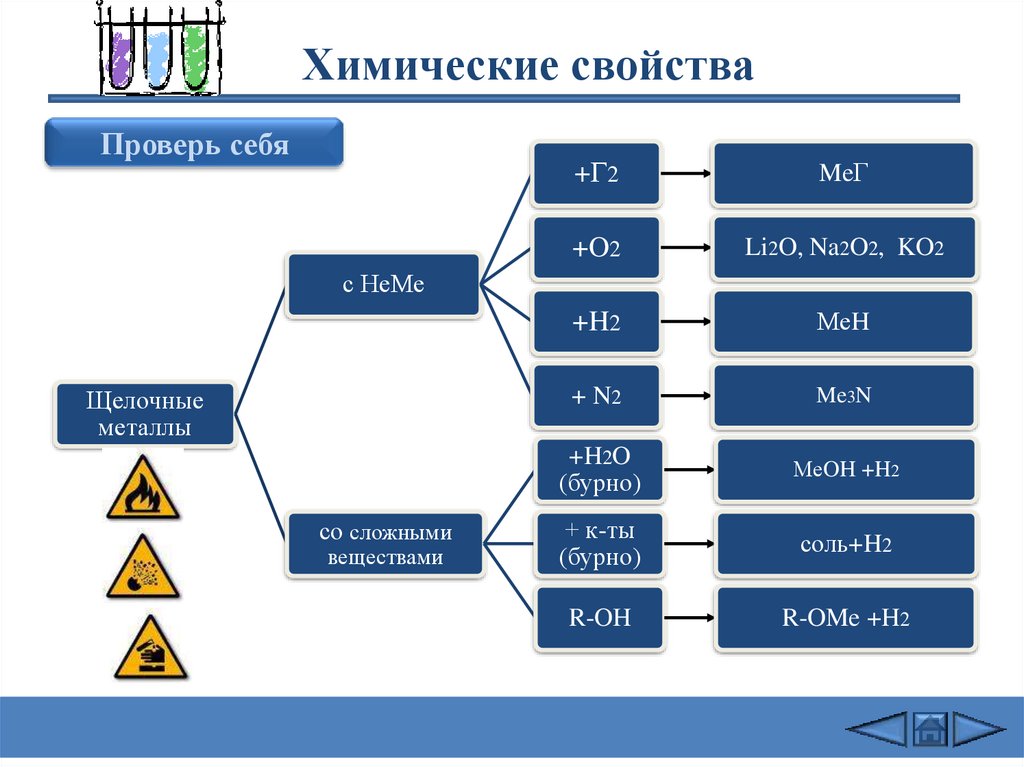
Химические свойстваПроверь себя
+Г2
MeГ
+O2
Li2O, Na2O2, KO2
+H2
МеH
+ N2
Me3N
+H2O
(бурно)
МеOH +H2
+ к-ты
(бурно)
соль+H2
R-OH
R-OMe +H2
с НеМе
Щелочные
металлы
со сложными
веществами
20.
Химические свойства1) 2Na + Cl2 = 2NaCl (в атмосфере F2 и Cl2 щелочные Me самовоспламеняются)
2) 4Li + O2 = 2Li2O
2Na + O2 = Na2O2
3) 2Na + Н2 = 2NaН
(при нагревании 200-400oC)
оксид Li
2K + 2O2 = K2O4
пероксид Na
надпероксид K
4) 6Li + N2 = 2Li3N (Li - при комнатной T, остальные щелочные Me -при нагревании)
5) 2Na + 2Н2О = 2NaОН + Н2
(Li - спокойно, Na - энергично,
остальные – со взрывом –
воспламеняется выделяющийся Н2
Rb и Cs реагируют не только
с жидкой Н2О, но и со льдом. .
6) 2Na+ Н2SО4 = Na2SО4 + Н2
(протекают очень бурно)
7) 2C2H5OH + 2Na = 2C2H5ONa + Н2
Щелочные металлы с водой
21.
Качественное определение щелочных металловДля распознавания соединений щелочных металлов по окраске пламени
исследуемое вещество вносится в пламя горелки на кончике железной
проволоки.
Li+ - карминово-красный
Na+ - желтый
Li+
K+ - фиолетовый
Rb + - красный
Na+
Cs+ - фиолетово-синий
K+
22.
Получение щелочных металлов1) Электролиз расплавов соединений
щелочных металлов:
2МеCl = 2Ме + Cl2
4МеOH = 4Ме + 2Н2О + О2
2) Восстановление оксидов и гидроксидов
щелочных металлов:
2Li2O + Si = 4Li + SiO2
KOH + Na = NаOH + K
Схема электролизера для получения натрия
Ванна состоит из стального кожуха с шамотной футеровкой, графитовым анодом А и
кольцевым железный катодом К, между которыми расположена сетчатая диафрагма.
Электролитом служит более легкоплавкая смесь его с 25% NaF и 12% КСl (что
позволяет проводить процесс при 610–650°С). Металлический натрий собирается в
верхней части кольцевого катодного пространства, откуда и переходит в сборник. По
мере хода электролиза в ванну добавляют NaCl.
23.
ФотографияСподуменн
Описание минерала
Химический
состав
LiAl[Si2O6]
Цвет
Бесцветный,
красный, желтый,
зеленый
Плотность
3,1—3,2 г/см3
Твердость
6,5
24.
ФотографияГалит
Описание минерала
Химический
состав
NaСl
Цвет
Бесцветный,
красный, желтый,
синий
Плотность
2,2—2,3г/см3
Твердость
2,5
Вкус
Солёный
25.
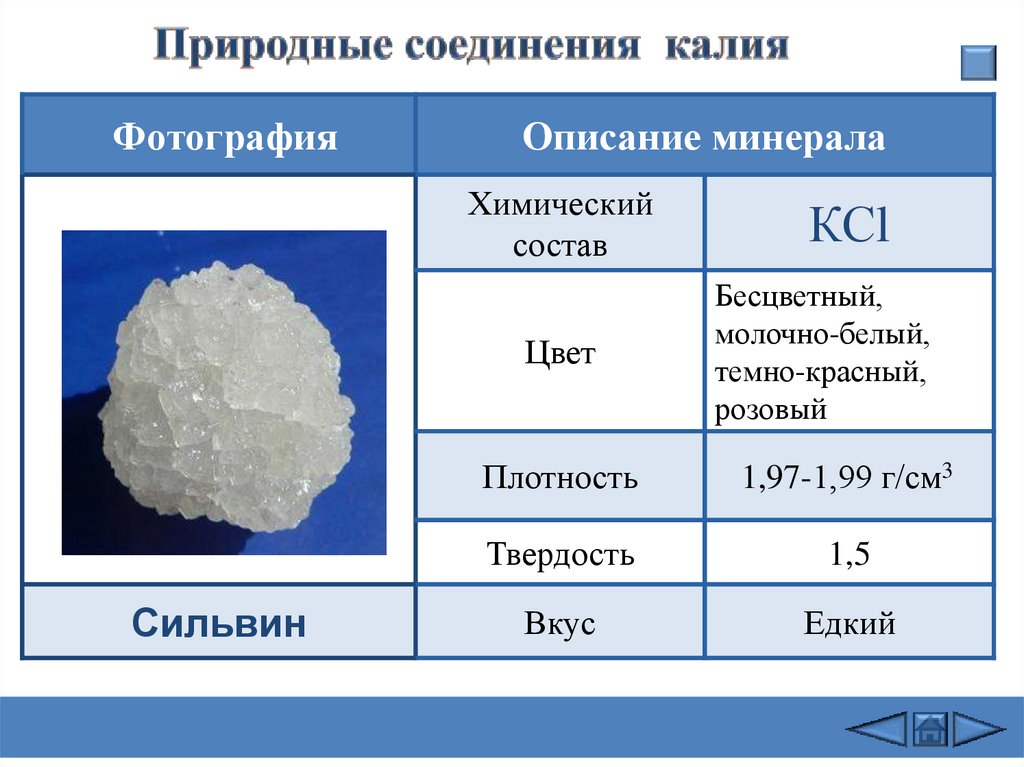
ФотографияОписание минерала
Химический
состав
Цвет
Сильвин
КСl
Бесцветный,
молочно-белый,
темно-красный,
розовый
Плотность
1,97-1,99 г/см3
Твердость
1,5
Вкус
Едкий
26.
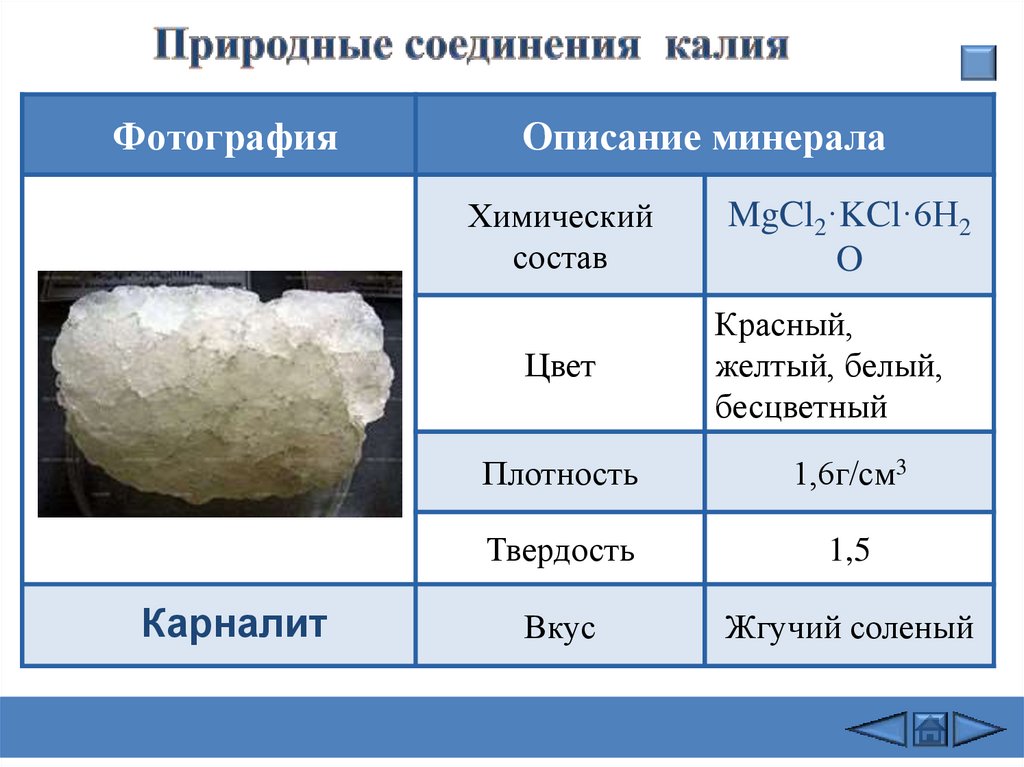
ФотографияКарналит
Описание минерала
Химический
состав
MgCl2·KCl·6H2
O
Цвет
Красный,
желтый, белый,
бесцветный
Плотность
1,6г/см3
Твердость
1,5
Вкус
Жгучий соленый
27.
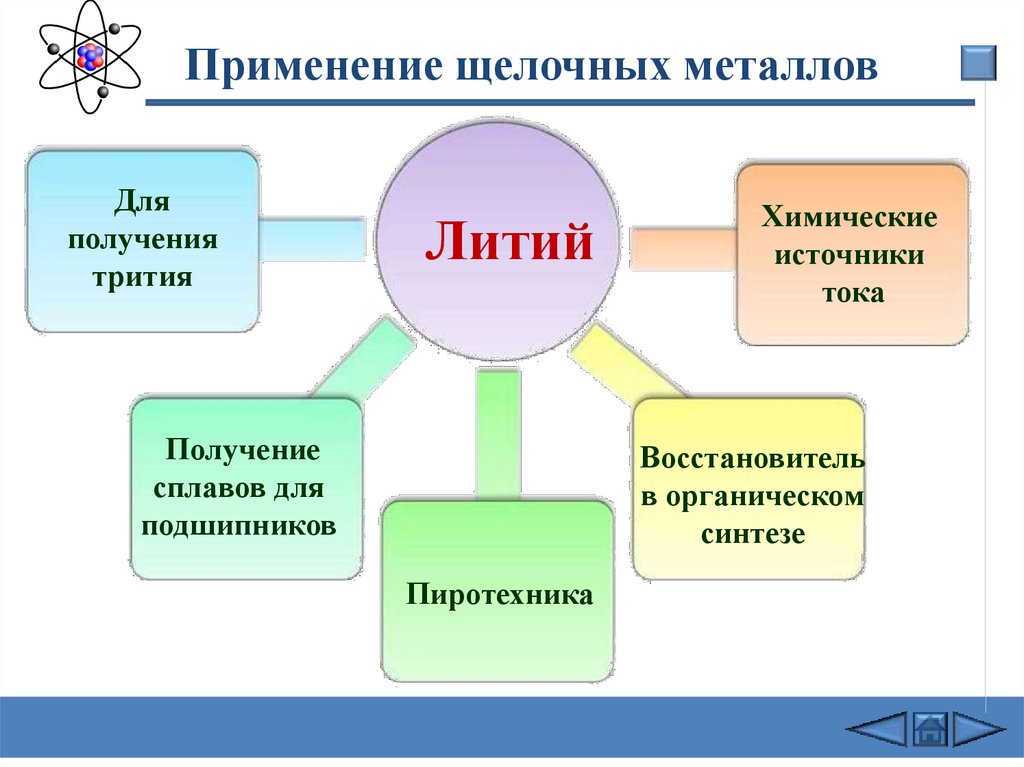
Применение щелочных металловДля
получения
трития
Литий
Получение
сплавов для
подшипников
Химические
источники
тока
Восстановитель
в органическом
синтезе
Пиротехника
28.
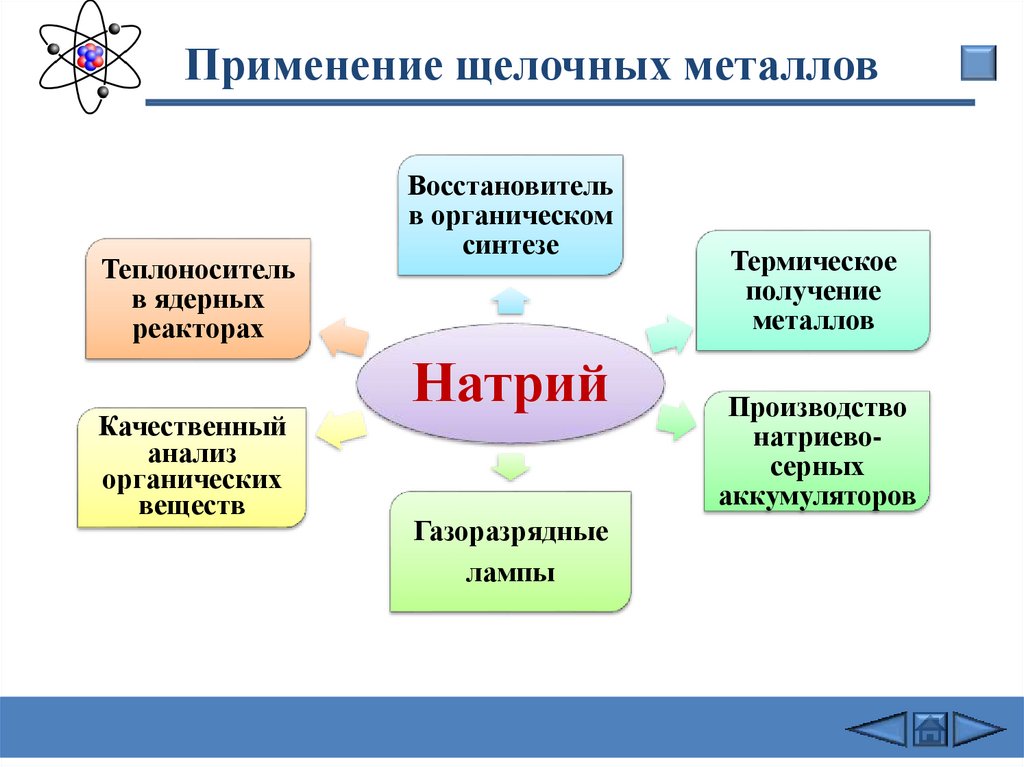
Применение щелочных металловТеплоноситель
в ядерных
реакторах
Качественный
анализ
органических
веществ
Восстановитель
в органическом
синтезе
Натрий
Газоразрядные
лампы
Термическое
получение
металлов
Производство
натриевосерных
аккумуляторов
29.
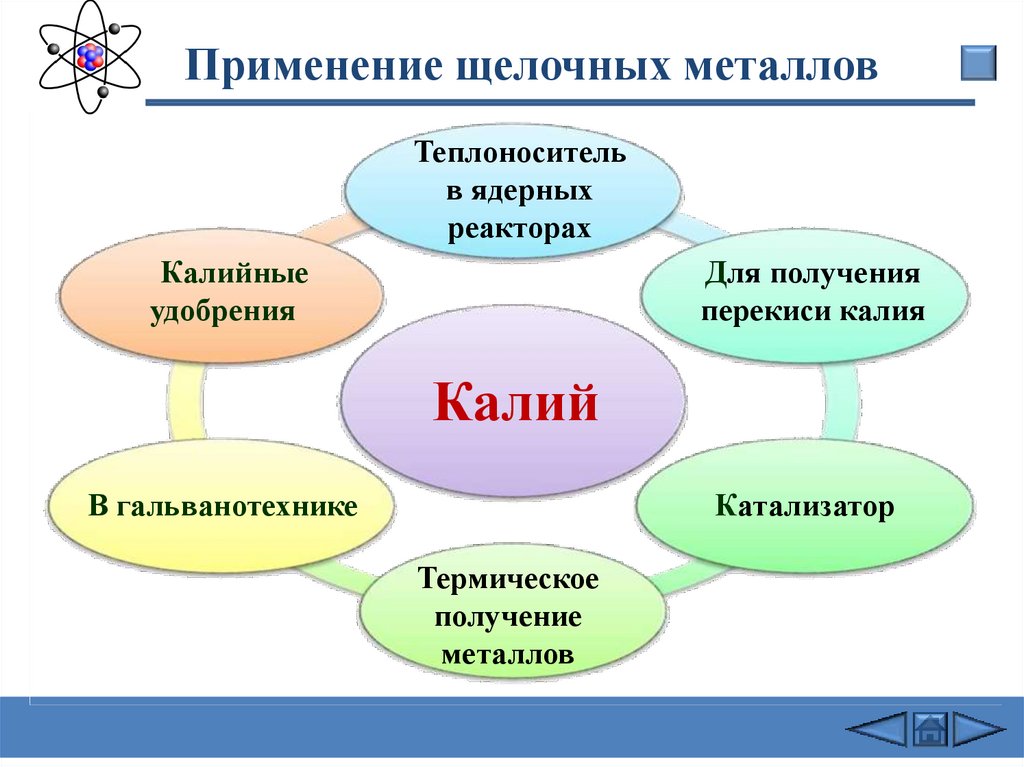
Применение щелочных металловТеплоноситель
в ядерных
реакторах
Калийные
удобрения
Для получения
перекиси калия
Калий
В гальванотехнике
Катализатор
Термическое
получение
металлов
30.
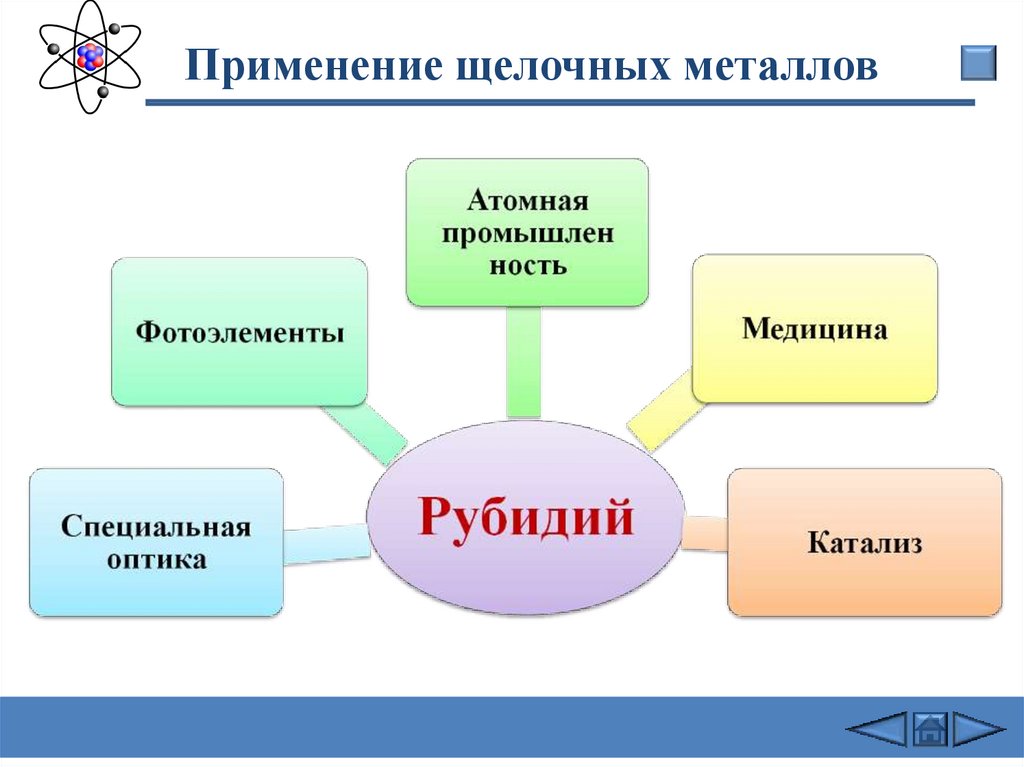
Применение щелочных металлов31.
Применение щелочных металлов32.
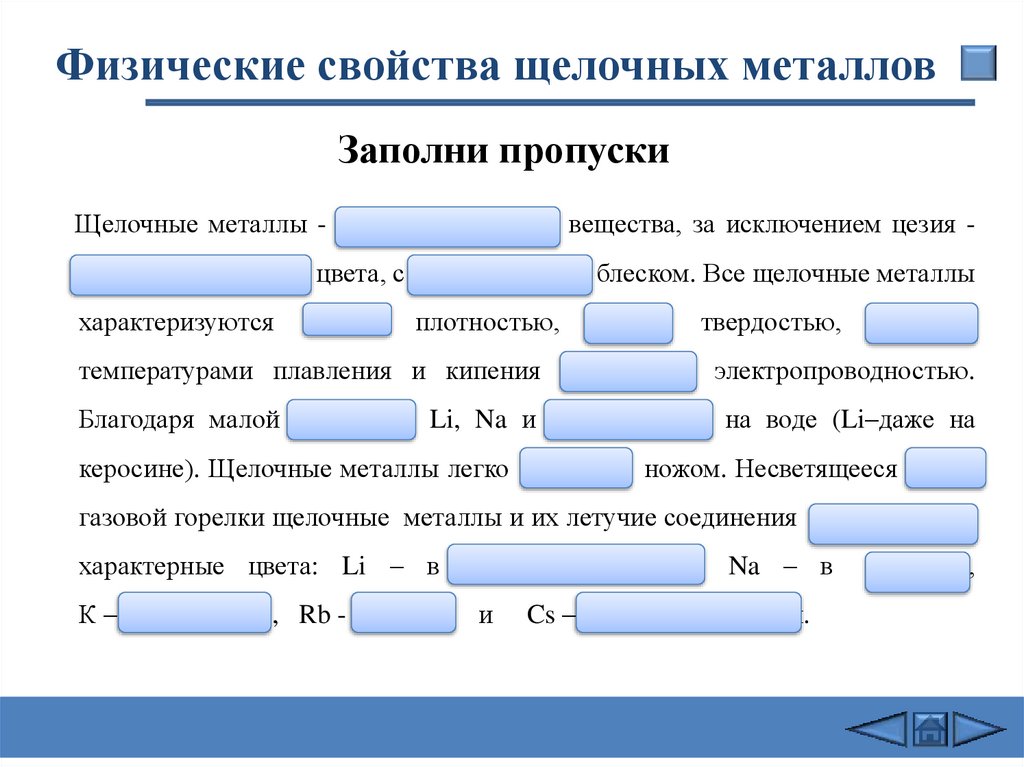
Физические свойства щелочных металловЗаполни пропуски
Щелочные металлы - серебристо–белые вещества, за исключением цезия серебристо-желтого цвета, с металлическим блеском. Все щелочные металлы
характеризуются
малой
плотностью,
малой
твердостью,
низкими
температурами плавления и кипения и хорошей электропроводностью.
Благодаря малой плотности Li, Na и К всплывают на воде (Li–даже на
керосине). Щелочные металлы легко режутся ножом. Несветящееся пламя
газовой горелки щелочные металлы и их летучие соединения окрашивают в
характерные цвета: Li – в карминово–красный, Na – в
К – фиолетовый , Rb - красный
и
Cs – в фиолетово-синий.
желтый,
33.
Тест «Щелочные металлы»1. Предложил назвать калий от арабского «алкали» - щелочь
И. Арфведсон
Г.Деви
Й. Берцеллиус
2. В ряду от лития к францию атомный радиус:
уменьшается
не изменяется
увеличивается
3. Степень окисления щелочных металлов равна:
+1
-1
+2
4. Цвет пламени, в который его окрашивают ионы натрия
фиолетовый
красный
желтый
5. Соединение NaOH называется.
каустическая сода
проверить
поташ
кристаллическая сода
34.
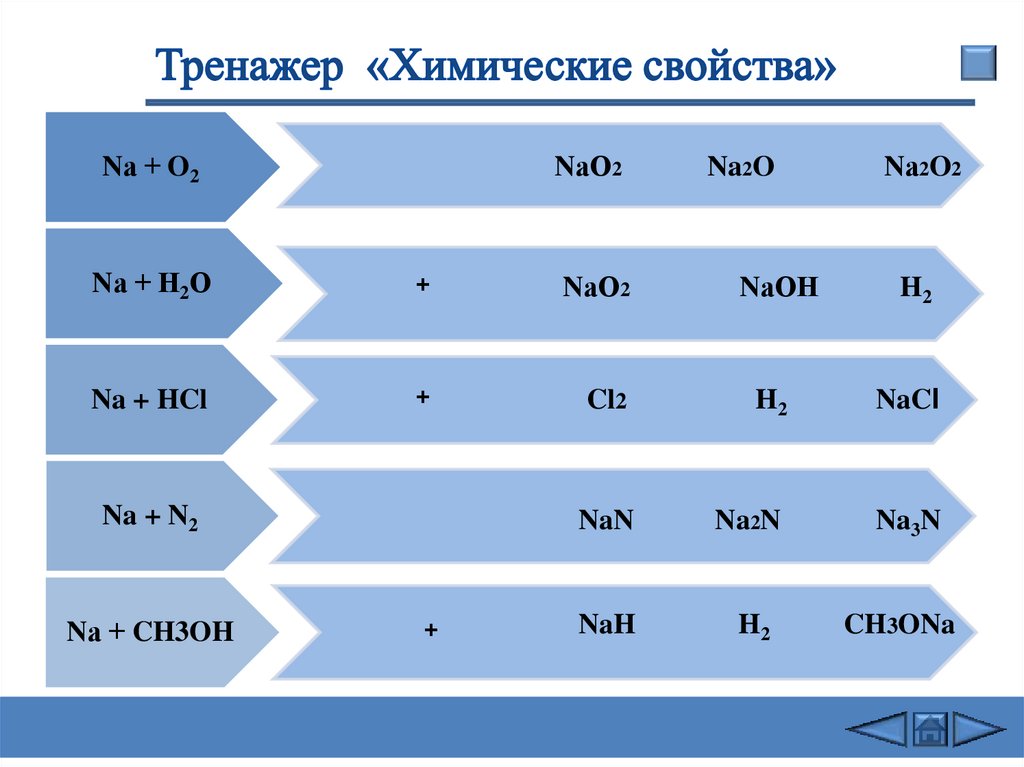
Nа + O2NаО2
Na2O
Nа2O2
Nа + Н2О
+
NаО2
NаОН
H2
Na + HCl
+
Cl2
H2
NaCl
NaN
Na2N
Na3N
NaH
H2
CH3ONa
Na + N2
Nа + CH3OH
+
35.
Литература и интернет-ресурсыГабриелян О.С. Химия. 9 класс: Учеб. для общеобразоват.учебн. заведений.-М.:
Дрофа,
Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001
Лидин Р. А., Андреева Л. Л., Молочко В. А. Справочник по неорганической
химии. — М.: Химия, 1987.
Некрасов Б. В. Основы общей химии. — М.: Химия, 1974.
Неорганическая химия. Весь школьный курс в таблицах,сост. МанкувичН.В., М.
2008г
“Видеоопыты из диска "Splint. Химия для всех - XXI: Самоучитель решению
химических задач"
http://ru.wikipedia.org/wiki/%D0%A5%D0%B8%D0%BC%D0%B8%D1%87%D0%
B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8D%D0%BB%D0%B5%D0%BC
%D0%B5%D0%BD%D1%82
http://www.catalogmineralov.ru/
http://www.xumuk.ru/encyklopedia/2/5263.html
http://www.physchem.chimfak.rsu.ru/Source/History/Persones/
36.
Спасибо за урок!Благодарю за сотрудничество.





















 Химия
Химия








