Похожие презентации:
Связь между основными классами неорганических соединений
1.
УРОК ХИМИИ8 класс
тема
«СВЯЗЬ МЕЖДУ ОСНОВНЫМИ
КЛАССАМИ НЕОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ»
2.
Задачи:• Обучающая: опираясь на знания учащихся об
основных классах неорганических веществ,
подвести их к понятию «связь между
основными классами неорганических
соединений; закрепить знания о номенклатуре
и свойствах веществ, относящихся к разным
классам;
• Развивающая: развивать умения выделять
главное, сравнивать и обобщать; выявлять и
устанавливать взаимосвязи; развивать
представления о причинно – следственных
связях явлений.
• Воспитывающая: осторожное отношение с
химическими веществами по отношению к
себе и одноклассникам.
3.
• Металлы1.
2.
3.
4.
5.
Металлический блеск
Ковкость
Высокая теплопроводность
Высокая электропроводность
Образуют основные оксиды
4.
Неметаллы1.
2.
3.
4.
Разноцветные
Изоляторы
Три агрегатных состояния
Образуют кислотные оксиды
5.
Распределить данные вещества поклассам:
MgO, SO2 , S, H2SO3, SO3, Mg, MgCl2,
Mg(OH)2, NaOH, Na2SO4, HCl.
6.
Химические элементы: S, MgОксиды: SO2, SO3,MgO
Кислоты: H2SO3, HCl
Основания: Mg(OH)2, NaOH
Соли: MgCl2, Na2SO3
7.
NaOHMgO
MgCl2
SO2
SO3
Распределить
данные вещества
по классам:
S
Mg
HCl
Mg(OH)2
Na2SO4
H2SO3
8.
Химические элементыS
Mg
Оксиды
SO2
SO3
Кислоты
H2SO3
HCl
Mg(OH)2
NaOH
MgCl2
Na2SO4
Основания
Соли
MgO
9.
• 1. Ca CaOCa(OH)2 CaSO4
• 2. Mg MgO
Mg(OH)2 MgCl2
• 3. S
SO2
H2SO3
Na2SO3
• 4. C
CO2
H2CO3
CO2
10.
11.
12.
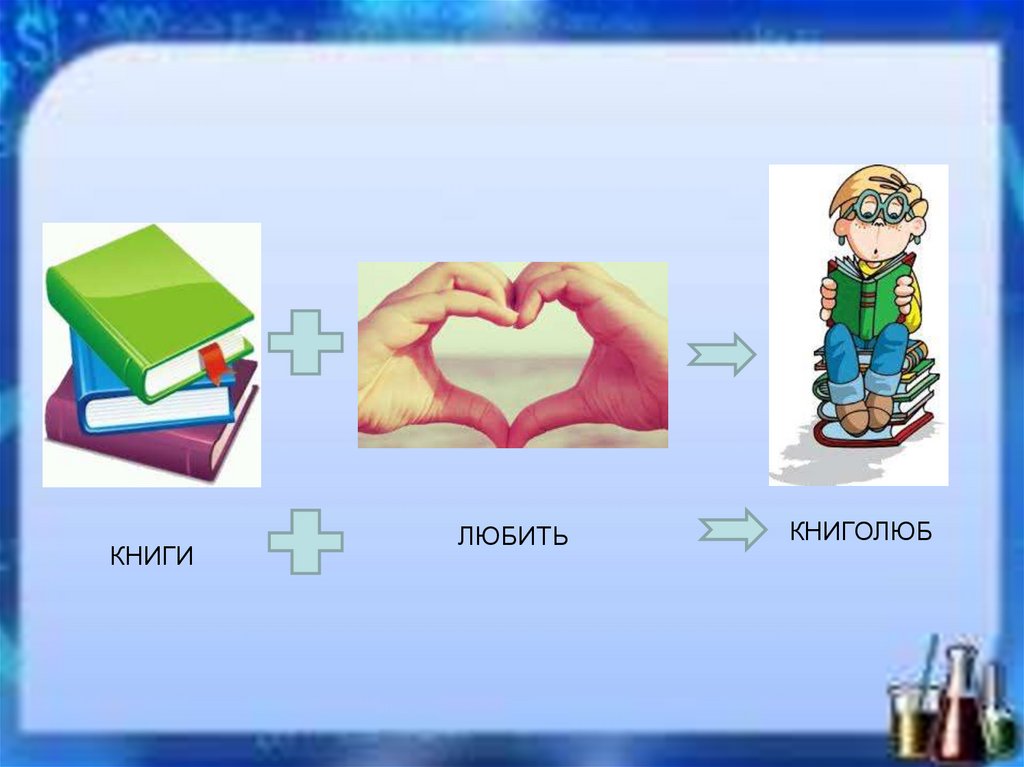
КНИГИЛЮБИТЬ
КНИГОЛЮБ
13.
Возможны ли обратные цепочкипревращений?
14.
Практическая работаЦель: закрепить теоретические знания
практическими навыками
15.
Техникабезопасности
во время практической
работы по химии
16.
Прежде чемприступить к
выполнению
эксперимента,
внимательно
изучи инструкцию
17.
Эксперименты нужновыполнять в строгом
соответствии с
инструкциями,
используя точно
указанные
количества веществ
18.
Помните, что любоевещество может быть
опасным, если
обращаться
с ним неправильно
Без указания учителя не смешивайте
неизвестные вам вещества
19.
Пользоваться реактивами можнотолько из тех склянок,
на которых есть надписи
20.
Используйте только чистуюлабораторную посуду
и тщательно промывайте ее
после выполнения эксперимента
21.
Жидкость из сосуда берите пипеткой22.
Остатки веществне высыпайте и
не вливайте обратно в
сосуд с чистыми
веществами
После эксперимента
не выливайте в раковину
остатки реактивов – они
должны быть
нейтрализованы и
разбавлены
23.
Вещества не должны храниться вместес пищевыми продуктами
24.
Не принимайте пищу во время химическихэкспериментов, а после их завершения
тщательно мойте руки
Никогда не пробуйте
химические вещества
на вкус
25.
Правила нагревания•В целях безопасности работы
пробирку заполняют
жидкостью только на треть
и закрепляют в держателе.
•Держите пробирку выходом
от себя, а также в сторону,
противоположную от любого
человека, находящегося
поблизости.
•При нагревании слегка
потряхивайте содержимое
пробирки
26.
Помните, что нюхать любое веществонужно очень осторожно.
Не склоняйтесь над сосудом
с кипящей жидкостью
Определять запах вещества
нужно слегка подгоняя
ладонью пары вещества в свою
сторону
27.
Никогда не добавляйте воду в кислоту28.
Юные химики, помните:кислоту добавляют в воду, а не наоборот
29.
Обращайте особое внимание напредупредительные знаки
30.
Практическаяработа
Цель: закрепить
теоретические знания
практическими
навыками
31.
• 1 вариант: С какимииз перечисленных
веществ вступает в
реакцию соляная
кислота: оксид серы
(6), оксид цинка,
серная кислота,
магний, хлорид
натрия, оксид
углерода (4),
гидроксид меди (2)?
Напишите уравнения
соответствующих
реакций.
• 2 вариант: С какими
из перечисленных
веществ вступает в
реакцию гидроксид
натрия: оксид серы
(6), серная кислота,
магний, хлорид
натрия, гидроксид
железа (2),
углекислый газ?
Напишите уравнения
возможных реакций.
32.
• Домашнее задание: параграф42, напишите уравнения
реакций получения хлорида
железа (2) с помощью 4-5
различных реакций.
33.
•Сегодня на уроке…•Теперь я знаю…
•Мне на уроке…
































 Химия
Химия








