Похожие презентации:
Воспользуйтесь ЛСМ «Химические реакции»
1.
РАЗМИНКАВоспользуйтесь ЛСМ
«Химические реакции»
Презентация подготовлена
учителем химии ГБОУ гимназии № 32
г.Санкт-Петербурга
Гречко Татьяной Олеговной
2.
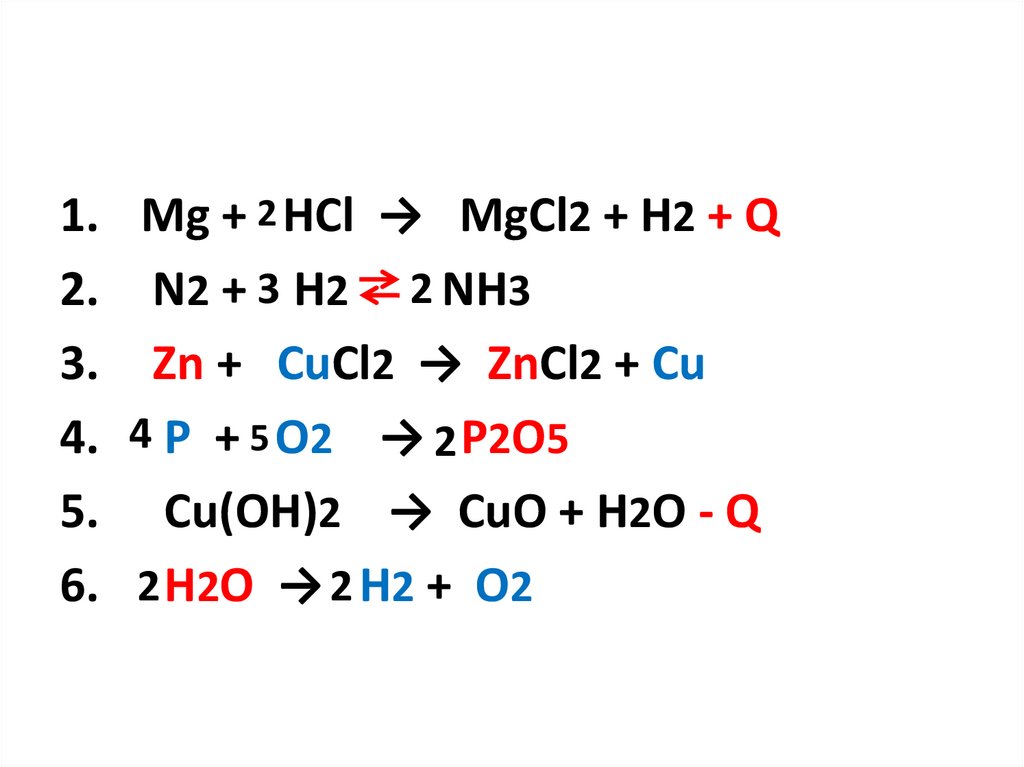
1. Mg + 2 HCl → MgCl2 + H2 + Q2. N2 + 3 H2 2 NH3
3. Zn + CuCl2 → ZnCl2 + Cu
4. 4 P + 5 O2 → 2 P2O5
5. Cu(OH)2 → CuO + H2O - Q
6. 2 H2O → 2 H2 + O2
3.
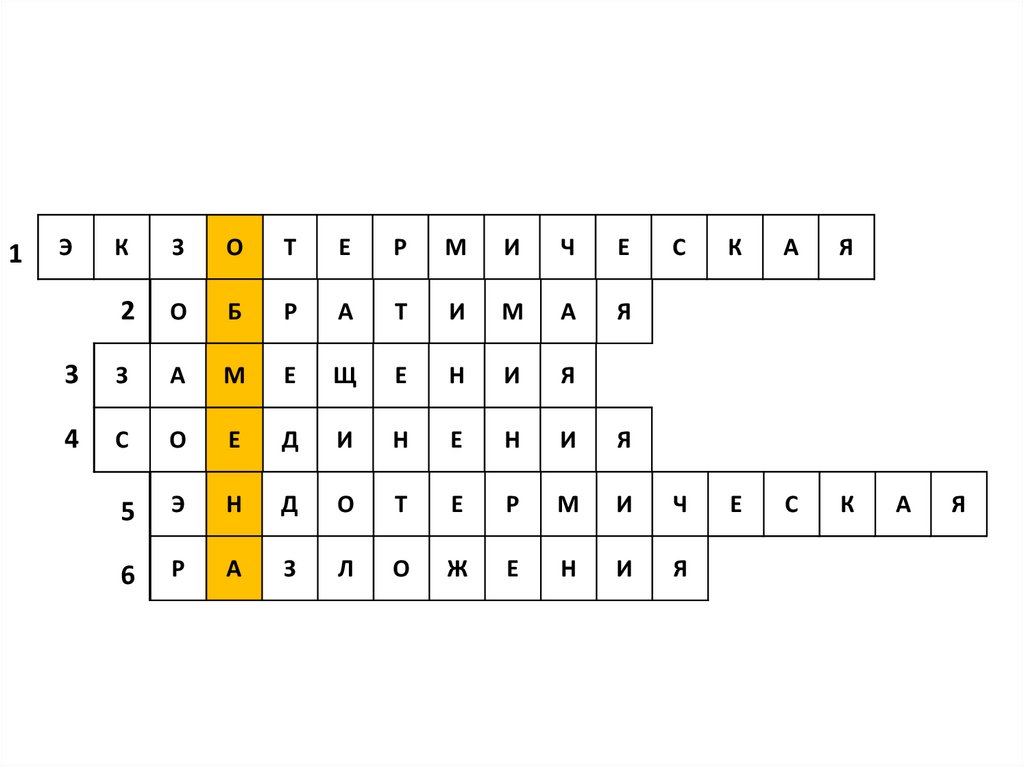
1Э
К
З
О
Т
Е
Р
М
И
Ч
Е
С
К
А
Я
2
О
Б
Р
А
Т
И
М
А
Я
3
З
А
М
Е
Щ
Е
Н
И
Я
4
С
О
Е
Д
И
Н
Е
Н
И
Я
5
Э
Н
Д
О
Т
Е
Р
М
И
Ч
Е
С
К
6
Р
А
З
Л
О
Ж
Е
Н
И
Я
А
Я
4.
Реакцииобмена
5.
ЭкспериментТехника безопасности!
6.
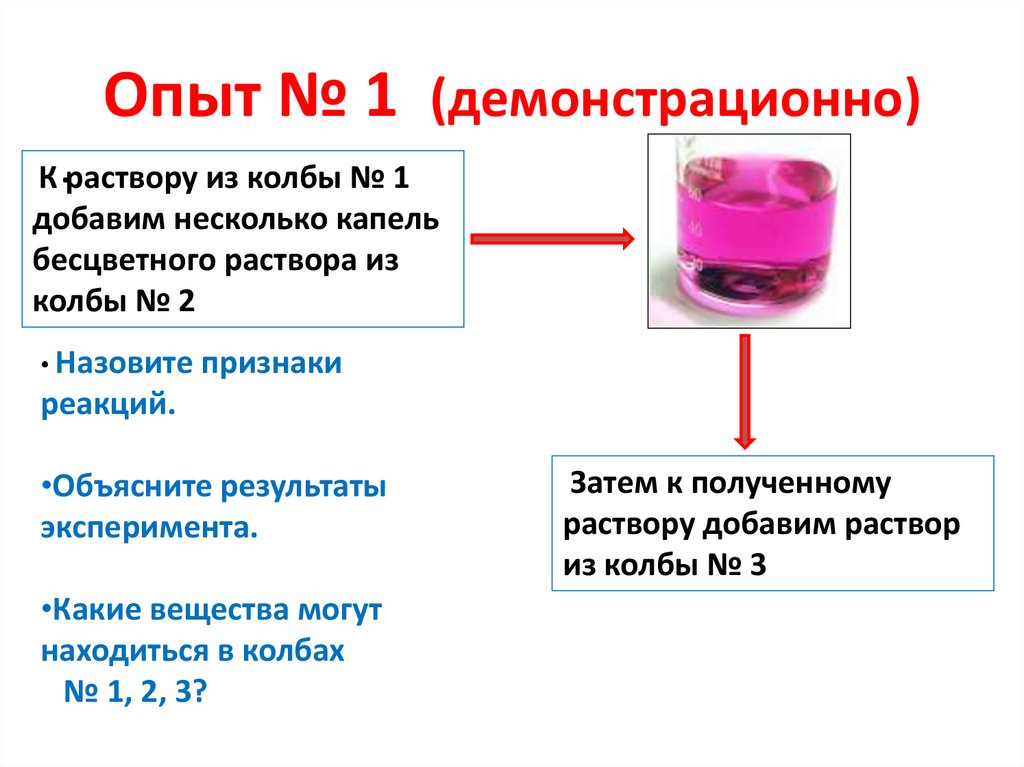
Опыт № 1 (демонстрационно)К .раствору из колбы № 1
добавим несколько капель
бесцветного раствора из
колбы № 2
• Назовите
признаки
реакций.
•Объясните результаты
эксперимента.
•Какие вещества могут
находиться в колбах
№ 1, 2, 3?
Затем к полученному
раствору добавим раствор
из колбы № 3
7.
Взаимодействие гидроксида натрияи соляной кислоты:
+1 -1
NaOH + HCl → Na Cl + H2O
ф/ф
Реакция между щелочью и кислотой
с образованием нейтрального вещества – воды
называется реакцией нейтрализации
Н2О
8.
Опыт № 2 «Взаимодействиегидроксида натрия и сульфата меди (II)
1. В пробирку налить 1 мл раствора гидроксида
натрия и добавить к нему 1 мл раствора сульфата
меди(II).
2. Назовите признак данной реакции
3. Составим уравнение:
+2
-1
2 NaOH + CuSO4 → Cu (OH)2 ↓ +
Реакция идет с образованием
осадка гидроксида меди (II)
+1 -2
Na2 SO4
↓
9.
Опыт № 3 (самостоятельно)• Прочтите инструкцию
(учебник, стр. 190) и
рассмотрите рис. 111 на
стр 190.
• Проведите
самостоятельно
лабораторный опыт
«Взаимодействие
карбоната натрия с
азотной кислотой»
Задание:
1. Укажите признак
данной реакции
2. Запишите уравнение
реакции
3. Почему данная
реакция возможна?
↑
10.
Подведем итоги экспериментов:1. В чем сходство всех трех реакций?
2. Сформулируйте и запишите
определение реакций обмена
3. Запишите схему реакции обмена
в общем виде AB + CD → AD + CB
4. Закончите правило:
Реакции обмена, протекающие в растворах ,
идут до конца, если в результате образуется
вода , __________
осадок или ______
газ .
________
11.
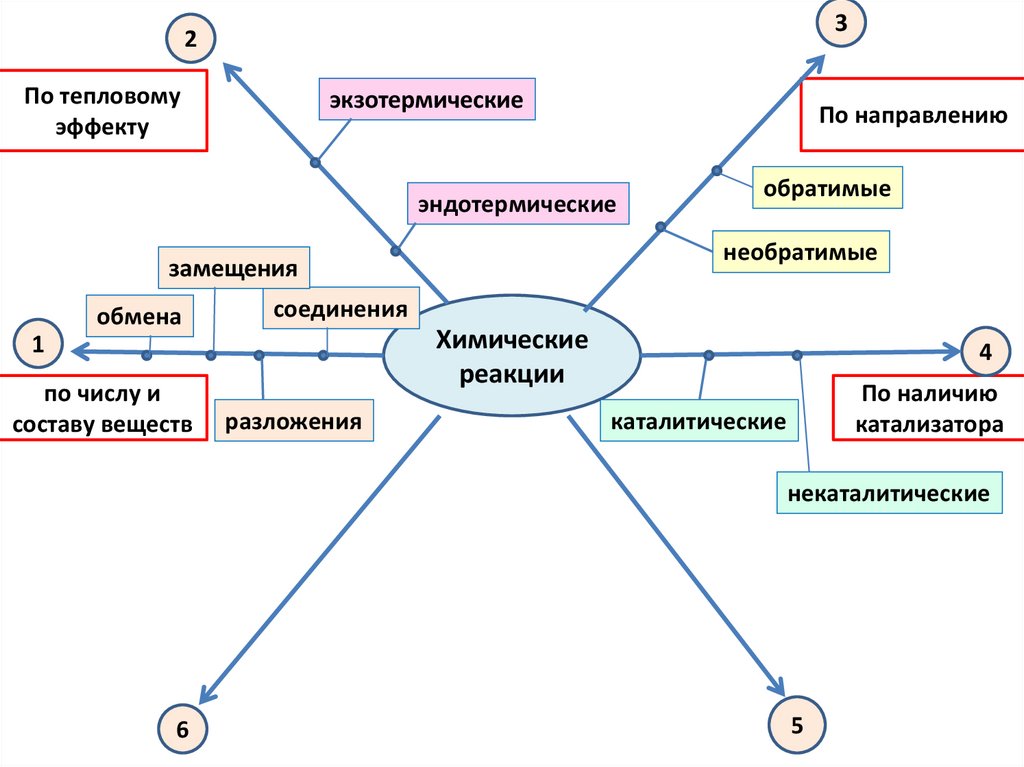
32
По тепловому
эффекту
экзотермические
По направлению
эндотермические
необратимые
замещения
обмена
соединения
Химические
реакции
1
по числу и
составу веществ
обратимые
разложения
4
По наличию
катализатора
каталитические
некаталитические
6
5








 Химия
Химия








