Похожие презентации:
Кислоты
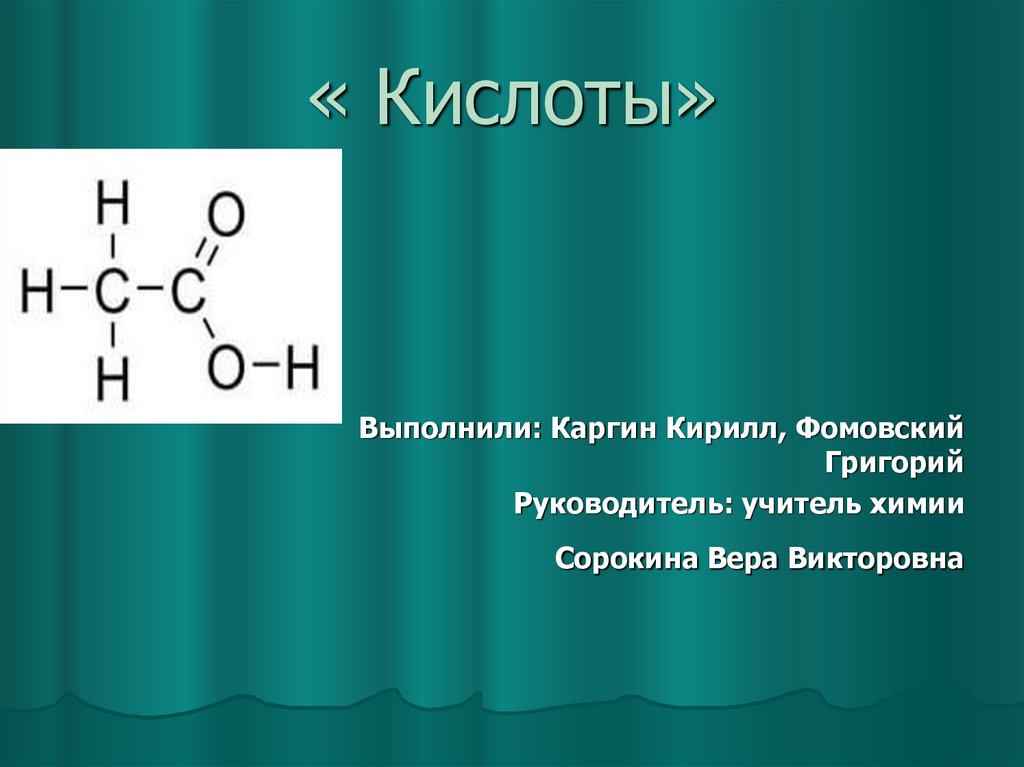
1. « Кислоты»
Выполнили: Каргин Кирилл, ФомовскийГригорий
Руководитель: учитель химии
Сорокина Вера Викторовна
2. Цели:
Изучить классификацию кислот,способы их получения, области
применения.
Исследовать физико – химические
показатели кислот.
Сравнить силу органических и
неорганических кислот.
3. Кислоты
сложныевещества,
состоящие из
атомов
водорода,
способного
замещаться на
водород, и
кислотных
остатков
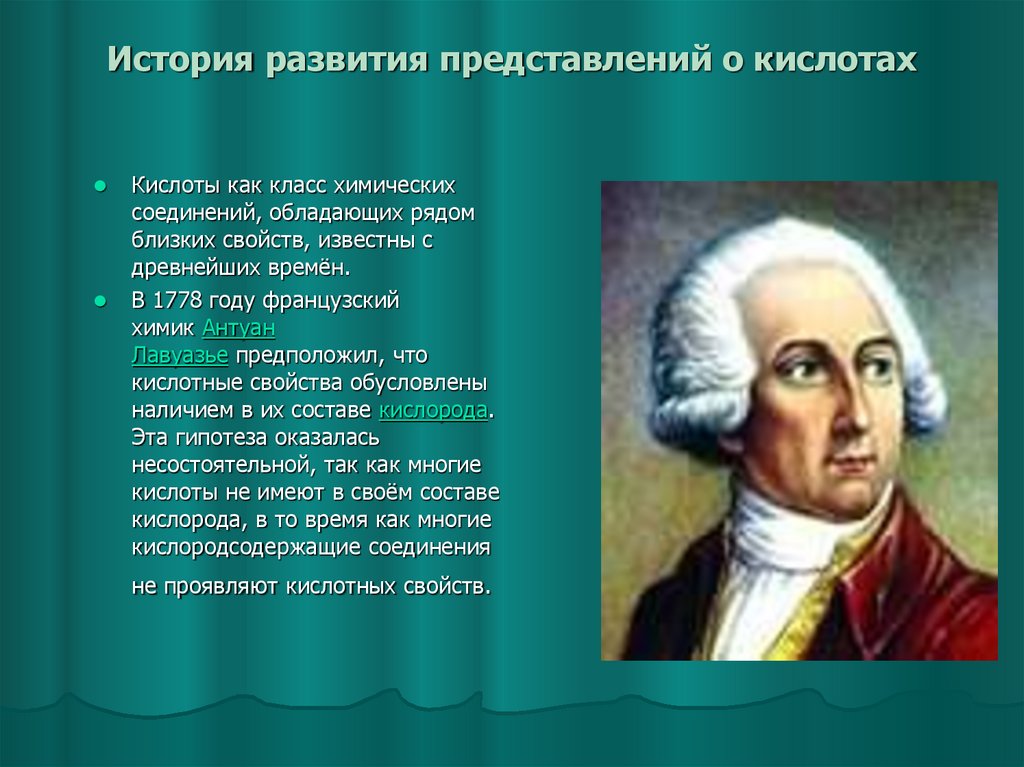
4. История развития представлений о кислотах
Кислоты как класс химическихсоединений, обладающих рядом
близких свойств, известны с
древнейших времён.
В 1778 году французский
химик Антуан
Лавуазье предположил, что
кислотные свойства обусловлены
наличием в их составе кислорода.
Эта гипотеза оказалась
несостоятельной, так как многие
кислоты не имеют в своём составе
кислорода, в то время как многие
кислородсодержащие соединения
не проявляют кислотных свойств.
5.
В 1833 году немецкийхимик Юстус Либих
определил кислоту как
водородсодержащее
соединение, в котором
водород может быть
замещён на металл.
6.
Первую попытку создать общуютеорию кислот и оснований
предпринял шведский
физикохимик Сванте Аррениус.
В его теории,
сформулированной в 1887 году,
кислота определялась как
соединение, диссоциирующее в
водном растворе с
образованием ионов водорода
H+
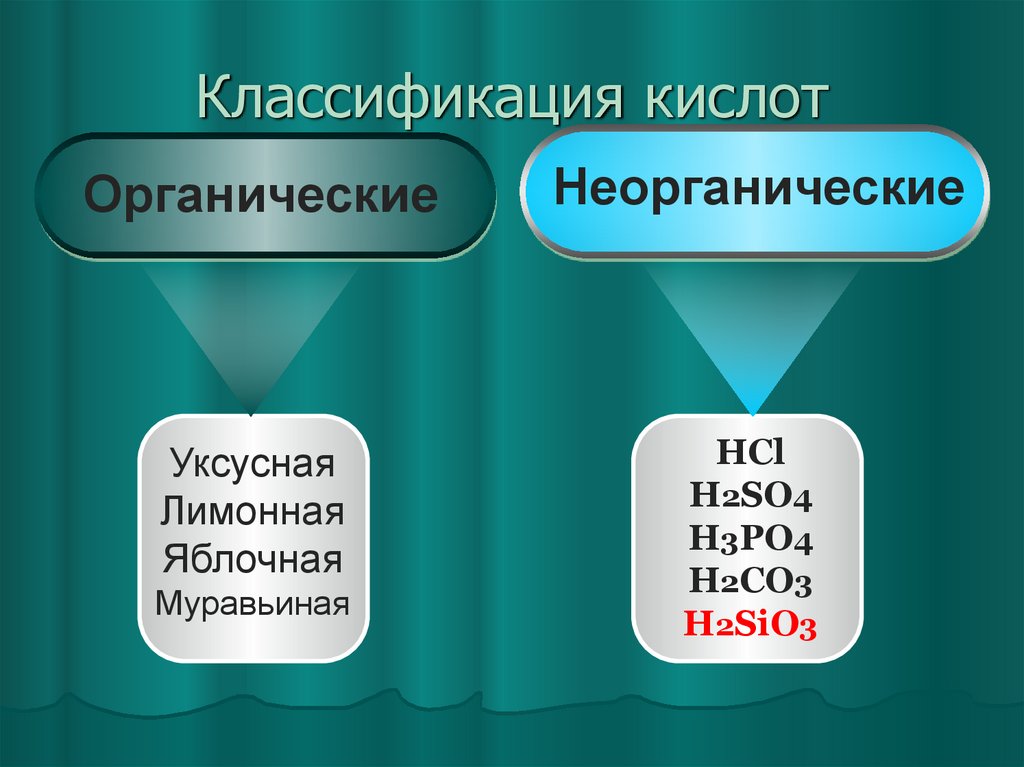
7. Классификация кислот
ОрганическиеНеорганические
Уксусная
Лимонная
Яблочная
HCl
H2SO4
H3PO4
H2CO3
H2SiO3
Муравьиная
8.
Что нас объединяет?9. Кислый вкус лимону придает лимонная кислота, яблоку — яблочная кислота, скисшему молоку — молочная кислота. Щавель имеет кислый
вкус благодаря наличию в его листьяхщавелевой кислоты.
10. Муравьиная кислота
Муравьиная кислота присутствует вкрапиве, и именно она ответственна
за ощущение жжения, которое
возникает при контакте с этим
растением. Она также используется
как химическое средство защиты
некоторыми насекомыми, например,
пчелами и муравьями. Когда в
организме муравья сокращается
ядовитая железа, муравьиная
кислота, которая хранится в ней,
попадает в жало и струями
выбрасывается наружу (у некоторых
особей - на расстояние до метра!).
Поскольку рН муравьиной кислоты
составляет 2-3 единицы, атакующие
насекомые обращаются в бегство
или гибнут.
11. Муравьиная кислота
Уже более 600 лет назаднатуралисты знали о том, что
муравьи вырабатывают едкую
жидкость. В 1671 году
английский натуралист Джон
Рей описал это вещество. Для
этого он собрал множество
мертвых муравьев и приготовил
их эссенцию. Кислота, которая
обнаружилась в этой эссенции,
позже получила название
муравьиной.
12.
Впервые синтезироватьмуравьиную кислоту смог
французский химик Жозеф ГейЛюссак, использовавший в
качестве исходного материала
синильную кислоту. В 1855 году
другой французский химик,
Марселин Бертло, разработал
синтез из окиси углерода
(угарного газа), и сегодня для
получения муравьиной кислоты
используется похожая
технология.
13. Муравьиную кислоту используют
Как консервирующий и антибактериальный агент при заготовке корма.Муравьиная кислота замедляет процессы гниения и распада, поэтому
сено и силос, обработанные муравьиной кислотой, дольше
сохраняются. Муравьиная кислота также используется в протравном
крашении шерсти, для борьбы с паразитами в пчеловодстве,
как растворитель в некоторых химических реакциях, как отбеливатель
при дублении кожи.
В медицине используется для приготовления растворов пермуравьиной
кислоты . Первомур используют в хирургии в качестве
предоперационного антисептического средства, в фармацевтической
промышленности для дезинфекции оборудования.
14. Уксусная кислота
Уксусная кислота былаединственной, которую знали
древние греки. Отсюда и ее
название: "оксос" - кислое,
кислый вкус. Уксусная кислота это простейший вид
органических кислот, которые
являются неотъемлемой частью
растительных и животных
жиров. В небольших
концентрациях она присутствует
в продуктах питания и напитках
и участвует в метаболических
процессах при созревании
фруктов.
15. Применение
Уксусная кислота – слабая.Кислотная среда подавляет
жизнедеятельность
микроорганизмов.
Используют при
консервировании.
Для получения искусственных
волокон и пластмасс на основе
целлюлозы.
В производстве красителей ,
медикаментов, ядохимикатов.
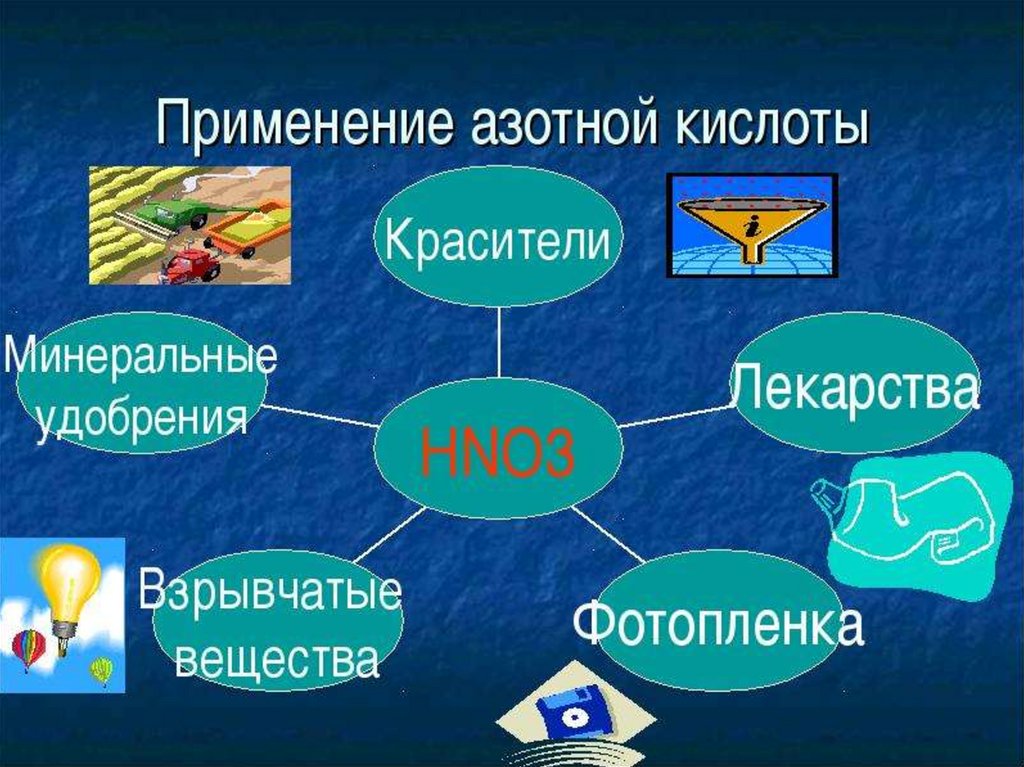
16. Азотная кислота
Воздействие на человекаАзотная кислота по степени
воздействия на организм относится
к веществам 3-го класса опасности.
Её пары очень вредны: пары
вызывают раздражение
дыхательных путей, а сама кислота
оставляет на коже
долгозаживающие язвы. При
действии на кожу возникает
характерное жёлтое окрашивание
кожи, обусловленное
ксантопротеиновой реакцией. При
нагреве или под действием света
кислота разлагается с образованием
высокотоксичного диоксида
азотаNO2 (газа бурого цвета).
17. Исторические сведения
Методика получения разбавленной азотной кислоты путём сухойперегонки селитры с квасцами и медным купоросом была, по
видимому, впервые описана в трактатах Джабира в VIII веке. Этот
метод с теми или иными модификациями применялся в европейской и
арабской алхимии вплоть до XVII века.
Во времена М. В. Ломоносова азотную кислоту называли крепкой
водкой.
18.
ГлауберВ XVII веке Глаубер предложил
метод получения летучих кислот
реакцией их солей с
концентрированной серной
кислотой, в том числе и азотной
кислоты из калийной селитры.
Метод Глаубераприменялся до
начала XX века, причём
единственной существенной
модификацией его оказалась
замена калийной на более
дешёвую натриевую
(чилийскую) селитру.
19.
20. Серная кислота.
Серная кислота известна с древности,встречаясь в природе в свободном виде,
например, в виде озёр вблизи вулканов.
Возможно, первое упоминание о кислых
газах, получаемых при
прокаливании квасцов или железног
о купороса «зеленого камня»,
встречается в сочинениях,
приписываемых арабскому
алхимику Джабир ибн Хайяну.
В IX веке персидский алхимик Ар-Рази,
прокаливая смесь железного и медного
купороса (FeSO4•7H2O и CuSO4•5H2O),
также получил раствор серной кислоты.
Этот способ усовершенствовал
европейский алхимик Альберт Магнус,
живший в XIII веке.
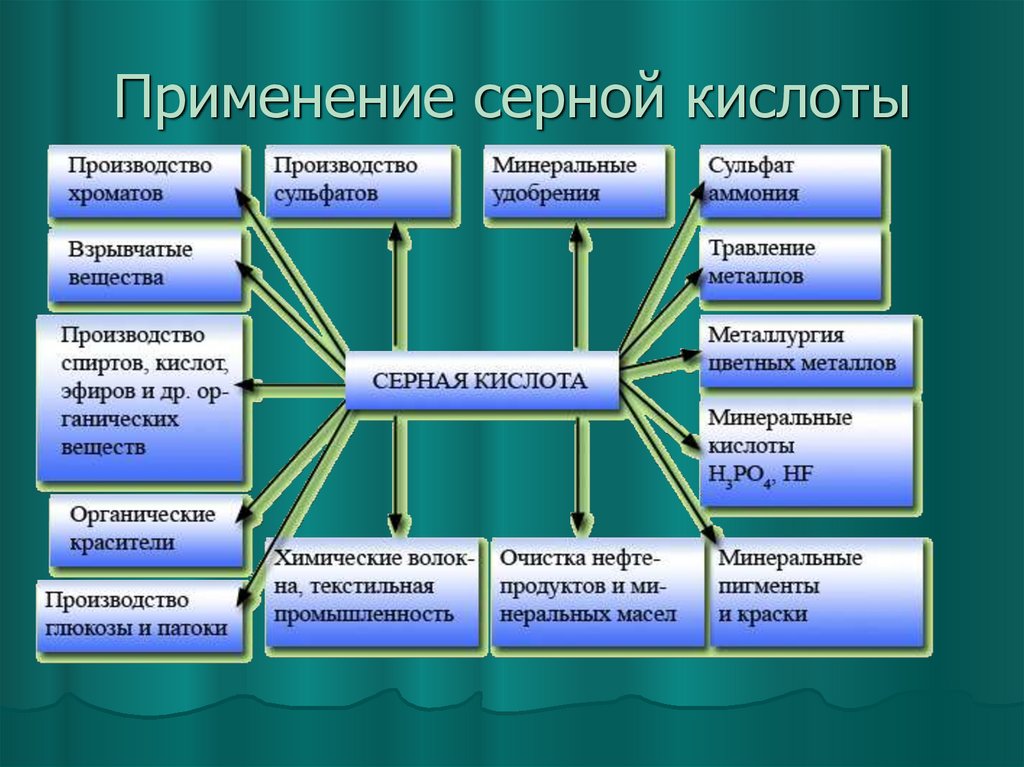
21. Применение серной кислоты
22. Химические показатели кислот.
Химическиесвойства
Уксусная
кислота
Серная
кислота
Степень
диссоциации
20%
100%
рН
2-3
2
Скорость
взаимодействия
с цинком
низкая
высокая
Скорость
взаимодействия
с оксидом
меди(II)
низкая
высокая
Действие на
органические
вещества
ожог
обугливание
23. Выводы
Органические кислоты являютсяслабыми электролитами.
Неорганические кислоты более
сильные.
24. Выводы по работе
Изучили классификацию кислот,способы получения , области
применения.
Исследовали физико – химические
показатели кислот.



















 Химия
Химия








