Похожие презентации:
Кинетика. Химическая кинетика
1.
ХИМИЧЕСКАЯ КИНЕТИКА2.
Химическая кинетика- учение о механизмах и скоростях
химических реакций - рассматривает гомогенные и гетерогенные
химические реакции, соответственно протекающие в гомогенных
или гетерогенных системах.
Гомогенная система – система, которая состоит из одной фазы.
Гетерогенная система – состоит из двух или более фаз.
Фаза – часть системы, отделенная от других частей системы
поверхностью раздела, при переходе которой свойства меняются
скачком. Гомогенные (или однофазные) реакции протекают во всем
объеме системы, а гетерогенные (как минимум двухфазные)- на
границе раздела фаз.
Скорость гомогенной химической реакции – изменение количества
вещества, вступающего в реакцию (или образующегося) в единицу
времени в единице объема (т.е. изменение молярной концентрации
со временем):
υгом = Δn ⁄(V•Δt) = ΔC ⁄Δt = dC ⁄dt.
Скорость гетерогенной химической реакции - изменение количества
вещества, вступающего в реакцию (или образующегося) в единицу
времени на единице площади поверхности фазы:
υгет. = Δn ⁄(S•Δt).
3.
ОСНОВНЫЕ ПОНЯТИЯВ ходе химической реакции исходные вещества (реагенты)
переходят в продукты реакции.
Элементарная реакция (элементарный акт) –
непосредственный переход исходных веществ в продукты.
Молекулярность реакции – число частиц, участвующих в
элементарном акте.(Разделяют мономолекулярные реакции: I2 → I•+•I;
бимолекулярные реакции: CH3Br+NaOH→CH3OH+NaBr; тримолекулярные
реакции: NO+NO+O2→2NO2 ).
Стадия химической реакции – последовательность
элементарных актов.
Механизм реакции – совокупность и последовательность
элементарных актов.
Интермедиат – короткоживущее промежуточное
вещество.
Прекурсор – вещество, участвующее в реакции,
приводящей к получению целевого продукта; или реагент,
любым образом играющий важную роль в получении
конечного продукта.
4.
Принципы (постулаты) химической кинетики- скорость простой (одностадийной) реакции
пропорциональна произведению концентраций
реагирующих веществ в степенях, равных
стехиометрическим коэффициентам в уравнении
реакции.
- скорость всей реакции можно считать равной
скорости ее самой медленной (лимитирующей)
стадии;
- принцип микроскопической обратимости
(детального равновесия): в состоянии равновесия
скорость прямой и обратной реакций равны;
5.
ЗАВИСИМОСТЬ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ ОТКОНЦЕНТРАЦИИ РЕАГИРУЮЩИХ ВЕЩЕСТВ
К.Гульдберг и П.Вааге, 1867 г., ЗАКОН ДЕЙСТВУЮЩИХ МАСС
Скорость элементарной химической реакции прямо пропорциональна
концентрации реагирующих веществ (при Т=const).
Для простой гомогенной реакции nаА + nbВ = nсC + ndD закон имеет вид:
υ=kCА nа •СВnb,
где na, nb, nc и nd – кол-во моль, k – константа скорости реакции,
показатель степени na и nb – порядок реакции, na + nb - общий порядок.
Одним условием протекания реакции является сближение (столкновение)
частиц А и В. Вероятность WА и WB нахождения частиц А и В точке x
пропорциональна их концентрация СА и СВ: WА≈ СА, WА≈ СВ.
Вероятность WАВ одновременного нахождения частиц А и В в точке х:
WАВ= WА∙WВ, тогда WАВ – это вероятность столкновения частиц А и В в
точке x. Скорость химической реакции пропорциональна вероятности столкновения частиц:
υ ≈ WА∙ WВ ≈ СА∙ СВ.
Следовательно, скорость реакции пропорциональна
произведению концентраций реагентов.
6.
ЗАКОН ДЕЙСТВУЮЩИХ МАСС ДЛЯГЕТЕРОГЕННОЙ ХИМИЧЕСКОЙ РЕАКЦИИ
Скорость гетерогенной химической реакции прямо
пропорциональна концентрации жидкой или
газообразной фазы и площади поверхности твердой
фазы (при Т=const).
В общем случае для простой гетерогенной реакции (вещество А – твердое)
νаА + νbВ = νсC + νdD закон действующих масс имеет вид:
υ = k'•const~SA • СВνb,
где νb, νc и νd – кол-во моль, k' – константа скорости реакции,
const ~SA- площадь поверхности твердой фазы.
Здесь отсутствует концентрация твердой фазы, которая в гетерогенном
процессе определяется числом частиц на единице поверхности; по
умолчанию условно считается, что Ст=1 и не записывается.
Для горения алюминия 4Alт + 3О2 г = 2Al2O3 т.
закон действующих масс будет иметь вид:
где р – парциальное давление кислорода.
υ = k р3,
7.
Температурная зависимость скорости химической реакции.В конце 19 века Вант-Гофф установил эмпирическим путем правило:
повышение температуры на 10о увеличивает скорость реакций в 2-4 раза.:
υ2 = υ1• γ ΔТ/10,
где υ1 и υ2 – скорости при температурах Т1 и Т2; ΔТ = Т2 - Т1, γ температурный коэффициент.
Не все столкновения частиц являются эффективными, частицы могут не
обладать достаточной для взаимодействия энергией. Необходимое и
достаточное количество энергии, которой должны обладать частицы,
является пороговым значением для каждой реакции и называется энергией
активации реакции Еа.
Энергия активации - минимальная избыточная (по
отношению к средней энергии частиц) энергия, которой
должны обладать частицы, чтобы их столкновение привело к
химическому взаимодействию.
Еа =const для данной реакции. Частицы, энергия которых Е≥Еа, являются
активными в данной системе, т.е. способными к взаимодействию при
столкновении.
8.
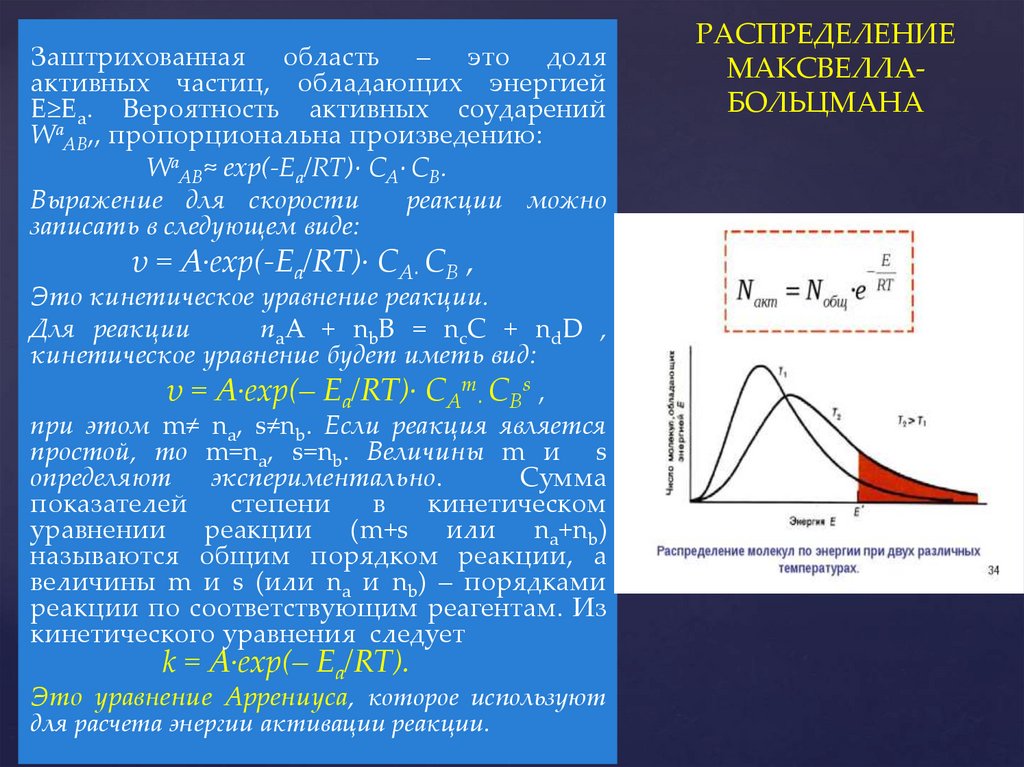
Заштрихованная область – это доляактивных частиц, обладающих энергией
Е≥Ea. Вероятность активных соударений
WаАВ,, пропорциональна произведению:
WаАВ≈ exp(-Ea/RT)∙ СА∙ СВ.
Выражение для скорости
реакции можно
записать в следующем виде:
υ = А∙exp(-Ea/RT)∙ СА∙ СВ ,
Это кинетическое уравнение реакции.
Для реакции
naA + nbB = ncC + ndD ,
кинетическое уравнение будет иметь вид:
υ = А∙exp(– Ea/RT)∙ САm∙ СВs ,
при этом m≠ na, s≠nb. Если реакция является
простой, то m=na, s=nb. Величины m и s
определяют экспериментально.
Сумма
показателей
степени
в
кинетическом
уравнении реакции (m+s или na+nb)
называются общим порядком реакции, а
величины m и s (или na и nb) – порядками
реакции по соответствующим реагентам. Из
кинетического уравнения следует
k = А∙exp(– Ea/RT).
Это уравнение Аррениуса, которое используют
для расчета энергии активации реакции.
РАСПРЕДЕЛЕНИЕ
МАКСВЕЛЛАБОЛЬЦМАНА
9.
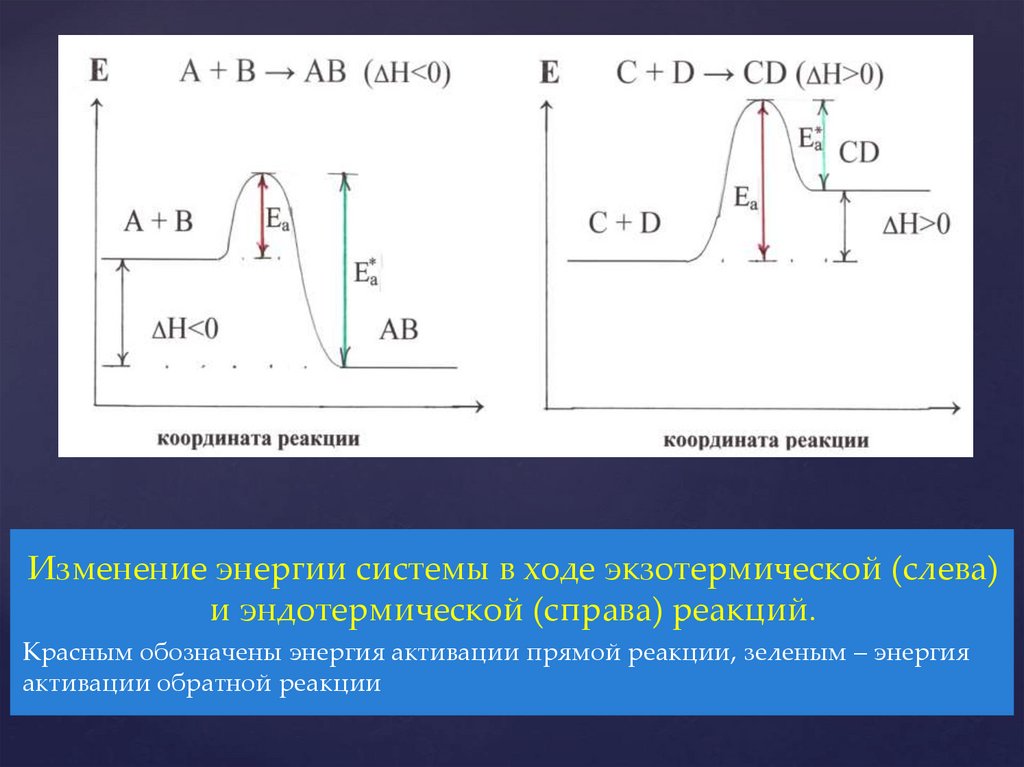
Изменение энергии системы в ходе экзотермической (слева)и эндотермической (справа) реакций.
Красным обозначены энергия активации прямой реакции, зеленым – энергия
активации обратной реакции
10.
АКТИВИРОВАННЫЙ КОМПЛЕКС.СХЕМА ГОМОГЕННОГО
КАТАЛИЗА
11.
ГОМОГЕННЫЙ И ГЕТЕРОГЕННЫЙ КАТАЛИЗКатализаторы – вещества, влияющие на скорость химической реакции, но не
расходующиеся по ее ходу и не входящие в продукты реакции.
Гомогенный катализ: 2SO2 газ + O2 газ — (NOгаз) → 2 SO3 газ
В присутствии и в отсутствии катализатора реакция идет разными путями: в
присутствии катализатора по ходу реакции образуются промежуточные
вещества (активированные комплексы) с участием катализатора,
снижающие энергию активации процесса.
Гетерогенный катализ: 2SO2 газ + O2 газ — (V2O5 тв.) → 2 SO3 газ
В этом случае также возможно образование активированных комплексов с
участием катализатора, но следует учитывать явление активированной
адсорбции на поверхности катализатора.
Адсорбция – явление, возникающее за счет свободной энергии поверхности
твердого вещества из-за частичной энергетической неуравновешенности
поверхностных частиц. Разделяют (1) физическую, (2) активированную
адсорбцию и хемосорбцию (3).
При активированной адсорбции частица из газовой фазы захватывает часть
энергии поверхности и активируется сама (а) и (б) – процесс сорбциидесорбции приводит к увеличению концентрации частиц газовой (жидкой)
фазы вблизи поверхности катализатора.
Любой катализатор обладает селективностью.
12.
СОСОТОЯНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ13.
СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯВлияние концентрации: при добавлении к равновесной системе какоголибо участвующего в процессе вещества, получает преимущество та
реакция, по ходу которой добавленное вещество расходуется.
Влияние температуры: повышение температуры в равновесной
системе стимулирует эндотермические процессы и мешает
экзотермическим.
k = A exp(- Ea / RT), k*= A*exp (- Ea* / RT)=> k*/k =A*/Aexp(-Ea*-(-Ea))/RT =
= B exp (-ΔH/RT), где B=A*/A.
Влияние давления: при увеличении давления получает
преимущество та реакция, которая приводит к получению
меньшего числа газовых молекул. 2NO + O2 ↔ 2NO2
v→= k* [NO]2•[O2] v→*= k* (2[NO])2•2[O2]=8 v→ ;
v←= k**[NO2]2 v←* = k**(2[NO2])2 = 4 v←
Принцип Ле-Шателье: если на систему, находящуюся в
состоянии равновесия, оказать какое-либо воздействие из вне, в
результате внутренних процессов это воздействия система
старается уменьшить.
14.
ЦЕПНЫЕ РЕАКЦИИЦепные реакции протекают с участием активных центров – атомов,
ионов или свободных радикалов и характеризуются:
- высоким квантовым выходом у ряда фотохимических процессов;
- высокой чувствительностью к примесям;
- влиянием формы и материала сосуда на скорость процесса,
- в некоторых случаях существует верхний и низкий порог давления;
- различие величин теоретической и экспериментальной экспонент в
уравнении Аррениуса.
Br2 + hν → Br* + H2 → HBr + H* + Br2 → HBr + Br* →….разветвление цепи;
→ Br* + H2 → HBr + H* + Br2 → HBr + Br* →….
Br*+*Br →Br2 + q; Br*+*H→HBr + q— обрыв цепи.
Н* + О2 → ОH* + Н2 → H2О + Н* →….
→ О* + H2 → ОH* + Н* →….
Препятствуют: 1. тройное столкновение с перераспределением энергии;
2. Столкновение с мешающей примесью, 3. столкновение со стенками сосуда с
передачей им энергии.












 Химия
Химия








