Похожие презентации:
Общие свойства кислот
1. ОБЩИЕ СВОЙСТВА КИСЛОТ:
Изменяют окраску индикаторов.Взаимодействуют :
с металлами, стоящими в ряду напряжений
до водорода;
с основными и амфотерными оксидами;
с основаниями;
с солями.
2.
HCl= H + + ClHNO3 = H+ + NO3H2SO4=2H+ + SO42Общие свойствакислот
определяются
наличием протона
водорода H + в
водных растворах
кислот.
3.
4.
5.
Cu + 4HNO3 = Cu (NO3)2+2H2O + 2NO2конц.
6. Тема: Взаимодействие азотной кислоты с металлами
Цели:Выяснить причину необычного
поведения азотной кислоты
при взаимодействии с
металлами.
Определить возможные
продукты реакций.
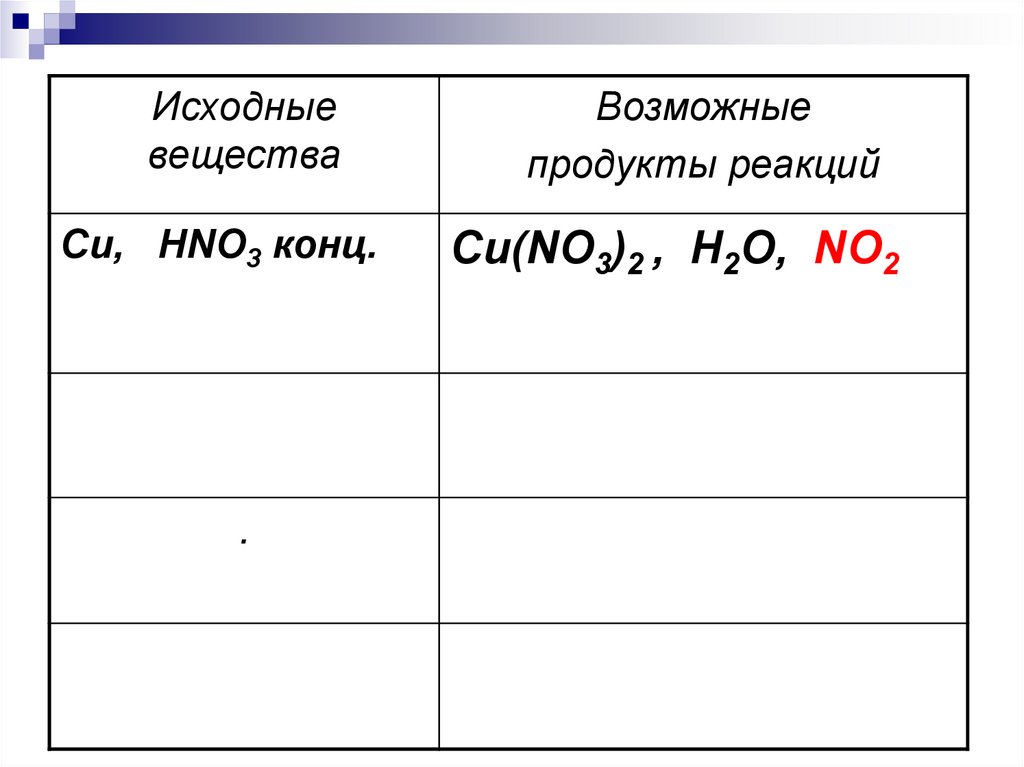
7.
Исходныевещества
Cu, HNO3 конц.
.
Возможные
продукты реакций
Cu(NO3)2 , H2O, NO2
8. Металл + HNO3 →соль + вода + соединение азота
ЗАПОМНИТЕ!При взаимодействии азотной
кислоты с металлами
водород не выделяется!
9.
01
1
2
1
0
Zn 2 H Cl Zn Cl2 H 2
2
0
Zn
2
e
Zn
вос-ль
1
0
2 Н 2е Н 2
ок-ль
окисление
восстановление
10.
2Cu 4 H N O 3 Cu N O3 2 H 2 O 2 N O2
2
0
1
5 2
0
вос-ль
5
2
1
2
4
2
Cu 2e Cu
5
ок-ль
2
1
окисление
2
восстановление
4
N 1e N
11. ВЫВОД:
HNO3- сильнейший окислитель.Окислителем будет не Н+ , а N+5
(+5 высшая с.о.)
У азотной кислоты любой концентрации
окислительные свойства протона
водорода Н+ не проявляются. Поэтому,
при взаимодействии с металлами
водород не выделяется, а образуются
продукты восстановления азотной
кислоты.










 Химия
Химия








