Похожие презентации:
Классификация химических реакций
1.
2.
3.
Тема урока:«Классификация
химических реакций»
4.
Задание № 1.Из предложенного перечня
химических формул:
Na2O, O2, SO3, H2, N2, H2S, NaCl, O3, H2O2
• Выпишите отдельно формулы:
а) простых веществ б) сложных веществ
4
5.
Задание № 2. «Классификация основа порядка в науке»• Расставьте коэффициенты в химических
уравнениях и ответьте на вопросы:
• Что объединяет эти реакции?
• В чем их отличие?
5
6.
Задание № 2. «Классификация основа порядка в науке»1. H2O2 → H2О + O2
2. Fe(OH)3 → Fe2O3 + H2O
3. HNO3 → NO2 + H2O + O2
6
7.
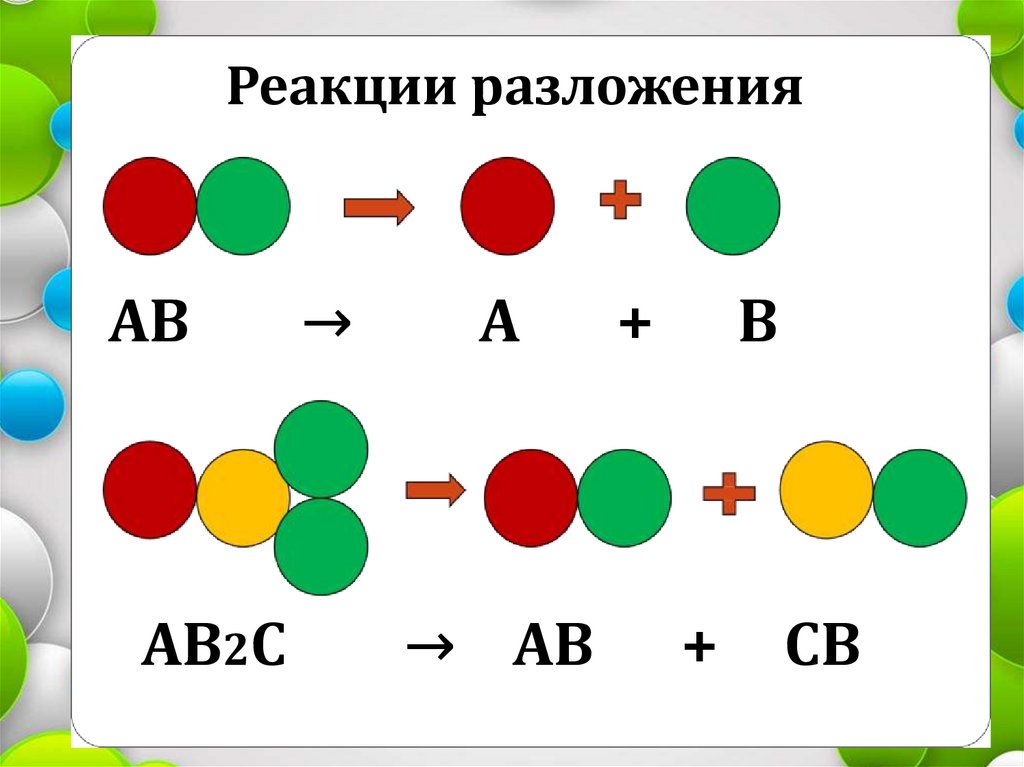
Реакции разложенияАВ
АВ2С
→
А
→ АВ
+
В
+
СВ
8.
Задание № 2. «Классификация основа порядка в науке»• Реакция разложения - это реакции, при
которых из одного сложного вещества
образуется два или более простых или менее
сложных веществ.
8
9.
Задание № 2. «Классификация основа порядка в науке»1. Na + O2 → Na2O2
2. К2О + Р2O5 → К3РO4
3. Li2O + H2O → LiOH
9
10.
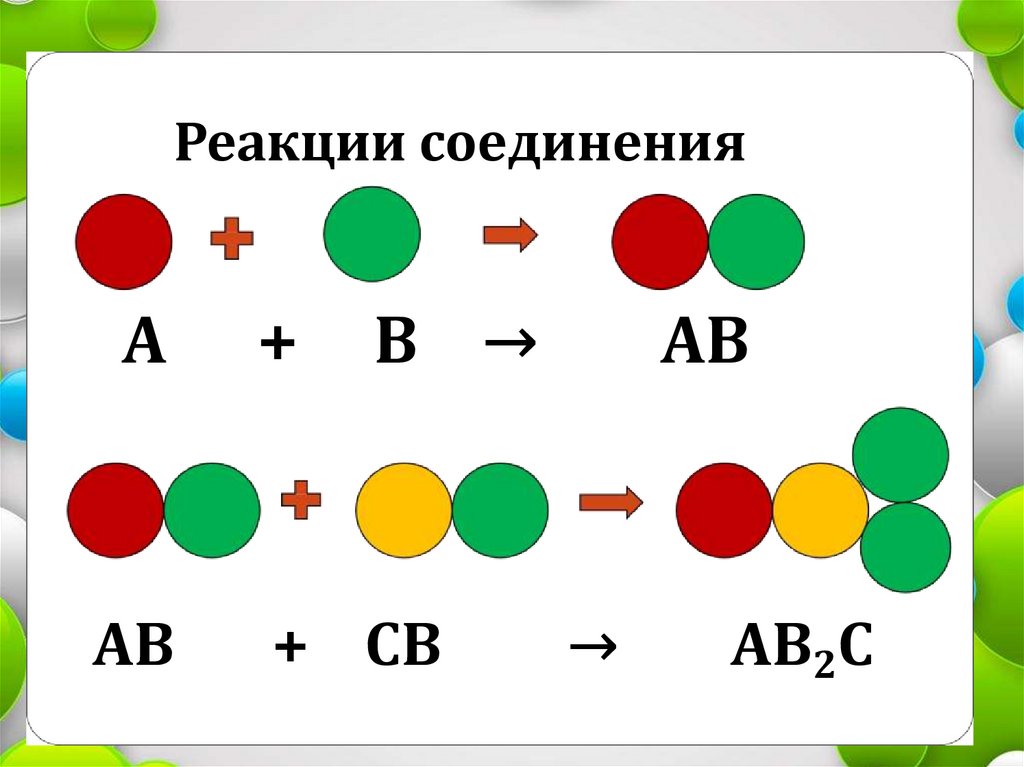
Реакции соединенияА
+
В →
АВ
+ СВ
АВ
→
АВ2С
11.
Задание № 2. «Классификация основа порядка в науке»• Реакция соединения – это реакции, при
которых из двух или более простых или
сложных веществ образуется одно новое
сложное вещество.
11
12.
Задание № 2. «Классификация основа порядка в науке»1. HСl + Al → AlСl3 + H2
2. Fe2O3 + C → Fe + CO2
3. CuSO4 + Al → Al2(SO4)3 + Cu
12
13.
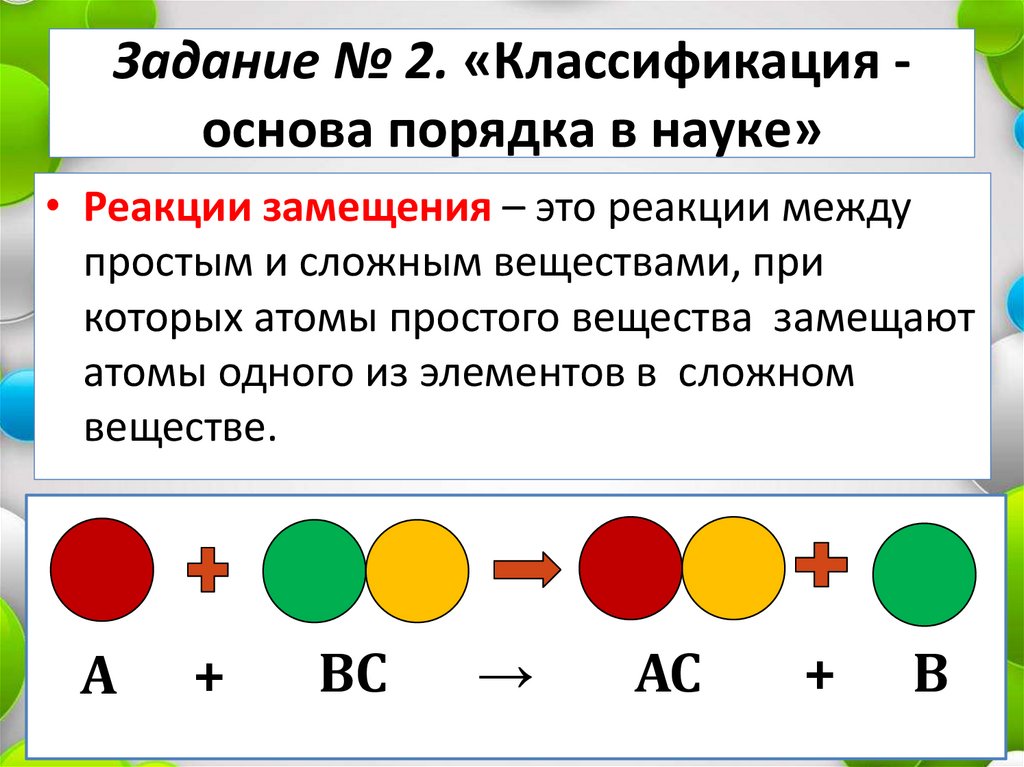
Задание № 2. «Классификация основа порядка в науке»• Реакции замещения – это реакции между
простым и сложным веществами, при
которых атомы простого вещества замещают
атомы одного из элементов в сложном
веществе.
А
+
ВС
→
АС
+
В
14.
Задание № 2. «Классификация основа порядка в науке»1. ВaCl2 + AgNO3→Вa(NO3)2 + AgCl
2. CuSO4 + KOH →K2SO4 + Cu(OH)2
3. HCl + MgO → MgCl2 + H2O
14
15.
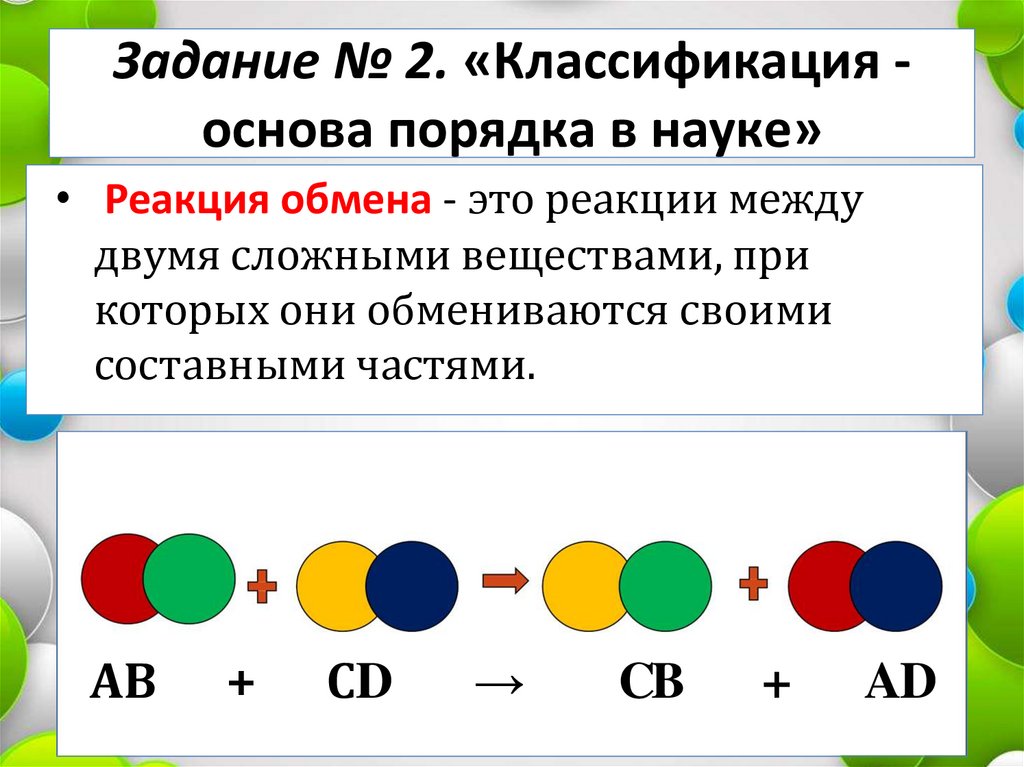
Задание № 2. «Классификация основа порядка в науке»• Реакция обмена - это реакции между
двумя сложными веществами, при
которых они обмениваются своими
составными частями.
АВ
+
СD
→
CB
+
AD
15
16.
Задание № 3. «Существует только одинзаменитель воображения - опыт»
• 2 и 4 группа - при взаимодействии медного купороса
(сульфата меди (II)) CuSO4 с едким натром (гидроксидом
натрия) NaOH выпадает осадок голубого цвета гидроксид меди
(II) Cu(OH)2 и образуется сульфат натрия Na2SO4.
• Напишите уравнение реакции и определите тип реакции.
• 1 и 3 группа – при взаимодействии цинка с соляной кислотой
HCl образуется хлорид цинка ZnCl2 и выделяется водород.
• Напишите уравнение реакции и определите тип реакции.
16
17.
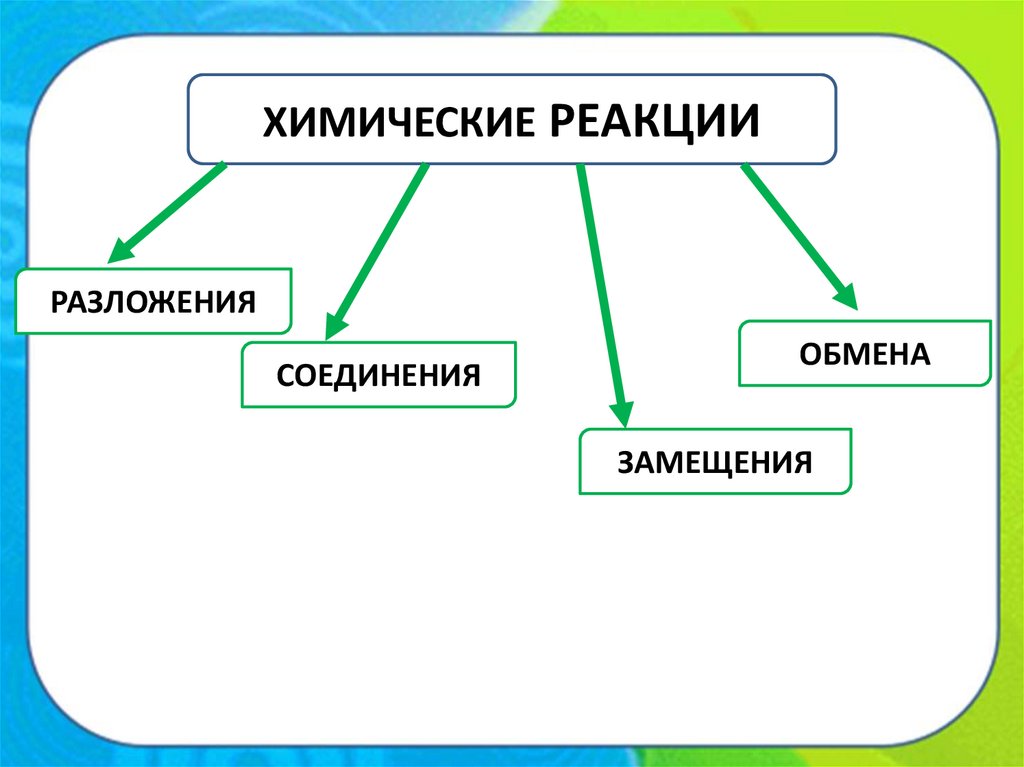
ХИМИЧЕСКИЕ РЕАКЦИИРАЗЛОЖЕНИЯ
СОЕДИНЕНИЯ
ОБМЕНА
ЗАМЕЩЕНИЯ
18.
Задание № 4. Составьте уравнения реакций поописанию, укажите тип каждой реакции:
• а) при нагревании питьевой соды
NaHCO3 образуется углекислый газ,
вода и кальцинированная сода
Na2CO3.
18
19.
ДОМАШНЕЕ ЗАДАНИЕ•§ 20
•I уровень №3 с.82
•II уровень № 2.18 (задачник)
•III уровень – задание №4 (из
презентации)
20.
РЕФЛЕКСИЯ• Что нового вы узнали на уроке?
• Что вам больше всего запомнилось
на уроке?
• В чём вы испытали затруднение?
• Оцените свою работу.
21.
ОТМЕТКА ЗА УРОК* 7 и более баллов – оценка «5»
* 5 – 6 баллов – оценка «4»
* 3 – 4 балла – оценка «3»
22.
23.
24.
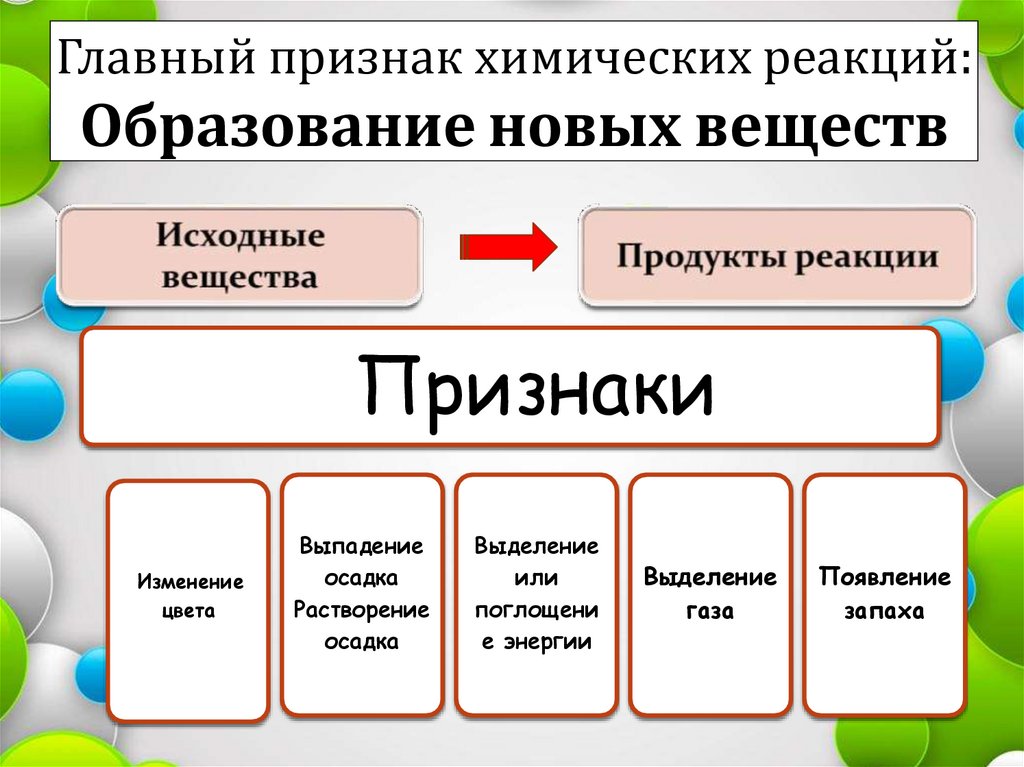
Главный признак химических реакций:Образование новых веществ
Признаки
Изменение
цвета
Выпадение
осадка
Растворение
осадка
Выделение
или
поглощени
е энергии
Выделение
газа
Появление
запаха
25.
Условия протеканияхимических реакций:
Первое условие:
Соприкосновение
реагирующих веществ (реагентов).
Второе условие: Нагревание реагентов
до определенной температуры.
Третье условие: Применение веществ,
ускоряющих реакцию (катализаторы).
26.
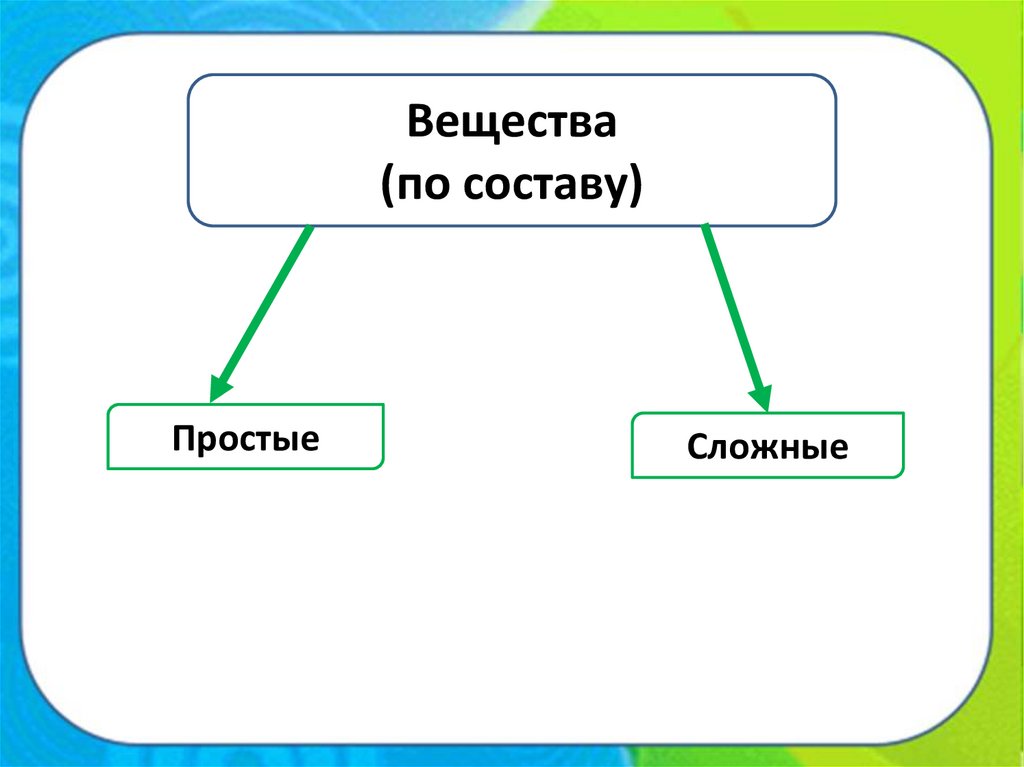
Вещества(по составу)
Простые
Сложные
27.
Задание № 4. Составьте уравнения реакций поописанию, укажите тип каждой реакции:
• 1 группа – а) при нагревании питьевой соды NaHCO3
образуется углекислый газ, вода и кальцинированная
сода Na2CO3.
• 2 группа - б) при взаимодействии калия и воды
образуется гидроксид калия КОН и водород.
• 3 группа - в) при нагревании железо взаимодействует
с кислородом с образованием железной окалины
Fe3O4.
• 4 группа – г) при взаимодействии негашеной извести
СаО с соляной кислотой HCl образуется хлорид
кальция CaCl2 и вода.
27




















 Химия
Химия








