Похожие презентации:
Люминесцентный анализ. Лекция 9-10
1.
Спектральные методы анализаЛекция 9-10
2023
1
2.
Лекция № 9Слайд 2
3.
Люминесцентный анализЛюминесценция (слабое действие) — один из видов
излучения вещества, избыточного над тепловым
излучением тела при данной температуре.
Излучение наблюдается вследствие перехода
электронно-возбужденных атомов, молекул,
радикалов, ионов — так называемых центров
люминесценции — в основное состояние.
По длительности процесса излучения различают
кратковременную люминесценцию, называемую
флуоресценцией (время излучения от 10−13 до 10−7с),
и медленную люминесценцию, называемую
фосфоресценцией (время излучения до нескольких
минут).
3
4.
Люминесцентный анализВ 1852 г. Дж.Г. Стокс установил, что длина волны
фотолюминесценции больше длины волны
возбуждающего света
( правило Стокса ).
В 1864 г. он предложил использовать явление
люминесценции для качественного анализа
органических веществ.
Широкое применение люминесцентные методы
анализа получили в 1930-е гг. благодаря работам
С.И.Вавилова и его школы.
4
5.
Люминесцентный анализПроцесс люминесценции может происходить в различных
веществах, находящихся в разных агрегатных состояниях.
Люминесцентными центрами могут быть атомы,
молекулы, радикалы, ионы, эксимеры (dimer) и
эксиплексы (complex) — молекулы и их соединения,
устойчивые только в электронно-возбужденном
состоянии.
При переходе в основное электронное состояние
эксимеры и эксиплексы распадаются, испуская при этом
квант электромагнитного излучения.
Особенности излучения различных люминесцентных
центров могут быть использованы в аналитических
целях.
5
6.
Люминесцентный анализДля возбуждения люминесцентного центра могут быть
использованы различные источники.
Необходимое условие их эффективности — энергия
излучения должна быть достаточна для возбуждения
электронного перехода в исследуемом веществе.
Возбуждение квантами света приводит к явлению фото
люминесценции .
Если вещество возбуждается потоком электронов
определенной энергии (длины волны), наблюдается
катодолюминесценция .
С помощью рентгеновского излучения можно возбудить
рентгенолюминесценцию . На этом основан метод
рентгенофлуоресцентного анализа .
6
7.
Люминесцентный анализПод действием ионизирующего излучения возникает
радиолюминесценция , или сцинтилляция .
Воздействие электрического поля на исследуемое вещество
приводит к электролюминесценции .
Под действием трения возникает триболюминесценция .
Ультразвуковое воздействие приводит к сонолюминесценции .
Энергия, выделяемая в результате химической реакции, может
быть источником хемилюминесценции .
При адсорбции вещества на поверхности может выделиться
энергия, достаточная для возбуждения люминесценции. Это
явление называют адсорболюминесценцией, или
гетерохемилюминесценцией .
Разные виды люминесценции находят применение в различных
вариантах метода люминесцентного анализа.
7
8.
Люминесцентный анализНаиболее универсальный метод возбуждения
люминесценции — фотовозбуждение
исследуемого вещества. Он используется чаще
всего в атомных и молекулярных методах
анализа.
При фотовозбуждении легко регулировать длину
волны возбуждающего излучения, его
интенсивность и поляризацию.
При анализе многокомпонентной смеси удается
возбудить электронный переход,
сопровождающийся люминесценцией только
одного из компонентов смеси.
Таким образом можно проводить избирательный
8
(селективный) анализ смеси веществ.
9.
Люминесцентный анализПроцесс электронного возбуждения протекает очень
быстро и характеризуется временем порядка 10 -14 с —
период колебания используемых электромагнитных волн.
Электронное возбуждение сопровождает процесс
внутримолекулярного колебательного перераспределения
энергии — колебательной релаксации (Intramolecular
Vibrational Relaxation — IVR), который протекает за время
порядка 10 −14 —10 −9 c.
Наиболее широкое применение в аналитических целях
имеет молекулярная фотолюминесценция для веществ,
находящихся в растворе.
9
10.
Люминесцентный анализСхематически процесс возбуждения и сопровождающий
его процесс люминесценции возможно представить
следующим образом:
где А( E vib ), A( E ′ vib ) — основное состояние центра
люминесценции А соответственно до поглощения
излучения и после испускания кванта люминесценции;
Evib , E′ vib — колебательная энергия основного состояния
соответственно до поглощения излучения и после
люминесценции соответственно;
A * — возбужденное состояние;
hνE — энергия кванта фотовозбуждения;
hνL — энергия кванта люминесценции.
10
11.
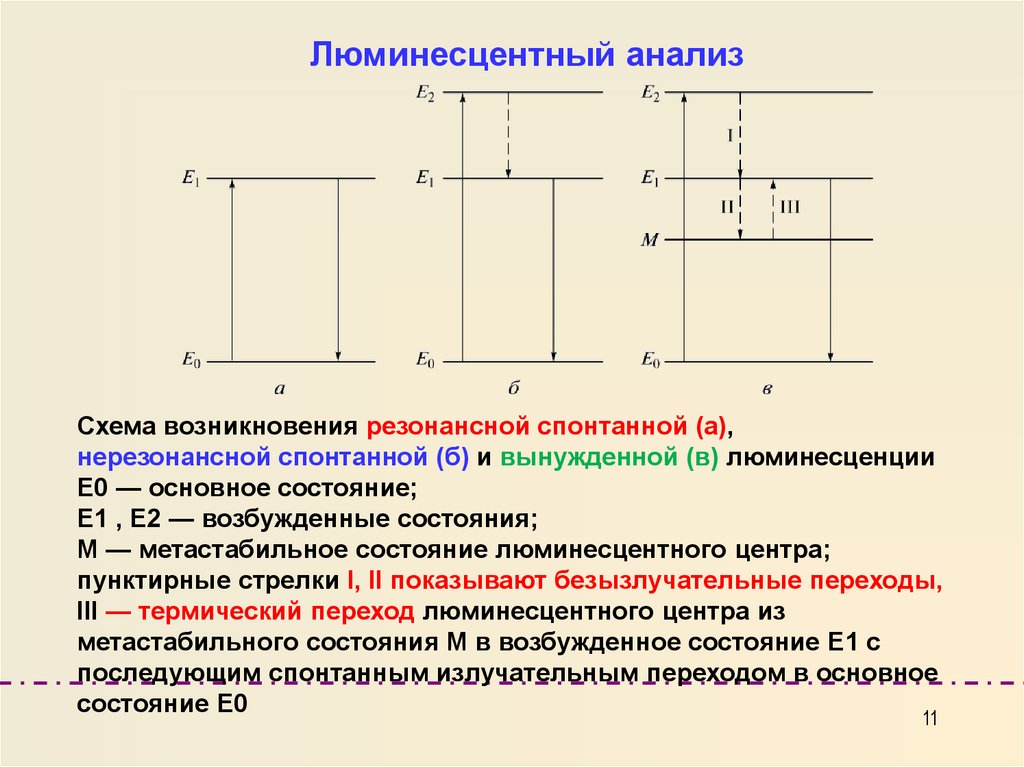
Люминесцентный анализСхема возникновения резонансной спонтанной (а),
нерезонансной спонтанной (б) и вынужденной (в) люминесценции
Е0 — основное состояние;
Е1 , Е2 — возбужденные состояния;
М — метастабильное состояние люминесцентного центра;
пунктирные стрелки I, II показывают безызлучательные переходы,
III — термический переход люминесцентного центра из
метастабильного состояния М в возбужденное состояние Е1 с
последующим спонтанным излучательным переходом в основное
состояние Е0
11
12.
Люминесцентный анализРазличают спонтанную и вынужденную люминесценцию
возбужденного состояния A*.
Спонтанная люминесценция сопровождает разрешенный
правилами отбора электронный переход возбужденного
центра люминесценции A * → A.
Если энергия возбуждающего кванта hνE равна энергии
электронного перехода, сопровождающего последующий
процесс
люминесценции, то наблюдается резонансная
люминесценция .
Вероятность такого перехода не зависит от температуры,
определяющей распределение по колебательным уровням
основного и электронно-возбужденного состояний центра
люминесценции, и определяется только правилами отбора
электронных переходов. Спектры спонтанной
люминесценции наблюдаются для паров металлов и ряда
сложных органических молекул, находящихся в растворах.
12
13.
Люминесцентный анализВ ряде случаев прямой переход из
возбужденного электронного состояния в
основное мало вероятен вследствие запрета по
правилам отбора. Тогда, например при
повышении температуры, можно достичь
возбужденного состояния, для которого
спонтанный переход в основное состояние
разрешен правилами отбора.
Такому переходу соответствует спектр
вынужденной люминесценции . Вынужденная
люминесценция наблюдается в растворах
сложных органических молекул при низких
температурах, а также для соединений,
локализованных в полимерных пленках, в
13
стеклах
14.
Механизм и особенностилюминесценции
Для объяснения явлений флуоресценции и
фосфоресценции была предложена схема
электронных переходов, в которой учитывался
переход из возбужденного электронного уровня
на промежуточный метастабильный уровень, на
котором электрон, имеющий избыток энергии,
может некоторое время удерживаться.
Избыток энергии затем относительно медленно
«высвечивается», и этим объясняется явление
фосфоресценции.
Метастабильные состояния являются
триплетными
14
15.
Механизм и особенностилюминесценции
В основном электронном состоянии молекулярные
орбитали большинства соединений заполнены
парами электронов.
Такое состояние называют синглетным и
обозначают символом S0.
В соответствии с принципом Паули электроны,
заполняющие одну и ту же орбиталь, должны
иметь противоположно направленные спины.
Таким образом, спиновое квантовое число в
основном состоянии равно нулю.
15
16.
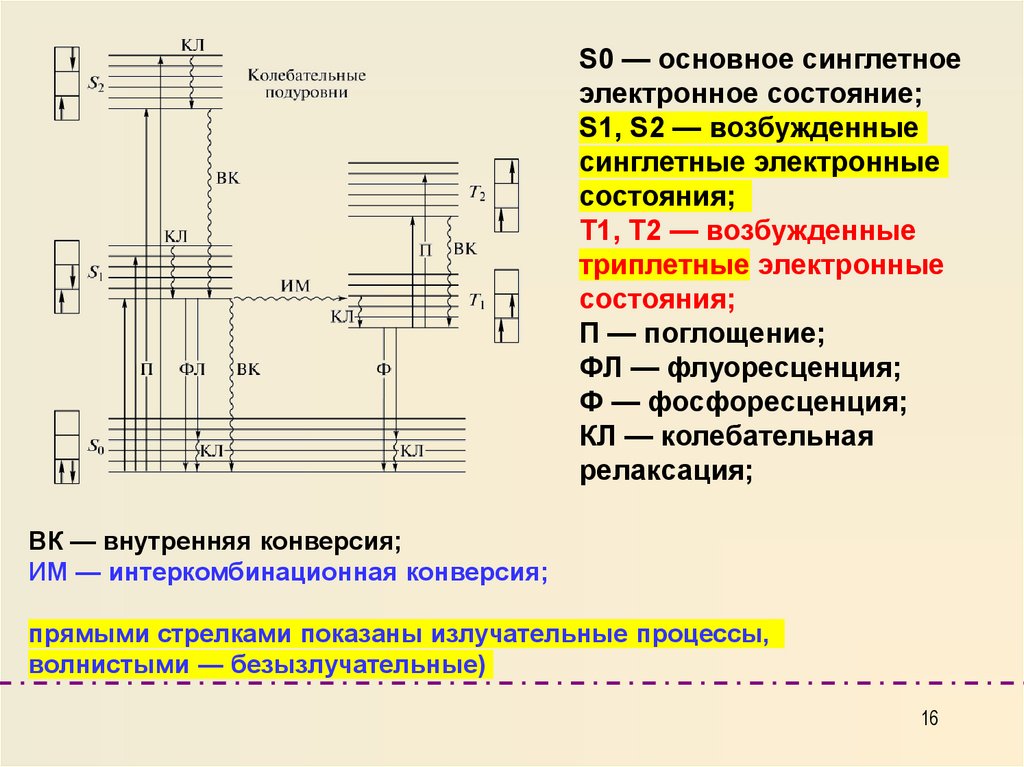
S0 — основное синглетноеэлектронное состояние;
S1, S2 — возбужденные
синглетные электронные
состояния;
Т1, Т2 — возбужденные
триплетные электронные
состояния;
П — поглощение;
ФЛ — флуоресценция;
Ф — фосфоресценция;
КЛ — колебательная
релаксация;
ВК — внутренняя конверсия;
ИМ — интеркомбинационная конверсия;
прямыми стрелками показаны излучательные процессы,
волнистыми — безызлучательные)
16
17.
Механизм и особенностилюминесценции
Мультиплетность состояния
При электронном возбуждении противоположная
ориентация спинов может сохраниться, и система снова
окажется в синглетном состоянии — S1, S2, …
Переход S0 → S1, S2 , … в соответствии с принципами
квантовой механики имеет наибольшую вероятность и
называется разрешенным , что соответствует правилу
отбора для электронных переходов:
17
18.
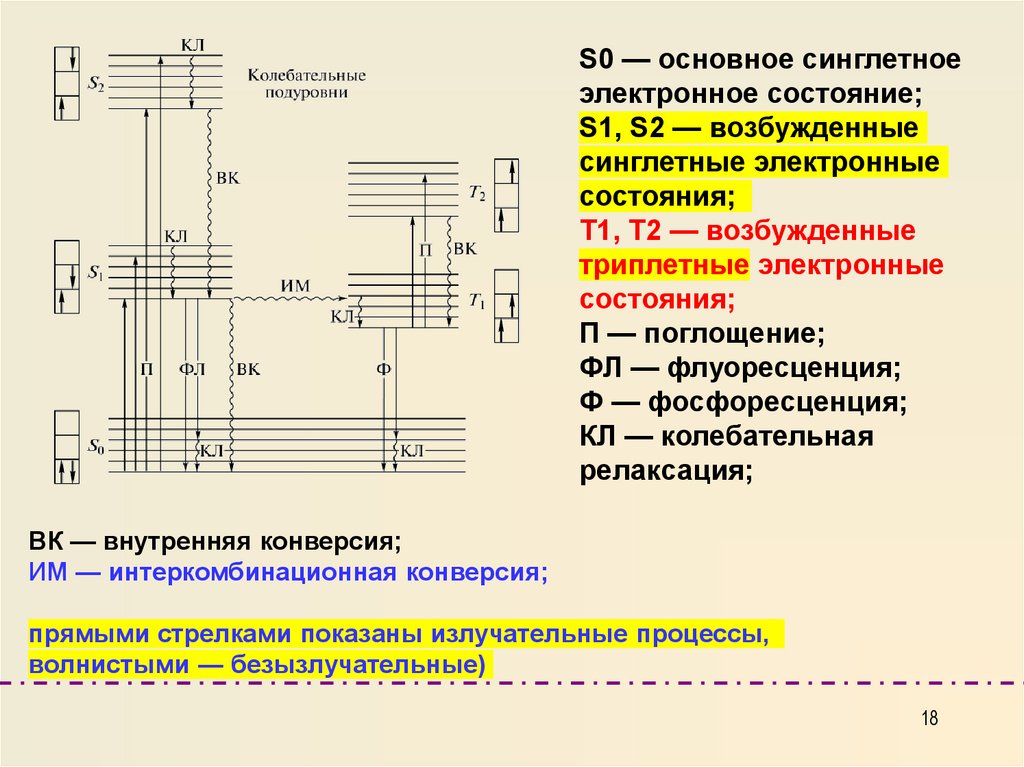
S0 — основное синглетноеэлектронное состояние;
S1, S2 — возбужденные
синглетные электронные
состояния;
Т1, Т2 — возбужденные
триплетные электронные
состояния;
П — поглощение;
ФЛ — флуоресценция;
Ф — фосфоресценция;
КЛ — колебательная
релаксация;
ВК — внутренняя конверсия;
ИМ — интеркомбинационная конверсия;
прямыми стрелками показаны излучательные процессы,
волнистыми — безызлучательные)
18
19.
Механизм и особенностилюминесценции
Если при электронном возбуждении перешедший на верхнюю
молекулярную орбиталь электрон ориентирован в том же
направлении, что и электрон в основном состоянии S0, то
результирующее квантовое число будет равно единице:
S = (+ 1 / 2 ) + (+ 1 / 2 ) = 1;
При орбитальном движении электрона создается магнитное поле.
В соответствии с принципами квантовой механики проекция
спина электрона, находящегося в состоянии S, на ось,
коллинеарную направлению магнитного поля электрона, может
принимать три значения: +1, 0, −1.
Такое состояние называют триплетным и обозначают буквой T
(triplet state).
Его энергия меньше энергии соответствующего возбужденного
синглетного состояния — правило Гунда .
19
20.
Механизм и особенностилюминесценции
Качественно это соответствует наименьшей
энергии кулоновского отталкивания электронов,
если они находятся на разных, ортогонально
расположенных орбиталях.
Правила отбора для перехода S0 → T не
выполняются, поскольку Δ J ≠ 0. Следовательно,
вероятность такого перехода мала.
Существенную заселенность триплетного
состояния можно создать при использовании
источников излучения большой интенсивности,
например импульсных ламп или импульсных
лазеров.
20
21.
Механизм и особенностилюминесценции
Процесс излучения, обусловленный переходом между
состояниями одинаковой мультиплетности, например S1 →
S0 или Т1 → Т0 , называют флуоресценцией ;
Это быстрый процесс, характеризующийся временами
порядка
10−13 —10−7 с.
Излучение света в результате перехода между
электронными состояниями разной мультиплетности, например Т1 → S0 или
S1 → Т0, называют фосфоресценцией.
Вероятность этого процесса существенно ниже, чем
флуоресценции, что определяет относительно большую
длительность процесса фосфоресценции.
21
22.
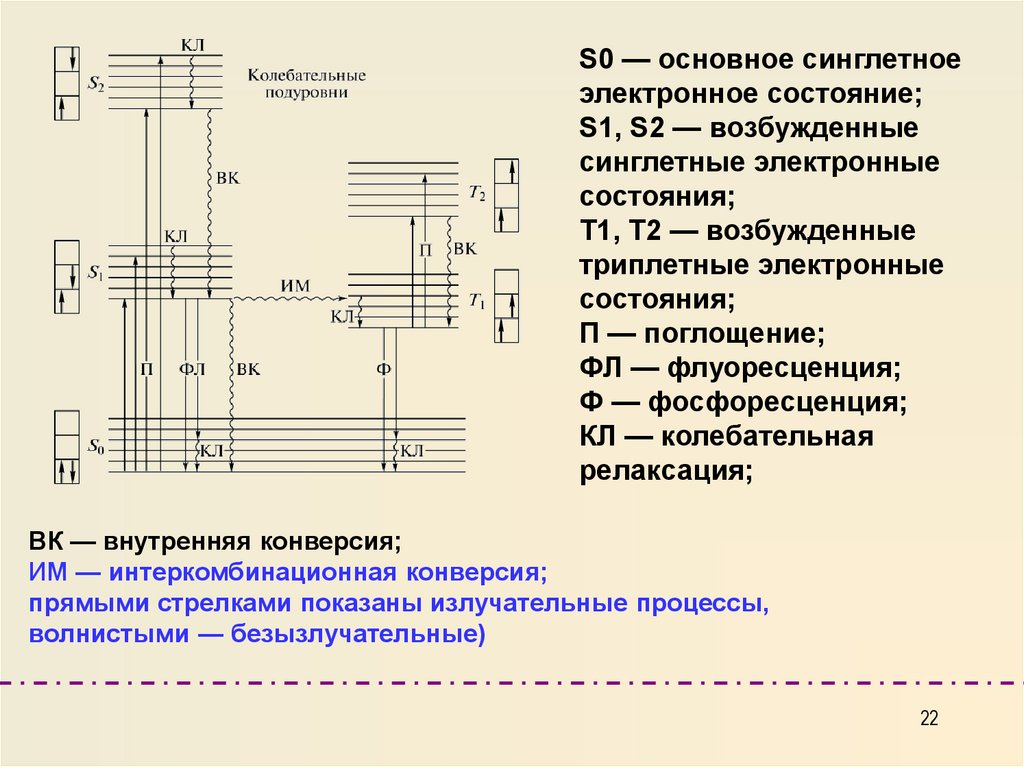
S0 — основное синглетноеэлектронное состояние;
S1, S2 — возбужденные
синглетные электронные
состояния;
Т1, Т2 — возбужденные
триплетные электронные
состояния;
П — поглощение;
ФЛ — флуоресценция;
Ф — фосфоресценция;
КЛ — колебательная
релаксация;
ВК — внутренняя конверсия;
ИМ — интеркомбинационная конверсия;
прямыми стрелками показаны излучательные процессы,
волнистыми — безызлучательные)
22
23.
Механизм и особенностилюминесценции
Дезактивация электронно-возбужденного
состояния молекулы может проходить в
результате излучательного процесса (прямые
стрелки) или безызлучательного процесса
(волнистые стрелки).
Безызлучательным процессом дезактивации
возбужденного состояния может быть
внутренняя конверсия энергии возбуждающего
излучения, интеркомбинационная конверсия или
колебательная релаксация.
23
24.
Лекция 10Слайд 24
25.
Энергетический и квантовый выходлюминесценции.
Количественными характеристиками люминесценции являются:
25
26.
Энергетический и квантовый выходлюминесценции.
26
27.
Энергетический и квантовый выходлюминесценции.
27
28.
Энергетический и квантовый выходлюминесценции.
28
29.
Количественный и качественныйлюминесцентный анализ
При непрерывном возбуждении образца (и отсутствии тушения
люминесценции) интенсивность люминесценции пропорциональна
числу испускаемых квантов:
Величины I0 , I связаны законом Бугера—Ламберта—Бера, которое
здесь запишем в виде
29
30.
Количественный и качественныйлюминесцентный анализ
30
31.
Количественный и качественныйлюминесцентный анализ
31
32.
Количественный и качественныйлюминесцентный анализ
32
33.
Количественный и качественныйлюминесцентный анализ
33
34.
Количественный и качественныйлюминесцентный анализ
34
35.
Люминесцентный спектрометр Perkin Elmer FL6500Спектральный диапазон
(возбуждение и эмиссия)
200-900 нм
Набор щелей (возбуждение и
эмиссия)
1, 2.5, 5, 10, 20 нм
Источник излучения Ксеноновая
пульсирующая лампа
Сигнал : шум Не менее 750 : 1
(RMS)
Скорость сканированияДо 24000
нм/мин
Слайд 35
36.
Основные Законы люминесценцииЭто закон Стокса, правило Каши,
правило
Левшина, закон Вавилова.
Слайд 36
37.
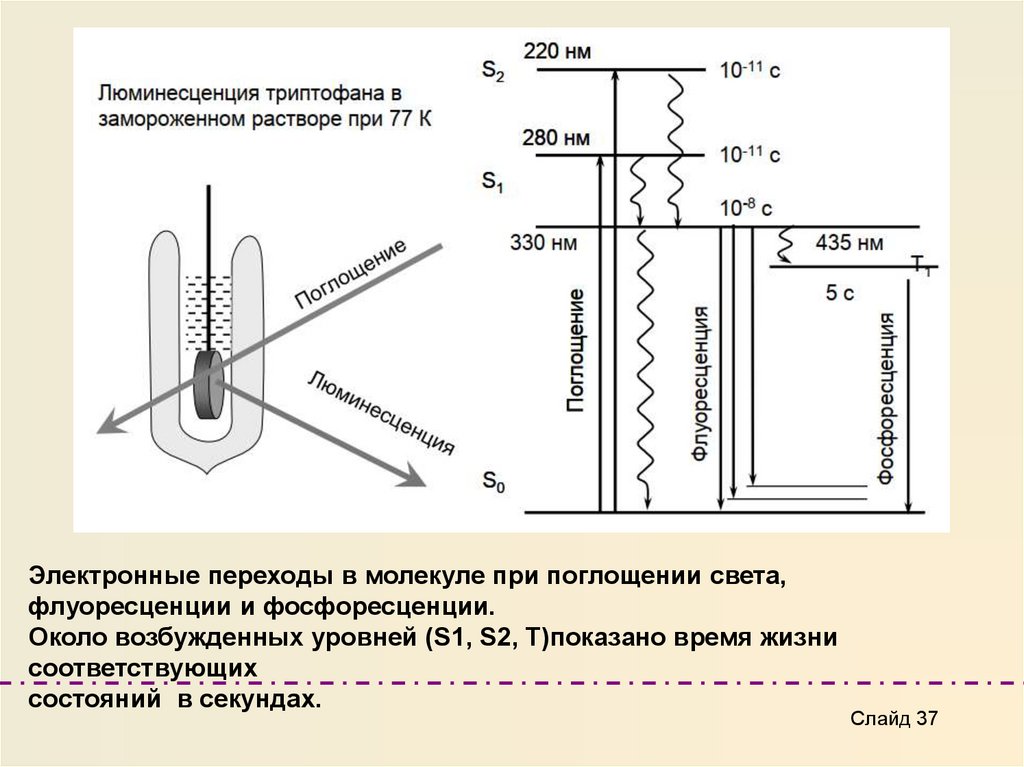
Электронные переходы в молекуле при поглощении света,флуоресценции и фосфоресценции.
Около возбужденных уровней (S1, S2, T)показано время жизни
соответствующих
состояний в секундах.
Слайд 37
38.
Закон СтоксаСпектром люминесценции (флуоресценции или фосфоресценции)
называют зависимость IL = f (λ),
где IL – интенсивность света люминесценции в относительных
единицах, измеренная при длине волны λ.
Согласно закону Стокса, спектр флуоресценции лежит в более
длинноволновой области по сравнению со спектром поглощения
того же соединения. Это означает, что средняя энергия квантов
флуоресценции меньше средней энергии поглощенных квантов.
На рисунке данная закономерность проявляется в том, что длина
прямых стрелок вверх (электронные переходы при поглощении
света) в среднем больше длины стрелок, направленных вниз
(электронные переходы при флуоресценции и фосфоресценции).
Причина такого явления уже была рассмотрена выше – это
превращение части энергии поглощенного фотона в тепловую
энергию окружающих молекул.
Слайд 38
39.
Правило КашиПравило Каши относится к форме спектра флуоресценции при
возбуждении объекта светом разных длин волн. Испускание квантов
флуоресценции всегда происходит с нижнего возбужденного уровня
молекулы, независимо от того, на какой уровень был заброшен
перед этим электрон в результате поглощения фотона. Это
означает, что какой бы длиной волны ни была возбуждена молекула
(разные вертикальные стрелки вверх на схеме), излучение будет
происходит из одного и того же состояния молекулы, и спектр
флуоресценции во всех случаях будет одинаковым.
Следовательно, спектр флуоресценции (и фосфоресценции) не
зависит от длины волны возбуждающего излучения.
Правило Каши и закон Стокса имеют большое значение при
проведении
спектрофлуориметрических измерений. В соответствии с законом
Стокса, для
возбуждения люминесценции используют излучение с длинами волн,
меньшими коротковолновой границы спектра флуоресценции.
Благодаря этому рассеянный объектом возбуждающий свет может
быть полностью убран при помощи светофильтров или
монохроматора и не мешает регистрации люминесценции.
Слайд 39
40.
Правило ЛевшинаПравило Левшина, называемое также законом зеркальной
симметрии, утверждает, что спектры флуоресценции по форме
зеркально симметричны длинноволновой полосе спектра
поглощения, если они построены в шкале частот (энергий).
Иллюстрацией этого правила могут служить спектры поглощения и
флуоресценции антрацена, приведенные на рисунке. Такое явление
можно объяснить тем, что свойства молекулы, в частности
расстояние между колебательными подуровнями и вероятности
переходов на них, близки у молекул в основном и в электронновозбужденном состояниях. Это говорит о том, что геометрия
молекул в электронно-возбужденном состоянии мало изменяется по
сравнению
с основным состоянием.
родамин 6Ж в
ацетоне
Слайд 40
41.
Закон ВавиловаЗакон Вавилова заключается в том, что квантовый выход
флуоресценции не зависит от длины волны возбуждения
люминесценции. Квантовым выходом люминесценции называют
отношение числа квантов, высвеченных в виде люминесценции, к
числу поглощенных образцом квантов. Очевидно, что эта величина
может принимать значения от 0 до 1.
От чего зависит квантовый выход? Поглощение кванта света в области
основного
электронного перехода приводит к образованию молекулы в
возбужденном состоянии т. е. в состоянии S1. Вероятность перехода
молекулы из состояния S0 в состояние S1 при поглощении фотона
равна единице и не зависит от длины волны поглощенного фотона.
Излучательный переход молекулы с нижнего подуровня
возбужденного состояния происходит с вероятностью η, меньшей
единицы, и сопровождается высвечиванием кванта флуоресценции.
Очевидно, что η и есть квантовый выход флуоресценции. Он
меньше единицы, поскольку есть некоторая вероятность (1– η)
безызлучательных переходов в основное состояние непосредственно
или через триплетное состояние, а также других способов растраты
энергии.
Слайд 41
42.
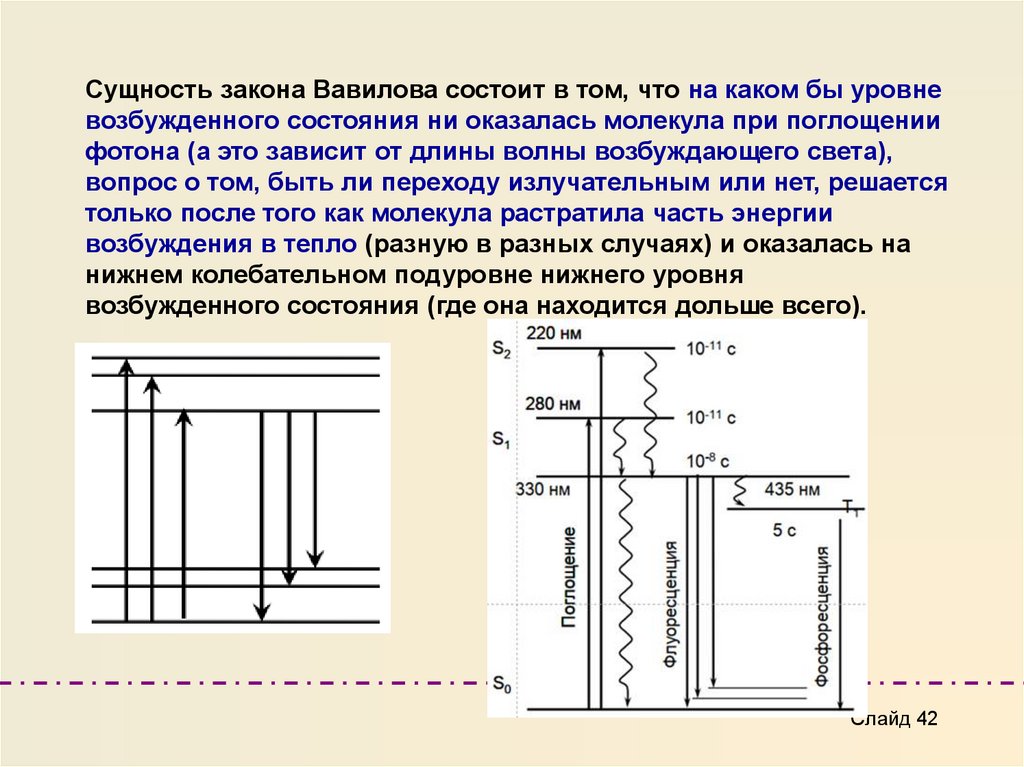
Сущность закона Вавилова состоит в том, что на каком бы уровневозбужденного состояния ни оказалась молекула при поглощении
фотона (а это зависит от длины волны возбуждающего света),
вопрос о том, быть ли переходу излучательным или нет, решается
только после того как молекула растратила часть энергии
возбуждения в тепло (разную в разных случаях) и оказалась на
нижнем колебательном подуровне нижнего уровня
возбужденного состояния (где она находится дольше всего).
Слайд 42
43.
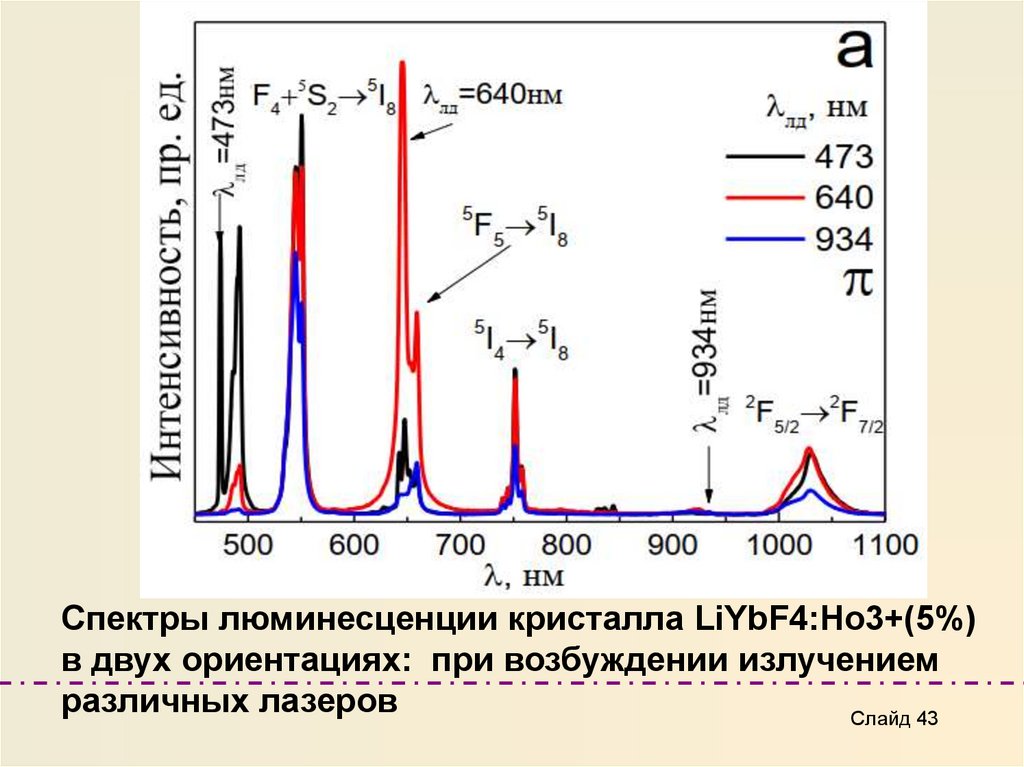
Спектры люминесценции кристалла LiYbF4:Ho3+(5%)в двух ориентациях: при возбуждении излучением
различных лазеров
Слайд 43
44.
Слайд 4445.
Вопросы для тестирования1.В чем состоит явление люминесценции?
2.Какими способами может быть возбуждено люминесцентное свечение ?
3.В чем отличие флуоресценции от фосфоресценции?
4.Как различается люминесценция по механизму возникновения свечения ?
5.Как выглядит типичный спектр люминесценции молекулярного вещества?
6.В чем заключается закон Стокса–Ломмеля?
7.Что такое квантовый и энергетический выход люминесценции? Какому закону подчиняется
зависимость энергетического выхода люминесценции от длины волны возбуждающего
света?
8.Назовите факторы, оказывающие влияние на интенсивность люминесценции.
9.Сформулируйте закон Вавилова.
10.Что такое концентрационное гашение люминесценции? Объясните причины явления.
11.Как влияет на интенсивность люминесценции температура?
12.Какое влияние может оказывать на интенсивность люминесценции наличие примесей в
анализируемом веществе?
13.Каковы особенности метода люминесцентного титрования? Что представляют собой
люминесцентные индикаторы и в каких случаях они применяются?
14.Назовите
основные
узлы
приборов
люминесцентного
анализа.
Приведите
принципиальную схему люминесцентного фотометра.
15.Опишите использование люминесцентного свечения вещества для его идентификации и
количественного определения.
16.Почему при проведении люминесцентного анализа предъявляются повышенные
требования к чистоте реактивов и посуды?
Слайд 45
46.
1.Что называют люминесцентным излучением и какова его природа?2.Сформулируйте основные закономерности люминесценции.
3.Какие виды люминесценции различают в зависимости от способа возбуждения?
4.Что такое флуоресценция?
5.Что такое квантовый выход в люминесценции и как он влияет на
чувствительность анализа?
6.Приведите принципиальную схему прибора для измерения интенсивности
флуоресценции. С чем связана необходимость использования двух светофильтров и
где их место в схеме?
7.Почему для измерения флуоресценции используют только разбавленные растворы
концентрацией 10-3...10-4 моль/л и менее?
8.Как связана интенсивность флуоресценции с концентрацией? Какие приемы
флуоресцентного анализа основаны на использовании этой зависимости?
9.Назовите факторы, влияющие на интенсивность люминесценции.
10.Приведите примеры качественных определений методом люминесценции в
технике, сельском хозяйстве, медицине и т.д.
11.Назовите основные узлы приборов для люминесцентного анализа. Приведите
принципиальную схему.
12.Укажите достоинства и недостатки люминесцентного анализа.
Слайд 46
47.
Решение типовых задачПо теме Люминесценция
Слайд 47
48.
Слайд 4849.
Слайд 4950.
Слайд 5051.
Слайд 5152.
Слайд 5253.
Слайд 5354.
Содержание железа в стандартных градуировочных растворах равно:V1=0,5 см3;
С(Fe)=m(Fe)·V=0,0406·0,5=0,0203 мг/100 см3
V2=1,0 см3
С(Fe)=0,0406·1,0=0,0406 мг/100 см3
V3=1,5 см3
С(Fe)=0,0406·1,5=0,0609 мг/100 см3
V4=2,0 см3
С(Fe+)=0,0406·2,0=0,0812 мг/100 см3
коэффициент 106 учитывает перевод м3 в см3.
Слайд 54















































 Физика
Физика








