Похожие презентации:
Валентность. 11 класс
1.
Презентация для 11 класса2. Валентность
Валентность–
способность
атомов
химических
элементов
образовывать
определенное число связей с другими атомами
―
―
Н
Н
―
―С ―Н
Н
Cl
―
N
―
Cl
―
Н―С ― С
Н
―
Н
―
―
Н
Cl
Понятие «валентность» применимо только для
соединений с ковалентным типом химической связи
3. Валентность определяется:
а) числом неспаренных электронов6 С 2е 4е
1S2 2S2 2P2
Валентность
углерода II
II
I
S
P
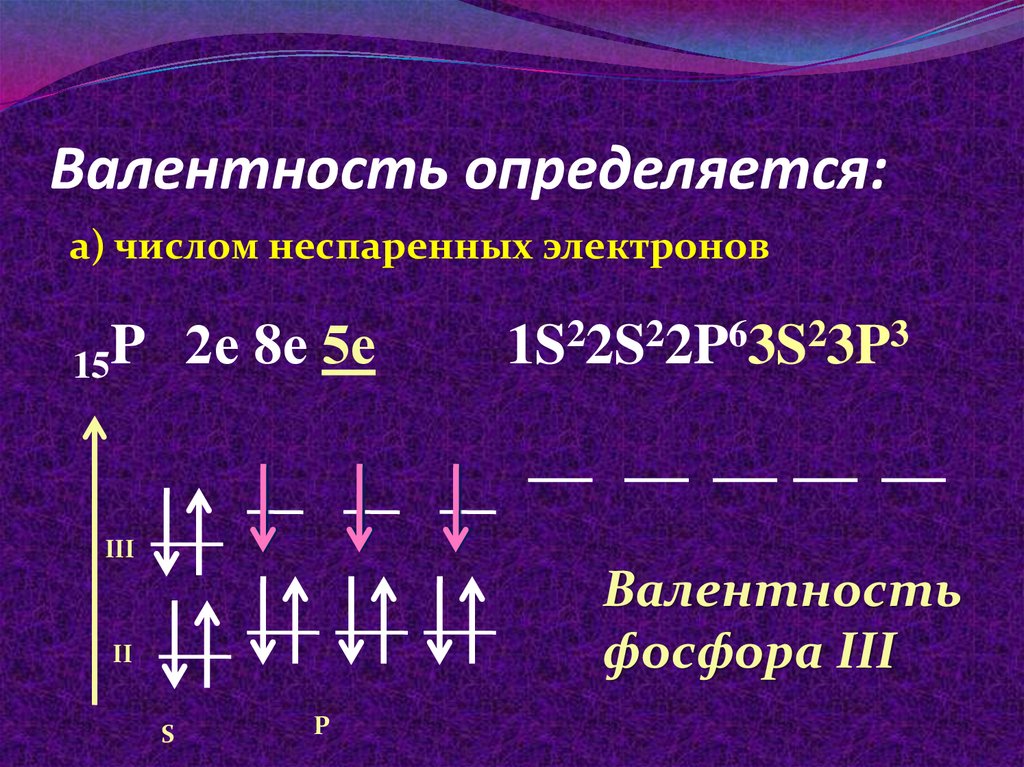
4. Валентность определяется:
а) числом неспаренных электронов15P 2е 8е 5е
1S22S22P63S23P3
III
Валентность
фосфора III
II
S
P
5. Задание
Определите валентность серы,хлора и азота в обычном состоянии
S
Cl
N
6.
Валентность определяется:б) числом свободных орбиталей
6 С 2е 4е
1S2 2S12 2P32
Валентность
углерода IV
II
II
I
S
P
7.
Валентность определяется:б) числом свободных орбиталей
15P 2е 8е 5е
1S
1S222S
2S222P
2P663S
3S123P
3P333D1
III
Валентность
фосфора V
III
II
S
P
8. Задание
Определите, какие валентныевозможности имеет сера
2е 8е 6е
16S
III
II
S
P
1S
1S222S
2S222P
2P663S
3S123P
3P3433D
3D21
Вывод:
Валентность
Валентность
сера проявляет
серы II
VI
IV
валентность
II,IV,VI
9. Задание
Оцените валентные возможностикислорода, хлора, углерода
Кислород – II
Почему нет других
валентных возможностей?
Хлор – I, III, V, VII
Углерод – II, IV
10. Валентность определяется:
в) наличием неподеленной электронной пары уодного атома и свободной орбитали у другого
7N
2е 5е
II
I
S
P
1Н 1е
+ 0е
Н
1
I
I
S
S
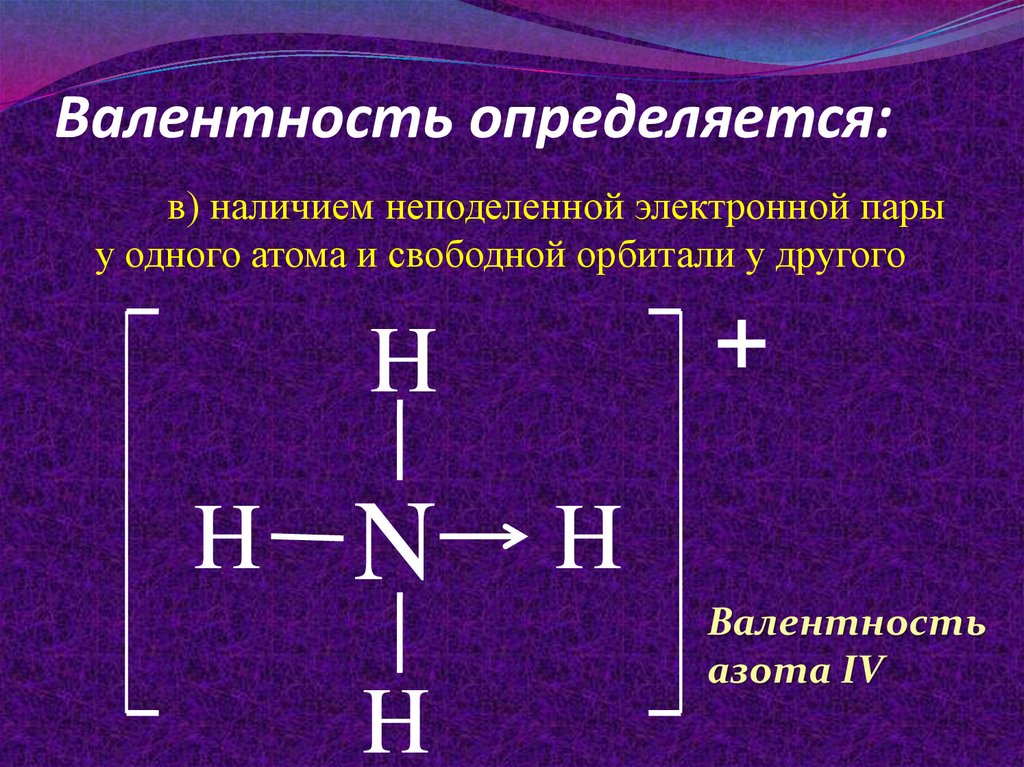
11. Валентность определяется:
в) наличием неподеленной электронной парыу одного атома и свободной орбитали у другого
+
H
H
N
H
H
Валентность
азота IV
12. Вывод:
Валентность определяется :числом неспаренных электронов;
наличием свободных орбиталей;
наличием неподеленных электронных пар у
одного атома и свободных орбиталей у
другого (при образовании ковалентной связи
по донорно-акцепторному механизму)









 Химия
Химия








